Общая характеристика и химические свойства щелочных металлов
 Скачать 192.31 Kb. Скачать 192.31 Kb.
|
*ф Получение: Оксид азота (I) получают термическим разложением нитрата аммония при температуре около 200 °С: NH4NO3 = N2O + 2H2O, нагревание нужно проводить очень осторожно, перегрев и использование больших количеств нитрата может привести к взрыву. Химические свойства: Оксид азота (I) не взаимодействует с водой. Несолеобразующий оксид. Проявляет окислительные свойства, в нем, как и в кислороде, вспыхивает тлеющая лучина и ярко горит сера. При нагревании выше 600 °С разлагается со взрывом: 2N2O = 2N2 + O2. Взаимодействует с водородом: N2O + H2 = N2 + H2O. При поджигании смеси оксида азота (I) и аммиака происходит взрыв: 3N2O + 2NH3 = 4N2 + 3H2O. При взаимодействии с сильными окислителями проявляет восстановительные свойства: 5N2O + 2KMnO4 + 3H2SO4 = 10NO + 2MnSO4 + K2SO4 + 3H2O. NO: несолеобразующий оксид азота. В нормальных условиях он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом ; в жидком и твёрдом виде имеет голубой цвет. Молекула NO малополярная, линейная, длина связи составляет 0,115 нм, её строение описывается двумя резонансными структурами, обе формы имеют один неспаренный электрон, поэтому молекула является радикалом, но при обычных условиях не склонна к димеризации. -%% •+- ±;n=o: Получение: В лаборатории получают действием на медь разбавленной азотной кислоты: 3Cu + 8HNO3 = 2NO + 3Cu(NO3)2 + 4H2O. В промышленности получают каталитическим окислением аммиака на платино-родиевом катализаторе при 700 °С: 4NH3 + 5O2 = 4NO + 6H2O. В атмосфере образуется из простых веществ в грозовых разрядах: N2 + O2 = 2NO. Химические свойства: Оксид азота (II) не взаимодействует с водой. Несолеобразующий оксид. Проявляет восстановительные свойства. Он легко окисляется кислородом: 2NO + O2 = 2NO2. Взаимодействует с перманганатом калия в кислой среде: 5NO + 3KMnO4 + 2H2SO4 = 2MnSO4 + 3KNO3 + Mn(NO3)2 + 2H2O. С хорошими восстановителями проявляет окислительные свойства, и восстанавливается до азота: Реагирует с сернистым газом: 2NO + 2SO2 = 2SO3 + N2. При использовании родиевого катализатора окисляет угарный газ в углекислый: 2NO + 2CO = 2CO2 + N2, такие катализаторы устанавливаются в выхлопных трубах автомобилей. Не реагирует с кислотами, при взаимодействии с расплавленной щелочью диспропорционирует: 6NO + 4KOH = N2 + 4KNO2 + 2H2O. N2O3: ;жидкость синего цвета (при н. у.), бесцветный газ (при стандартных условиях), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже -4 °C. Без примесей NO2 и NO существует только в твёрдом виде. Молекула N2O3 плоская и состоит из фрагментов ON - NO2 c непрочной связью N - N. У атома азота имеется неподеленная пара электронов. Твердый оксид азота (III) - ионное соединение. 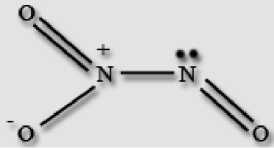 Получение: Получение:Образуется при охлаждении до -36 °С смеси оксидов азота (II) и (IV): NO + NO2 = N2O3. При взаимодействии 50 %-ной азотной кислоты с оксидом мышьяка (III) при низкой температуре: 2HNO3 + As2O3 + 2H2O = 2H2AsO4 + N2O3. При обезвоживании азотистой кислоты: NaNO2 + H2SO4 = NaHSO4 + HNO2; 2HNO2 = N2O3 + H2O. Химические свойства: Оксид азота (III) - типичный кислотный оксид, взаимодействует с водой с образованием азотистой кислоты: N2O3 + H2O = 2HNO2. При взаимодействии со щелочами образуются соли азотной кислоты - нитриты: N2O3 + 2NaOH = 2NaNO2 + H2O. NO2: газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость. Молекула NO2 имеет угловую форму, предполагается, что атом азота находится в состоянии sp2-гибридизации, длина связи N - O равна 0,119 нм, что соответствует полуторной связи.  NO2 На атоме азота имеется неспаренный электрон, поэтому он легко димеризуется с образованием димера N2O4. Молекула N2O4 плоская и состоит из фрагментов 2ON - NO2 c непрочной связью N - N. 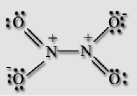 Получение В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной кислотой: Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O; при термическом разложении высушенных нитратов тяжелых металлов: 2Pb(NO3)2 = 2PbO + 4NO2 + O2. В промышленности окисление оксида азота (II) кислородом: 2NO + O2 = 2NO2, реакция является обратимой. Химические свойства Оксид азота, и мономер, и димер, хорошо растворим в воде, и взаимодействует с ней: 2NO2 + H2O = HNO3 + HNO2, при этом происходит диспропорционирование на азотную и азотистую кислоты. При температуре выше 0 °С реакция протекает по другому: 3NO2 + H2O = 2HNO3 + NO. Если через воду пропускать смесь оксида азота (IV) и воздуха, то образуется только азотная кислота: 4NO2 + 2H2O + О2 = 4HNO3. Диоксид азота - сильный окислитель, в его атмосфере горят углерод и сера: С + 2NO2 = CO2 + 2NO; S + 2NO2 = SO2 + 2NO.   и NO3", в газовой фазе и растворе состоит из молекул + 2 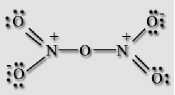 N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив. Оксид азота (V) - ангидрид азотной кислоты, построен из ионов NO N2O5. Получение Образуется при пропускании азотной кислоты через колонку с оксидом фосфора (V): 2HNO3 + P2O5 = N2O5 + 2HPO3, реакция протекает при -10 °С. Получается при окислении оксида азота (IV) озоном: 2NO2 + O3 = N2O5 + O2. Химические свойства Разложение: 2N2O5 = 4NO2 + O2. При растворении в воде образует азотную кислоту: N2O5 + H2O = 2HNO3. Является сильным окислителем: N2O5 + 42 = I2O5 + N2. Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта). Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных р-электрона атома азотаучаствуют в образовании полярных ковалентных связей с ls-электронами трёх атомов водорода (связи N-H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2 + 3H2 2NH3 Это так называемый процесс Габера Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4C1 + NaOH = NH31 + NaCl + H2O. NH4NO3 + NaOH = NH3| + NaNO3 + H2O. С кислородом: 4NH3 + 3О2 = 2N2 + 6H2O 4NH3 + 5О2 = 4NO + 6H2O C хлором: NH3 + 3C12 = 2N2 | + 6HC1 С оксидом меди (II): 3CuO + 2 NH3 = 3Cu + N2 | + 3H2O C металлами: 2NH3 + 2A1 = 2A1N +3H2 С углекислым газом 2 NH3 + CO2 = H2O + CO(NH2)2 Реакция разложения: 2 NH3 = N2 + 3H2 Гидразин (диамид) H2N—NH2 — бесцветная, сильно гигроскопическая жидкость с неприятным запахом. Ядовитый. Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO: NH3 + NaClO —>■ реакция проводится при температуре 160 °C и давлении 2,5-3,0 МПа. Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману: H2NCONH2 + NaOCl + 2 NaOH реакция проводится при температуре 100 °C и атмосферном давлении. В целом гидразин характеризуется восстановительными свойствами: N2H4+O2=N2+2H2O (t) 2N2H4+4KMnO4+6H2 SO4=5N2+4MnSO4+K2 SO4+16H2O Только очень сильные восстановители способны восстановить его до N N2H4+Mg+4HCl=MgCl2+2NH4Cl -3 ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ СОЛЕЙ АММОНИЯ: NH4NO3 =N2O+2H2O (250°) 2NH4NO3 =2N2+O2+2H2O (400°) NH4NO2=N2+2H2O (t) (NH4)2Cr2O7=N2+Cr2O3+4H2O (t) NH4Cl=NH3+HCl (t) (NH4)2 SO4=2NH3 +H2 SO4 (t) Гидроксиламин (NH2OH) -кристаллическое ядовитое вещество, проявляющее преимущественно восстановительные свойства. Получение: электрохимиичекски врсстанавливают раствор азотной кислоты, на катоде суммарно происходит реакция: HNO3+ 6Н++6е= NH2OH+2H2O Свойства: NH2OH+2KMnO4+9H2 SO4=5N2+2MnSO4+K2 SO4+18H2O 2NH2OH+I2+2KOH=N2+2KI+4H2O Промежуточная степень окисления атома азота объясняет диспропорционирование этого соединения при нагревании и способность восстанавливаться до иона NH4+ 3NH2OH=N2+NH3+3H2O(t) 4KI+2NH2OH+3H2 SO4=2I2+(NH4)2 SO4+K2 SO4+2H2O NH2OH+HCl=[NH3 OH] Cl Азотистый водород (в растворе-азотистоводородная кислота) может быть получена следующим образом: N2H4+HNO2=HN3+H2O Соль этой кислоты-азид натрия-получают так: 2NaNH2+N2O=NaN3+H2O (200°) Как окислитель HN3 в растворе имее черты сходства с азоткой, например: Cu+3HN3=Cu(N3)2+N2+NH3 Азиды щелочные и щелочноземельных металлов плавятся не разлагаясь и хорошо растворимы в воде, азиды тяжелых металлов при нагревании и даже от удара взрываются. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С АЗОТНОЙ КИСЛОТОЙ HNO3 как сильная одноосновная кислота взаимодействует: а) с основными и амфотерными оксидами: |
