Общая характеристика и химические свойства щелочных металлов
 Скачать 192.31 Kb. Скачать 192.31 Kb.
|
2H+ +CO32-
[A1(H20)30H]2+ + H+Общая характеристика и химические свойства щелочных металлов. Особенности соединений лития по сравнению с соединениями других щелочных металлов. Гидриды, оксиды, пероксиды, гидроксиды щелочных металлов : химическая связь в соединениях, получение и свойства. Получение натрия, гидроксида натрия и карбоната натрия в промышленности. Взаимодействие с растворами щелочей: а)амфотерных металлов; б)неметаллов; в)кислотных оксидов; г)амфотерных оксидов. Металлы подгруппы IA периодической системы элементов I. И. Менделеева Li, Na, К, Rb, Cs и Fr называются щелочными. Щелочные, щелочноземельные металлы, Be и Mg относятся к наиболее электроположительным, элементам. В соединениях с другими элементами для металлов подгруппы IA типична степень окисления + 1, а для металлов подгруппы ПА +2. С ростом числа электронных слоев и увеличением радиусов энергия ионизации атомов уменьшается. Вследствие этого химическая активность элементов в подгруппах увеличивается с ростом их порядкового номера. С малой энергией ионизации связан характерный для них фотоэффект, а также окрашивание их солями пламени" газовой горелки. Благодаря легкой отдаче наружных электронов щелочные и щелочноземельные металлы образуют соединения преимущественно с ионной связью. Щелочные и щелочноземельные металлы проявляют высокую химическую активность. При нагревании в водороде они образуют гидриды — солеподобные соединения, в которых водород находится а виде отрицательно заряженного иона. На воздухе щелочные металлы быстро окисляются, образуя в зависимости от их активности оксиды, пероксиды, надпероксиды или озониды. При этом Ci, Na и К 'загораются на воздухе или в атмосфере сухого кислорода только при нагревании, a, Rb и Cs самовоспламеняются без нагревания. Образование при горении оксида состава М2О характерно только для лития. Натрий образует пероксид состава М202, калий, рубидий и цезий — надпероксиды состава МО2. Щелочные металлы энергично взаимодействуют с водой, вытес-из нее водород и образуя соответствующие гидроксиды. Активность взаимодействия этих металлов с водой возрастает по мере увеличения порядкового номера элемента. Так,- литий реагирует с водой без плавления, натрий — плавится, калий — самовозгорает-ся , взаимодействие рубидия и цезия протекает еще более энергично. Щелочные металлы энергично взаимодействуют с галогенами, а при нагревании — с серой. Гидроксиды щелочных металлов — соединения с преимущественно ионной связью. В водных растворах они нацело диссоциируют ным характером связи объясняется и их высокая термическая устойчнвость:они не, отщепляют воду дажепри нагревании до температуры кипения (выше 1300 °С) Исключение составляет, гидроксид лития, который при нагревании разлагается с отщепле-нием ,воды. Поведение лития отличается и в других отношениях от поведения остальных щелочных металлов. Это объясняется его неполной электронной аналогией с остальными элементами группы. Из щелочных металлов только литий при сравнительно небольшом нагревании взаимодействует с азотом, углеродом и крем-нием, образуя соответственно нитрид Li3N, карбид Li^2 и силицид Li6Si2. В присутствии влаги образование нитрида идёт уже при комнатной температуре. В отличие от щелочных металлов, почти все соли которых хорошо растворимы в воде, литий образует малорастворимый фторид LiF карбонат Li2CO3 и фосфат Li3PO4. Кальций, стронций и барий по отношению к кислороду и воде ведут себя подобно щелочным металлам. Они разлагают воду с выделением водорода и образованием гидроксидов М(ОН)2. Взаимодействуя с кислородом, образуют оксиды (СаО) и пероксиды (SrO2, ВаО2), которые реагируют с водой подобно аналогичным соединениям щелочных металлов. Магний также существенно отличается от щелочноземельных металлов. Например, из-за малой растворимости его гидроксида он не взаимодействует с холодной водой. При нагревании процесс облегчается. В целом металлы подгруппы ПА химически активны: при нагревании они взаимодействуют с Галогенами и серой с .образованием соответствующих солей, соединяются с молекулярным азотом. Соли щелочноземельных металлов, как и соли щелочных металлов, состоят из ионов. Соли этих металлов окрашивают пламя горелки в характерные цвета, для соединений Be и Mg этого не наблюдается. В отличие от солей щелочных металлов многие соли металлов подгруппы ПА малорастворимы, в частности фториды (кроме BeF2). сульфаты (кроме BeS04 и MgSO4), карбонаты. Из водных раствороэ Ве2+ осаждается в виде основных карбонатов перемен-.ного состава, Mg2+— в Са2+, Sr2 + и Ва2+ осаждаются в виде средних карбонатов МСОз. Be+2NaOH= Na2BeO2+H2 Al+NaOH+H2O=NaAlO2+H2 Б) Неметаллы, за исключением галогенов, не реагируют с растворами щелочей Cl2+NaOH=NaClO3+NaCl+H2O кислотные оксиды растворяются только в щелочах с образование соли и воды SO3+2NaOH=Na2So4+H2o Г) Амф ме реагируют с сильными щелочами, проявляя этим свои кислотные свойства, например: ZnO + 2NaOH ^ Na2ZnO2 + H2O Амфотерные оксиды могут реагировать с щелочами двояко: в растворе и в расплаве. При реакции с щёлочью в расплаве образуется обычная средняя соль(как показано на примере выше). При реакции с щёлочью в растворе образуется комплексная соль. Al2O3 + 2NaOH + 3H2O ^ 2Na[Al(OH)4] (В данном случае образуется тетрагидроксоаллюминат натрия) Особенности соединений бериллия по сравнению с соединениями щелочно-земельных металлов. Общая характеристика солей бериллия, магния и щелочно-земельных металлов, их растворимость и гидролиз. Получение оксида, гидроксида кальция и хлорной извести в промышленности. Элементы II группы имеют общую электронную конфигурацию: (n-1)p6ns2, кроме Ве 1s22s2. В силу последнего, свойства Ве немного отличаются от свойств подгруппы в целом. Свойства магния тоже отличаются от свойств подгруппы, но в меньшей степени. Из всех металлов II группы только бериллий практически не взаимодействует с водой (препятствует защитная пленка на его поверхности) 2Be + 3H2O = BeO| + Be(OH)2j + 2H2| 2H2O + 2e- = 2OH- + 2H2 ( восстановление) 2Be + 4OH— 4e- = BeO + Be(OH)2 + H2O ( окисление) С сухим водородом металлы 2 группы (кроме Be) при небольшом нагреве образуют гидриды: Э + Н2 = ЭН2 Гидрид бериллия получают следующим образом: BeCl2 + 2LiH = BeH2 + 2LiCi По многим химическим свойствам бериллий больше похож на алюминий, чем на находящийся непосредственно под ним магний (проявление "диагонального сходства").
Ве, его оксид и гидроксид проявляют амфотерные свойства, в частности растворяются и сплавляются со щелочами: Be + 2NaOH =(сплавл)= Na2BeO2 + H2 BeO + 2KOH + H2O = K2[Be(OH)4] Be(OH)2 + 2KOH =(^)=K2BeO2 + 2H2O Be(OH)2 -малорастворимое соединение в отличии от гидроксидов щелочноземельных металов И так, особенности химии бериллия: амфотерность Be, BeO, Be(OH)2; -образование сравнительно прочных комплексных ионов ( например:] [Be (H2O) 4]2+, [Be (OH) 4]2-, [BeHal4]2-; соединения бериллия склонны к полимеризации и образованию многоядерных комплексных соединений в растворах. Соли бериллия магния и щелочноземельных металлов. Соли бериллия имеют более ковалентную связь, чем соли других металлов этой подгруппы, и поэтому обладают в растворе меньшей электропроводностью. В водных растворах соли бериллия гидратированы благодаря малому радиусу иона Be2+ и сильному взаимодействию с дипольными молекулами воды. Бериллий в отличие от других металлов плохо реагирует с азотной кислотой, так как на поверхности образуется защитная пассивирующая пленка BeO. Сульфиды металлов 2 группы гидролизованы в водных растворах, гидролиз усиливается от RaS к BeS, сульфиды бериллия и магния гидролизованы практически полностью. Галогениды Be, Mg и щелочноземельных металлов хорошо растворимы в воде кроме MgF2, CaF2, SrF2, BaF2. К малорастворимым соединениям относятся карбонаты, оксолаты, фосфаты, арсенаты и дркгие соли этих металлов, малорастворимы сульфаты CaSO4, SrSO4, BaSO4. В водных растворах сильно гидролизованы соли бериллия, менее - соли магния; растворимые соли кальция,стронция и бария практически не гидролизованы в водных растворах. В силу гидролиза при сливании растворов солей Ве+2 и Мд+2 с растворами карбонатов выпадают в осадок основные карбонаты, у остальных металлов осаждаются в этом случае малорастворимые карбонаты. Нитраты и карбонаты металлов 2 группы термически неустойчивы,их стабильность возрастает с ростом радиуса 2+ катиона Э Жесткость воды определяется содержанием в ней растворимых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»). Получение оксида, гидроксида кальция и хлорной извести в промышленности. В промышленности оксид кальция получают термическим разложением известняка: CaCO3 = CaO + CO2 CaO + H2O ^ Ca(OH)2 Хлорная известь CaOCl2 (у Соловьева) Cl2 + Ca(OH)2 = CaOCl2 + H2O (В Википедии) Хлорная известь Ca(Cl)OCl — смесь гипохлорита, хлорида и гидроксида кальция 2Ca(OH)2 + 2Cl2 = Ca(OCl)2 +CaCl2 +2H2O 3 Бороводороды: получение, строение молекул и свойства. Борогидриды металлов. Бор Природные источники и получение В природе бор встречается в виде солей полиборных кислот, например, буры Na2B4O7*10H2O, а также самой борной кислоты Н3ВО3. При получении бора буру переводят в В2О3 (подкисление раствора и обезвоживание выделившейся Н3ВО3). Далее В2О3 + 3Mg = t 3MgO + 2В(амосф) . Получение из аморфного бора кристаллического затруднено из-за его высокой температуры плавления (2180 °С). Небольшие порции кристаллического бора получают по специальным методикам: 2BI3 = t 2Вло + 3I2 ; 3Н2 + 2BBr3 = t 2Впг| +ЗНВг Возможно получение бора электролизом расплавов боратов и фторборатов. Химические свойство бора Кристаллический бор очень твёрд (тверже его только алмаз), относится к полупроводникам. Валентные возможности атома бора 1 и 3, степени окисления в соединениях от -3 до +3 при доминирующей +3. В большинстве соединений бора химическую связь можно описать с позиции Бр2-гибридизации, возможно и sp (0 = В = О) и sp3 ([BF4] -). При сильном прокаливании бор вытесняет элементы из оксидов СО2, SiO2, P4O10; это в значительной степени обусловлено очень низким значением энергии Гиббса образования В2Оз (к), при 298,15 К AG°o6p B2O3(k)= = -1193,8 кДж/моль. Указанный оксид образуется при сгорании бора в атмосфере кислорода. При спекании мелкораздробленного бора с порошками металлов образуются бориды этих металлов, например, MgB2, Mg^2. Бор растворяется только в кислотах-окислителях: В + 3HNO3 ,конц) = t НзВОз + 3NO2 2В + 3H2SO4(ko»>=2 Н3ВО3 + 3SO2 Аморфный бор (или очень мелкораздробленный кристаллический) медленно растворяется в щелочах: 2В + 2КОН + 2Н2О = 2КВО2 + ЗН2 Наиболее эффективный способ переведения бора в растворимое в коде соединение - окисление «щелочным плавом»: 2В + 3KNO3 + 2КОН =спл. 3KNO2 + 2КВО2 + Н2О. Соединения бора Для бора достаточно характерно образование бороводородов (Боранов). ВН3 (р) термодинамически нестабилен и легко димеризуется: 2ВН3 (г) = В2Н6 (г); AGo298 = - 102 кДж. Известны два гомологических ряда боранов с общей формулой ВпНп+4, и ВпНп+6, соединения первого ряда более стабильны. Все бороводороды имеют AG°обр > 0, т. е. являются термодинамически неустойчивыми соединениями, но характеризуются сравнительной кинетической устойчивостью. Бороводороды могут быть получены следующими способами: MgBB2 + 6HC1 = В2Н6 + 3MgCl2 t 6Н2 + 2ВС13 = В2Н + 6НС1 2ВС13 + 6КН = В2Н6 + 6КС1 В реальных условиях получается смесь боранов. Особенности химической связи в этих соединениях рассмотрим на примере молекулы диборана В2Н6, в которой четыре атома Н и атомы В находятся в одной плоскости, а два других атома H расположены над и под этой плоскостью: 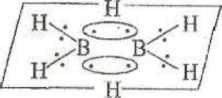 Первые четыре атома Н могут быть замещены на другие атомы без нарушения целостности молекулы диборана, тогда как попытка замещения двух других атомов водорода ведёт к разрушению молекулы. Как следует из электронного строения атомов бора и водорода на связи двух атомов бора с двумя атомами водорода по одному электрону у каждого атома бора и атома водорода, что явно не достаточно для образования четырёх двухцентровых связей. Поэтому об этих соединениях говорят как об «элекгронодефицитных» или «орбитальноизбыточных». Для объяснения химической связи в обсуждаемых соединениях привлекаются представления о трёхцентровой связи - пара электронов связывает ие два, а три атома - атом водорода и два атома бора. Именно эта особенность химической связи в бороводородах в значительной степени объясняет их химические свойства. Для бороводородов характерны электроноакцепторные свойства: В2Н6 + 2К=K2B2H6 B2H6 + 2LiH = 2Li[BH4]. Они неустойчивы, загораются на воздухе: В2Н6 + 3О2=В^3 + 3Н2О, проявляют восстановительные свойства: В2Н,5 + 6Н2О = 2Н3ВО3 + 6Н2 При прокаливании бора в атмосфере азота или оксида бора в атмосфере аммиака образуется нитрид бора - белый слоистый гетероатомный аналог графита. Он жирен на ощупь, делится на чешуйки, но не электропроводен, химически инертен. Если синтез вести при температурах свыше 1500 °С и давлении 60000-80000 атм, то получается алмазоподобная модификация нитрида Пора. Техническое название этого продукта - боразон (США) и эльбор (СССР - Россия). По твердости этот материал близок к алмазу, но ныдерживает нагрев до 2000 °С (алмаз сгорает уже при 800 °С). Известны и другие соединения азота и бора, например, B3N3H6 -фиборинтриимид, называемый боразолом или неорганическим бензолом. Это соединение может быть получено: З В2Н + 6NH3 = 2B3N3H6 + 12Н2 3Li[BH4] + 3NH4C1 = B3N3H6 + 3LiC1 + 9Н2 Это бесцветная жидкость, имеющая температуру плавления -56 °С и температуру кипения 55 °С. Молекула Вз№Нб изоэлектронна молекуле бензола, боразол похож на бензол по растворяющей способности и даже по запаху! Но боразол более реакционноспособен (полярные связи!), легче окисляется, растворим в воде и медленно в ней разлагается на Н3ВОз, NH3 и Н2. При высокой температуре образуется карбид бора: t 7С + 2В2Оз = 6СО + В4С ,являющийся отличным абразивным материалом. В2О3 проявляет кислотные свойства, реагируя с основаниями с образованием боратов и метаборатов. Метаборатьт d-элементов окрашены, что позволяет использовать их для идентификации этих металлов. Ортоборная кислота Н3ВОз медленно образуется при гидратации В2О3: В2О3 + Н2О —> полиметаборные кислоты (НВО2)п —> Н3ВО3 Она может быть выделена в кристаллическом виде из раствора при подкислении боратов: Na2B4O7 + 2HC1 + 5Н2О = 4Н3ВО3 + 2NaCl, имеет t пл. = 171 °С и АНраста. >0. В кристаллическом виде представляет собой слоистый полимер со сравнительно прочными межмолекулярными водородными связями. Борная кислота в водном растворе - слабая одноосновная кислота, при её нейтрализации получаются тетрабораты, метабораты и соли других полиборных кислот: 4НзВО3 + 2NaOH = Na2B4O7 + 7Н2О Н3ВО3 + NaOH = NaBO2 + 2Н2О Н3ВОз нелетуча, поэтому вытесняет из солей более летучие кислоты, например: t Н3ВОз+NaCl = NaBO2 + НС1 + Н2О В ортоборатах, например Mg3(BO3)2, содержатся ионы ВOз3- В метаборатах одновременно присутствуют группы ВО 3 (структура правильного треугольника) и ВО4 (структура тетраэдра). Для боратов в кристаллическом состоянии характерны сложные структуры, в которых группы ВОз и ВО4 образуют цепи и кольца, а в растворах - полиядерные ионы. В растворах при гидратации боратов фактически происходит превращение ионов О2- —» ОН-. Как соли слабых кислот бораты в водных растворах сильно гидролизованы и имеют рН > 7. Расплав буры растворяет оксиды металлов -(так называемые перлы буры): t Na2B4O7 = 2NaBO2 + В2О3 t СоО + В2О3 = Со(В02)2 t Na2B4O7 + СоО = 2NaBO2 + Co(BO2)2 Галогенные соединения бора могут быть получены синтезом из элементов или восстановительным галогенированием оксида бора: t В2О3 + ЗС + ЗС12 = 2ВС13 + ЗСО При комнатной температуре ВС13 и BF3 - газы, ВВг3 - жидкость и В13 - кристаллическое вещество. Все эти соединения являются фактически галогенангидридами борной кислоты, в водном растворе сильно гидролизованы: ВС13 + ЗН2О = Н3ВО3 + ЗНС1 Гидролиз BF3 ведёт к образованию двух продуктов (Н3ВО3 и H[BF4]), что связано с взаимодействием ортоборной кислоты с HF: 4BF3 + 12Н2О - 4Н3ВО3 + 12HF 12HF + 3H3BO3 = 3H[BF4] + 9Н2О 4BF3 + ЗН2О = Н3ВО3 + 3H[BF4] Применение Бор - компонент сплавов; 10 В обладает большим сечением захвата тепловых нейтронов, этим определяется его использование в виде борсодержащих сталей или карбида бора при изготовлении контрольных стержней для ядерных реакторов. Бороводороды, в частности диборан В 2Н6, представляют интерес как топливо. Ортоборная кислота применяется для получения керамики, цементов, моющих средств и как дезинфицирующее вещество. Бура входит как компонент в состав флюсов для сварки и пайки металлов, вводится в щихту глазурей, эмалей, стекол и керамики, применяется в качестве микрокомпонента удобрений. Боралюмосиликатное стекло «пирекс» менее чем обычное растворимо в воде и имеет значительно меньший температурный коэффициент расширения, поэтому из него изготавливают жаростойкую и химическую посуду. Общая характеристика и химические свойства алюминия, индия, галлия и таллия. Получение алюминия, его оксида и гидроксида в промышленности. Оксид, гидроксид и соли алюминия: их получение и свойства. Алюминий в природе. Алюминий самый распространенный металл на земле. Природными источниками являются различные алюмосиликаты, например, нефелин (Na2O . Al2O3.2SiO2) . Наиболее концентрированные источники боксит (Al2O3.xH2O) и корунд (Al2O3). Химические свойства. Al в чистом виде - мягкий, лёгкий металл, хороший тепло- и электропроводник. Валентные возможности 1 и 3, со 0, +1, +3, при этом соединения со +3 доминируют. Al- достаточно реакционный Ме, уступающий по активности лишь щелочным и щелочноземельным Ме. Легко окисляется на воздухе, но образующаяся на поверхности плотная оксидная пленка предозраняет от дальнейшего взаимодействия с кислородом. Именно поэтому медленно вступает в хим. взаимодействие, поскольку первоначально должна быть разрушена оксидная пленка. Для увеличения толщены пленки Al подвергают анодированию, которое осуществляется электролизом разбавленного раствора H2SO4, где анодом служит алюминиевое изделие. Добавление в р-р красителей позволяет получить анодированный Al с окрашенными покрытиями. В целом Al основнее В, но кислотнее Mg; ион Al3+ -сильный поляризатор, склонен к образованию комплексных соединений, отмечается не ярко выраженная склонность к полимеризации соединений. Холодные концентрированные растворы H2SO4 и HNO3 пассивируют Al, поэтому эти кислоты перевозят в алюминиевых цистернах. После удаления пленки Al активно реагирует с растворами минеральных к-т: 2Al+ 6H+ = 2Al3+ + 3H2; Разбавленную азотную к-ту восстанавливает до NH4+(N2): 8Al + 3 HNO^s^ = 8Al(NO3)3 + 3NH4NO3 + 9H2O Al - амфотерный металл, сравнительно легко растворяется в р-рах щелочей и сплавляется с ними: 2Al + 2NaOH + 2H2O = 2 NaAlO2 + 3H2 2Al + 6NaOH(ro6.) + 6H2O = 2Na3[Al(OH)6] + 3H2 спл. 2Al + 6NaOH = 2Na3AlO3 + 3H2 Вопрос о составе гидроксокомплексов - дискуссивный; по всей видимости, в различных областях концентрации щелочи возможны разные гидроксокомплексы. При нагревании порошкообразный алюминий легко взаимодействует с неметаллами: t 4Al + 3C = Al4C3 t 2Al + N2 = 2AlN t 2 Al + 3S = Al2S3 t Al + P = AlP t 4Al + 3O2 = 2Al2O3 Al используют как восстановитель металлов из оксидов( алюмотермия), таким способом получают в промышленности Cr, Ba, W, Mn, V, Sr, Ca. Общая характеристика и химические свойства индия, галлия и таллия. Сравнительно малораспространенные, рассеянные Ме. Проявляют в соединениях со: 0, +1, +2, +3. В ряду Ga-In-Tl растет склонность к проявлению со +1. Обратим внимание, что ион Al3+ имеет электронную конфигурацию благородногазового типа, а ионы Ga3+, In3+ Tl3+- нет. У галлия очень большой интервал жидкого состояния(около 2200К), при этом жидкий галлий имеет плотность выше кристаллического. Химические св-ва. Ga и In растворяются в р-рах минеральных к-т, образуя соли с катионом Э3+ 2Э + 3H2SO4 = Э2(SO4)3 + 3H2 Э=Ga, In. Растворяясь в минеральных к-тах, Tl дает соли с катионом Tl+: 2Tl + H2SO4 = Tl2SO4 + H2 C водой медленно реагирует только Tl: 2Tl + 2H2O =2TlOH + H2 Ga амфотерен, и( как Al) растворим в водных р-рах щелочей. При этом в зависимости от концентр. Цёлочи обр. гидроксогаллаты (K[Ga(OH)4]; K3[Ga(OH)6]) или галлаты(KGaO2). Эти соединения устойчивы только в сильнощелочных р-рах. In медленно растворим в щелочах, Tl можно растворить в тех же условиях, лишь окисляя. Порошки Ме. Сгорая образуют Э2О3, в случае Tl получается ещё и Tl2O. Me уже при комнатной температуре реагируют с F2, Cl2, Br2, а при повышенной с I2, S,P, и др. Получение алюминия, его оксида и гидроксида в промышленности. Оксид, гидроксид и соли алюминия: их получение и свойства. Алюминий получают электролизом расплава Al2O3 в криолите Na3[AlF6](90-95%) ; добавлением криолита добиваются снижения температуры плавления реакционной смеси до 1000оС (температура плавления самого Al2O3 составляет 2050оС). Электролиз проводят при силе тока около 1500000 А и напряжении 5-6 В. Электролизер представляет собой железную ванну, выложенную огнеупором; дно ванны графитовое, оно является катодом. Анодами служат алюминиевые каркасы, заполненные графитом. При плавлении Л120з подвергается ионизации: A1203 = Л13+ + Л1033- 2Л1203 = Л13+ + 3Л102". Процессы, идущие при электролизе: На катоде: 2Л13++ 6е = 2Л1 На аноде: 2Л1033- - 6е = Л1203 + 3/2 02 Алюминий оседает на дно ванны и сливается, часть графита с анодов неизбежно попадает в алюминий, именно этим обуславливается сероватый налет, появляющийся на поверхности алюминиевого изделия при обработке его кислотой или щелочью. Гидрид алюминия получают косвенным путем: Л1С13 + 3NaH = Л1Н3 + 3NaC1 Синтез ведут в безводной среде; полимерное соед. (Л1Н3)П. Широкое применение в качестве сильных восстановителей находят комплексные алюмогидридные соединения, например: Л1С13 + 4LiH = Li[A1H4] + 3LiC1. Ион [Л1Н4]- - тэтраэдрическое строение, sp3- гибрид. Известные 3 полиморфные модификации Л1203(к) . Только одна из них не безразлична к р-рам кислот и щелочей и четко демонстрирует амфотерность этого соединения: Ab03 + 3H2SO4 = Al2(S04)3 + 3H2O A12O3 + 2K0H(Kонц) = 3KA102 + H2O Л1203 + 6K0H(ro6.) + 3H2O =2K3[A1(0H)e] Наиболее простые способы получения Л1203: t 2A1(0H)3 = A1203 + 3H20 t 4A1 + 302 =2A1203 t 4A1(N03)3 = 2A1203 + 12N02 + 302 Добавление небольшого кол-ва щелочи к р-рам солей алюминия ведёт к осаждению малорастворимого A1(0H)3. Лучшими вариантами получения A1(0H)3 являются: A1C13 + 3NH3 + 3H20 = A1(0H)3| + 3NH4C1 A12(S04)3 + 3Na2C03 + 3H2O = 2 A1(0Hb| + ЗСО2+ 3Na2S04 A1(0H)3 представляет собой полимер. Как A1203 и A1, проявляет амфотерные св-ва: A1(0H)3 + 3H+ = A13+ + 3H20 спл. A1(0H)3 + KOH = KA102 + 2H20 Метаалюминат Калия спл. A1(0H)3 + 3K0H = K3A103+ 2H20 Ортоалюминат Калия A1(0H)3 + 3K0H(ro6.) = K3[A1(0H)e] Галогениды алюминия занимают промежуточное положение между солями и галогенангидридами. A1F3 малорастворим в воде, высокоплавок, малоактивен. Остальные галогениды A1, наоборот, отлично растворимы в воде и ряде органических растворителей. Все растворимые соли A13+ подвергаются гидролизу в водных р-рах: A13+ + H20 |
Не могут быть получены в водных р-рах соли алюминия с анионами слабых к-т: сульфид, цианид, карбонат, сульфит и др. В газовой фазе галогениды алюминия склонны к полимеризации.
Общая характеристика и химические свойства углерода.
Оксиды углерода ( II , IV ): получение в промышленности и в лаборатории, кислотно-основные и окислительновосстановительные свойства. Карбонилы металлов.
Углерод в природе : уголь, нефть, природный газ, графит, сланцы, алмаз, карбонаты.
4 аллотропные модификации: 2 природные - графит, алмаз. 2 искусственные - полиин, поликумулен.
-графит - бесконечная двухмерная молекула. 8р2-гибр. Переходит в алмаз при давлении около 100тыс атм и температуре 1500-2000С и катализаторах.
-алмаз - трехмерный полимер. Sp3 - гибридизация. При нагревании свыше 2000оС (без доступа кислорода) превращается в графит.
-карбины- одномерные полимеры, полупроводники, впервые получены в СССР -фуллерены- sp2- гибридизация. С66 -Сп
Хим. Св-ва : валентные возможности С по методу ВС 2 и 4. С.О от -4 до +4
при комн.температуре только F2
-при повыш.температурах С+О2 = СО2. С+ О2(недост) = СО при t> 1000C, а при К400С равновесие смещается в другую сторону. -Fe2O3 + 3C= 1500C= 2Fe + 3 CO. 2CuO + C =250C= 2Cu + CO2
С + Н2 = СН4 трудно осуществимы. Метан так не получают.
-С + Ме и неМе =t= карбиды. (СаС2, Мg2С3, SiC)
в эл.дуге 2С+ N2= (CN)2 - дициан.
С+ Н+ (ОН-) ф
-только с H2SO4 (конц) и HNO3(конц)
С+ 2H2SO4(конц)=t= СО2 + 2SO2 + 2H2O C+ 4HNO3(конц)= СО2 + 4NO2 + 2H2O Соединения:
СО + Н+ (ОН-) Ф несолеобразующий оксид.
Получение: В промышл. С+ Н2О = СО + Н2 водяной газ (1000С)
С + СО2 =t= 2СО
В лаборатории : НСООН (конц) = СО + Н2О (обезвоживание H2SO4(конц) или Р2О5)
СО проявляет восстановительные св-ва: 4TO+Fe3O4 =t= 4CO2 + 3Fe. CO+C12 =hv=COCl2
CO + H[CuC12](CuC1)= [CuCO]C1 + HC1. CO +NH3 =(500C, ThO2)= HCN + H2O. СО+2Н2=(рД,кат)=СЮОН.
СО + NaOH =(200с, 15 атм.)= HCOONa. СО+ PdC12 +H2O= Pd + CO2+ 2HC1 (бесц ^ черн)
Ni + 4CO=t,p= Ni(CO)4. Re2O7 + 17CO = Re2(CO)10 + 7CO2. 2CoCO3+ 2H2+8CO= Co2(CO)8+ 2CO+ 2H2O.
Лаб - СаСО3 + НС1
