Общая характеристика и химические свойства щелочных металлов
 Скачать 192.31 Kb. Скачать 192.31 Kb.
|
|
CuO + 2HNO* = Cu(N03)2 + Н20 ZnO + 2HN03 = Zn(N03)2 + H20 Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до -3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует: а) с металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO3 Разбавленная HNO3 б) с металлами, стоящими в ряду напряжений левее водорода: Zn + 4HNO3(60%) = Zn(NCb)2 + 2N021 +2H20 3Zn + 8HNO3(30%) = 3Zn(N03)2 + 2NO | +4H20 4Zn + 10HN03(20%) = 4Zn(N03)2 + N20 t +5H20 5Zn + 12HNO3(10%) = 5Zn(N03)2 + N21 +6H20 4Zn + 10HNO3(3%) = 4Zn(N03)2 + NH4N03 + 3H20 С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа: Fe + 4HN03(25%) = Fe(NO3)3 + NO f +2H20 4Fe + 10HNO3(2%) = 4Fe(N03)2 + NH4N03 + 3H20 Смесь 3 объемов концентрированной соляной и 1 объема азотной кислоты называют «царской водкой». Это название отражает тот факт,что указанная смесь растворяет «царя металлов»- золото: Au+4HCl+HNO3 =H [AuCl4] +NO+2H2O 3Pt+4HNO3+18HCl=3H2 [PtCl6] +4NO+8H2O 3HgS + 8HNO3(конц.) + 6HCl(конц.) = 3HgCl2+ 3H2SO4 + 8NO| + 4H2O Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом: а) нитраты металлов, стоящих в ряду напряжений левее магния: 2NaNO3 = 2NaNO2 + O2 б) нитраты металлов, расположенных в ряду напряжений между магнием и медью: 4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2 в) нитраты металлов, расположенных в ряду напряжений правее ртути: 2AgNO3 = 2Ag + 2NO2 + O2 г) нитрат аммония: NH4NO3 = N2O + 2H2O Общая характеристика и химические свойства фосфора его получение в промышленности. Оксиды фосфора: получение, строение молекул и свойства. Фосфорноватистая и фосфористая кислоты: получение, строение молекул, кислотно-основные и окислительновосстановительные свойства. Фосфиты и гипофосфиты. Кислоты фосфора (+5) и качественные реакции на них. Получение фосфорной кислоты в промышленности. В природных условиях фосфор представлен минералами фосфоритом Сa3(PO4)2 и апатитом 3Ca3(PO4)2*CaX2 (X=F,Cl,OH).Тело человека в среднем содержит около полутора килограммов фосфора. Описано 11 модификаций фосфора, причем каждая модификация полиморфна. Наибольший интерес представляют белый, красный и черный фосфор. Белый фосфор-мягкое, реакционноспособное очень токсичное вещество, хранят под слоем воды, так как на воздухе он самовоспламеняется.Белый фосфор представлен молекулами P4,имеющими форму тетраэдра и распадающимися при температурах выше 800 на молекулы состава P23ra молекулы менее прочны чем молекулы №.При длительном нагревании свыше 250 белый фосфор переходит в красный фосфор, который вполне устойчив на воздухе, не ядовит и воспламеняется только при нагревании свыше 400.Черный фосфор, являющийся наиболее устойчивой модификацией, получается из белого фосфора при высоком давлении. Черный фосфор жирен на ощупь, похож на графит, полупроводник не ядовит. Из всех аллотропных модификаций фосфора за стандартное состояние принят белый фосфор, хотя он не является термодинамически наиболее стабильной модификацией. Белый фосфор получают путем прокаливания фосфорной руды с коксом и кварцевым песком в электропечи: Ca3(PO4)2+5 C+3 Sio2=(t)=2P+3 CaSiO3 +5 CO. Химические свойства. Валентные возможности атома фосфора по методу ВС 3 и 5,степени окисления в соединениях изменяются от -3 до +5,у атома фосфора в отличие от атома азота имеется возможность донорно-акцепторного механизма за счет свободных d-орбиталей. Окисление фосфора ведет к Двум оксидам P4O6 и P4OШ,первый образуется при недостатке кислорода(избытке фосфора),а второй-при избытке кислорода P4+3O2^.)=P4O6 P4+5O2(hs6.)=P4O10 В молекулах этих оксидов сохраняется тетраэдрическое строение молекулы белого фосфора. В оксиде P4O6 каждое ребро тетраэдра P4 «встраивается» атом кислорода, а в оксиде P4O10-еще и к каждому атому фосфора, находящемуся в вершинах тетраэдра, присоединяется по атому кислорода. Фосфор реагирует сравнительно легко с серой, галогенами и другими неметаллами: Р4+6Г2(недост)=4РГ3 Р4+10Г2(изб)=4РГ5 P4+10S=P4S10 (и другие соединения) При спекании порошков металлов с фосфором образуются Фосфиды металлов P4+6Zn=t=2Zn3P2 12K+P4=4K3P Фосфор безразличен к водным растворам минеральных кислот. Медленно реагирует с кислотами-окислителями: 3P4+20HNO3 (конц)+8Н20= 12H3PO4+20NO P4+20HNO3 (конц)=4HP03+20NO2+8H2O P4+10H2 S04(конц)=4HP04+10 S02+4H20 В теплом растворе щелочи P4 диспропорционирует P4+3NAOH+3H2O=PH3+3NaH2PO2 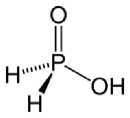  гипофосфитами являются хорошими фосфора 3 и 5,находят применение для химической Фосфорноватистая кислота может быть получена P4+3Ba(OH)2+6H2O=PH3+3Ba(H2PO2)2 Ba(H2PO2)2+H2SO4=BaSO4+2H3PO2 H3P02-одноосновная, достаточно сильная Соли фосфорноватистой кислоты называются восстановителями,легко окисляются до соединений металлизации диэлектриков: H3PO2+4AgNO3+2H2O=H3PO4+4Ag+4HNO3 2CuSO4+NaH2PO2+2H2O=2Cu+NaH2PO4+2H2SO4. Ангидрида кислота H3PO2 не имеет. Фосфористая кислота, H2(PHO3), двухосновная в водных растворах, а формально трёхосновная кислота средней силы. Р406+6Н20(холод)=4НЗРОЗ ’ |
