Вопросы и упражнения
для повторения и самостоятельной работы
Сформулируйте основной круг задач, решаемых в химической технологии при выборе технологического режима на основании законов химической термодинамики.
Как определить направленность химической реакции? Как, сравнивая значения энергии Гиббса ∆G для различных реакций, определить, какая из них является спонтанной (самопроизвольной)?
Сформулируйте основные условия устойчивого равновесия.
Что характеризует химическое равновесие?
Вычислите величины Кc, KN, Кnдля равновесной реакции
С6Н5 – С2Н5 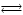 С6Н5 – СН = СН2 + Н2, С6Н5 – СН = СН2 + Н2,
если при температуре 580 °С найдена Kр = 0,20, общее давление р = 0,005 МПа.
Сформулируйте принцип Ле Шателье. Как он помогает предсказать влияние изменения температуры и давления на состояние равновесия химической реакции?
Используя принцип Ле Шателье, проанализируйте для приведенных реакций все возможные способы смещения равновесия вправо:
N2 + 3H2 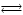 2NH3 ∆H < 0; 2NH3 ∆H < 0;
CH4 + H2O 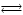 CO + 3H2 ∆H > 0; CO + 3H2 ∆H > 0;
СО + Н2О 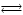 СО + Н2 ∆H < 0; СО + Н2 ∆H < 0;
2С2Н5ОН 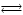 С4Н6 + 2Н2О + Н2 ∆Н > 0. С4Н6 + 2Н2О + Н2 ∆Н > 0.
Выведите уравнение для расчета равновесной степени превращения реагента А по известной величине Кc(для реакции 2А 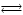 R). R).
Выведите уравнение для расчета равновесной степени превращения реагента А по известным значениям Кри давления р в системе для реакции А + В 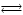 R. R.
Выведите уравнение для расчета равновесного состава участников реакции синтеза аммиака по известным значениям Kp, и давления p в системе.
Рассчитайте константу равновесия для реакции СО2 + С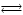 2СО, если известно, что для СО2 2СО, если известно, что для СО2 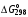 = –394572 и для СО = –394572 и для СО 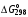 = –137334 Дж/моль. = –137334 Дж/моль.
Найдите константу равновесия при температурах 500 и 2000 К для реакции Н2О + СО 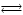 Н2 + СО2, если Н2 + СО2, если 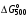 = 20,2 кДж/моль и = 20,2 кДж/моль и 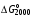 = 25,3 кДж/моль. = 25,3 кДж/моль.
Почему можно исключить из выражения для константы равновесия концентрации компонентов, являющихся чистыми твердыми веществами или жидкостями?
Глава 3
ИСПОЛЬЗОВАНИЕ ЗАКОНОВ ХИМИЧЕСКОЙ
КИНЕТИКИ ПРИ ВЫБОРЕ ТЕХНОЛОГИЧЕСКОГО
РЕЖИМА И МОДЕЛИРОВАНИИ
ХИМИЧЕСКИХ ПРОЦЕССОВ
Химическая термодинамика позволяет решать вопрос о направлении протекания химических реакций и оценить предельно достижимые (равновесные) состояния реакционной системы. Однако она не может ответить на вопросы, имеющие чрезвычайно важное практическое значение в химической технологии: как быстро произойдет химическое превращение, за какой промежуток времени будет получено то или иное количество продукта реакции.
Решающее значение при выборе условий проведения химико-технологических процессов имеют вопросы скорости химических превращений, изучаемые химической кинетикой.
Для химической технологии важен конечный результат кинетических исследований – конкретный вид уравнения, позволяющего рассчитывать скорость химической реакции при различных условиях ее проведения. Кинетические уравнения, содержащие необходимую информацию об основных закономерностях химических превращений, являются первоосновой математической модели химического реактора. Без знания кинетических закономерностей невозможно правильно выбрать тип реактора и рассчитать его конструктивные размеры.
Вопросы изучения кинетики химических реакций, определения кинетических параметров подробно рассматриваются в руководствах по физической химии и химической кинетике. Здесь основное внимание будет обращено на практические приложения результатов кинетических исследований.
|
 Скачать 1.75 Mb.
Скачать 1.75 Mb.