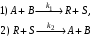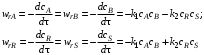|
|
Общая химическая технология
Скорость химической реакции wrJпринято выражать количеством (моль) nJ одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени τ в единице реакционного пространства.
Для гомогенной химической реакции
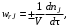 (3.1) (3.1)
где V – реакционный объем.
Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции. Она всегда положительна, поэтому знак перед производной dnJ/dτ должен определяться тем, является ли вещество J исходным реагентом (тогда dnJ/dτ отрицательна) или продуктом (тогда dnJ/dτ положительна). Иногда нельзя определенно сказать, является ли вещество J реагентом или продуктом. Например, при протекании последовательных реакций
A 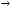 R, R,
R 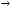 S S
вещество R является продуктом по отношению к первой стадии и реагентом по отношению ко второй. В этом случае необходимо, чтобы знак перед производной находился в определенном соответствии со знаками в кинетическом уравнении (см. § 3.2).
В том случае, если реакция протекает при постоянном объеме, скорость определяют как изменение молярной концентрации с в единицу времени:
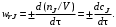 (3.2) (3.2)
Если химическая реакция описывается стехиометрическим уравнением
аА + bB + сС +… 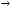 rR + sS + qQ ..., rR + sS + qQ ...,
то изменения количеств реагентов и продуктов 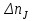 , в результате ее протекания связаны между собой соотношениями (1.3). Скорости реакции, определенные по изменению количества различных реагентов в соответствии с уравнениями (3.1) или (3.2), количественно различаются между собой, если не равны стехиометрические коэффициенты у этих реагентов. , в результате ее протекания связаны между собой соотношениями (1.3). Скорости реакции, определенные по изменению количества различных реагентов в соответствии с уравнениями (3.1) или (3.2), количественно различаются между собой, если не равны стехиометрические коэффициенты у этих реагентов.
В то же время из уравнений (3.1) и (1.3) следует, что для скоростей реакции, рассчитанных по изменению количества разных реагентов или продуктов, будет выполняться условие
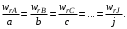
Такая ситуация создает некоторые неудобства в количественном определении скорости реакции, так как измеренная по изменению количеств различных реагентов скорость одной и той же реакции будет выражаться различными числовыми значениями. Для устранения этого неудобства далее будем определять скорость реакции по уравнению
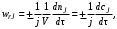 (3.3) (3.3)
где j – стехиометрический коэффициент у компонента J, по которому рассчитывают скорость реакции.
Тогда скорость «приводится к общему знаменателю» и независимо от того, по изменению количества какого конкретного реагента или продукта она определялась, численно будет одинакова, т. е.
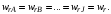
Экспериментально скорость химической реакции определяют, изучая изменение во времени количества (или концентрации) некоторого реагента или продукта.
Численно скорость реакции выражают в единицах концентрации, отнесенных к единице времени, например: кмоль·м–3·ч–1; моль·л–1·с–1 и т. д.
§ 3.2. Зависимость скорости химических реакций
от концентрации реагентов. Кинетические уравнения
Скорость химического превращения зависит от большого числа переменных. Результаты экспериментальных исследований различных реакций показали, что на скорость влияют не только факторы, определяющие состояние химического равновесия (температура, давление, состав реакционной системы), но и иные причины, такие, как наличие или отсутствие посторонних веществ, не претерпевающих изменений в результате реакции, условия физической транспортировки реагентов к реакционным центрам и др.
Факторы, оказывающие влияние на скорость химического превращения, обычно подразделяют на две группы:
– чисто кинетические (микрокинетические), определяющие скорость взаимодействия на молекулярном уровне;
– макрокинетические, определяющие влияние на скорость реакции условий транспорта реагентов к зоне реакции, наличия или отсутствия перемешивания, геометрических размеров реактора.
Рассмотрим сначала влияние микрокинетических факторов на скорость химических реакций.
Законы химической кинетики основаны на двух простых принципах (постулатах), впервые установленных при изучении реакций в растворах:
скорость химической реакции пропорциональна концентрациям реагентов;
суммарная скорость нескольких последовательных превращений, широко различающихся по скорости, определяется скоростью наиболее медленной стадии.
Функциональная зависимость скорости химической реакции от концентраций компонентов реакционной смеси
wr = wr(cA,сВ, ...,сJ)
называется кинетическим уравнением реакции.
В химической кинетике принято делить химические реакции на элементарные и неэлементарные (сложные).
Элементарными (одностадийными) называются реакции, осуществление которых связано с преодолением одного энергетического барьера при переходе из одного состояния реакционной системы в другое. Механизм такой реакции соответствует ее стехиометрическому уравнению.
Кинетическое уравнение необратимой элементарной реакции
аА + bB  rR + sS (I) rR + sS (I)
в соответствии с первым постулатом, основанном на законе действующих масс, имеет вид
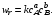 (3.4) (3.4)
Коэффициент пропорциональности k,входящий в кинетическое уравнение (3.4), называют константой скорости химической реакции. Целочисленные показатели степени а и b уконцентраций реагентов А и В в кинетическом уравнении (3.4) для элементарной реакции называются порядками реакции по реагентам соответственно А и В. Их сумма а + b = n называется общим порядком реакции. Для элементарных реакций частные порядки (порядки реакций по отдельным реагентам) равны соответствующим стехиометрическим коэффициентам в уравнении реакции.
Наряду с понятием «порядок реакции» в химической кинетике используют понятие «молекулярность реакции». Молекулярность реакции равняется минимальному числу молекул, одновременно принимающих участие в одном элементарном акте реакции.
Для элементарных реакций порядок равен молекулярности и может иметь значения 1, 2, 3. Порядок (или молекулярность) элементарных реакций не превышает значения 3, так как вероятность одновременного столкновения более чем трех молекул чрезвычайно низка.
Однако большинство химических реакций не являются элементарными: они протекают через ряд промежуточных стадий. Стехиометрическое уравнение неэлементарной (сложной) реакции отражает лишь начальное и конечное состояния данной реакционной системы и не описывает механизм реакции.
Сложную реакцию иногда удобно рассматривать как формально простую,т. е. считать, что она протекает в одну, а не в несколько стадий. Так можно поступить, если в условиях рассматриваемой задачи промежуточные продукты не обнаруживаются.
Для формально простой реакции
аА + bВ + dD 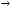 rR + sS + qQ rR + sS + qQ
кинетическое уравнение по аналогии с простой (элементарной) реакцией можно записать в следующем виде:
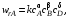
где частные порядки реакции α, β и δ находят экспериментально. В общем случае α ≠ a,β ≠ b, δ ≠ d,т. е. молекулярность и порядок реакции не совпадают. Полный порядок реакции п = α + β + δ и частные порядки в таком уравнении могут быть целочисленными, но могут быть и дробными, так как закон действующих масс, предполагающий целочисленные показатели степеней у концентраций в кинетическом уравнении, строго применим только к элементарным реакциям.
Наряду с неэлементарными реакциями, которые можно рассматривать как формально простые, существует много сложных реакций, которые явно распадаются на стадии (продукты различных стадий образуются в значительных количествах).
Простейшими типами сложных реакций являются параллельные и последовательные реакции.
В параллельных реакциях взаимодействие одних и тех же реагентов может протекать по различным реакционным путям с образованием различных продуктов. В качестве примера можно указать на параллельные реакции окисления аммиака, продуктами которых могут быть или оксид азота NО, или оксид диазота N2О, или азот N2.
В последовательных реакциях продукт первой реакции является исходным реагентом для второй. Реакция может состоять как из двух, так и из большего числа стадий, следующих друг за другом. Примером таких реакций могут служить реакции расщепления углеводородов с длинной углеродной цепочкой на все более мелкие молекулы.
В случае если известен механизм сложной реакции (элементарные стадии, через которые она протекает), скорость реакции по одному из веществ – ее участников – равна алгебраической сумме скоростей тех элементарных стадий, в которых это вещество принимает участие.
При определении знаков у членов этой суммы удобно пользоваться формальным правилом: производной концентрации данного компонента по времени dcJ/dτ приписывают знак минус независимо от того, является ли компонент J исходным реагентом или продуктом реакции; скорости элементарных стадий, в которых компонент J расходуется (является реагентом), записывают в общей сумме со знаком плюс, скорости стадий, в которых компонент J образуется (является продуктом), – со знаком минус.
Пример 3.1. Составим кинетическое уравнение по веществам R и А – участникам сложной реакции:
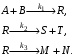
Эта реакция состоит из трех стадий. Вторая и третья стадии являются последовательными по отношению к первой и параллельны по отношению друг к другу. Скорость по компоненту R, участвующему во всех трех реакциях,
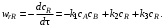
Скорость по исходному реагенту А, участвующему лишь в первой элементарной стадии,
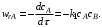
Пример 3.2. Обратимую реакцию
А+ В 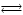 R+ S R+ S
с точки зрения химической кинетики можно рассматривать как сложную, состоящую из двух стадий:
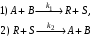
Поэтому с помощью уравнений
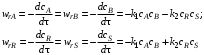
можно записать скорость исчезновения или образования участников этой реакции.
|
|
|
 Скачать 1.75 Mb.
Скачать 1.75 Mb.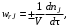 (3.1)
(3.1)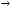 R,
R,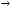 S
S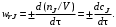 (3.2)
(3.2)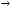 rR + sS + qQ ...,
rR + sS + qQ ...,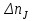 , в результате ее протекания связаны между собой соотношениями (1.3). Скорости реакции, определенные по изменению количества различных реагентов в соответствии с уравнениями (3.1) или (3.2), количественно различаются между собой, если не равны стехиометрические коэффициенты у этих реагентов.
, в результате ее протекания связаны между собой соотношениями (1.3). Скорости реакции, определенные по изменению количества различных реагентов в соответствии с уравнениями (3.1) или (3.2), количественно различаются между собой, если не равны стехиометрические коэффициенты у этих реагентов.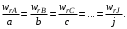
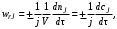 (3.3)
(3.3)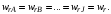

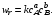 (3.4)
(3.4)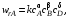
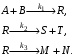
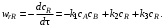
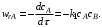
 R+ S
R+ S