Вопросы и упражнения
для повторения и самостоятельной работы
Чем различаются определения скорости гомогенной и гетерогенной химических реакций?
Как взаимосвязаны между собой реальные скорости образования или расходования отдельных участников реакции aA + bB 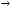 rR + sS? rR + sS?
В чем заключается различие между микрокинетикой и макрокинетикой?
Что такое частный порядок реакции по компоненту J? Как взаимосвязаны частные порядки по разным компонентам и общий порядок реакции?
Какие реакции называют простыми, формально простыми, сложными?
Как составляют кинетические уравнения простых реакций?
Как составляют кинетические уравнения сложных реакций:
а) с известным механизмом реакции;
б) с неизвестным механизмом реакции?
Используя правило составления кинетических уравнений сложных реакций (см. § 3.2), запишите кинетические уравнения для расчета скорости по веществам А, В, R и М для сложной реакции
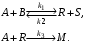
При постоянной температуре протекают две параллельные реакции:
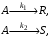
характеризующиеся значениями констант скорости k1 = 10–3 с–1, k2 = 10–2 с–1. Перед началом реакции сA,0 = 2 кмоль/м3, cR,0 = CS,0 = 0. Определите значения скорости химической реакции по исходному реагенту А (w > rА) и продукту S в момент времени, когда cR = 0,05 кмоль/м3, CS = 0,5 кмоль/м3.
Протекает сложная реакция
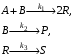
при температуре, когда константы скоростей отдельных элементарных реакций имеют следующие значения: k1= 0,02 м3/(кмоль·с), k2= 0,0015 с–1, k3 = 0,0028 c–1. Начальный состав реакционной смеси: сА,0 = 0,1 кмоль/м3, сB,0 = 0,3 кмоль/м3, cR,0 = cS,0 = сР,0 = 0. В реакторе установились концентрации продуктов: cR = 0,028 кмоль/м3, ср= 0,05 кмоль/м3; степень превращения исходного реагента хА= 0,2. Определите значения скоростей химической реакции по веществам R и Р.
Протекает сложная реакция
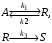
при температуре, когда константы скоростей отдельных элементарных реакций имеют следующие значения: k1 = 0,0028 c–1, k2 = 0,051 c–1, k3 = 0,0032 c–1. Начальная концентрация исходного реагента сА,0=1,65 кмоль/м3; фактическая степень превращения исходного реагента хАсоставляет 30 % от равновесной степени превращения хА,e; концентрация продукта RcR= 0,15 кмоль/м3. Определите значение скорости реакции по продукту R (wrR).
От каких микрокинетических факторов зависит скорость химической реакции?
В гомогенной химической реакции участвуют два реагента А и В. Реакция имеет первый порядок по реагенту А и второй порядок по реагенту В. Увеличение концентрации какого реагента даст больший эффект увеличения скорости реакции?
Выведите уравнение зависимости дифференциальной селективности от концентрации реагента А для параллельных реакций, имеющих разный порядок по реагенту А.
Вещества А и В участвуют в двух параллельных реакциях, причем частный порядок по реагенту А выше в целевой реакции, а частный порядок по реагенту В выше в побочной реакции. Какие можно сделать рекомендации по изменению концентраций реагентов для обеспечения высокой дифференциальной селективности? Как можно эти рекомендации выполнить при технологическом оформлении процесса?
Запишите уравнение Аррениуса в дифференциальной, интегральной и логарифмической формах. В чем суть уравнения Аррениуса?
Определите энергию активации реакции, если при изменении температуры с 450 до 500 °С ее скорость возрастет в 2,73 раза.
При температуре 748 К константа скорости реакции составляет 3,2·105 ч–1.Определите константу скорости этой реакции при температуре 793 К, если ее энергия активации Е = 87,9 кДж/моль.
При проведении кинетических экспериментов определены следующие значения константы скорости химической реакции (м3/(кмоль·ч)) при различных температурах (К):
Т 298 323 348 373 398 м3/(кмоль·ч).
K 0,51 0,82 1,35 1,92 2,62 К.
Определите энергию активации реакции.
Для реакции n-го порядка
nА 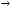 Продукты Продукты
экспериментально получена зависимость концентрации реагента (кмоль/м3) от времени проведения реакции (мин) в периодическом реакторе при постоянной температуре:
τ, мин 0 1 2 3 4 5;
сА, кмоль/м3 2,00 0,96 0,63 0,47 0,39 0,31.
Определите порядок реакции и вычислите константу скорости.
Почему эффективность повышения температуры, как средства относительного увеличения скорости реакции, выше при низких температурах, чем при высоких температурах?
Проанализируйте зависимость дифференциальной селективности от температуры для двух параллельных реакций одинакового порядка.
Две параллельные реакции
а1А + b1В 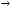 rR + sS (целевая реакция); rR + sS (целевая реакция);
a2А + b2В 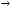 yY + zZ (побочная реакция) yY + zZ (побочная реакция)
характеризуются кинетическими уравнениями
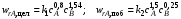
и энергиями активации E1 = 45 кДж/моль, Е2= 65 кДж/моль.
Проанализируйте зависимость дифференциальной селективности для такой системы реакций:
а) от концентрации реагента А;
б) от концентрации реагента В;
в) от температуры.
Какие можно дать рекомендации по выбору технологического режима для этого процесса на основе проведенного анализа?
Две параллельные реакции характеризуются одинаковым порядком и различными значениями энергии активации: энергия активации целевой реакции равна 84 кДж/моль, энергия активации побочной реакции – 45 кДж/моль. Как повлияет увеличение температуры на дифференциальную селективность? Во сколько раз изменится дифференциальная селективность φ' при увеличении температуры проведения реакции от 100 до 500 °С?
|
 Скачать 1.75 Mb.
Скачать 1.75 Mb.