|
|
Скрипко Т.В. Общая и неорганическая химия Практикум. Общая и неорганическая химия
Низшее энергетическое состояние:
33As 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 4d0
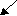
    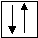 
Валентность равна трем
_____________________________________________________________________
27Co 1s2 2s2 2p6 3s2 3p6 3d7 4s2 4p0
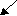

         
Валентность равна трем
_____________________________________________________________________
38Sr 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d0 4f0 5s2 5p0
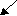
  
Валентность равна нулю
___________________________________________________________________
Высшее энергетическое состояние:
33As* 1s2 2s2 2p6 3s2 3p6 3d10 4s1 4p3 4d1
   
 

Валентность равна пяти
___________________________________________________________________
27Co* 1s2 2s3 2p6 3s2 3p6 3d7 4s1 4p1

      
  
Валентность равна пяти
_____________________________________________________________________
38Sr* 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d0 4f0 5s1 5p1

 
Валентность равна двум
При выполнении заданий рекомендуется использовать учебное пособие [9].
В задачах 881–890 составить электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразить орбитали внешнего энергетического уровня
№ задачи
|
Элементы
|
№ задачи
|
Элементы
|
881
882
883
884
885
|
Ba, B
Al, Sr
Ge, Se
Pb, Mg
Sb, Cd
|
886
887
888
889
890
|
Ga, Bi
Si, Ra
Sn, Cl
Be, As
S, I
|
В задачах 891–896 определить, какие частицы являются изоэлектронными, то есть содержащими одинаковое число электронов. Написать электронные формулы данных частиц
№ задачи
|
Частицы
|
№ задачи
|
Частицы
|
891
892
893
|
Se, As3+ , Ge2+ , Br-
Kr, Sr2+ , Se2-, Br-
Mg, Si, Al3+, S2-
|
894
895
896
|
Fe2+, Cr3+, Co3+, Ni2+
Ti, V3+, Cr2+, Fe3+
Sn2+, Sb3+, Cd, Sn4+
|
В задачах 897–906 , пользуясь правилом Хунда, распределить электроны по квантовым ячейкам (орбиталям), отвечающим низшему и высшему энергетическому состоянию атомов элементов
№ задачи
|
элементы
|
№ задачи
|
элементы
|
897
898
899
900
901
|
As, Co, Sr
Mo, Sb, Ca
Pb, In, Be
Th, As, Fe
Te, Ac, Cr
|
902
903
904
905
906
|
Sm, Pb, Ag
Os, Se, Na
B, Re, Mn
La, Xe, Ba
I, Hg, S
|
7. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексными соединениями называются определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии.
В молекуле комплексного соединения различают комплексообразователь (центральный атом) – обычно положительно заряженный ион металла (реже неметалла), вокруг которого расположены (координированы) отрицательно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Общее число -связей, образуемых комплексообразователем с лигандами, называется координационным числом. Координационное число показывает число мест вокруг комплексообразователя, на которых могут размещаться лиганды.
Теория метода валентных связей рассматривает образование комплексных ионов при донорно-акцепторном взаимодействии неподеленных электронных пар лигандов и свободных орбиталей комплексообразователя.
Различают моно-, ди- и более дентатные лиганды (полидентатные). Монодентатными называются лиганды, занимающие одно координационное место. К ним относятся одноатомные ионы O–2, S2–, Cl–, Br–, I– и более сложные: CN–, SCN–, NO2–, а также нейтральные лиганды H2O, NH3 и многие другие. Примерами дидентных лигандов могут служить оксалат ион C2O42–, сульфат ион SO42– и некоторые другие.
За пределами внутренней сферы комплексного соединения находится его внешняя сфера. Ионы внешней сферы связаны с комплексным ионом в основном электростатическими силами и в растворах легко отщепляются подобно ионам сильных электролитов (первичная диссоциация комплексного соединения). Диссоциация внутренней сферы осуществляется в незначительной степени, ступенчато и характеризуется константой нестойкости Кн (вторичная диссоциация).
При составлении названий комплексных соединений надо пользоваться следующими правилами.
1. Первым в именительном падеже называют анион, а потом в родительном - катион, независимо от того, который из них комплексный.
2. Перечисляют в порядке увеличения их сложности: лиганды-анионы, лиганды-молекулы, лиганды-катионы, а затем указывают центральный атом (ц.а.). Если ц.а. входит в состав комплексного катиона, то используют русское название элемента, в скобках римской цифрой указывают степень его окисления. Если ц.а. входит в состав комплексного аниона, используют латинское название элемента с суффиксом - ат, после него римской цифрой в скобках обозначают степень окисления.
3. К названиям лигандов-анионов прибавляют суффикс "о" (С1– - хлоро, CSN– - тиоциано). Нейтральные лиганды суффикса "о" не имеют (H2O -аква, NН3–аммин, СО - карбонил).
Примеры составления задач и их решение
Задача 915
Определить степень окисления и координационное число комплексобразователя в комплексном соединении [CrBr(NH3)4(H2O)]Cl2. Написать уравнение первичной диссоциации комплексного соединения. Определить гибридные орбитали и пространственную структуру комплексного иона. Назвать комплекс.
Решение:
Комплексообразователем является хром. По внешней сфере определяем заряд комплексного иона [CrBr(NH3)4(H2O)]2+. Зная заряд комплексного иона, определяем степень окисления комплексообразователя [CrBr(NH3)4(H2O)]2+:
X + (-1) = +2,
X = 3.
Следовательно, степень окисления хрома равна трем (III).
Лигандами являются ион Вг– и нейтральные молекулы NН3, Н2O . Все лиганды монодентантные. Координационное число равно количеству лигандов, т.е. шести.
В растворах комплексные соединения подвергаются диссоциации с отщеплением внешней сферы по типу диссоциаций сильных электролитов (первичная диссоциация):
[CrBr(NH3)4(H2O)]Cl2 = [СrВг(NН3)4(Н2O)]2+ + 2Сl-.
Изобразим электронно-графическую формулу иона Сr3+:
3d3 4s0 4р0

Cr3+ ….3d34s04p0 .
В образовании связей с лигандами участвуют свободные орбитали 3d, 4s и 4р: происходит d2sp3 – гибридизация:
d2sp3 - гибридизация


   
C             r3+ + Br- +4NH3 + H2O r3+ + Br- +4NH3 + H2O
Br– NH3 NH3 NH3 NH3 H2O
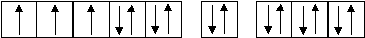
 [CrBr(NH3)4(H2O)]2+ [CrBr(NH3)4(H2O)]2+
Пространственная структура иона [CrBr(NH3)4(H2O)]2+ – октаэдр.
Комплексное соединение [CrBr(NH3)4(H2O)]Cl2 называется хлорид акватетраамминбромохрома (III).
При выполнении заданий рекомендуется использовать методические указания [10].
В задачах 907–921 указать для перечисленных ниже комплексных соединений комплексообразователь, координационное число, степень окисления комплексообразователя. Написать уравнения первичной диссоциации комплексных соединений. Определить гибридные орбитали и пространственную структуру комплексных ионов. Назвать комплексы
№ задачи
|
Комплексное соединение
|
№ задачи
|
Комплексное соединение
|
907
908
910
911
912
913
914
|
К3[Со(NО2)6]
[PdCl(NH3)2H2O]Cl
Ba[Cu(CN)2(SCN)2]
[PdCl2(CO3)(NH3)2]
[Co(CN)(H2O) NH3)2]Cl2
K4[Mo(CN)8(H2O)2]
K3[Ag(S2O3)2]
|
915
916
917
918
919
920
921
|
[СrВr(NН3)4Н2O]Сl2
H[Co(CN)4(H2O)2]
[CoSO4(NH3)4]NO3
(NH4)2[PtCl4(OH)2]
[Co(NO2)2(NO3)(NH3)3]
Na2[PtCI2(CN)4]
[Сu(NН3)4]SO4
|
В задачах 922–937 написать формулы комплексных соединений, указать комплексообразователь, координационное число, степень окисления комплексообразователя. Составить уравнения первичной диссоциации комплексных соединений. Определить гибридные орбитали и пространственную структуру комплексных ионов
№
задачи
|
Комплексное соединение
|
922
923
924
925
926
927
928
929
930
931
932
933
934
935
936
937
|
Бромид цианоакватетрааммин кобальта (III)
Нитрат гидроксоаквадиамминплатины (II)
Хлорид нитрохлоротетраплатины (IV)
Дицианоаргентат (I) калия
Гексацианоферрат (II) калия
Тринитротриамминкобальт
Тетрагидроксоцинкат калия
Нитрат тиоцианопентаамминкобальта (Ш)
Тетрацианоплатинат (II) калия
Бромид аквахлородиамминпалладия (II)
Дигидроксотетрахлорплатинат (IV) аммония
Хлорид гексаамминникеля (II)
Гексанитрокобальтат (III) натрия
Тетрахлороаурат (I) калия
Пентакарбонилжелезо
Гидроксид тетрацианоникеля (II)
|
Библиографический список
Основные законы и закономерности протекания химических процессов: Метод. указания / Сост. Г.Ф. Бродовская. Омск: Изд-во ОмПИ, 1992.
Основные классы неорганических соединений: Метод. указания к лабораторной и самостоятельным работам / Сост. А.В. Юрьева. Омск: Изд-во ОмГТУ, 1994.
Химическая кинетика и химическое равновесие: Метод. указания к лаб. и самост. работе / Сост. А.В. Юрьева. Омск: Изд-во ОмПИ, 1990.
Окислительно-восстановительные реакции: Метод. указания к лаб. и самост. работе / Сост. Л.Н. Котова. Омск: Изд-во ОмПИ, 1992.
Электрохимические процессы, протекающие в гальванических элементах: Метод. указания к самост. и лаборат. работам по химии / Сост. Г.Ф. Бродовская. Омск: Изд-во ОмГТУ, 1997.
Электрохимические процессы, протекающие при электролизе: Метод. указания к самост. и лаборат. работам по химии / Сост. Г.Ф. Бродовская, Л.Н. Антропова. Омск: Изд-во / ОмГТУ, 2000.
Растворы: Метод. указания к самост. и лаборат. работам по химии / Сост. Г.М. Зелева, А.В. Юрьева. Омск: Изд-во ОмПИ, 1989.
Ионное произведение воды. Гидролиз солей: Метод. указания / Сост. А.В. Юрьева. Омск: Изд-во ОмГТУ, 1991.
А.В. Юрьева, Л.Н. Котова Общая химия. Строение атома и химическая связь: Практикум. – Омск: Изд-во ОмГТУ, 1997.
Комплексные соединения: Метод. указания к самостоятельным и лабораторным работам / Сост. Г.М. Зелева, А.В. Юрьева. Омск: Изд-во ОмПИ, 1989.
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ
|
3
|
1. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
4
|
2. ГАЗОВЫЕ ЗАКОНЫ. ПРОСТЕЙШИЕ СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ
|
14
|
2.1. Взаимозависимые параметры состояния газов
|
14
|
2.2. Химические эквиваленты
|
16
|
3. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ РЕАКЦИЙ
|
20
|
3.1. Энергетика химических реакций. Химико-термодинамические расчеты
|
20
|
3.2. Скорость химических реакций и химическое равновесие
|
25
|
4. ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
|
32
|
4.1. Окислительно-восстановительные реакции
|
32
|
4.2. Гальванические элементы
|
42
|
4.3. Электролиз
|
48
|
5. РАСТВОРЫ
|
57
|
5.1 Способы выражения содержания растворенного вещества в растворе
|
57
|
5.2. Физико-химические свойства разбавленных растворов неэлектролитов
|
59
|
5.3. Растворы электролитов
|
66
|
5.4. Ионное произведение воды. Водородный показатель
|
71
|
5.5. Молекулярно-ионные уравнения обменных реакций между растворами
Электролитов
|
74
|
5.6. Произведение растворимости
|
75
|
5.7. Гидролиз солей
|
78
|
6. СТРОЕНИЕ АТОМА
|
82
|
7. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
|
87
|
Библиографический список
|
90
|
ПРИЛОЖЕНИЯ
|
92
|
Таблица 1 Кислоты и кислотные остатки
|
92
|
Таблица 2 Растворимость соединений
|
95
|
Таблица 3 Термодинамические константы некоторых веществ
|
96
|
Таблица 4 Электрохимический ряд напряжений металлов (стандартные электродные петенциалы)
|
101
|
Таблица 5 Криоскопические и эбуллиоскопические константы растворителей
|
102
|
Таблица 6 Коэффициенты активности ионов при различной ионной силе растворов
|
102
|
Таблица 7 Константа диссоциации некоторых электролитов
|
104
|
Таблица 8 Произведение растворимости некоторых малорастворимых в воде электролитов для температур 18-25 °С
|
107
|
ПРИЛОЖЕНИЯ
Таблица 1
Кислоты и кислотные остатки
Кислота
|
Кислотный
остаток
|
Н а з в а н и я
|
Кислоты
|
кислотного остатка (соли)
|
1
|
2
|
3
|
4
|
HalO2
|
AlO2–
|
Метаалюминиевая
|
метаалюминат
|
HAsO2
H3AsO3
HAsO3
H3AsO4
H3AsS3
H3AsS4
|
AsO2–
AsO33-
AsO3–
AsO43–
AsS33–
AsS43–
|
метамышьяковистая
ортомышьяковистая
метамышьяковая
ортомышьяковая
тиомышьяковистая
тиомышьяковая
|
метаарсенит
ортоарсенит
метаарсенат
ортоарсенат
тиоарсенит
тиоарсенат
|
H3AuO3
HAuCl4
|
AuO33–
AuCl4–
|
золотая
тетрахлорозолотая (золотохлористоводородная)
|
аурит
хлороаурат
|
HBO2
H3BO3
H2B4O7
|
BO2–
BO33–
B4O72–
|
метаборная
ортоборная
четырехборная
|
метаборат
ортоборат
тетраборат
|
H2BeO2
|
BeO22–
|
Берилливая
|
бериллат
|
HBiO3 *
|
BiO3-
|
Висмутовая
|
висмутат
|
HBr
HBrO
HBrO3
HBrO4
|
Br-
BrO-
BrO3-
BrO4-
|
бромоводород
бромноватистая
бромноватая
бромная
|
бромид
гипобромид
бромат
пербромат
|
HCOOH
CH3COOH
HCN
H2CO3
H2C2O4
|
HCOO-
CH3COO-
CN-
CO32-
C2O42-
|
муравьиная
уксусная
циановодород (синильная)
угольная
щавелевая
|
формиат
ацетат
цианид
карбонат
оксалат
|
HCl
HClO
HClO2
HClO3
HClO4
|
Cl–
ClO-
ClO2-
ClO3-
ClO4-
|
хлороводород (соляная)
хлорноватистая
хлористая
хлорноватая
хлорная
|
хлорид
гипохлорид
хлорит
хлорат
перхлорат
|
HCrO2
H2CrO4
H2Cr2O7
|
CrO2-
CrO42-
Cr2O72-
|
метахромистая
хромовая
двухромовая
|
метахромит
хромат
дихромат
|
HF
|
F–
|
фтороводородная (плавиковая)
|
фторид
|
Продолжение табл. 1
|
1
|
2
|
3
|
4
|
HFeO2
H2FeO4
|
FeO2-
FeO42-
|
железистая
железная
|
феррит
феррат
|
H2GeO3
|
GeO32-
|
германиевая
|
Германат
|
HI
HIO
HIO3
HIO4
H5IO6
|
I-
IO-
IO2-
IO4-
IO65-
|
иодоводород
иодноватистая
иодноватая
метаиодная
ортоиодная
|
иодид
гипоиодид
иодат
метапериодат
ортопериодат
|
H2MnO4 *
HMnO4
|
MnO42-
MnO4-
|
марганцовистая
марганцовая
|
манганат
перманганат
|
H2MoO4*
|
MoO42–
|
молибденовая
|
Молибдат
|
HN3
HNO2
HNO3
H2N2O2
|
N3–
NO2–
NO3–
N2O2–
|
азиводород (азотистоводородная)
азотистая
азотная
азотноватистая
|
азид
нитрит
нитрат
гипонитрит
|
H2OsO4
|
OsO42–
|
осьмиевая
|
Осмат
|
HSbO2
H3SbO3
H3SbO4
|
SbO2
SbO33–
SbO43–
|
метасурьмянистая
сурьмянистая
сурьмяная
|
метаантимонит
антимонит
антимонат
|
H(PH2O2)
H2(PHO3)
H3PO2
H3PO3
HPO3
H3PO4
H4P2O7
|
PH2O2–
PHO32–
PO23–
PO33–
PO3–
PO43–
P2O74–
|
фосфиновая
фосфоновая
фосфорноватистая
фосфористая
метафосфорная
ортофосфорная
дифосфорная
|
фосфинат
фосфонат
гипофосфит
фосфит
метафосфат
ортофосфат
дифосфат
|
H2PbO2*
H2PbO3*
|
PbO22-
PbO32-
|
свинцовистая
свинцовая
|
плюмбит
плюмбат
|
H2PtO4
H2[PtCl6]
H2[Pt(CN)4]
|
PtO42–
PtCl62–
[Pt(CN)4]2–
|
платиновая
гексахлороплатиновая (платинохлористоводородная)
тетрацианоплатиновая (II)
|
платинат
хлорплатинат
тетрацианоплатинат
|
HReO4
|
ReO43–
|
рениевая
|
Перренат
|
H2RuO4*
|
RuO42–
|
рутеневая
|
Рутенат
|
H2S
HSCN
H2SO3
H2SO4
H2S2O7
H2SnO6
H2S4O6
|
S2–
SCN–
SO32–
SO42–
S2O72–
SnO62–
S4O62–
|
сероводород
родановодород
сернистая
серная
дисерная
политионовая
тетратионовая
|
сульфид
роданид
сульфит
сульфат
дисульфат
политионат
тетратионат
|
Окончание табл. 1
|
1
|
2
|
3
|
4
|
H2S2O3
H2S2O6
|
S2O32–
S2O62–
|
тиосерная
пероксодвусерная
|
тиосульфат
пероксодисульфат
|
H2Se
H2SeO3
H2SeO4
H2Se2O7
|
Se2–
SeO32–
SeO42–
Se2O72–
|
селеноводород
селенистая
селеновая
диселеновая
|
селенид
селенит
селенат
диселенат
|
H2SiO3
H4SiO4
H2SiF6
|
SiO32–
SiO44–
SiF62–
|
метакремниевая
ортокремниевая
кремнефтористоводородная
(гексафторокремниевая)
|
метасиликат
ортосиликат
кремнефторид
(фторосиликат)
|
H2SnO2
H2SnO3
H2SnS3
H2SnCl6
|
SnO22–
SnO32–
SnO32–
SnCl62–
|
оловянистая
оловянная
тиооловянная
гексахлорооловянная
(оловянохлористоводородная)
|
станнит
станнат
тиостаннат
хлорстаннат
|
НТсО4
|
ТсО4–
|
технециевая
|
пертехнетат
|
Н2Те
Н2ТеО3
Н2ТеО4
Н6ТеО6
|
Те2–
ТеО32–
ТеО42–
ТеО66–
|
теллуроводород
теллуристая
метателлуровая
ортотеллуровая
|
теллурид
теллурит
метателлурат
ортотеллурат
|
H2TiO3
H4TiO4
|
TiO32–
TiO44–
|
метатитановая
ортотитановая
(-титановая)
|
метатитанат
ортотитанат
|
H2UO4
H2U2O7
|
UO42–
U2O72–
|
урановая
двуурановая
|
уранат
диуранат
|
HVO3
H3VO4
|
VO3–
VO43–
|
метаванадиевая
ортованадиевая
|
метаванадат
ортованадат
|
H2WO4
|
WO42–
|
вольфрамовая
|
вольфрамат
|
H2XeO3
|
XeO32–
|
ксеноновая
|
ксенонат
|
H2ZnO2 *
|
ZnO22–
|
цинковая
|
цинкат
| |
|
|
 Скачать 2.12 Mb.
Скачать 2.12 Mb.




























































 r3+ + Br- +4NH3 + H2O
r3+ + Br- +4NH3 + H2O
 [CrBr(NH3)4(H2O)]2+
[CrBr(NH3)4(H2O)]2+