Скрипко Т.В. Общая и неорганическая химия Практикум. Общая и неорганическая химия
 Скачать 2.12 Mb. Скачать 2.12 Mb.
|
|
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования «Омский государственный технический университет» Т. В. Скрипко ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ Практикум Омск – 2006 УДК 54+546(075) ББК 24 я 73 С 45 Рецензенты: Н.Н. Струнина, канд. физ.-мат.наук, доцент ОмГУ; Н.А. Воронкова, канд. с.-х.наук, СибНИИСХ Скрипко Т.В. С 45 Общая и неорганическая химия: Практикум. Омск: Изд-во ОмГТУ, 2006. 108 с. Пособие содержит широкий набор задач, охватывающий разделы курса. Каждому разделу предпосланы краткое теоретическое введение и примеры с детальным разбором решения задач. Из текста задач исключен весь справочный материал, который помещен в приложении. Поиски необходимых данных создадут у студентов предпосылки к выработке полезной привычки обращения к справочной литературе. Пособие предназначено для студентов всех форм обучения. Печатается по решению редакционно-издательского совета ОмГТУ. УДК 54+546(075) ББК 24 я 73 © Т.В. Скрипко, 2006 © Омский государственный технический университет, 2006 ВВЕДЕНИЕ
Одной из основных задач методики обучения в высшей школе является разработка наиболее эффективных методов обучения и контроля знаний. Эффективность обучения определяется многими факторами и прежде всего активизацией самостоятельной работы студентов над изучаемым курсом. Основным видом самостоятельной работы является проработка лекционного материала по конспекту, учебнику и методическим разработкам. Для более четкого усвоения материала, активизации самостоятельной работы и систематического самоконтроля в межсессионный период студентам необходимо выполнить индивидуальные домашние задания на основе раздела общетеоретической части курса. Пособие содержит широкий набор задач, расположенных в логической последовательности изложения курса. Каждому разделу предпослано краткое теоретическое введение и примеры с детальным разбором хода решения типовых задач. Домашнее задание выполняется в отдельной тетради, причем каждая задача решается на отдельном листе с указанием темы задания, номера задачи и составленного полного условия задачи. Если задача не зачтена, ее нужно выполнить вторично с учетом замечаний на том же месте, где она выполнялась в первый раз. При решении расчетных задач необходимо приводить уравнения реакций, математическое выражение законов и правил (формулы), числовые значения констант. Необходимо указывать весь ход решения задач и все математические преобразования. Домашнее задание должно быть аккуратно оформлено. Представленный спектр задач – материал и для контрольных работ по темам дисциплины. Основная цель контрольных работ – закрепление знаний, анализ и контроль освоения студентом программного материала. Пособие предназначено для студентов всех форм обучения. 1. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Фундаментом для изучения химии является четкое представление о классах неорганических соединений и их свойствах. Внимательно изучив раздел о классах неорганических соединений, можно дать ответ, какие соединения называют оксидами, кислотами, основаниями, солями. Общие свойства этих соединений приведены ниже в виде схем. 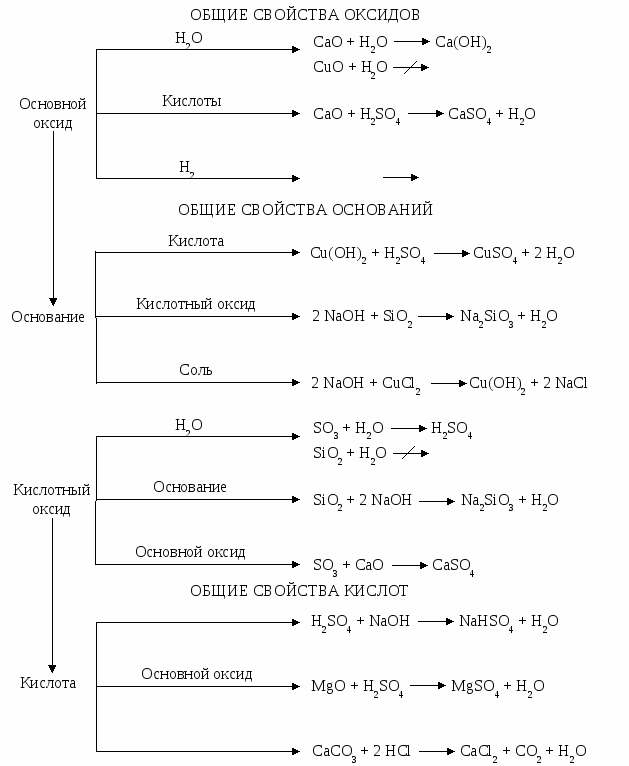 При выполнении заданий рекомендуется использовать методические указания [1, 2]. Для правильного составления химических уравнений необходимо использовать Прил. 1.2. Генетическую связь между классами неорганических веществ можно изобразить следующей схемой: 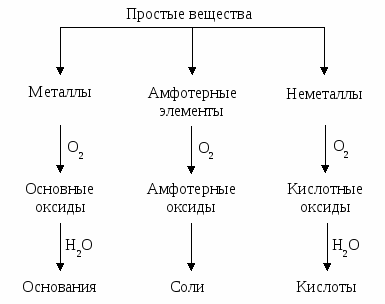 Эти схемы можно использовать при написании химических уравнений и при решении задач. Примеры составления условий задач и их решения Задача 41 Определить, какие реакции будут протекать. Написать их уравнения и назвать все вещества по международной номенклатуре. Решение: SiO2 + PbO PbSiO3, оксид оксид силикат кремния (IV) свинца (II) свинца кислотные оксиды взаимодействуют с основными с образованием соли. SO2 + 2NH4OH (NH4)2SO3 + H2O, оксид гидроксид сульфит оксид серы (IV) аммония аммония водороа (I) кислотные оксиды взаимодействуют с основными гидроксидами с образованием соли и воды. 2 KСN + H2SO4 = 2 HCN + K2SO4, цианид серная циано- сульфат калия кислота водород калия при взаимодействии соли с кислотой образуется новая соль и новая кислота при условии, если взятая кислота сильнее образующейся или менее летуча. 2 KHCO3 + Na2O Na2CO3 + K2CO3 + H2O, гидрокарбонат оксид карбонат карбонат оксид калия натрия (I) натрия калия водорода(I) кислые соли могут быть переведены в средние соли при реакции с металлами, основными и амфотерными оксидами, гидроксидами, солями, кислотами. CdOHBr + HBr CdBr2 + H2O, бромид гидрок- бромо- бромид оксид сокадмия водород кадмия водорода(I) образование основных солей нехарактерно для сильных оснований. Подобно малорастворимым основаниям основные соли способны реагировать с кислотами с образованием средних солей. NaOH tо не разлагается; гидроксид натрия все нерастворимые в воде основания, а при сильном нагревании и гидроксиды щелочноземельных металлов разлагаются с образованием оксидов. Гидроксиды щелочных металлов при нагревании не распадаются. Задача 54 Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: Na NaOH NaHCO3 Na2CO3 Na2SO4 NaCl Na. Решение: Натрий взаимодействует с водой, образуя гидроксид натрия: 2 Na + 2 H2O = 2 NaOH + H2 . При пропускании избытка оксида углерода (IV) через раствор гидроксида натрия можно получить гидрокарбонат натрия: NaOH + CO2 = NaHCO3. Карбонат натрия получается при нагревании гидрокарбоната натрия: Сульфат натрия можно получить, действуя серной кислотой на карбонат натрия: Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O. Приливая раствор хлорида бария к раствору сульфата натрия, можно получить раствор хлорида натрия: Na2SO4 + BaCl2 = 2 NaCl + BaSO4 . Чтобы получить металлический натрий, надо выделить хлорид натрия из раствора и провести электролиз расплава NaCl. На катоде будет выделяться металл: катод (-) Na+ + Задача 131 Составьте уравнения реакций. При взаимодействии каких веществ можно получить дигидрофосфат кальция? Решение: Са(OH)2 + 2 H3PO4 = Ca(H2PO4)2 + 2 H2O (1) Ca3(PO4)2 + 4 H3PO4 = 3 Ca(H2PO4)2 , (2) кислые соли могут быть получены либо неполной нейтрализацией кислот (1), либо действием избытка кислот (2) на средние соли. В задачах (1–46) определить, какие реакции будут протекать. Написать их уравнения и назвать все вещества по международной номенклатуре:
|
