Скрипко Т.В. Общая и неорганическая химия Практикум. Общая и неорганическая химия
 Скачать 2.12 Mb. Скачать 2.12 Mb.
|
|
В задачах 798–812 вычислить произведение растворимости малорастворимых электролитов
В задачах 813-824 вычислить растворимость электролита по величине произведения растворимости (прил. табл.8)
5.7. Гидролиз солей Гидролиз солей относится к обменным реакциям, поскольку процесс идет без изменения степени окисления реагирующих веществ. Сущность реакций гидролиза состоит во взаимодействии ионов соли с ионами водыс образованием слабых электролитов. В процессе гидролиза один из ионов воды связывается в слабый электролит, а другой, как правило, накапливается в растворе. Тот ион, который накапливается в растворе, определяет реакцию среды. Если накапливаются ионы Н+, то среда будет кислой, если группы ОН – щелочной. При образовании одинаковых по силе электролитов среда может быть и нейтральной. Последний случай встречается редко. Уравнения гидролиза пишутся аналогично другим ионным уравнениям: малодиссоциированные (в том числе и вода) и малорастворимые, а также газообразные вещества пишутся в виде молекул, сильные электролиты записываются в виде ионов. Уравнения гидролиза солей многоосновных кислот и многокислотных оснований записываются по ступеням, аналогично ступенчатой диссоциации. Гидролиз солей, или их обменное взаимодействие с водой, происходит лишь в тех случаях, когда ионы, образующиеся в результате электролитической диссоциации соли–катион, анион или оба вместе, способны образовывать с ионами воды Н+ и ОН– – малодиссоциированные сочетания. Гидролизу подвергаются соли, образованные: слабыми кислотами и сильными основаниями; слабыми основаниями и сильными кислотами; слабыми кислотами и слабыми основаниями. Если процесс гидролиза необходимо усилить, то следует разбавить раствор и повысить температуру. Если необходимо уменьшить гидролиз солей, то к раствору добавляют кислоту или щелочь в зависимости от типа гидролизуемой соли. Примеры составления задач и их решения Задача 858 Какие из перечисленных ниже солей подвергаются гидролизу: NH4I, Na2S, Al(CH3COO)3, CaCl2? Решение: Иодид аммония - соль, образованная сильной кислотой и слабым основанием. Гидролиз соли: гидролизу подвергается катион соли. Реакция раствора кислая: рН<7. NH4I + HOH NH4OH + HI. Или в ионном виде: NH4+ + HOH NH4OH + H+. Сульфид натрия – соль, образованная сильным основанием и слабой кислотой. При растворении солей многоосновных кислот гидролиз протекает ступенчато: Na2S + H2O NaHS + NaOH. Или в ионной форме: S2– + H2O HS– + OH–. Гидролизу подвергается анион соли. Процесс отражает гидролиз по первой стадии. Чтобы гидролиз соли многоосновной кислоты прошел полностью, как правило, увеличивают температуру процесса: или в ионной форме: Раствор такой соли проявляет щелочную реакцию рН7. Ацетат алюминия – соль, образованная слабым основанием и слабой кислотой. Гидролизу подвергается как катион, так и анион соли: Al(CH3COO)3 + H2O AlOH(CH3COO)2 + CH3COOH. Параллельно идут два процесса: Al3+ + H2O AlOH2+ + H+, CH3COO– + H2O CH3COOH + OH–. В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль. Для гидролиза А1(СН3С00)3 реакция полученного раствора будет слабокислотной, поскольку константа диссоциации А1(OН)3 (К=1,3810-9) меньше константы диссоциации уксусной кислоты (К=I,7510-5). Хлорид кальция - соль, образованная сильным основанием и сильной кислотой. Взаимодействие с водой можно представить таким образом: CaCl2 + 2H2O Ca(OH)2 + 2HCl, H2O H+ + OH–. Однако единственным малодиссоциирующим соединением в реакции остается сама вода, следовательно, равновесие реакции полностью смещено влево - гидролиз не идет. Раствор соли проявляет нейтральную среду. Реакция гидролиза представляет собой эндотермический процесс. Поскольку гидролиз является обычным равновесным процессом, то он зависит от всех тех факторов, которые влияют на равновесие реакций, и к нему применимо правило Ле-Шателье. Задача 864 Вычислить константу гидролиза NН4Сl. Решение: Гидролиз соли, образованной слабым основанием и сильной кислотой, характеризуется константой гидролиза: где Из табл. 7 приложения находим Отсюда Задача 880 Вычислить степень гидролиза ZnCl2 по 1 ступени в 0,5 М растворе. Решение: Ионное уравнение гидролиза Zn2+ + H2O ZnOH+ + H+, Степень гидролиза вычисляем по формуле: 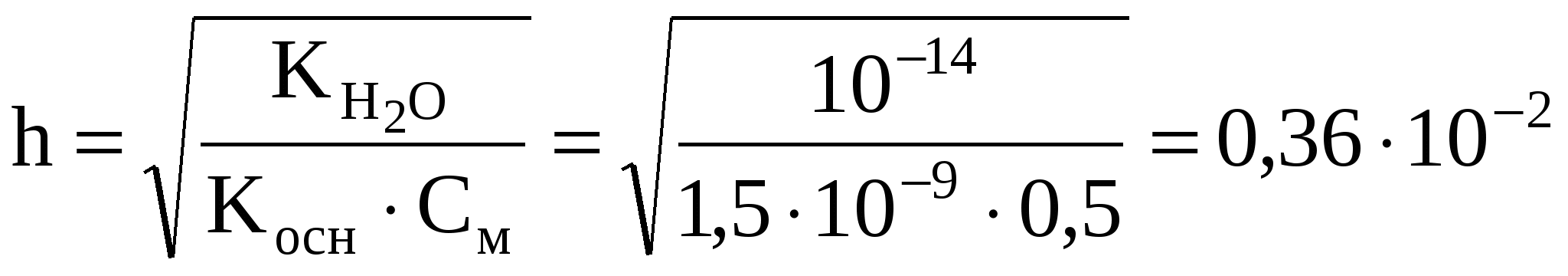 (0,36 %). (0,36 %).Степень гидролиза соли тем больше, чем меньше ее концентрация; иначе говоря, при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает. При выполнении заданий рекомендуется использовать методические указания [8]. При решении задач по гидролизу использовать данные констант диссоциации некоторых электролитов, приведенные в табл. 7 приложения. В задачах 825–858 указать, какие из перечисленных ниже солей подвергаются гидролизу. Для каждой из гидролизующихся солей написать в молекулярной и ионной форме уравнения гидролиза, указать реакцию водного раствора соли
В задачах 859–868 вычислить константу гидролиза
В задачах 869–880 вычислить степень гидролиза
6. СТРОЕНИЕ АТОМА Вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами: главным n , побочным ℓ , магнитным mℓи спиновым mS. Главное квантовое число n определяет общую энергию электрона на данной орбитали и его удаленность от ядра. Оно может принимать любые целые значения, начиная с единицы: 1,2,3,4... . Под главным квантовым числом, равным , подразумевают, что атому сообщена энергия, достаточная для полного отделения электрона от ядра (ионизация атома). N = 2n2 – максимальное число электронов, которое находится на каждом энергетическом уровне. Энергетические уровни представляют собой совокупность некоторых энергетических подуровней. Существование различий в энергетическом состоянии электронов отражается побочным (орбитальным) квантовым числом ℓ. Это квантовое число может принимать целочисленное значение от 0 до n-1 (ℓ = 0, 1, 2 ... n - 1). Численные значения ℓпринято обозначать буквенными символами:
В этом случае говорят о s, p, d, f, g, – состояниях электронов, или s, p, d, f, g –орбиталях. Орбиталь – совокупность положений электрона в атоме, т.е. область пространства, где энергетически выгоднее всего находиться электрону. ℓ – определяет форму электронного облака, а также орбитальный момент – момент количества движения электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа – орбитальное). Если ℓ = 0 (s -орбиталь), то электронное облако имеет сферическую форму и не обладает направленностью в пространстве. При ℓ = 1(р -орбиталь) электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из "восьмерки". При ℓ = 2 (d- орбиталь) электронное облако имеет четырехлепестковую фигуру. Формы f и g электронных облаков намного сложнее. Максимальное число электронов на подуровне рассчитывается по формуле 2(2ℓ + 1). Ориентация электронного облака в пространстве не может быть произвольной. Она определяется значением третьего, так называемого магнитного квантового числа mℓ. mℓ может принимать значения любых целых чисел, как положительных так и отрицательных от -1до +1, включая 0, т.е. всего (2ℓ + 1) значений. Например, при l = 0 mℓ= 0; при ℓ = 1 mℓравно -1, 0, +1; при ℓ, равном 3, mℓ имеет семь значений (2ℓ + 1 = 2∙3 + 1 = 7): -3, -2, -1, 0, +1,+2,+3 – семь различных ориентаций fэлектронных облаков в пространстве. mS – спиновое квантовое число определяет собственное состояние электрона, результат вращения электрона вокруг своей оси. Спиновое квантовое число может иметь два значения: +1/2 или -1/2. Итак, состояние электронов можно описать набором четырех квантовых чисел, но для объяснения строения электронных оболочек атомов нужно знать еще три основных положения: принцип Паули, правило Хунда, принцип наименьшей энергии. Принцип Паули. В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Правило Хунда. При данном значении ℓ (то есть в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Принцип наименьшей энергии – правило Клечковского: в атоме каждый электрон располагается так, чтобы его энергия была минимальна (что отвечает наибольшей его связи с ядром). Энергия электрона в основном определяется главным квантовым числом n и побочным числом ℓ, поэтому сначала заполняются те подуровни, для которых сумма значений n + ℓ является меньшей (энергия электрона на подуровне 4s меньше , чем на подуровне 3d, так как n + ℓ = 4 + 0 = 4 для 4sи n + ℓ = 3 + 2 = 5 для 3d. Когда для двух подуровней суммы n + ℓ равны, сначала идет заполнение с меньшим значением n (на подуровнях 3d, 4p, 5s n + ℓ = 5 – в этом случае происходит заполнение подуровней сначала с меньшим значением n , т.е. 3d 4p 5s). Примеры составления условий задач и их решения Задача 889 Составить электронную формулу атомов Be, As в стабильном и возбужденном состояниях и изобразить орбитали внешнего энергетического уровня. Решение: Атом бериллия Be. Стабильное состояние 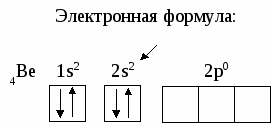  В Орбитали внешнего энергетического уровня озбужденное состояние 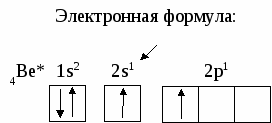 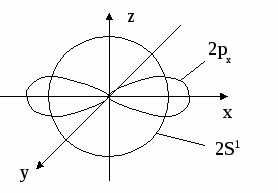 После Sp –гибридизации строение возбужденного атома бериллия 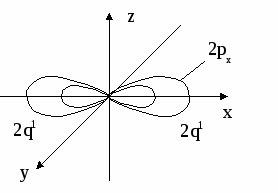 Атом мышьяка As. Э 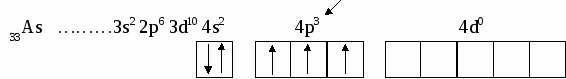 лектронная формула: Стабильное состояние лектронная формула: Стабильное состояниеВозбужденное состояние Электронная формула: 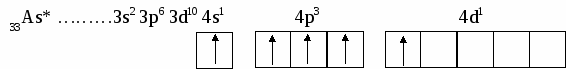 Задача 893 Определить, какие частицы Mg, Si, Al+ , S2– являются изоэлектронными, то есть содержащими одинаковое число электронов. Написать электронные формулы данных частиц. Решение: Изоэлектронными являются частицы Mg и Al+. Их электронные формулы следующие: С 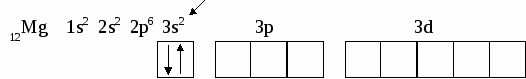 табильное состояние табильное состояниеВ 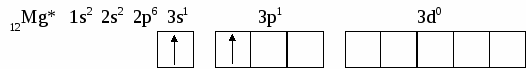 озбужденное состояние озбужденное состояниеВозбужденное состояние 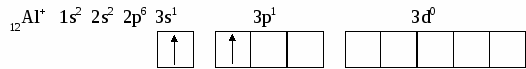 Задача 897 Пользуясь правилом Гунда, распределить электроны по квантовым ячейкам, отвечающим низшему и высшему энергетическим состояниям атомов мышьяка As, кобальта Co, стронция Sr. Решение: |
