Пат физ устно экзамен. патфиз устно. Общая патофизиология патофізіологія як наука та навчальна дисципліна. Методи патофізіології
 Скачать 1.7 Mb. Скачать 1.7 Mb.
|
|
10.18. Что такое феномен Оверим? Как его воспроизводят в эксперименте? Феномен Оверим - это местная анафилактическая реакция. Существует два варианта его воспроизведения: активный и пассивный. Активный вариант. Сенсибилизированному морской свинке внутренне кожно вводят завершающую дозу антигена вместе с высокомолекулярным красителем (синим Эванса). В результате в месте введения антигена увеличивается проницаемость сосудов кожи и образуется большое синее пятно. Пассивный вариант. Несенсибилизированных морской свинке в кожу вводят одновременно сыворотку, содержащую антитела против антигена, сам антиген и краситель (синий Эванса). Результат тот же. 10.19. Приведите примеры клинических форм аллергических реакций I типа (анафилактических). Анафилактический шок, бронхиальная астма, поллиноз (аллергия на пыльцу растений), крапивница, аллергический насморк, ангионевротический отек (отек Квинке). 10.20. Что происходит во время иммунологической стадии аллергических реакций I типа? Антигены, способные вызвать аллергические реакции I типа, является тимусзависимые. Поэтому при первом поступлении их в организм происходят следующие процессы: 1) поглощение, переработка и презентация антигена макрофагами; 2) активация соответствующих антигенспецифичних Т-хелперов; 3) активация клонов антигенспецифичних В-лимфоцитов, их бласттрансформация и превращения в плазматические клетки; 4) образование плазматическими клетками цитофильних антитил- реагинов. Реагины представлены двумя группами иммуноглобулинов - IgE и IgG 4 ; 5) распространение реагинов в организме и фиксация их на поверхности клеток, главным образом тканевых базофилов и базофилов крови. Образование реагинов и распространение их в организме с фиксацией на поверхности тканевых базофилов составляют сущность сенсибилизации организма к данному антигену. Минимальная продолжительность периода сенсибилизации - 5-7 суток; 6) взаимодействие антигена с фиксированными на поверхности клеток реагинов. Такая реакция ан-тиген + антитело происходит при повторном поступлении антигена в уже сенсибилизированная организм. 10.21. Чем характеризуется патохимическая стадия аллергических реакций 1 типа? Различают классический и дополнительный механизмы патохимическую стадии анафилактических реакций. Сущность классического механизма состоит в дегрануляции тканевых базофилов, на поверхности которых происходит реакция антиген + антитело. В результате высвобождаются так называемые первичные медиаторы анафилактических реакций. Они определяют ход событий в первые полчаса после повторного поступления антигена, то есть раннюю фазу анафилактической реакции. В результате дегрануляции тканевых базофилов в навкружну ткань выделяются: а) гистамин (у некоторых видов животных, но не в человека, еще и серотонин) б) гепарин; в) медленно реагирующая субстанция анафилаксии (входит в лейкотриенов) г) фактор эмиграции эозинофилов; г) фактор эмиграции нейтрофилов; д) фактор агрегации тромбоцитов; е) ферменты (нейтральные и кислые протеазы). Значение продуктов дегрануляции тканевых базофилов заключается в том, что они непосредственно действуют на клетки-мишени (гладкие мышцы сосудов, бронхов, матки, кишечника, эндотелиоциты) и вовлекают в аллергическую реакцию другие популяции клеток (эозинофилы, нейтрофилы, тромбоциты). 10.22. Действие имеет гистамин в условиях развития анафилактических реакций? Эффекты гистамина в тканях связаны с Н - и Н 2 рецепторами. В низких концентрациях гистамин стимулирует в основном H t - в высоких - Н 2 рецепторы. Основные проявления анафилактических реакций обусловлены действием гистамина на Н, -рецеп-торы. В результате возникают следующие изменения: 1) сокращение гладких мышц бронхов, матки, кишечника; 2) расширение артериол; 3) повышение проницаемости сосудистой стенки, в основном на уровне венул; 4) раздражение нервных окончаний (зуд, боль) 5) увеличение образования и выделение слизи в верхних дыхательных путях. Действие гистамина на Н 2 рецепторы, наоборот, вызывает угасание анафилактических реакций. Этому способствует торможению дальнейшей дегрануляции тканевых базофилов, подавления активности лимфоцитов, активация Т-супрессоров. 10.23. Какие существуют механизмы, ограничивающие патохимическую стадию анафилактических реакций? 1. Активация гистамином Н, рецепторов (см. Запрос. 10.22). 2. Поступление в ткань эозинофилов, которые высвобождают ингибитор дегрануляции тканевых базофилов и ферменты (гистаминазу, арилсульфатазы, фосфолипазу D), разрушающих первичные медиаторы анафилактических реакций. 3. Гистаминопексия - связывание гистамина белками плазмы крови. 10.24. В чем суть дополнительного механизма патохимическую стадии анафилактических реакций? Этот механизм связан с активации тканевых базофилов, а других клеток, имеющих на своей поверхности низькоафинни (с низким сродством) рецепторы для фиксации реагинов. Это макрофаги, нейтрофилы, эозинофилы, тромбоциты. их активацию вызывают большие завершающие дозы антигена и продукты дегрануляции тканевых базофилов. Активированные клетки крови высвобождают вещества, получившие название вторичных медиаторов анафилактических реакций. Они обусловливают развитие поздней фазы реакций I типа, признаки которой проявляются через 6-12 ч. и связанные с инфильтрацией тканей макрофагами, нейтрофилами и эозинофилами. / 0.25. Какие местные клинические проявления характерны для анафилактических реакций? Механизм их развития? Местные проявления анафилактических реакций связаны с действием биологически активных веществ - продуктов дегрануляции тканевых базофилов. Эти вещества вызывают: а) спазм гладких мышц бронхов - приступы удушья (бронхиальная астма). Развиваются в результате действия медленно реагирующей субстанции анафилаксии и гистамина; б) аллергический насморк, фарингит, ларингит, трахеит. Эти проявления возникают как следствие повышенного образования и выделения слизи в верхних дыхательных путях; в) спазм гладкой мускулатуры кишечника - понос (диарея); w .. г) расширение артериол - покраснение, аллергический сыпь на коже, кон 'юнктивит; г) повышение проницаемости стенок сосудов - развитие местных отеков; д) раздражение нервных окончаний - зуд, боль. 10.26. Назовите основные механизмы развития клинических проявлений анафилактического шока. Иммунные и патохимическую механизмы анафилактических реакций в конечном итоге приводят к развитию функциональных изменений, которые составляют сущность патофизиологической стадии аллергической реакции, которая проявляется развитием анафилактического шока (рис. 27).  Рис. 27. Схема патогенеза анафилактического шока Главными в этот период есть такие процессы. И. Нарушение общей гемодинамики, проявляют себя прежде всего падением артериального давления. В основе этих нарушений лежат: а) генерализованное расширение артериол и связанное с этим падение общего периферического сопротивления; б) генерализованное повышение проницаемости сосудов, что приводит к выходу жидкости из сосудов в ткани и уменьшения объема циркулирующей крови. ее. Расстройства микроциркуляции. Возникают в результате падения артериального давления и сгущение крови. III . Развитие острой недостаточности внешнего дыхания вследствие спазма бронхов и бронхиол и закупорки слизью воздухоносных путей. Все указанные процессы приводят к развитию острой гипоксии, вызывает нарушение функции дыхательного и сердечно-сосудистого центров и в конечном итоге - смерть. 31. Цитотоксичні реакції: експериментальне моделювання, основні клінічні форми. Механізми цитолізу: комплементзалежний цитоліз, антитілозалежний фагоцитоз, антитілозалежна клітинна цитотоксичність. Роль комплементу і продуктів його активації в розвитку цитотоксичних реакцій. 10.27. В чем сущность аллергических реакций и 2 типа (цитотоксических) по классификации Кумбса иДжелла? Антигены находятся на поверхности клеток, антитела в свободном состоянии. Реакция антиген * антитело происходит на поверхности клетки (рис. 28).  Рис. 28. Аллергические реакции ее типа: Кл - клетка 10.28. Как в эксперименте воспроизводят цитотоксические реакции? С целью воспроизведения аллергических реакций II типа используют цитотоксические сыворотки, содержащие антитела против антигенов той или другой ткани. Такие сыворотки получают путем иммунизации животных тканевыми антигенами. Подобным образом можно получить антимиокардиальну, антинефротичну, антиретикулярной и другие цитотоксические сыворотки. 10.29. Приведите примеры клинических форм цитотоксических реакций. Цитотоксические реакции проявляют себя такими клиническими формами: аутоалергич-ни болезни, гемотрансфузионный шок, возникающий при переливании несовместимой по группам АВО или резус-фактором крови гемолитическая болезнь новорожденных (рсзус-конфликт) аллергия на лекарственные препараты. 10.30. Антигены и антитела участвуют в развитии цитотоксических реакций? антигены: а) компоненты мембран собственных клеток (изменены и изменены под действием различных факторов); б) вторично фиксированные (адсорбированные) на клеточных мембранах антигены, например, лекарственные препараты; в) неклеточные компоненты тканей (коллаген, миелин). Антитела: IgG ] 3 IgG 2 , IgG 3 . По происхождению они могут быть естественными (изо-антитела к антигенам групп крови) и иммунными, то есть такими, которые образуются в организме в результате контакта его с антигенами. Для развития цитотоксических реакций имеют значение такие свойства антител: 1) способность связывать комплемент; 2) эффект опсонизацией; 3) способность проникать в, ткани. 10.31. Какие механизмы обеспечивают разрушение клеток (цитолиз) во время цитотоксических реакций? выделяют такие механизмы цитолиза (рис. 29). 1. Комплементзалежний цитолиз. После того как антитела связываются с антигеном на поверхности клетки, происходит фиксация комплемента к Р с -фрагменты иммуноглобулинов. В результате активации комплемента мембрана клетки, несет антиген, перфорируется (в ней образуются отверстия) и клетка повреждается, а затем погибает. 2. антителозависимую фагоцитоз. Связанные с антигенами антитела вызывают эффект опсонизацией, то есть облегчают фагоцитоз клетки, несет антигены, макрофагами (см. Разд. 8). 3. антителозависимую клеточная цитотоксичность. Уничтожение клетки, несет антигены, связанные с антителами, может быть осуществлено К-лимфоцитами (киллерами), которые являются разновидностью О-лимфоцитов и имеют рецепторы к Р с -фраг-мента антител. 10.32. Чем характеризуется патохимическая стадия цитотоксических реакций? Для патохимическую стадии характерны: 1) активация комплемента и образования промежуточных (СЗЬ) и побочных (СЗа, С5а) продуктов его активации; 2) генерация свободных радикалов и пероксидов активированными макрофагами и К-лимфоцитами; 3) высвобождение макрофагами лизосомальных ферментов. 10.33. Что происходит во время патофизиологической стадии цитотоксических реакций? Активированный комплемент, свободные радикалы, пероксиды и лизосомальные ферменты повреждают клетки и вызывают их гибель. Это в свою очередь является причиной развития воспаления (см. Разд. 14). Если количество антител, реагирующих с антигеном, небольшая и недостаточна, чтобы вызвать повреждения, то может наблюдаться эффект стимуляции функциональной активности клеток. Этим, в частности, обусловлены стимулирующее действие небольших доз антиретикулярной цитотоксической сыворотки (сыворотки Богомольца) и развитие аутоиммунного тиреотоксикоза. 32. Імунокомплексні реакції: відтворення в експерименті, основні клінічні форми. Фактори, що визначають патогенність імунних комплексів. Імунокомплексні ушкодження, їх місцеві та загальні прояви. 10.34. В чем сущность аллергических реакций III типа (иммунокомплексных) по классификации Кумбса иДжелла? Антиген и антитело находятся в свободном состоянии (не фиксированы на поверхности клеток), их взаимодействие происходит в крови и тканевой жидкости (рис. ЗО). 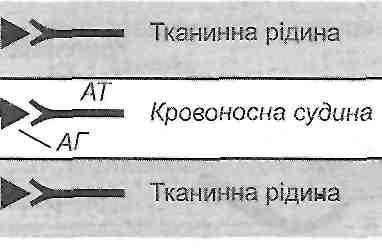 Рис. ЗО. Аллергические реакции III типа 10.35. Как воспроизводят иммунокомплексные реакции в эксперименте? При однократном введении животному большой дозы чужеродной сыворотки может рас- виватися сывороточная болезнь. Первые ее морфологические и клинические признаки появляются на 8-е сутки и достигают максимума на 12-14-е сутки после введения сыворотки. В эксперименте можно моделировать и местный иммунокомплексный процесс - феномен Артюса. Кроликам подкожно с интервалами в 5 суток вводят лошадиную сыворотку. Начиная с 3-го введения появляется отек, увеличивается после каждого последующего введения сыворотки. После 6-го введения возникает центральный геморрагический некроз. 10.36. Приведите примеры клинических форм иммунокомплексных реакций. Иммунокомплексные механизмы имеют значение в патогенезе таких групп недугов. I. Болезни, обусловленные экзогенными антигенами (сывороточная болезнь, некоторые формы аллергии на лекарственные препараты, аллергический альвеолит). II. Аутоаллергическое болезни (системная красная волчанка, ревматоидный артрит, узелковый периартериит, тиреоидит Хашимото). III. Инфекционные болезни (гепатит В, стрептококковые инфекции). 10.37. Антигены и антитела участвуют в развитии иммунокомплексных реакций? Антигены, вызывающие развитие иммунокомплексных реакций, должны быть растворимыми. Антитела - IgM, IgG p IgG 2 , IgG 3 - имеют свойство преципитации. При взаимодействии с антигеном они образуют преципитаты и способны связывать комплемент. 10.38. Какие факторы определяют патогенные свойства циркулирующих иммунных комплексов? Патогенные свойства циркулирующих иммунных комплексов определяются следующими факторами: а) структурными и функциональными свойствами комплексов антиген-антитело, в частности размерами комплексов и структурой их решеток; б) продолжительностью циркуляции иммунных комплексов в организме в) местом образования комплексов. 10.39. Какие существуют виды циркулирующих иммунных комплексов? Каково их значение в развитии аллергических реакций? Виды иммунных комплексов: а) большие комплексы, образующиеся в избытке антител. Они быстро удаляются из крови, циркулирующей макрофагами, а потому не оказывают патогенного действия; б) преципитовапи, нерастворимые комплексы, образующиеся в эквивалентных соотношениях антигена и антител. Как и предыдущие, они быстро удаляются из крови и поэтому повреждения не вызывают. Исключение составляют случаи, когда такие комплексы образуются на фильтрующей мембране, например в клубочках почек в) небольшие растворимые комплексы, которые образуются в большом избытке антигена или в случае одновалентных антигенов. Такие комплексы циркулируют в организме длительное время, но имеют слабую повреждающее действие; г) растворимые комплексы промежуточной величины. Они образуются в небольшом избытке антигена. их средняя молекулярная масса составляет 900 тыс. - 1 млн. даль-тонов. Именно эти комплексы являются причиной развития аллергических реакций III типа. 10.40. Какие условия способствуют развитию иммунокомплексных повреждений? В норме элиминация (удаление) иммунных комплексов осуществляется при участии комплемента и макрофагов. Учитывая это, развития иммунокомплексных повреждений способствуют: 1) нарушение системы комплемента; 2) функциональные дефекты системы мононуклеарных фагоцитов; 3) условия, при которых скорость образования иммунных комплексов значительно превышает скорость их элиминации. 10.41. Чем характеризуется патохимическая стадия иммунокомплексных реакций? В патохимической стадии реакций III типа имеют значение две группы процессов. I. Активация биохимических систем плазмы крови: а) системы комплемента; б) калликреин-кининовой системы; в) системы свертывания крови. Активация двух последних связана с повреждением иммунными комплексами сосудистой стенки, что приводит к активации фактора Хагемана (ф. ХП). II. Высвобождение активированными макрофагами: а) лизосомных ферментов б) основных катионных белков; в) свободных радикалов и пероксидов. 10.42. Что происходит во время патофизиологически) "стадии аллергических реакций III типа? 1. Местные изменения. Иммунные комплексы откладываются на поверхности эндотелия, на базальных мембранах сосудов в тканях. В результате активации комплемента и действия продуктов, которые секретируют макрофаги, происходит повреждение клеток и развивается воспаление (см. разд. 14). Чаще всего оно возникает в клубочках почек (гломерулонефрит), легких (альвеолит), сосудистой стенке (васкулит). Кроме того, образование преципитатов непосредственно в капиллярах вызывает первичные нарушения микроциркуляции и развитие некротических изменений в тканях. 2. Общие изменения. Активация биохимических систем крови может быть причиной дисеми-ноеаного внутрисосудистого свертывания крови (ДВС-синдрома) (см. Разд. 26). Кроме того, прикрепление иммунных комплексов через F рецепторы к поверхности форменных элементов крови (нейтрофилов, тромбоцитов) вызывает поглощения и разрушения последних макрофагами. В результате развивается цитопения (лейкопения, тром боцитопения). 33. Клітинно-опосередковані реакції: експериментальне відтворення, основні клінічні форми. Особливості імунологічних механізмів. Роль лімфокінів. 10.43. В чем сущность аллергических реакций IV типа (гиперчувствительность замедленного типа) по классификации Кумбса иДжелла? С клетками, несущими на своей поверхности антиген, взаимодействуют Т-лимфоциты, имеющие специфические к данному антигену рецепторы (рис. 31). 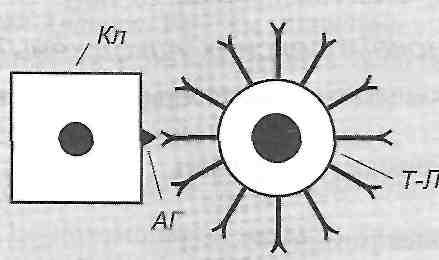 Рис. 31. Аллергические реакции IV типа: Кл - клетка; Т-Л Т-лимфоцит 10.44. Как воспроизводят гиперчувствительность замедленного типа в эксперименте? Гиперчувствительность замедленного типа можно моделировать: а) введением животным убитых вакцин или антигенных экстрактов бактериальных клеток вместе с адъювантом Фрейнда; б) введением внутрикожно минимальных доз антигена. 10.45. Приведите примеры клинических форм гиперчутливости замедленного типа. Туберкулиновая реакция, бактериальная аллергия, контактный дерматит, реакция отторжения трансплантата, аутоаллергическое болезни, реакции противоопухолевого иммунитета. 10.46. В чем суть иммунологической стадии аллергических реакций IV типа? Во время иммунологической стадии этого типа реакций происходит сенсибилизация организма, в основе которой - образование клона Т-лимфоцитов, имеющих на своей поверхности специфические рецепторы к данному антигену. Если образование таких "сенсибилизированных" Т-лимфоцитов происходит в самом организме, то говорят о активноесенсибилизации. Введение в организм готовых Т-лимфоцитов, имеющих специфические рецепторы к данному антигену, вызывает состояние пассивной сенсибилизации. 10.47. Биологически активные вещества выделяются при патохимическую стадии аллергических реакций IV типа? Высокомолекулярные вещества белкового и Гликопротеидный происхождения, продуцируемых Т-лимфоцитами, - лимфокины. 10.48. Как классифицируют лимфокины? По механизму действия выделяют: 1) лимфокины, повреждают клетки-мишени (цитотоксины) 2) лимфокины, вызывают пролиферацию клеток (митогеном факторы); 3) лимфокины, влияющие на миграцию различных типов клеток (хемотаксинами). По характеру воздействия на клетки-мишени лимфокины могут быть такими, активирующие, и такими, что подавляют. Клетками-мишенями для лимфокинов есть разные популяции лимфоцитов, макрофаги, гранулоциты, свои и чужеродные клетки тканей. Есть лимфокины, которые вызывают и общие реакции организма. Примеры лимфокинов: интерлейкин-2, фактор переноса Лоуренса, фактор бласт-трансформации, миграциеингибуючий фактор (МИФ), фактор активации макрофагов (МАФ), интерферон. 10.49. Какие механизмы обеспечивают уничтожение клеток, несущих антигены, в реакциях гиперчувствительности замедленного типа? 1. Прямая цитотоксичность Т-ко-лерив- уничтожение клетки, несет антигены, непосредственно Т-киллерами, которые имеют на своей поверхности специфические рецепторы к антигенам этой клетки. 2. Опосредованное лимфокинами цитотоксичность. Обеспечивается лимфокинами: лимфоциты-токсинами, цитотоксическим фактором и др. 3. Опосредованное макрофагами цитотоксичность. Сенсибилизированные Т-лимфоциты выделяют лимфокины, которые активируют макрофаги (специфически армирующий фактор), вызывают их хемотаксис (фактор хемотаксиса, фактор активации макрофагов), задерживают фагоцитов в очаге сосредоточения клеток, несущих антигены, (миграциеингибуючий фактор). Активированные макрофаги фагоцитируют обнаружены иммунной системой чужеродные и свои измененные клетки (рис. 32). СМАФ - специфически макрофаг-армирующий фактор; МИФ - миграциеингибуючий фактор; ФХ- фактор хемотаксиса; МАФ - макрофаг-активирующий фактор. 34. Алергічні реакції стимулюючого та гальмівного типу, клінічні форми. Псевдоалергічні реакції. Автоалергічні (автоімунні) реакції. Причини і механізми їх розвитку. Роль автоалергічного компоненту в патогенезі хвороб. 70.50. Что такое аутоаллергическое реакции? Аутоолергичии реакции - это реакции, причиной которых есть собственные антигены (ендоалер-гсны) (см. Запрос. 10.5.). их патогенез включает в себя механизмы развития аллергических реакций II и IV типов по классификации Кумбса и Джелли. 10.51. Какие механизмы лежат в основе развития аутоалерпьи? I. Механизмы, повязкам связанные с антигенами: 1) демаскировка природных эндоаллергены (нарушение целостности специализированных гистогематических барьеров) 2) образование приобретенных эндоаллергены (действие факторов, изменяющих конформацию собственных белков). II. Механизмы, связанные с иммунной системой: 1) отмена иммунологической толерантности к нормальным компонентов клеток (например, нарушение Т-супрессоров) 2) появление в результате мутации "запрещенных" клонов лимфоцитов, воспринимают "свое" как "чужое". 70.52. Что такое псевдоаллергические реакции? Приведите примеры. Псевдошиергични - это реакции, имеющие внешние клинические признаки аллергических, но не являются, поскольку в их основе лежат не иммунные механизмы (Нет иммунологической стадии). Реакции, подобные аллергии, вызывают химические факторы (либераторов гистамина), непосредственно действующих на тканевые базофилы и вызывают их дегрануляцию; порушен-. ния системы комплемента (дефицит ингибиторов его компонентов, неиммунный активация) нарушения метаболизма полиненасыщенных жирных кислот, в частности арахидоновой (ас-пиринова бронхиальная астма). Примерами экспериментального воспроизведения псевд в аллергических реакций является феномен Шварцмана (местная реакция) и феномен Санарелли (общая реакция). Феномен Шварцмана вызывают введением в кожу животных фильтрата культуры возбудителя брюшного тифа. Через сутки фильтрат вводят внутривенно и на месте первичного введения наблюдают геморрагическое воспаление. Феномен Санарелли воспроизводят при внутривенном введении нелегальной дозы эндотоксина холерных вибрионов, а через сутки - фильтрата культуры кишечной палочки. Развивается тяжелая общая реакция по типу шока. 70.53. Назовите основные принципы предупреждения и лечения аллергии. I. Предотвращение контакта организма с аллергенами (этиологический принцип). II. Предупреждение сенсибилизации, когда контакт организма с аллергеном неизбежен: создание иммунологической толерантности к данному антигену или состояния иммунологической супрессии, если первое невозможно. III. Десенсибилизация. Одним из методов является введение антигена в сенсибилизированная организм дробными дозами с целью постепенного связывания антител (метод Бсзредкы). ; IV. Влияние на патохимическую стадию аллергических реакций: предупреждение образования и высвобождения медиаторов аллергии, их инактивация (например, антигистаминными препаратами); блокада рецепторов к медиаторам аллергических реакций на клетках-мишенях. V. Влияние на патофизиологическую стадию. Они направлены на ликвидацию структурных и функциональных изменений, возникающих при аллергии. Это достигают применением противовоспалительных, спазмолитических, гипертензивных и других фармакологических средств. 35. Характеристика поняття «пошкодження клітин». Принципи класифікації пошкодження клітин. Насильницьке та дизрегуляторне пошкодження клітин. Структурні, функціональні, фізико-хімічні, біохімічні та термодинамічні ознаки пошкодження клітини. Екзо- і ендогенні причини пошкодження клітин: гіпоксія, дія фізичних, хімічних, інфекційних агентів, імунні реакції, генетичні дефекти. 11.1. Что такое повреждение клетки и какие существуют принципы его классификации? Повреждения клетки - это типовой патологический процесс, в основе которого составляют изменения внутриклеточного гомеостаза, приводящие к нарушению структурной целостности клетки и ее функциональных свойств. В зависимости от скорости развития и выраженности основных проявлений повреждения клетки может быть острым ихроническим, в зависимости от степени изменений внутриклеточного гомеостаза - оборотным и необратимым, в зависимости от периода жизненного цикла, на который приходится действие повреждающего агента, - митотическим и интерфазним, в зависимости от патогенетических механизмов инициирования повреждения - насильственным и цитопатическим. 11.2. Какие факторы могут вызвать повреждения клетки? Непосредственное (первичное) повреждения клетки возникает в результате прямого действия факторов: 1) физической природы (механическое воздействие, высокая и низкая температуры, ионизирующее излучение и др.) 2) химического происхождения (кислоты, щелочи, низкомолекулярные органические соединения, ферменты и др.) 3) биологической природы (вирусы, бактерии, простейшие). Опосредованное (вторичное) повреждения возникает как следствие первичных нарушений постоянства внутренней среды организма (гипоксия, ацидоз и алкалоз, гипер- и гипоосмия, гипогликемия и др.). 11.3. Какие признаки свидетельствуют о повреждении клетки? О повреждении клетки свидетельствуют следующие признаки: 1. Структурные. их обнаруживают с помощью гистологических и електронномикроскопич-ных методов исследования, они являются предметом изучения патологической анатомии. 2. Функциональные. К ним относят: нарушение электрофизиологических процессов (деполяризация плазматической мембраны, изменения свойств возбудимости и проводимости, развитие парабиоза) расстройства сократимости, экзо- и эндоцитоза; нарушения клеточного деления, межклеточных контактов и взаимодействий; изменения в восприятии клеткой нервных и гуморальных регуляторных воздействий. 3. Физико-химические, которые включают: а) нарушение со стороны клеточных коллоидов (уменьшение степени дисперсности коллоидов цитоплазмы и ядра, повышение вязкости цитоплазмы, изменение сорбционных свойств относительно поздравительных красителей) и б) изменения водно-электролитного обмена (увеличение концентрации в цитоплазме ионов натрия и кальция и уменьшение концентрации ионов калия, отек клетки и отдельных ее органелл, накопление ионов водорода - ацидоз повреждения). 4. Биохимические: 1) уменьшение концентрации высокоэнергетических сполук- креатинфосфата и АТФ - и увеличение концентрации продуктов их гидролитического расщепления - креатина, АДФ, АМФ, неорганического фосфата; 2) подавление тканевого дыхания; 3) разъединения окисления и фосфорилирования; 4) активация гликолиза; 5) активация процессов протеолиза; 6) увеличение интенсивности процессов дезаминирования. 5. Термодинамические. Это декомпартментализация, то есть нарушение относительной обособленности внутриклеточных отсеков; конформационные изменения макромолекул, происходящих в направлении наиболее выгодного термодинамического состояния (денатурация) распад больших, сложных молекул на мелкие, простые; выравнивание концентрационных градиентов как между клеточными отсеками, так и между клеткой и внеклеточной средой. 11.4. Чем принципиально отличаются два патогенетических варианта повреждения клетки: насильственный и цитопатический? Насильственное повреждение развивается при воздействии на здоровую клетку физических, химических и биологических факторов, интенсивность которых превышает обычные возбуждающие влияния, к которым клетка адаптирована. Цитопатический вариант возникает в результате первичного нарушения защитно-компенсаторных гомеостатических механизмов клетки. В этом случае факторами, запускают патогенетические механизмы повреждения, являются природные для данной клетки возбуждающие стимулы, которые в этих условиях становятся повреждающими. К цитопа-ческого варианта относят все виды повреждения клетки, вызванные отсутствием каких-либо необходимых для нее компонентов (при гипоксии, голодании, гипо- и авитаминозах, антиоксидантной недостаточности, генетических дефектах, нарушениях нервной трофики и др.). 11.5. Изменения на молекулярном уровне имеют большое значение в патогенезе повреждения клетки? * Можно выделить 6 групп молекулярных механизмов, которые играют важную роль в патогенезе повреждения клеток: липидные (перекисное окисление липидов, активация мембранных фосфолипаз, детергентные действие свободных жирных кислот), кальциевые, электролитно-осмотические, ацидотического, протеиновые и нуклеиновые. 11.6. В чем сущность перекисного окисления липидов? Перекисного окисления липидов (ПОЛ) называют свободнорадикальное окисление ненасыщенных жирных кислот, входящих в состав фосфолипидов клеточных мембран. Инициаторами ПОЛ являются свободные радикалы, среди которых наибольшее значение имеют: "О" (Н0 2 ») - супероксидных радикалов; ОН '- гидроксильный радикал; Н '- водородный радикал; * 0 2 - синглетный (возбужденный) кислород. 11. 7. Какие реакции лежат в основе инициирования перекисного окиснемня липидов? Первичный свободный радикал, появившийся в клетке (А ') взаимодействует с молекулой ненасыщенной жировой кислоты (RH), в результате чего образуется свободный радикал этой кислоты (R') и молекулярный продукт реакции (НА): Свободный радикал жировой кислоты, образовавшийся взаимодействует с молекулярным кислородом, который всегда содержится в клетке, в результате чего появляется перекисного радикал этой кислоты (ROO '): Перекисного радикал, в свою очередь, вступает во взаимодействие с новой молекулой ненасыщенной жировой кислоты, находится рядом. В ходе этой реакции образуется гидропероксид (ROOH) и новый свободный радикал: Следует отметить две важные особенности ПОЛ. Первая заключается в том, что реакции ПОЛ имеют цепной характер. Это означает, что в ходе реакций ПОЛ не происходит уничтожение свободных радикалов и в процесс вовлекаются все новые и новые молекулы не на-Сичэн жирных кислот. Вторая особенность- это разветвленный характер ПОЛ. Иначе говоря, в реакциях ПОЛ в количестве, нарастает, появляются свободные радикалы, источником которых являются сами промежуточные продукты ПОЛ. Примером может быть образование свободных радикалов с гидропероксидов липидов при их взаимодействии с имеющимися в клетке металлами переменной валентности: Так как во многих биохимических реакциях в условиях нормы образуется небольшое количество свободных радикалов, существует постоянная опасность активации ПОЛ в клетке. Однако в естественных условиях этого не происходит, так как клетка располагает механизмы антиоксидантной защиты, благодаря которым достигается инактивация свободных радикалов, ограничения и торможения ПОЛ. 11.8. Какие антиоксидантные системы есть в клетках? И. Ферментные антиоксидантные системы: 1. Супероксгиддисмутазна. Компоненты: супероксиддисмутаза (СОД), каталаза. Назначение: инактивация супероксидных радикалов (HOj): Причины нарушений: приобретенные расстройства синтеза ферментов, дефицит меди и железа. 2. Глютатионова. Компоненты: глютатион (Г), Глютатионпероксидаза (ГП), глютатионредуктазы (ГР), НАДФ-Н 2 . Назначение: инактивация и разрушение гидропероксидов липидов: Причины нарушений: наследственно обусловленные и приобретенные нарушения синтеза ферментов, дефицит селена, нарушения пентозного цикла (уменьшение образования НАДФН 2 ). II. Неферментный антиоксиданты: 1. "Истинные" антиоксиданты. Компоненты: токоферолы, убихинон, нафтохиноны, флавоноиды, стероидные гормоны, биогенные амины. Назначение: инактивация свободных радикалов жирных кислот: где In - антиоксидант; In '- свободный радикал этого антиоксиданта, имеет низкую реакционную способность. Причины нарушений: гиповитаминоз Е, нарушение регенерации "истинных" антиоксидантов. 2. Вспомогательные антиоксиданты. Компоненты: аскорбиновая кислота, соединения, содержащие серу - глютатион, цистин, цистеин. Назначение: регенерация "истинных" антиоксидантов: где DH - восстановлена, D - окисленная форма вспомогательного антиоксиданта. Причины нарушений: гиповитаминоз С, нарушение пентозного цикла, дефицит соединений, содержащих серу. 11.9. В каких случаях происходит активация ПОЛ? Активация ПОЛ происходит: 1) при избыточном образовании первичных свободных радикалов (ультрафиолетовое и ионизирующее излучение, гипероксии, отравления четыреххлористым углеродом, гипервитаминоз D и др.) 2) при нарушении функционирования антиоксидантных систем (недостаточность ферментов - супероксиддисмутазы, каталазы, глутатион пер оксид азы, глютатионредуктазы; дефицит меди, железа, селена; гиповитаминозы Е, С, нарушение пентозного цикла). 11.10. Какие механизмы лежат в основе нарушений барьерных функций клеточных мембран при активации ПОЛ? I. Ионофорнш механизм обусловлен появлением в клетке веществ, обладающих свойствами Ионофоры, то есть соединений, способных облегчать диффузию ионов через мембрану благодаря образованию комплексов, проходящих через ее слои. В процессе активации ПОЛ среди промежуточных продуктов его реакций появляются вещества-ионофоры для ионов кальция и водорода. В результате этого повышается проницаемость клеточных мембран до сих ионов. II. Механизм электрического пробоя связан с существованием на многих мембранах (плазматической, внутренней митохондриальной) разности потенциалов. В результате появления гидрофильных продуктов ПОЛ нарушаются электроизоляционные свойства гидрофобного слоя клеточных мембран, призводтггь к электрическому пробою мембраны, то есть до электромеханического ее разрыва с образованием новых трансмембранных каналов ионной проводимости. 11.11. Как нарушается матричная функция мембран в процессе активации ПОЛ? Сущность матричной функции липидного двойного слоя мембран заключается в том, что в нем встроенные мембранные ферменты и некоторые специализированные белки. В процессе ПОЛ нарушается активность мембранных ферментов, поскольку меняется их липидное микроокружения, которое во многом определяет свойства белковых молекул. Кроме того, в ходе реакций ПОЛ происходит образование "сшивок" между молекулами белков и фосфолипидов, а также окисление сульфгидрильных групп активных центров, что приводит к необратимой инактивации ферментов. 11.12. Каким образом повышение активности фосфолипаз влияет на повреждение клеточных мембран? В патогенезе повреждения клетки большое значение имеет чрезмерная активация фос-фолипазы А 2 - фермента, осуществляющего гидролитическое отщепление ненасыщенных жирных кислот от молекул фосфолипидов клеточных мембран (рис. 33). В результате этого образуются лизофосфолипиды, в молекулах которых только один жировокислотний "хвост", в связи с чем они обладают способностью к мицеллообразования и очень сильными детергентами (рис. 34). С детергентные действием лизофосфолипидов и связано повреждения клеточных мембран в условиях чрезмерной активации фосфолипазы А ,, которую, как правило, вызывают высокие концентрации ионов кальция в цитоплазме клетки. 11.13. При каких условиях возникает опасность детергентноидии свободных жирных кислот на клеточные мембраны? Детергентные действие свободных жирных кислот (СЖК) проявляется при увеличении их содержания в клетке. Это может быть обусловлено (ОИС. 35): а) усиленным поступлением СЖК в клетку при гиперлипацидемии (например, активация липолиза в жировой ткани при стрессе, сахарном диабете); б) высвобождением СЖК в лизосомах с триглицериднои части липопротеидов, поступивших в клетку из плазмы крови (например, гиперлипопротеинемия при атеросклерозе) в) высвобождением СЖК с фосфолипидов мембран под действием мембранных фосфолипаз; г) нарушениями использования СЖК в качестве источника энергии (уменьшение активности ферментов Р-окисления и цикла Кребса, например, при гипоксии). Для того чтобы предотвратить повреждающему действию избытка жирных кислот, клетка располагает систему ферментов, которые переводят свободные жировые кис- лоты в форму триглщеридив. При этом происходит несвойственное для нормы отложения триглицеридов в виде жировых капель, то есть возникает жировая дистрофия клетки. 11.14. В каких случаях ионы кальция вовлекаются в патогенез повреждения клетки? С какими эффектами этих ионов повязанная их участие в повреждении клеточных структур? Повреждения клеточных структур может быть обусловлено устойчивым повышением концентрации ионов Са 2+ в цитоплазме клетки. Такая ситуация возникает либо в результате избыточного поступления ионов Са 2+ в цитоплазму (гиперкальциемия, повышение проницаемости плазматической мембраны), либо в результате нарушения механизмов, обеспечивающих удаление ионов Са 2+ из цитоплазмы (нарушение Са-насосов, Na-Ca-об- минного механизма, Са-акумулгоючои функции митохондрий). Повышение концентрации ионов Са 2т в цитоплазме вызывает: а) контрактуры (пер является сокращение) фибриллярных структур клетки (миофибрилл, элементов цитоскелета) б) активацию фосфолипазы ,; в) разъединение процессов окисления и фосфорилирования. 11. 15. Чем могут быть обусловлены изменения содержания ионов натрия и калия в клетке и какова роль таких нарушений в патогенезе клеточного повреждения? Выравнивание концентраций ионов Na + и К + по обе стороны плазматической мембраны (увеличение содержания Na + и уменьшение содержания К + в цитоплазме) в своей основе может иметь два механизма: 1) усиленную диффузию ионов через плазматическую мембрану по существующему концентрационным и электрическим градиентом и 2 ) нарушение механизмов активного транспорта Na + и К + (Na-K-насоса). Первый механизм реализуется в условиях общих нарушений водно-электролитного обмена (гипернатриемия, гипокалиемия) и нарушений барьерной функции плазматической мембраны (повышение ее ионной проницаемости). Нарушения Na-K-насоса могут быть обусловлены дефицитом АТФ в клетке, увеличением содержания холестерина в липидном бислое мембраны (например, при атеросклерозе), действием целого ряда специфических ингибиторов Na-K-АТФ-азы (например, строфантина). Изменения содержания ионов Na + и К + вызывают: а) потерю клеткой электрического мембранного потенциала (потенциала покоя), а следовательно и возбудимости; б) отек клетки; в) осмотическое растяжение клеточных мембран, сопровождается повышением их проницаемости. 11. 16. Чем может быть обусловлен развитие внутриклеточного ацидоза и какие изменения в клетке могут быть с ним повязкам связанные? К развитию внутриклеточного ацидоза могут вызывать: 1) избыточное поступление ионов Н + в клетку из внеклеточной среды (декомпенсированный газовый или негазовый ацидоз) 2) избыточное образование кислых продуктов в самой клетке при активации гликолиза (молочная кислота), нарушениях цикла Кребса (трех- и дикарбоновые кислоты), гидролитическом расщеплении фосфолипидов клеточных мембран (свободные жировые кислоты, фосфорная кислота) и др .; 3) нарушение связывания свободных ионов Н + в результате недостаточности буферных систем клетки; 4) нарушение выведения ионов Н + из клетки при расстройствах Na-H-обменного механизма, а также в условиях нарушенного местного кровообращения в ткани. Внутриклеточный ацидоз вызывает: а) изменение конформации белковых молекул с нарушением их ферментативных, сократительных и других свойств; б) повышение проницаемости клеточных мембран; в) активацию лизосомальных гидролитических ферментов. 11.17. Изменения белковых молекул имеют значение в патогенезе повреждения клетки? К белковых (протеиновых) механизмов повреждения клетки можно отнести: 1) ингибуванння ферментов (обратимое и необратимое) 2) денатурацию, т.е. нарушение нативной строения белковых молекул в результате обусловленных разрывом ковалентных связей изменений вторичной и третичной структур белка; 3) протеолиз, что осуществляется под действием лизосомальных протеолитических ферментов (ка-тепсинив) и протеаз, которые активируются ионами Са 2+ , В результате протеолиза могут появляться пептиды, обладающие свойствами физиологически активных веществ. С выходом последних из поврежденных клеток может быть связано развитие как местных, так и общих реакций организма (воспаление, лихорадка). 11. 18. Какие нарушения функционирования генетического аппарата клетки могут приводить к ее повреждения? Основу повреждения клетки могут составлять так называемые нуклеиновые механизмы, обусловленные нарушениями процессов: 1) репликации ДНК (денатурация ДНК, повреждение ДНК репликазнои ферментной системы, дефицит трифосфонуклеотидив - АТФ, ГТФ, ТТФ и ЦТФ) 2) транскрипции (мутационные дефекты генной матрицы, ингибирование ДНК-зависимой РНК-полимеразы антибиотиками и токсинами, нарушение посттранскрипционная модификации информационной РНК: неприсоединения "кэпа" к головному концу молекулы, нарушение образования поли-А-хвоста, расстройства сплайсинга и т.д.); 3) трансляции (дефицит или качественные изменения информационной, рибосомной или транспортной РНК, а также рибосомных ферментов и неферментних белков; дефицит свободных аминокислот и АТФ ингибирования процесса антибиотиками и микробными токсинами). 36. Інформаційні механізми пошкодження клітин. Патологія сигналізації, рецепції сигналів. Феномен молекулярної мімікрії. Розлади механізмів сигнальної трансдукції, порушення вторинних месенджерів. Дефекти клітинних програм як основа розвитку патологічних процесів. ПОВРЕЖДЕНИЕ КЛЕТКИ - такие изменения её структуры, метаболизма,которые ведут к нарушению жизнедеятельности, физико‑химических свойств и функции. Причины По происхождению повреждающие факторы подразделяются на экзогенные и эндогенные. Экзогенные: Физические воздействия (механические, термические, лучевые, электрический ток). Химические агенты (кислоты, щелочи, этанол, сильные окислители). Инфекционные факторы (вирусы, риккетсии, бактерии и их токсины, гельминты и др.) Эндогенные: Физической природы (избыток свободных радикалов, колебания осмотического давления) Химические факторы (накопление или дефицит определенных ионов, кислорода, углекислого газа, перекисных соединений, метаболитов и др.) Биологические агенты (белки, лизисомальные ферменты, метаболиты, дефицит или избыток гормонов, ферментов, простагландинов). Эффекты повреждающего фактора Первичные – достигаются непосредственным действием фактора, и вторичные – эффект достигается опосредованно при формировании цепи вторичных патологических реакций. Обратимые и необратимые. Если степень повреждения выходит за пределы адаптивных возможностей, процесс становится необратимым (некроз, апоптоз, дисплазия, опухолевый рост). Обратимые – гипертрофия, гипотрофия, гипоплазия, гиперплазия, дистрофия и др. Специфические и неспецифические изменения клетки. Специфические изменения развиваются при действии определенного патогенного фактора на разные клетки или в определенных видах клеток при действии разных повреждающих агентов (эритроциты при различных повреждениях подвергаются гемолизу). Неспецифические изменения (стандартные) развиваются при повреждении различных видов клеток широким спектром повреждающих факторов (денатурация молекул белка, изменение проницаемости мембран, снижение эффективности биологического окисления). |
