овр. ОВР. Окислительно восстановительные реакции в неорганической химии Восстановители и продукты их окисления
 Скачать 104.83 Kb. Скачать 104.83 Kb.
|
|
Окислительно – восстановительные реакции в неорганической химии Восстановители и продукты их окисления:
Окислители и продукты их восстановления:
При составлении уравнений ОВР важно уметь определять окислитель и восстановитель. Некоторые вещества могут быть только восстановителями. Это металлы и вещества, которые содержат элемент, изменяющий степень окисления, в низшей степени окисления (например: NH3, PH3, H2S, HCl, HBr, HI и их соли). Фтор и сложные вещества, содеожащие элемент в высшей степени окисления, могут быть только окислителями (например: HNO3, H2SO4, SO3, KMnO4, K2CrO4, K2Cr2O7). Вещества, которые содержат элементы в промежуточной степени окисления, могут проявлять, в зависимости от природы реагента – как окислительные, так и восстановительные свойства. Это – все неметаллы (кроме фтора): N2, NO, HNO2, KNO2, H2O2, S, SO2 и другие. 2KI + 2SO3 = I2 + SO2 + K2SO4 SO2 + NO2 = SO3 + NO В этой реакции оксид серы (IV) проявляет восстановительные свойства, т.к. реагирует с сильным окислителем – NO2. 2H2S + SO2 = 3S + 2H2O В данной реакции SO2 проявляет окислительные свойства, т.к. реагирует с более сильным восстановителем – H2S. На ход окислительно – восстановительных реакций в растворах влияет среда, в которой протекает реакция и, поэтому, окислительно – восстановительный процесс между одними и теми же веществами в разных средах приводит к образованию различных продуктов. Для создания кислой среды обычно используют разбавленную серную кислоту. Азотную и соляную применяют редко, т.к. первая является сильным окислителем, а вторая способна окисляться. Для создания щелочной среды применяют растворы гидроксидов калия или натрия. Примеры влияния среды на характер продуктов ОВР: 5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH Na2SO3 + 2KMnO4 + 4KOH = Na2SO4 + 2K2MnO4 + 2H2O 16HBr + 2NaMnO4 = 5Br2 + 2MnBr2 + 2NaBr + 8H2O 4KMnO4 + 4KOH = 4K2MnO4 + O2 + 2H2O Кислоты – сильные окислители Это серная кислота концентрированная и азотная кислота в любом виде. Они окисляют почти все металлы и такие неметаллы, как углерод, фосфор, серу, и многие сложные вещества. Возможные продукты восстановления этих кислот: H2SO4 SO2 S H2S HNO3 NO2 NO N2O N2 NH3(NH4NO3) При взаимодействии с металлами получаются три вещества: соль, вода и продукт восстановления кислоты, который зависит от концентрации кислоты, активности металла и температуры. Чем меньше концентрация кислоты. А металл более активен, тем больше степень восстановления кислоты. Представим возможные направления взаимодействия этих кислот с различными веществами в виде схем: H2SO4 конц.    не реагирует не реагирует восстанавливается восстанавливается с Au, Pt и на холоде до SO2 с неактивными до SO2, S или H2S некоторыми с Fe,Al, Cr металлами и с металлами средней другими неметаллами активности и активными, металлами со сложными  веществами веществами Cu + H2SO4 конц. = CuSO4 + SO2 + 2H2O Zn + 2H2SO4 конц.= ZnSO4 +SO2 + 2H2O 3Zn + 4H2SO4 конц. = 3ZnSO4 + S + 4H2O 4Zn + 5H2SO4 конц. = 4ZnSO4 + H2S + 4H2O HNO3 конц.     не реагирует не реагирует восстанавливается восстанавливается с Au, Pt и на холоде до NO2 с неактив - до NO, N2O, N2 или некоторыми с Fe, Al, Cr ными металлами, NH4NO3 (если кислота другими неметаллами, очень разбавлена или металлами сложными сказано, что газ не выделялся) веществами с металлами средней активности и активными Cu + 4HNO3 конц. = Cu (NO3)2 + 2NO2 + 2H2O HNO3 разб.     не реагирует не реагирует восстанавливается восстанавливается с Au, Pt и на холоде до NO с неактивными до NO, N2O, N2 или некоторыми с Fe, Al, Cr металлами, неметаллами, NH4NO3 (если кислота другими сложными веществами очень разбавлена или металлами сказано, что газ не вы – делялся) с металлами средней активности и активными 3Cu + 8HNO3 разб.. = 3Cu (NO3)2 + 2NO + 4H2O Al + 4HNO3 разб. = Al (NO3)3 + NO + 2H2O 8Al + 30HNO3 разб. = 8Al (NO3)3 + 3N2O + 15H2O 10Al + 36HNO3 разб. = 10Al (NO3)3 + 3N2 + 18H2O 8Al + 30HNO3 разб. = 8Al (NO3)3 + 3NH4NO3 + 5H2O Концентрированные H2SO4 и HNO3 реагируют с Fe, Al, Cr только при нагревании: 2Fe + 6H2SO4 конц. = Fe2 (SO4)3 + 3SO2 + 3H2O Fe + 6HNO3 конц. = Fe (NO3)3 + 3NO2 + 3H2O Концентрированная H2SO4 и HNO3 в любом виде окисляют неметаллы - восстановители - углерод, фосфор, серу - до соответствующих кислот. C + 4HNO3 конц. = CO2 + 2H2O + 4NO2 3C + 4HNO3 разб. = 3CO2 + 2H2O + 4NO C + 2H2SO4 конц. = CO2 + 2H2O + 2SO2 P + 5HNO3 конц. = H3PO4 + 5NO2 + H2O 3P + 5HNO3 разб. + 2H2O = 3H3PO4 + 5NO 2P + 5H2SO4 конц. = 2H3PO4 + 5SO2 + 2H2O S +6HNO3 конц. = H2SO4 + 6NO3 + 2H2O S + 2HNO3 разб. = H2SO4 + 2NO S +2H2SO4 конц. = 3SO2 +2H2O Концентрированная азотная кислота окисляет йод до йодноватой кислоты: I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O Взаимодействие этих кислот со сложными веществами рассмотрим в следующем разделе. Особое значение имеет ОВР между соляной и азотной кислотами. Смесь трёх объёмов соляной кислоты и одного объёма концентрированной азотной называют «царская водка», в ней растворяется даже золото, которое алхимики считали царём металлов: 3HCl +HNO3 = Cl2 + NOCl + 2H2O В ряде случаев между веществами, которые проявляют сильные восстановительные и окислительные свойства, возможны только ОВР, а не реакции обмена: 1. Окислители – соединения железа (III), восстановители – сульфиды, йодиды. При этом катион Fe3+ восстанавливается до катиона Fe2+, сульфид – анион S2-окисляется до серы S0, а йодид – анион I- окисляется до йода I2. В зависимости от количественного соотношения реагирующих веществ могут получиться различные соединения железа (II): 2FeCl3 + H2S = S + 2FeCl2 + 2HCl 2FeCl3 + Na2S = S + 2FeCl2 или 2FeCl3 + 3Na2S = S + FeS + 6NaCl Fe2(SO4)3 + H2S = S + 2FeSO4 +H2SO4 Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O 2FeCl3 +2HI = 2FeCl2 + I2 + 2HCl 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl или 2FeCl3 + 6KI = 2FeI2 + I2 + 6KCl Fe2(SO4)3 + 2KI = 2FeSO4 + I2 + K2SO4 Fe2(SO4)3 + BaI2 = 2FeSO4 + I2 + BaSO4 2. Окислители – соединения меди (II), восстановители - йодиды. При этом катион Cu2+ восстанавливается до катиона Cu+, а йодид – анион окисляется до йода I2 : 2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4 2CuCl2 + 4KI = 2CuI + I2 + 4KCl 2CuCl2 + 4HI = 2CuI + I2 + 4HCl 3. Окислитель – азотная кислота, восстановитель – сульфиды, йодиды, сульфиты. При этом азотная кислота, в зависимости от концентрации, восстанавливается до NO2 (концентрированная), до NO (разбавленная); сульфид – анион S2- окисляется до серы S0 или сульфат – аниона SO42-, йодид – анион – до йода I2, a сульфит – анион SO32- - до сульфат – аниона SO42- : 8HNO3 конц. + CuS = CuSO4 + 8NO2 + 4H2O или 4HNO3 конц.+ CuS = S + 2NO2 + Cu(NO3)2 + 2H2O 8HNO3 разб.+ 3CuS = 3S + 2NO + 3Cu(NO3)2 + 4H2O 4HNO3 конц.+ Na2S = S + 2NO2 + 2NaNO3 + 2H2O 24HNO3 конц.+ Al2S3 = Al2(SO4)3 + 24NO2 + 12H2O 2HNO3 разб.+ H2S = 3S + 2NO + 4H2O 8HNO3 конц.+ H2S = H2SO4 + 8NO2 + 4H2O или 2HNO3 конц.+ H2S = S + 2NO2 + 2H2O 2HNO3 разб.+ 3K2SO3 = 3K2SO4 + 2NO + H2O 6HNO3 конц.+ HI = HIO3 + 6NO2 + 3H2O 2HNO3 конц.+ 2KI = I2 + 2NO2 + H2O 4. Окислитель – азотная кислота или серная концентрированная кислота, восстановитель – соединения железа (II). При этом азотная кислота восстанавливается до NO2 или NO, серная – до SO2, а катион Fe2+ окисляется до катиона Fe3+ : Fe(OH)2 + 4HNO3 конц. = Fe(NO3)3 + NO2 + 3H2O FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O 3Fe(NO3)2 + 4НNO3 разб. = 3Fe(NO3)2 + NO + 2H2O 2Fe(OH)2 + 4H2SO4 конц. = Fe2(SO4)3 + SO2 + 6H2O 5. Окислитель – серная кислота концентрированная, восстановитель – сульфиды, йодиды и бромиды. При этом серная кислота восстанавливается до SO2, S или H2S; сульфид – анион S2- окисляется до серы S, SO2 или H2SO4; йодид – анион до йода I2, бромид – анион до брома Br2: CuS + 4H2SO4 конц. = CuSO4 + 4SO2 + 4H2O H2S + H2SO4 конц.= S + SO2 + 2H2O или H2S + H2SO4 конц. = 4SO2 + 4H2O 8HI + H2SO4 конц. = 4I2 + H2S + 4H2O или 6HI + H2SO4 конц.= 3I2 + S + 4H2O 2HI + H2SO4 конц. = I2 + SO2 + 2H2O 8KI + 9H2SO4 конц. = I2 + H2S + 8KHSO4 + 4H2O или 6KI + 2H2SO4 конц. = 3I2 + H2S + 3K2SO4 + 4H2O 2HBr + H2SO4 конц. = Br2 + SO2 + 2H2O 2KBr + 2H2SO4 конц. = Br2 + SO2 + K2SO4 + 2H2O 6KBr + 2H2SO4 конц. = 3Br2 + S + 3K2SO4 + 2H2O 6. Железная окалина – Fe3O4, это смесь двух оксидов - FeO и Fe2O3. Поэтому при взаимодействии с сильными окислителями она окисляется до соединения железа (III) за счёт катионов Fe2+ - восстановителей, а при взаимодействии с сильными восстановителями восстанавливается до соединения железа (II) за счёт катионов Fe3+ - окислителей: Fe3O4 + 10HNO3 конц. = 3Fe(NO3)3 + NO2 + 5H2O 3Fе3O4 + 28HNO3 разб. = 9Fe(NO3)3 + NO + 14H2O Fe3O4 + 8HI = 3FeI2 + I2 + 4H2O При взаимодействии с большинством кислот происходит реакция обмена, получаются две соли: Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O Реакции диспропорционирования. Это реакции, в которых атомы одного и того же элемента, входящие в состав одного и того же исходного вещества, повышают и понижают степень окисления. Они очень часто встречаются в заданиях С-2, поэтому их нужно запомнить тем, кто хочет сдать ЕГЭ на высокий балл. Все галогены, кроме F2, диспропорционируют в растворах всех щелочей. При комнатной температуре или на холоде получаются две соли – МГ, МГО и Н2О; при нагревании – две соли: МГ, МГО3 и Н2О. Cl2 +2KOH = KCl + KClO + H2O – на холоде, 3Cl2 + 6KOH = 5KCl +KClO3 + 3H2O – при нагревании, 2Br2 + 2Sr(OH)2 = SrBr2 + Sr(BrO)2 + H2O – на холоде, 6Br2 + 6Sr(OH)2 = 5SrBr2 + Sr(BrO3)2 + 6H2O – при нагревании Аналогично происходят реакции с растворами карбонатов: Cl2 + K2CO3 = KCl + KClO + CO2 – на холоде, 3Cl2 + 3K2CO3 = 5KCl + KClO3 + 3CO2 – при нагревании. 2. Диспропорционирование серы в растворах щелочей: 3S + 6KOH = 2K2S + K2SO3 + 3H2O или 4S + 6KOH = K2S2O3 + 2K2S +3H2O Диспропорционирование фосфора в растворах щелочей. 4P + 3KOH + 3H2O = PH3 + 3KH2PO2 8P + 3Ba(OH)2 + 6H2O = 2PH3 + 3Ba(H2PO2)2 4. Диспропорционирование оксида азота (IV) в воде и щелочах: 2NO2 + H2O = HNO2 + HNO3 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O 5. Другие реакции диспропорционирования: 3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH 4NaClO3 = 3NaClO4 + NaCl 4K2SO3 = 3K2SO4 + K2S ClO2 + H2O = HCl + HClO3 Окислительно-восстановительные реакции с участием органических веществ. Окисление атомов углерода, не несущих функциональных групп. Окисление алканов до карбоновых кислот проводят в промышленном масштабе с использованием катализаторов. В большинстве случаев эти реакции сопровождаются образованием ряда побочных продуктов и не могут быть использованы в качестве лабораторного метода получения карбоновых кислот. Более широко известным вариантом окисления углеводородов является окисление боковых цепей ароматических соединений. Алкильные цепи, соединенные с ароматическими кольцами, окисляются до COOH-групп под действием таких окислителей, как азотная кислота, бихромат калия в кислой среде и перманганат калия. Чаще всего окисляют метильные группы, хотя в реакцию можно вводить и соединения и с более длинными цепями. При этом вторичные группы окисляются легче, чем первичные, а третичные группы устойчивы к окислению. Не забывайте, что при проведении реакции окисления перманганатом калия в щелочной среде, продуктом реакции является не свободная кислота, а ее калиевая соль. Если с ароматическим кольцом связано несколько алкильных групп, то могут быть окислены все эти группы: Молекулы, в которых арильные группы соединены с различными атомами углерода, окисляются так, что у каждого ароматического кольца остается один атом углерода от алкильной цепи, например: 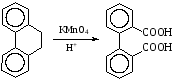 . .Если один атом углерода соединен с двумя арильными группами, то реакция останавливается на стадии образования диарилкетона: При использовании в качестве окислителя оксида хрома (VI) в уксусном ангидриде окисление метильной группы, связанной с арильным кольцом, можно остановить на стадии образования альдегида. Окисление алкенов. Окисление алкенов, в зависимости от используемых реагентов и условий реакции, может происходить как с сохранением углеродного скелета (гидроксилирование), так и с разрывом С=С-связи (окислительное расщепление). Реакция гидроксилирования алкенов, протекающая под действием холодного нейтрального или слабощелочного раствора перманганата калия и сопровождающаяся его обесцвечиванием, известна как реакция Вагнера. Эта реакция используется как качественная проба на двойную связь: 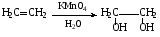 Если проводить окисление алкенов горячим щелочным или кислым раствором перманганата калия или кислым раствором бихромата калия, то первоначально образующиеся диолы расщепляются с разрывом С-С связи. Продуктами окислительного расщепления (в зависимости от строения алкена) являются карбоновые кислоты и (или) кетоны. Чтобы изобразить продукты реакции окисления алкена, выполните следующую последовательность действий: разорвите двойную связь; по месту двойной связи напишите атомы кислорода, а также внедрите атомы кислорода по всем имеющимся при двойной связи связям СН: 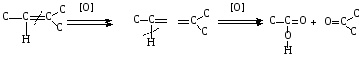 Так при окислении монозамещенных алкенов образуется карбоновая кислота и углекислый газ: 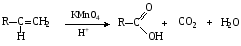 . .Дизамещенные алкены, содержащие разные алкильные группы у двух атомов углерода двойной связи при окислении дают смесь карбоновых кислот: 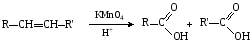 Окисление тризамещенных алкенов приводит к смеси карбоновой кислоты и кетона: 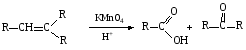 Тетразамещенные симметричные алкены при окислительном расщеплении образуют две молекулы кетона, а несимметричные – смесь двух разных кетонов: 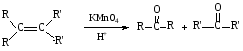 При использовании некоторых реагентов (например, NaIO4 в присутствии каталитического количества KMnO4) окисление двойной связи удается остановить на стадии образования альдегидов. Окисление алкинов Внутренние алкины можно осторожно окислить до -дикетонов действием перманганата калия в нейтральной среде: 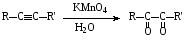 Окислительное расщепление алкинов проводят теми же реагентами, что и в случае алкенов, но в более жестких условиях. При этом образуются карбоновые кислоты. При окислении концевой тройной связи выделяется углекислый газ: Окисление моноатомных спиртов При окислении первичные спирты легко превращаются в альдегиды, а вторичные – в кетоны. 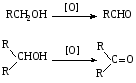 Для окисления вторичных спиртов наиболее часто используют бихромат калия в кислой среде при комнатной температуре или небольшом нагревании. Применяют также KMnO4 и MnO2. Для окисления первичных спиртов до альдегидов обычно используют реактив Джонсонаили комплекс CrO3 c пиридином. Перманганат калия не применяют для окисления спиртов в альдегиды, т.к. реакция не останавливается на стадии образования альдегида, и окисление идет дальше до кислоты. Однако широкое применение нашел MnO2. Этот реагент не затрагивает кратные связи, поэтому может быть использован для получения и непредельных альдегидов и кетонов: Третичные спирты устойчивы к действию окислителей: они не окисляются ни в нейтральной, ни в щелочной среде. Но если в третичном спирте у атома углерода, соседнего с С-ОН-группой, есть атом водорода, то такие спирты окисляются в кислой среде, с отщеплением воды, образованием в качестве промежуточного продукта алкена и разрывом С-С -связи: 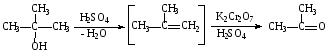 Окисление гликолей 1,2-Гликоли легко расщепляются в мягких условиях при действии иодной кислоты. В зависимости от строения исходного гликоля продуктами окисления могут быть альдегиды или кетоны: 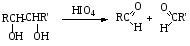 Если три или более ОН-групп связаны с соседними атомами углерода, то при окислении иодной кислотой средний или средние атомы превращаются в муравьиную кислоту. Окисление гликолей перманганатом калия в кислой среде проходит аналогично окислительному расщеплению алкенов и также приводит к образованию кислот или кетонов в зависимости от строения исходного гликоля. 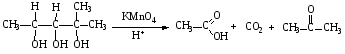 Окисление альдегидов и кетонов Альдегиды легко окисляются до карбоновых кислот. Окисление можно проводить на холоду раствором перманганата калия, раствором оксида хрома (VI) в серной кислоте, гидроксидом меди (II), а также аммиачным раствором гидроксида серебра (реакция серебряного зеркала). 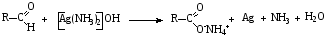 Окисление кетонов протекает в более жестких условиях, т.к. сопровождается разрывом углерод-углеродных связей. Для этого применяют сильные окислители в кислой или щелочной среде. В результате реакции образуется смесь карбоновых кислот: 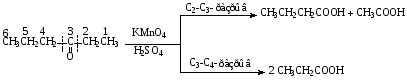 Окисление карбоновых кислот Среди предельных одноосновных кислот легко окисляется только муравьиная кислота. Это связано с тем, что в муравьиной кислоте кроме карбоксильной группы можно выделить и альдегидную группу. Поэтому эта кислота может быть окислена теми же соединениями, что и обычные альдегиды: аммиачным раствором оксида серебра, гидроксидом меди (II) и другими. Продуктом окисления муравьиной кислоты является угольная кислота, распадающаяся до углекислого газа и воды. Среди двухосновных кислот наиболее легко окисляется щавелевая кислота. Примеры: C6H5CH=CH2 + 2KMnO4 + 3H2SO4 →C6H5COOH + CO2↑ + 2MnSO4 + 4H2O + K2SO4 5C6H5CH=CHCH2CH3 + 8KMnO4 + 12H2SO4→ 5C6H5COOH + 5C2H5COOH + 8MnSO4 +12H2O + 4K2SO4 5CH3CH=C(CH3)CH2CH3 + 6KMnO4 + 9H2SO4 5CH3COOH + 5 CH3C(O)C2H5 + 6MnSO4 +9H2O + 3K2SO4 3CH3CH(OH) CH2CH3 + 3KMnO4 →3CH3C(O)C2H5 + 2MnO2↓ + 2KOH + 2H2O C6H4(CH3)2 + 2K2Cr2O7 + 8H2SO4 →C6H4(COOH)2 + 2K2SO4+ 2Cr2(SO4)3 + 10H2O HCOOH + 2Cu(OH)2 →CO2↑ + Cu2O↓+ 3H2O 3C6H5CH=CH2 + 2 KMnO4 + 4H2O →3C6H5CH(OH)CH2OH + 2MnO2↓ + 2KOH |
