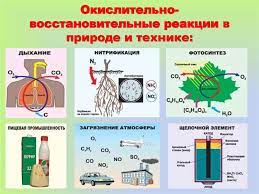
Окислительновосстановительные процессы
 Скачать 489.57 Kb. Скачать 489.57 Kb.
|
|
Поурочный план по химии.
Ход урока
Характеристика класса. В 10А классе 24 ученика, 12 девушек и 12 юношей. Класс среднего уровня мотивации к учёбе. В классе есть несколько учащихся у которых довольно высокий уровень мотивации. Так же есть несколько учеников со слабым зрением. Приложение 1. https://www.google.com/search?q=%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5+%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8+%D0%B2+%D0%BF%D1%80%D0%B8%D1%80%D0%BE%D0%B4%D0%B5+%D0%B8+%D1%82%D0%B5%D1%85%D0%BD%D0%B8%D0%BA%D0%B5&sxsrf=ALiCzsYp9ganp6ra3OQwCsnYSGjxclaNPg:1656311757952&source=  Приложение 2. Дескриптор для учащихся к этапу урока – актуализация знаний (Таксономия Блума). https://teacher.yandex.ru/posts/stavim-tseli-v-obrazovanii-taksonomiya-bluma 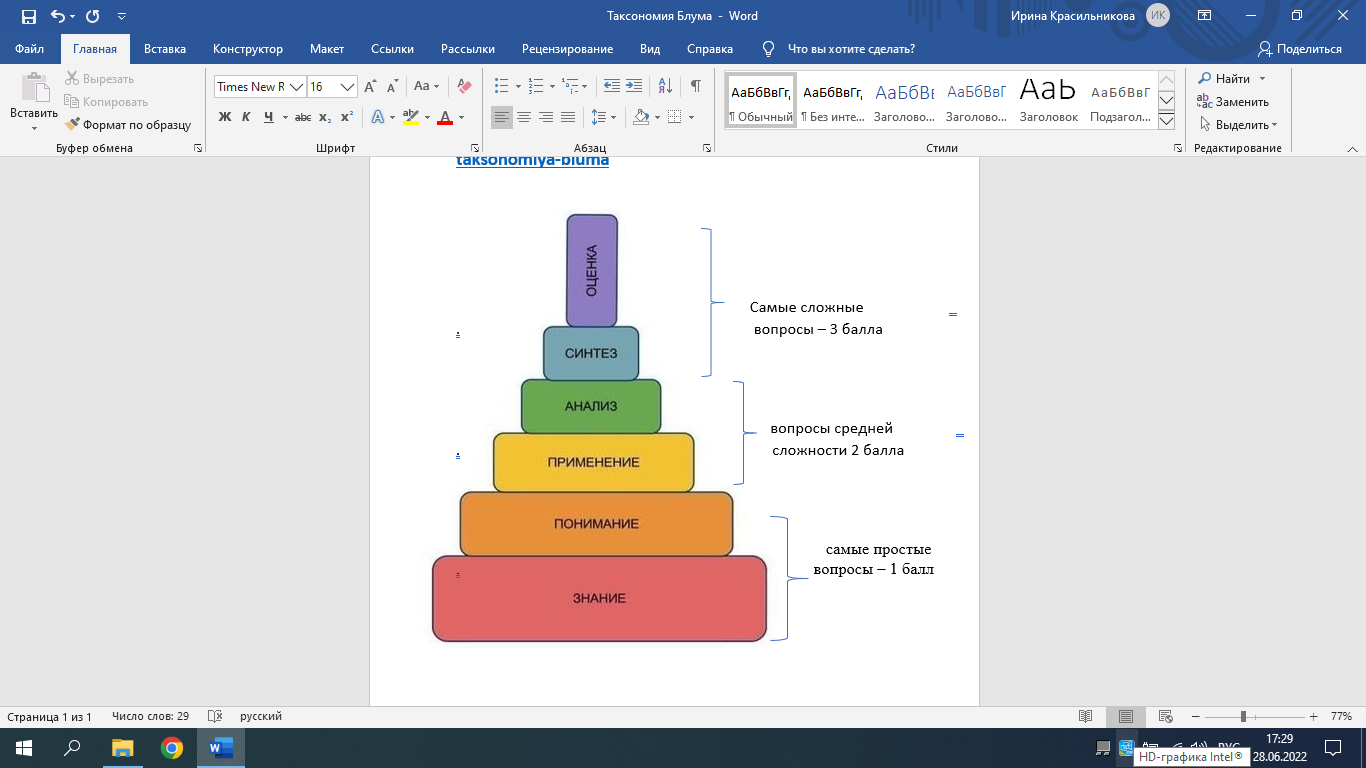 Приложение 3. Метод «Ромашка Блума» «Знание» - красные лепестки. 1.Что такое степень окисления. 2.Какие реакции называются окислительно-восстановительными? 3.Какой процесс называется «восстановление»? 4.Какой процесс называется «окисление»? «Осмысление» - оранжевые лепестки. 1.Классифицируйте следующие реакции по изменению степени окисления: А) 2Mg + O2 → 2MgO Б) CaCO3 → CaO + CO2 2.Классифицируйте следующие реакции по изменению степени окисления: В) Zn + 2HCl → ZnCl2 + H2 Г) BaO + H2O → Ba(OH)2 3.Определите процесс окисления и восстановления: А) Zn0… → Zn2+ B) N0 … → N-3 4.Определите процесс окисления и восстановления: C) 2O-2 … → O20 D) S+4 … → S0 «Применение» - жёлтые лепестки. 1.Определите степень окисления по формуле? Fe2O3; CH4; SO3 2.Определите степень окисления по формуле: Cl2O7; NH3; SO2 3.Составьте формулу по степени окисления: AlO; NaCl; CO 4.Составьте формулу по степени окисления: AlO; NaCl; CO «Анализ» - зелёные лепестки. 1.В каком случае степень окисления элемента равна нулю? 2.Какие элементы могут быть только восстановителями? 3.Какие элементы могут быть и окислителями, и восстановителями? 4.Как можно определить высшую степень окисления элемента? «Синтез» - синие лепестки. 1.Закончите уравнение химической реакции, расставьте коэффициенты методом электронного баланса. SO2 + O2 → 2.Закончите уравнение химической реакции, расставьте коэффициенты методом электронного баланса. CO + O2 → 3.Закончите уравнение химической реакции, расставьте коэффициенты методом электронного баланса. NO + O2 → 4.Закончите уравнение химической реакции, расставьте коэффициенты методом электронного баланса. MnO2 + Al → «Оценка» - фиолетовые лепестки. 1.Могут ли происходить окислительно-восстановительные реакции между веществами: H2S и Hl 2.Могут ли происходить окислительно-восстановительные реакции между веществами: H2S и H2SO3 3.Могут ли происходить окислительно-восстановительные реакции между веществами: H2SO3 и HClO4 4.Могут ли происходить окислительно-восстановительные реакции между веществами: H2S и SO2 Приложение 4. Основные моменты теории ОВР.
Для составления сбалансированных уравнений ОВР методом ионно-электронного баланса.
При составлении составления уравнений окислительно-восстановительных реакций надо соблюдать следующий порядок: 1.Определить степени окисления всех элементов и подчеркнуть символы тех элементов, которые изменили степени окисления: Р0 + K+1Cl+5O3-2 → P2+5O5-2 + K+1Cl-1 2.Составить уравнения процессов окисления и восстановления: P0 – 5e → P+5 |6 |5| в-ль, ок-ся Cl+5 + 6e → Cl-1 |5 |6| ок-ль, в-ся 3.Находим НОК числу отданных и принятых электронов и делим его на количество принятых и отданных электронов. 4.Полученные коэффициенты выставляем в уравнение химической реакции перед формулами исходных веществ. 6Р0 + 5K+1Cl+5O3-2 → P2+5O5-2 + K+1Cl-1 5.Коэффициенты перед продуктами реакции находим подбором: 6Р0 + 5K+1Cl+5O3-2 = 3P2+5O5-2 + 5K+1Cl-1 Приложение 5. Задания. Группа 1. Рассказать о правилах сбалансирования уравнений ОВР методом ионно-электронного баланса для реакций, протекающих в кислотной среде на примере уравнений реакций, приведённых в учебнике. Группа 2. Рассказать о правилах сбалансирования уравнений ОВР методом ионно-электронного баланса для реакций, протекающих в щелочной среде на примере уравнений реакции, приведённых в учебнике. Группа 3. Рассказать о правилах сбалансирования уравнений ОВР методом ионно-электронного баланса для реакций, протекающих в нейтральной среде на примере уравнений реакции, приведённых в учебнике. Группа 4. Составить сбалансированное уравнение ОВР методом ионно-электронного баланса реакции, протекающей в кислотной среде для реакции, приведённой на видио: KMnO4 + Na2SO4 + H2SO4 → Группа 5. Составить сбалансированное уравнение ОВР методом ионно-электронного баланса реакции, протекающей в щелочной среде для реакции, приведённой на видио: KMnO4 + Na2SO4 + NaOH → Группа 6. Составить сбалансированное уравнение ОВР методом ионно-электронного баланса реакции, протекающей в нейтральной среде для реакции, приведённой на видио: KMnO4 + Na2SO4 + Н2О → Дескриптор для оценивания работы по изучению новой темы.
ПРИЛОЖЕНИЕ 6. Для самопроверки. Составление сбалансированного уравнения ОВР методом ионно-электронного баланса в кислотной среде: 1.Определить молекулы и ионы, которые участвуют в процессе окисления и восстановления: K+1MnO4- + Na2+1SO32- + H2SO4 → Mn+2SO42- + Na2SO4 + K2SO4 + H2O Ок-ль в-ль среда 2.Записать в ионном виде полуреакции окисления и восстановления: MnO4- + → Mn+2 + SO32- + → SO42- + 3.Для уравнения числа атомов кислорода, в ту часть уравнения, где недостаточно кислорода добавить воду, а в другую часть катионы водорода Н+ MnO4-1 + 8Н+ → Mn+2 + 4Н2О -1 + 8 → +2 +7 → +2 SO32- + H2O → SO42- + 2H+ -2 → 0 4.Уравнять кислород, водород и электроны. MnO4-1 + 8Н+ +5е → Mn+2 + 4Н2О SO32- + H2O – 2e → SO42- + 2H+ 5.Уравнять число принятых и отданных электронов в полуреакциях. MnO4-1 + 8Н+ +5е → Mn+2 + 4Н2О|2 SO32- + H2O – 2e → SO42- + 2H+ | 5 6.Суммировать сначала левые, а затем правые части полуреакций, не забывая умножить на коэффициент, если он стоит перед формулой. 2MnO4-1 + 16Н+ + 5SO32- + 5H2O = 2Mn+2 + 8Н2О + 5SO42- + 10H+ Сократить одинаковые ионы и молекулы. 2MnO4-1 + 6Н+ + 5SO32- = 2Mn+2 + 3Н2О + 5SO42- 7.Добавить недостающие катионы и анионы. 2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
Составление сбалансированного уравнения ОВР методом ионно-электронного баланса в щелочной среде: 1.Определить молекулы и ионы, которые участвуют в процессе окисления и восстановления: K+1MnO4- + Na2+1SO32- + КОН → K+12MnO42- + Na2SO4 + H2O Ок-ль в-ль среда 2.Записать в ионном виде полуреакции окисления и восстановления: MnO4- + 1e → MnO42- SO32- + → SO42- + 3.Чтобы уравнять число атомов водорода и кислорода, добавляют воду в ту часть реакции, где избыток атомов кислорода, а в противоположную часть – удвоенное число гидроксид-анионов. MnO4- + 1e → MnO42- SO32- + 2ОН- → SO42- + Н2О 4.Уравнять кислород, водород и электроны. MnO4- + 1e → MnO42- |2 SO32- + 2ОН- -2е → SO42- + Н2О |1 5.Уравнять число принятых и отданных электронов в полуреакциях. 6.Суммировать сначала левые, а затем правые части полуреакций, не забывая умножить на коэффициент, если он стоит перед формулой. 2MnO4- + SO32- + 2ОН- = 2MnO42- + SO42- + Н2О 7.Добавить недостающие катионы и анионы. 2KMnO4 + Na2SO3 + 2KОН = 2K2MnO4 + Na2SO4 + Н2О
Составление сбалансированного уравнения ОВР методом ионно-электронного баланса в нейтральной среде: 1.Определить молекулы и ионы, которые участвуют в процессе окисления и восстановления: K+1MnO4- + Na2+1SO32- + Н2О → MnO2 + Na2SO42- + КОН Ок-ль в-ль среда 2.Записать в ионном виде полуреакции окисления и восстановления. MnO4- + → MnО2 + SO32- + → SO42- + 3.Так как среда нейтральная, то в левые части полуреакций добавляют воду. Тогда одну полуреакцию рассматривают как для кислотной среды, а другую - как для щелочной. MnO4-1 + 2H2O → MnO2 + 4OH- -1 → 0 -4 SO32- + H2O → SO42- + 2H+ -2 → 0 4.Уравнять кислород, водород и электроны. MnO4- + 2Н2О +3е → MnО2 + 4ОН-|2 SO32- + H2O – 2e → SO42- + 2H+ |3 5.Уравнять число принятых и отданных электронов в полуреакциях. 6.Суммировать сначала левые, а затем правые части полуреакций, не забывая умножить на коэффициент, если он стоит перед формулой. 2MnO4- + 4Н2О + 3SO32- + 3H2O = 2MnО2 + 8ОН- + 3SO42- + 6H+ 7.Сократить одинаковые ионы и молекулы. 2MnO4- + 7Н2О + 3SO32- = 2MnО2 + 8ОН- + 3SO42- + 6H+ 8OH- + 6H+ = 6H2O + 2OH- 2MnO4- + 7Н2О + 3SO32- = 2MnО2 + 3SO42- + 6H2O + 2OH- 2KMnO4 + 3Na2SO3 + Н2О = 2MnO2 + 3Na2SO4 + 2КОН
Приложение 7. Лист достижений:
Приложение 8. Задание по функциональной грамотности. Для уверенных в своих знаниях учащихся: ОВР на практике. При различных загрязнениях на ткани, помогают усилители порошка и пятновыводители. Если подходящего средства нет под рукой, с пятнами поможет справиться 3%-перекись водорода. Она обладает отбеливающим свойством, убирает жировые следы и пятна крови, обесцвечивает чай и кофе, отпечатки от вина и сока. Выведение пятен аптечной перекисью водорода привлекает еще и потому, что само по себе средство стоит недорого и не разрушает волокна ткани. Обычно перекись всегда под рукой, ведь это завсегдатай домашней или походной аптечки. Нашатырный спирт – еще одно хорошее средство чем вывести пятно от йода на одежде. Как вывести пятно от йода с одежды при помощи аммиака? Замочите одежду в растворе нашатыря и воды. Достаточно подержать вещь 30-40 минут, после чего прополоскать в воде. Если пятно еще видно, одежду надо постирать в машинке. Задание: 1.Объясните, на чём основаны отбеливающие свойства перекиси водорода и исчезновение пятна йода под действием раствора аммиака. 2.Составьте уравнения реакций для этих примеров, расставьте коэффициенты методом электронного баланса. 3.В промышленности для отбеливания широко используется гидросульфит натрия, объясните, почему его не рекомендуют использовать для отбеливания в домашних условиях. Составьте уравнение реакции разложения гидросульфита натрия при нагревании. Объясните, будет ли эта реакция окислительно-восстановительной.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||