Определение физико-химических свойств бутилового спирта. Определение физикохимических свойств бутилового спирта
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
МИНОБРНАУКИ РОССИИ Нижнекамский химико-технологический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего образования «Казанский национальный исследовательский технологический университет» (НХТИ ФГБОУ ВО «КНИТУ») Факультет: подготовительный Кафедра: нефтехимический синтез Группа: 5008 ОТЧЕТ по УП.01.01 учебной практике Тема: «Определение физико-химических свойств бутилового спирта» Выполнил: _____________ Д.К.Хивинцева Проверил: _____________ С.С. Гуничева Н  ижнекамск, 2021 ижнекамск, 2021 СодержаниеВведение 4 1 Теоретическая часть 5 1.1 Анализируемое вещество 7 1.2 Методы исследования анализируемого вещества 9 1.2.1 Вязкость 11 1.2.2 Плотность 16 1.2.3 Показатель приломления 18 Вывод 20 Список литературы 21 ВведениеПрактика проходила на базе федерального государственного бюджетного образовательного учреждения высшего образования «НХТИ ФГБОУ ВО «КНИТУ». Данная практическая работа составляет основную частью профессионально образовательной программы, целью которой является закрепление, расширение и углубление теоретических знаний, полученных за время обучения. Основной идеей работы было ознакомление с химическим веществом - бутиловым спиртом. Задачи учебной практики: ознакомится с нормативной документацией; ознакомится с должностными инструкицями работников лаборатории; изучить методы исследования; изучить свойства исследуемого вещества; определить показатели преломления, вязкости и плотности; оформление работы; защита практической работы. Продолжительность УП.01.01 учебной практики 01.06.2021 — 21.06.2021 1 Теоретическая частьСпиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с углеводородным радикалом. Они могут рассматриваться поэтому как производные углеводородов, в молекулах которых один или несколько атомов водорода заменены на гидроксильные группы. Бутанол начал производиться в 10-х годах XX века с использованием бактерии Clostridia acetobutylicum. Сырьём для производства могут быть сахарный тростник, свекла, кукуруза, пшеница, маниока, а в будущем и целлюлоза. В 50-х годах из-за падения цен на нефть начал производиться из нефтепродуктов. В США ежегодно производится около 1,39 млрд литров бутанола. Бутанол-1 - легковоспламеняющаяся жидкость. Температура вспышки 34 °С (в закрытом тигле), 41 °С (в открытом тигле), температура воспламенения 41 °С, температура самовоспламенения 340 °С, область воспламенения 1,7-12,0% (по объему) при 100 °С, температурные пределы воспламенения: нижний 34 °С, верхний 68 °С. При загорании для тушения используют химическую и воздушно-механическую пены, тонкораспыленную воду. Описывая бутанол можно затронуть такие его характеристики как вязкость, плотность и показатель преломления. Вязкость (внутреннее трение) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Прибор для измерения вязкости называется вискозиметром. Плотность жидкости – это физическая величина, которая показывает массу данной жидкости в единице объема. Плотность жидкости можно измерять как косвенным методом, так и прямыми измерениями с помощью специального приспособления. Показатель преломления — это величина, характеризующая среду и равная отношению скорости света в вакууме к скорости света в среде (абсолютный показатель преломления). Существует два вида показателей преломления: относительный и абсолютный. Первый равен отношению скоростей света в данных средах: n = u1/u2. Абсолютный показатель преломления является показателем относительно вакуума, определяющим во сколько раз скорость света в данной среде меньше скорости в вакууме: n=c/u. 1.1 Анализируемое веществоАнализируемым веществом в практической работе был бутиловый спирт. Прежде чем переходить к исследованию вещества нужно изучить его химические и физические свойства, а также его применение в промышленности и меры предосторожности при работе. Химические свойства. Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования). Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–. Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения. С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления. Обобщая выше сказанное можно выделить что, для спиртов характерны следующие свойства: слабые кислотные свойства, замещение водорода на металл; замещение группы ОН; отрыв воды (элиминирование) – дегидратация; окисление; образование сложных эфиров — этерификация. К физическим свойствам бутанола относятся следующие характеристики: бесцветная вязковатая жидкость с характерным запахом. Смешивается с органическими растворителями. В отличие от метанола, этанола и пропанола только умеренно растворяется в воде — 7,6 г на 100 г воды. С ней образует азеотроп, содержащий 55,5 % по массе бутанола и кипящий при 92,4 °C. Свое применение бутанол как растворитель нашел в лакокрасочной промышленности, в производстве смол и пластификаторов. Бутанол используется как растворитель для красок, лаков и олиф, натуральных и синтетических смол, каучуков, растительных масел, красок и алкалоидов. Он играет роль промежуточного звена в производстве фармацевтических препаратов и химикалий, и используется в отраслях промышленности, производящих искусственную кожу, текстиль, небьющееся стекло, резиновый клей, шеллак, плащи, фотографические пленки и духи. Трет-бутанол используется для удаления воды из различных материалов, как растворитель в производстве лекарств, духов и ароматических веществ, а также в качестве химического промежуточного продукта. Он также входит в состав промышленных моющих средств, применяется для денатурации этилового спирта и добавляется в бензин для повышения его октанового числа. Токсичность бутанола относительно невелика (LD50 составляет 2290–4360 мг/кг), но наивысшая среди младших спиртов. При употреблении внутрь возникает эффект, сходный с эффектом от употребления Этанола. Бутанол содержится в небольших количествах в различных алкогольных напитках. Концентрация в 0.01% в воздухе никак не влияет на организм, в то время как 0.02% вызывает воспаление роговой оболочки глаза. Работать с ними следует под тягой, в защитных очках, предельно-допустимая концентрация этих спиртов составляет 200 мг/м3. При попадании препарата в глаза необходимо промыть их 3%-м раствором борной кислоты, при раздражении верхних дыхательных путей следует пить горячее молоко. 1.2 Методы исследования анализируемого веществаВ данном разделе пойдет речь о исследование адсорбции бутилового спирта на поверхности модифицированных силикагелей методами 13С ЯМР и инфракрасной спектроскапии. Методами 13С ЯМР - и ИК-спектроскопии изучена адсорбция бутилового спирта на поверхности силикагеля и образцов SiO2, модифицированных соединениями бора и фосфора. Показано, что доминирующим является взаимодействие функциональной группы молекул спирта с протонодонорными и особенно электроноакцепторными центрами поверхности. *ЯМР измерения были проведены в лаборатории ядерного магнитного резонанса Лейпцигского университета (г. Лейпциг, Германия). 13С – ядро с низким природным содержанием (1,07%) и меньшим, чем у протона, магнитным моментом, а термин ЯМР обозначает Ядерный магнитный резонанс. Методом 13С ЯМР высокого разрешения была изучена зависимость химических сдвигов и ширины резонансных линий для всех атомов углерода молекул спирта, адсорбированных на индивидуальном и модифицированных силикагелях. Рассмотрим условия, влияющие на характер резонанса ядер. При адсорбции спирта на поверхности чистого силикагеля не наблюдали зависимости химического сдвига этого атома углерода от степени заполнения поверхности адсорбатом и температуры предварительной вакуумной обработки образца. При адсорбции бутанола на силикагеле, модифицированном борной кислотой, отмечено увеличение химического сдвига с ростом температуры вакуумирования. Химический сдвиг бутанола, адсорбированного на образце Р/SiO2, не зависел от температуры вакуумной обработки и совпадал по величине с измеренным на индивидуальном SiO2. ИК-спектры н-бутилового спирта, адсорбированного на индивидуальном и модифицированных силикагелях, были измерены в области ковалентных С–Н-связей углеводородного радикала. Полученные спектры адсорбированного бутанола были сопоставлены со спектрами индивидуального спирта (в жидком и парообразном состояниях). Частоты колебаний С–Н сместились в область более высоких значений и для СН3-групп совпали с величиной для парообразного состояния. Для СН2-групп частоты колебаний имели промежуточные значения между жидкостью и паром. При переходе от спектра жидкого спирта к эфиру борной кислоты было отмечено усиление низкочастотного плеча у полосы CH2, которое наиболее отчетливо проявлялось при адсорбции бутанола на образце Р/SiO2. Переход к эфиру борной кислоты и затем к адсорбированному состоянию н-бутанола изменял соотношение оптических плотностей для полос асимметричных колебаний групп СН2 и СН3. Регистрируемый при выбранных условиях адсорбции и десорбции н-бутанола ИК-спектр отражает суммарный эффект присутствия на поверхности как слабо, так и более прочно связанных молекул спирта. 13С ЯМР высокого разрешения фиксирует только молекулы, обладающие достаточной подвижностью и, следовательно, исключает из рассмотрения случай прочной хемосорбции. Однако, сопоставляя результаты, полученные этими методами, можно видеть, что для всех присутствующих на поверхности форм адсорбированного бутанола состояние углеводородного радикала его молекул ближе к газообразному, чем к жидкому. Это подтверждает отсутствие специфических форм связи метиленовых групп с центрами поверхности. Проведенное методами 13С ЯМР и ИКС исследование адсорбции н-бутилового спирта на образцах модифицированных силикагелей показало, что доминирующим является взаимодействие функциональной группы молекул спирта с кислотными центрами поверхности как бренстедовского, так и льюисовского типа. При определенных условиях может также проявляться неспецифическое взаимодействие протонов метиленовых групп углеводородного радикала с электронодонорными участками поверхности – атомами кислорода тетраэдров РО4. 1.2.1 ВязкостьВ статье рассматриваются вопросы экспериментального определения вязкости спиртов. Рассмотрена методика определения вязкости, обработка экспериментальных данных. Приведена погрешность расчетов на примере спиртов и их смесей. Расчеты проведены кандидатами физико-математических наук, доцентами кафедры физики Тувинского государственного университета, г. Кызыл. Вязкость (внутреннее трение) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Прибор для измерения вязкости называется вискозиметром. Методы определения вязкости жидкостей можно разбить на две группы. Первая группа включает в себя метод истечения, метод падающего шарика, метод вращающихся коаксиальных цилиндров. Вторая группа подразделяется на метод затухающих крутильных колебаний диска, цилиндра или пластины и ультразвуковой метод. Наиболее широкое применение нашёл капиллярный метод, основанный на законе Пуазейля. При абсолютных измерениях вязкости капиллярным вискозиметром необходимо вносить поправки на кинетическую энергию и опорожнение рабочего резервуара, на дополнительное сопротивление, происходящее от присутствия плоских концов толстостенного капилляра, обрезанного под прямым углом к оси и прочее. Относительный же метод измерения вязкости выгодно отличается от абсолютного метода более высокой точностью, которая достигается частью из-за упрощения прибора, частью за счёт того, что в этом случае исключаются ошибки, связанные с измерением размеров капилляров. Среди многочисленных относительных вискозиметров наибольшее применение получили вискозиметры типа Оствальда-Мартина, для которых высота рабочего столба жидкости практически не зависит от температурных изменений его объёма. Для расчёта вязкости Оствальд предложил формулу η= (ηо / ρо*τо) ρ*τ = К ρ τ, (1) где ηо, ρо, τо – вязкость, плотность и время истечения градуировочной жидкости, К = ηо/(ρо*τо) - постоянная прибора, ρ и τ – плотность и время истечения исследуемой жидкости. Предназначенные для изучения и приготовления растворов вещества предварительно осушали и очищали, жидкие вещества подвергали двух-трёхкратной перегонке. Для измерения вязкости исследуемой жидкости вискозиметр (рис.1) сначала градуируют по стандартной жидкости. В тщательно вымытый и высушенный под вакуумом прибор через трубку 8 заливали необходимое количество градуировочной жидкости и затем трубку 8 запаивали. После этого вискозиметр закрепляли на специальной рамке, имеющей горизонтальную ось вращения, и помещали в воздушный термостат. После 2,5-3 часов термостатирования производили измерения времени истечения жидкости по капилляру 4 из рабочего резервуара 2. Для этого вискозиметр поворачивали вокруг оси, на угол, превышающий 90о, в результате чего жидкость по трубке 1 перетекала в резервуар 11. После этого прибор возвращали в исходное положение. Жидкость из резервуара 11 перетекала в резервуар 2, заполняя нижнюю часть резервуара 3 до уровня трубки 5, и начинала перетекать в резервуар 6. Как это показано на Рис.1 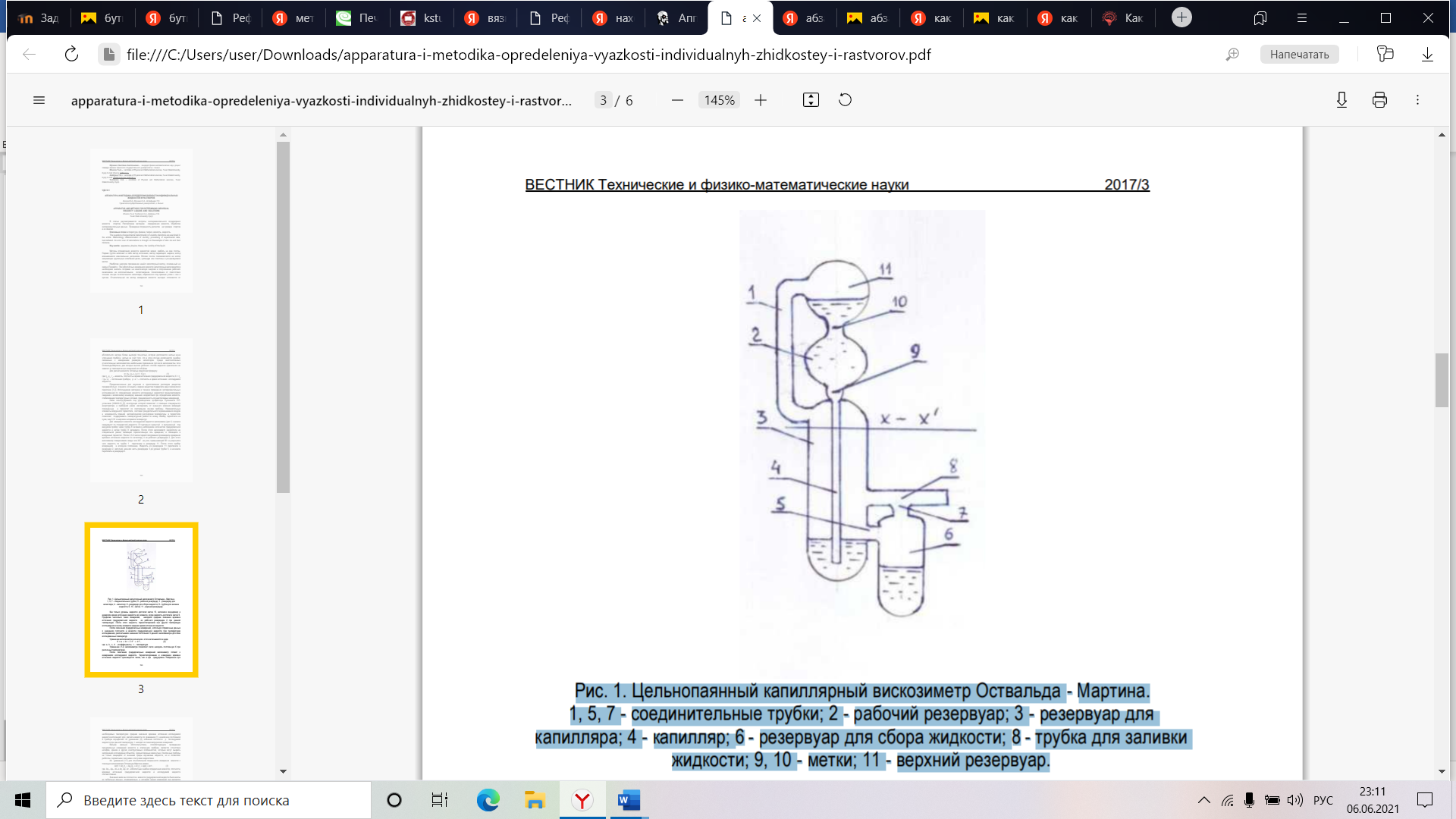 Рис. 1. Цельнопаянный капиллярный вискозиметр Оствальда - Мартина. 1, 5, 7 - соединительные трубки; 2 - рабочий резервуар; 3 - резервуар для капилляра; 4 - капилляр; 6 - резервуар для сбора жидкости; 8 - трубка для заливки жидкости; 9, 10 - метки; 11 - верхний резервуар. Как только уровень жидкости достигал метки 10, включали секундомер и измеряли время истечения жидкости до момента, когда жидкость достигала метки 9. Проделав несколько таких измерений, находили среднее значение времени истечения градуировочной жидкости из рабочего резервуара 2 при данной температуре. После этого жидкость термостатировали при другой температуре исследования и вновь измеряли среднее время истечения жидкости. После окончания градуировочных измерений, используя справочные данные о значениях плотности и вязкости градуировочной жидкости при температурах исследования, рассчитывали значения постоянной. К данного вискозиметра для всех исследованных температур. Уравнение вискозиметра в итоге записывается в виде К = а + b*t + с*t^2+ d*t^3, (2) где а, b, c, d - коэффициенты, t – температура. Уравнение (вискозиметра позволяет легко находить постоянную К при различных температурах. После окончания градуировочных измерений вискозиметр готовят к измерениям исследуемой жидкости. Термостатирование и измерение времени истечения жидкости производится также, как и при градуировке. Найденные при необходимых температурах средние значения времени истечения исследуемой жидкости используют для расчёта вязкости по уравнению (1), а величину постоянной К прибора определяют по уравнению (2), значения плотности ρ исследуемой жидкости при данной температуре t находят из пикнометрических измерений. Весьма важным обстоятельством, способствующим проведению весьма точных измерений вязкости в описанном приборе, является отсутствие шлифов, кранов и других конструктивных особенностей, которые могут вызвать загрязнения исследуемых объектов. Цельнопаянные замкнутые стеклянные приборы не только защищают от внешней среды изучаемые жидкости, но и позволяют работать с ядовитыми, пахучими и летучими жидкостями. Из уравнения (1) для относительной погрешности измерения вязкости с помощью вискозиметра Оствальда-Мартина имеем Δη/η = Δηо/ηо + Δρо/ρо + Δτо/τо + Δρ/ρ + Δτ/τ , (3) где Δηо, Δρо, Δτо и Δη, Δρ, Δτ - абсолютные ошибки определения вязкости, плотности, времени истечения градуировочной жидкости и исследуемой жидкости соответственно. Значения величин плотности и вязкости градуировочной жидкости были взяты из табличных данных, следовательно, в условиях наших измерений они являются постоянными величинами и их относительными ошибками можно пренебречь. В результате получаем Δη/η = Δτо/τо + Δρ/ρ + Δτ/τ. Средняя относительная погрешность в определении вязкости составляет 0,8%. В таблице 1 показаны результаты экспериментального определения вязкости чистых спиртов: изоамилового, изобутилового, н-бутилового, изопропилового. На основании анализа полученных результатов можно сделать следующие выводы: вязкость чистых спиртов и их смесей с повышением температуры уменьшается; вязкость чистых спиртов возрастает с увеличением молекулярной массы и зависит от химической структуры молекул; в смесях изопропилового спирта с н-бутиловым и изоамиловым отсутствуют химические реакции. Значения вязкости зависят от температуры, и с ее увеличением понижается значение этого свойства. Экспериментальные значения вязкости (η 10^3, Па с) одноатомных спиртов. Таблица 1.
1.2.2 ПлотностьПлотность жидкости – это физическая величина, которая показывает массу данной жидкости в единице объема. Плотность жидкости можно измерять как косвенным методом, так и прямыми измерениями с помощью специального приспособления. Инструкция для нахождения плотности жидкостей: Итак, у вас есть жидкость, плотность которой собираетесь определить, первоначально нужно её взвесить в сосуде известного объема (и не забыть вычесть вес самого сосуда). Возьмите пустой мерный стакан или мензурку, поставьте на весы и определите массу пустого сосуда без жидкости. Обозначьте ее m1, например. Далее налейте в этот сосуд жидкость, плотность которой хотите измерить. Наливайте жидкость до такого уровня, чтобы легко было определить ее объем (на небольших мерных стаканах нанесена шкала объема в миллилитрах); После того, как вы определили и записали объем жидкости (V), поставьте снова эту емкость на весы, только что теперь она будет с жидкостью. Запишите новую массу и обозначьте ее m2. Зная массу пустого сосуда m1 и полного сосуда m2, определите массу жидкости m по формуле: m = m2 – m1. Теперь можно переходить непосредственно к определению плотности ρ: ρ = m / V, где m и V – масса и объем жидкости, найденные выше; Помните, что объем жидкости измеряется, как правило, в килограммах на метр кубический или в граммах на сантиметр кубический. Поэтому переводите измеренные величины к одной или второй стандартной системе единиц измерения. Если сосуд с жидкостью достаточно большой, но вы знаете массу пустого сосуда m1 и массу наполненного сосуда m2, то можно поступить следующим образом. Сначала найдите массу жидкости в сосуде по формуле m = m2 – m1. Затем с помощью линейки или рулетки измерьте геометрические размеры сосуда: для прямоугольных сосудов измерьте высоту, ширину и длину, а для цилиндрических – диаметр и высоту. Для нахождения объема прямоугольного сосуда воспользуйтесь формулой: V = a * b * h, где a – ширина, b – длина, h – высота сосуда; Для нахождения объема цилиндрического сосуда возьмите формулу: V = (pi * d * d * h) / 4, где pi – число Пи, равное 3,14, d – диаметр сосуда, h – его высота (высота уровня жидкости); После нахождения объема найдите плотность жидкости, как и в предыдущем случае, по формуле ро = m / V; Задача определения плотности намного упрощается, если у вас есть ареометр. Этот прибор представляет собой стеклянную колбу с поплавком и шкалой. Просто опустите его в жидкость таким образом, чтобы он не касался дна, а по шкале в верхней части ареометра посмотрите значение плотности жидкости. Часто ареометром пользуются автолюбители для определения плотности электролита в аккумуляторе. В таблице 2 приведены значения плотности бутанола, из них можно заметить, чем выше температура , тем меньше плотность вещества. В таблице 2 представлена плотность бутанола кг/м3 при температуре (°С)
1.2.3 Показатель приломленияСуществуют много способов измерения концентрации воды в растворе, но более дешевым, надежным, и в то же время быстрым методом определения концентрации в широком диапазоне является измерение коэффициента преломления. Показатель преломления зависит от следующих факторов: природы вещества; плотности вещества; концентрации вещества в растворе; температуры и давления, при которых проводится измерение (так как они влияют на плотность вещества); длины волны света. Наиболее часто измеряют показатель приломления при 20C, при этом температуру поддерживают встроенным в рефрактометр термостатом. Рефрактометр – не единственный прибор, используемый для измерения показателя преломления. В некоторых случаях требуется более высокая точность и чувствительность анализа. Например, показатели преломления газов при обычных условиях близки к единице, отличаясь на несколько десятитысячных интерферометры, принцип действия которых основан на интерференции света. Изучено, что в водно-спиртовых смесях наиболее точный рефрактометрический анализ возможен только в определенном диапазоне концентраций. Для большинства лекарственных веществ верхний предел этого диапазона находится в области 20-30%, а нижний предел концентрации, в общем случае, составляет 3%. Это связано с тем, что при низком содержании вещества в растворе недопустимо возрастает относительная погрешность рефрактометрического анализа. Рефрактометрический анализ спиртовых растворов имеет ряд особенностей, требующих специального рассмотрения. При исследовании спиртовых растворов на призму рефрактометра рекомендуется наносить не менее 4–5 капель смеси. Вследствие летучести спирта анализ следует проводить быстро, а освещение призмы включать лишь в момент снятия показателя преломления. Если исследование проводится не при 20С, следует вносить поправку на температуру. Соответствующие величины температурных коэффициентов спирто-водных растворов на 1С приведены в приложении. Температурная поправка равна произведению температурного коэффициента на величину отклонения от 20С. Если определение проводится при температуре выше 20С, то поправку прибавляют к измеренной величине показателя преломления, если ниже 20С – поправку вычитают. Из таблицы 3 ниже мы можем заметить закономерность увеличения показателя преломления с увеличением концентрации бутанола в водном растворе.  ВыводЗа время прохождения учебной практики были закреплены изученные знания и изучены свойства химического вещества. В данной практической работе рассматривались следующие физические и химические свойства бутилового спирта: вязкость, плотность и показатель преломления. Также были изучены методы исследования бутилового спирта, а именно, его адсорбции, такими методами являлись 13С ЯМР метод и ИК-спектроскопии. Из вышесказанного следует, что при прочих равных условиях показатель преломления раствора зависит от концентрации растворенного вещества, а плотность и вязкость бутанола зависят от температуры и с ее увеличением эти показатели уменьшаются. Считаю, что полученные мною опыт будет способствовать продуктивному освоению специальных дисциплин и применению теоретических знаний в практической деятельности. Список литературыХимическая энциклопедия 1988, "Советская энциклопедия", Т1, стр. 336-337 Вайсбергер "Органические растворители: Физические свойства и способы очистки", М., 1958, стр. 317-319 Глинка Н.Л. Общая химия. – Л.: Химия, 1978. – 720 с. Зурабян С.Э., Колесник Ю.А., Кост А.А. Органическая химия: Учебник. – М.: Медицина, 1989. - 432 с. “Исследование адсорбции н-бутилового спирта на поверхности модифицированных силикагелей методами 13С ЯМР и инфракрасной спектроскопией” Л.Е. Китаев, А.А. Кубасов, С.В. Малышев АППАРАТУРА И МЕТОДИКА ОПРЕДЕЛЕНИЯ ВЯЗКОСТИ ИНДИВИДУАЛЬНЫХ ЖИДКОСТЕЙ И РАСТВОРОВ Хворов Ю.А., Юрченко С.А., Астафьева Т.Н. Тувинский государственный университет, г. Кызыл Текст научной статьи по специальности «Химические технологии» Хворов Юрий Алексеевич, Астафьева Татьяна Николаевна, Юрченко Светлана Анатольевна | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
