Юбельт. Определитель минералов. Определитель минералов
 Скачать 1.68 Mb. Скачать 1.68 Mb.
|
|
| Элемент | Атомная масса | Содержание железа |
| Железо, Fe | 55,85 | 55,85:15,86 = |
| Углерод, С Кислород, Оз | 12,01 48,00 | = 48,2 мас.% Fe |
| 115,86 |
Чтобы в более наглядной форме представить химические взаимоотношения в минералах сложного состава, формулы в минералогии записывают несколько иначе. Калиевый полевой шпат (ортоклаз) имеет, например, химическую (структурную) формулу KAlSi3O8; если же выразить состав этого минерала в виде окислов, то его формула примет вид К2О-Аl2О3-6SiO2. Минерал состоит из
| 64,8 мас. % | SiO2 | (двуокись кремния), |
| 18,3 мас. % | А1203 | (окись алюминия), |
| 16,9 мас. % | КаО | (окись калия). |
ОБРАЗОВАНИЕ
И ОБЛИК МИНЕРАЛОВ
И КРИСТАЛЛОВ
Изучение облика минералов, т. е кристалломорфо-логия, составляет один из существенных разделов минералогии. Минералогам, петрографам и исследователям месторождений, словом, каждому, кто занят изучением минерального мира, кристаллография — учение о кристаллах— необходима для диагностики минералов и их агрегатов. Подчас минералы встречаются в природе в виде правильных кристаллов, выросших в пустотах, но гораздо чаще в виде сплошных зернистых или плотных образований (рис. 3). Минералы, кристаллизовавшиеся в условиях земной коры, образованы по определенным законам. Их кристаллографическая форма зависит от химического состава, а также от физических условий образования — давления и температуры.
По своим размерам природные кристаллы могут быть самыми разными: от микроскопических до весьма крупных вплоть до нескольких метров длиной и в поперечном сечении. Внешний облик кристаллов зависит от того, насколько спокойно происходил их рост. Большинство кристаллов в природе растут медленно — тысячи и миллионы лет. Однако некоторые кристаллы растут очень быстро, например кристаллы легко растворимых солей, иногда сублимационных минералов (сера, таблички гематита) в кратерах действующих вулканов.
Вообще говоря, кристаллы образуются в тех случаях, когда какое-либо вещество переходит из жидкого или газообразного состояния в твердое. Рост кристалла начинается с образования зародышей и скелетных форм. При длительном, равномерном, беспрепятственном поступлении вещества со всех сторон возникают нормальные кристаллические формы, что, однако, едва ли является правилом. В большинстве случаев кристаллы стеснены в своем росте соседними телами (соседними кристаллами). Это приводит к образованию несовершенных кристаллов с искаженными гранями, так как поступление растворов, питающих кристалл, происходит с разных сторон неравномерно.
Признаками хорошо образованных форм монокристалла являются ровные, блестящие грани, отсутствие входящих углов (только двойниковые сростки имеют разнообразные входящие углы). Часто грани кристаллов бывают шероховатыми, с притупленными ребрами, а сами ребра закругленными. Подобные особенности следует относить за счет процессов растворения, когда на кристалл воздействовали активные растворы.
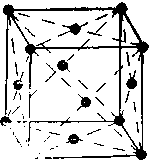
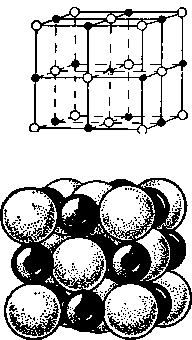
Многочисленные физические и химические свойства выкристаллизовавшихся минералов, такие, например, как характер роста кристаллов, форма кристаллов, твердость, спайность, растворимость и т. д., зависят от химического состава кристаллов, от их упорядоченного атомного или молекулярного строения. Изучением этих вопросов заняты специалисты одного из наиболее важных направлений исследований в кристаллографии. Например, кристалл каменной соли — хлорида натрия (NaCl), состоит из атомов натрия и хлора. По углам кубической элементарной ячейки NaCl располагаются, чередуясь, атомы натрия и хлора (табл. 1). Эти «кирпичики» расположены в пространстве закономерно. В целом подобная конструкция называется кристаллической решеткой. Каменная соль образует кубические кристаллы и спайные выколки по кубу именно вследствие своей характерной структуры.
В соответствии с химическим и кристаллографическим многообразием в минеральном мире существует некоторое количество структурных типов кристаллических решеток, иногда построенных просто, но чаще имеющих весьма сложное строение. Исследования атомного строения кристаллических решеток, успешно проводимые с помощью рентгенографии, включают изучение химии минералов и некоторых аспектов атомной физики.
Можно привести следующие примеры отдельных типов кристаллических структур: кубическая гранецентрированная решетка самородной меди, построенная из атомов меди, кубическая решетка галита (каменной соли), построенная из как бы вложенных друг в друга кубических гранецентрированных решеток из ионов Na+ или Сl-, кубическая решетка флюорита, слоистая решетка молибденита, гексагональная и тригональная решетки кварца, тригональная решетка кальцита.
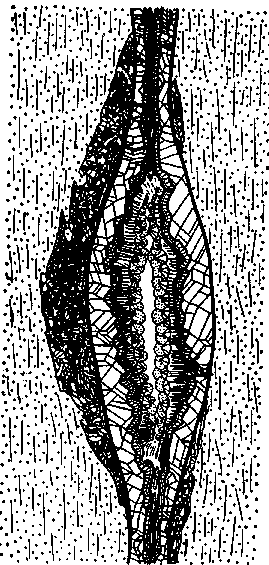
Рис. 3. Полость рудной жилы в разрезе.

Многообразны типы кристаллических решеток у сульфидов и окислов. Особый интерес с точки зрения их структуры представляют силикаты, преобладающие в составе горных пород, и среди них в первую очередь такие, как полевые шпаты, слюды, оливин, пироксены, амфиболы. В составе этих минералов большую роль играют кремний (Si) и кислород (О). В силикатах атом кремния всегда окружен четырьмя атомами кислорода,
ТАБЛИЦА 1
КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ И КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ
Самородная медь, Сu Сингония кубическая, представлена гранецентрированным кубом с плотнейшей упаковкой атомов. Атомы меди расположены по углам куба и в центре каждой грани элементарной ячейки образующими правильный тетраэдр [SiO4]4. Каждый атом кислорода в решетке силикатов одновременно принадлежит двум разным тетраэдрам. Благодаря этому возникают сдвоенные тетраэдры, кольцеобразные замкнутые группы тетраэдров (например, у берилла — двойные кольца), а при дальнейшей группировке атомов— цепи, двойные цепи (например, у пироксенов и амфиболов), двумерные бесконечные слои и трехмерные бесконечные каркасы (например, у полевых шпатов и лейцита).
Галит (каменная соль), NaCl Сингония кубическая, кристаллическая структура представлена ионной решеткой. Ионы натрия (Na+, черные шарики) и ионы хлора (Сl-, белые шарики) попеременно располагаются в углах малых кубов
Спайный выколок галита в форме куба, замкнутая спайная форма
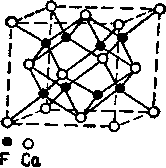
Флюорит (плавиковый шпат), CaF2
Сингония кубическая. Ионы кальция (Са2+) расположены по закону гранецентрированного куба. Ионы фтора (F-) занимают центры всех малых кубов
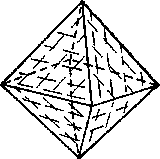
Спайный выколок флюорита в форме октаэдра, замкнутая спайная форма
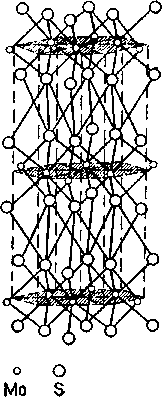
Молибденит (молибденовый блеск), MoS2
Сингония гексагональная, кристаллическая структура слоистая. Ионы молибдена (Мо2+) и ионы серы (S-) образуют плоские сетки. Характер кристаллической решетки обусловливает совершенную спайность, параллельную базальной плоскости
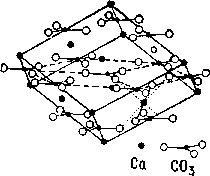
Кальцит (известковый шпат), СаСОз
Кристаллическая решетка тригональная. Кристаллическая структура в элементарной ячейке спайного ромбоэдра состоит из ионов кальция (Са2+) и карбонат-ионов [СОз]2-. Оба типа ионов располагаются как бы в гранецентрированных решетках
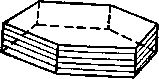
Спайный выколок кальцита, замкнутая спайная форма (ромбоэдр). Примеры: кальцит, доломит, магнезит, сидерит и др.
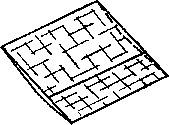
Открытая спайная форма, листоватость, свойственная слюдистым минералам. Примеры: мусковит, биотит, хлорит
Примеры структур силикатных минералов (анионные комплексы) На рис. (а) и (б) изображены изолированные группы кремнекислородных тетраэдров, представ-лекные двумя различными видами (а) Отдельный изолированный тетраэдр [SiO4]4-(6) Группа из двух тетраэдров, связанных между собой общим углом, с формулой [Si207]6-
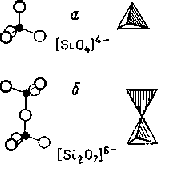
(в) Группа из трех тетраэдров, соединенных в кольцо, с формулой [Si3О9]6-
(г) Группа из четырех тетраэдров, соединенных в кольцо, с формулой [Si4O12]8-
(д) Группа из шести тетраэдров, соединенных в кольцо, с формулой [Si6O18]12-
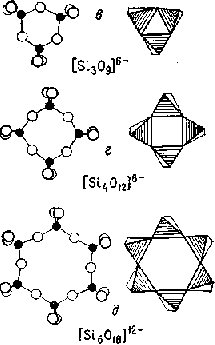
Многие соединения встречаются в различных структурных типах, так что разные минеральные виды обнаруживают в этом случае одинаковый состав. Такое явление называется полиморфизмом, а химически идентичные минералы, различающиеся структурой кристаллической решетки, — полиморфными модификациями, например пирит и марказит (оба имеют состав FeS2).
Рамки данного карманного справочника позволяют привести лишь ограниченные (но важные!) сведения о многообразии кристаллических форм и о специальных, базирующихся на математической теории принципах классификации кристаллов. Более подробные данные по этому вопросу читатель найдет в разделе «Кристаллографические свойства минералов», написанном д-ром В. Шмицем.
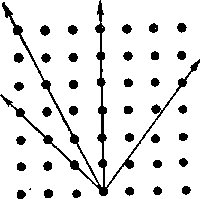
Для графических построений и в классификационных целях минералоги и кристаллографы используют кристаллографические оси и осевые системы. В зависимости от длины отрезков, отсекаемых на кристаллографических осях, и взаимного расположения этих осей различают семь осевых систем (см. приложение 1А) [В отечественной литературе употребляется термин сингония», который мы и будем использовать в дальнейшем. — Прим. перев.].
Триклинная сингония. Три оси разной длины пересекаются под косыми углами; например известково-нат-риевые полевые шпаты (плагиоклазы).
Моноклинная сингония. Две оси разной длины пересекаются под косым углом, третья ось составляет с ними прямой угол, например ортоклаз, авгит, слюда и гипс.
Ромбическая сингония. Три оси разной длины пересекаются под прямыми углами; например оливин, энста-тит, топаз, ангидрит, барит и сера.
Тетрагональная сингония. Два отрезка оси одинаковой длины пересекаются под прямым углом, третья ось перпендикулярна им, и отсекаемый на ней отрезок имеет иную длину, например рутил, циркон, касситерит и халькопирит.
Тригональная сингония. Три отрезка осей равной длины пересекаются в одной плоскости под углом 60°, третья ось перпендикулярна этой плоскости, и отсекаемый на ней отрезок имеет иную длину, например кальцит.
Гексагональная сингония. Положение осей аналогично их положению в тригональной сингонии, например кварц (высокотемпературный), берилл, апатит, снег и
лед.
Кубическая сингония. Три равновеликие оси пересекаются под прямым углом, например каменная соль, алмаз, магнетит, пирит, хромит, галенит, золото и гранат.
Для определения сингонии кристалла важным признаком является форма выделения минерала. Изомет-ричные, порой округленные зерна минерала, вкрапленные в агрегат других минералов, позволяют предположить для него кубическую сингонию. Так выглядит, например, гранат в слюдистом сланце или лейцит в фоно-литах, трахитах или базальтах. У большинства кристаллов гексагональной, тригональной, тетрагональной, ромбической, моноклинной или триклинной сингонии преобладает призматический габитус. Грани, ориентированные параллельно оси с, обычно называют призматическими. Хорошо образованные призматические грани характерны, например, для монокристаллов кварца, берилла, топаза, турмалина, кальцита, арагонита, дистена, ставролита и др. Другие формы этих сингонии могут иметь таблитчатый или пластинчатый габитус, параллельный оси с.
У хорошо образованных некубических кристаллов важны базальные и пирамидальные грани, определяющие различия их облика. Для высокотемпературного кварца характерна гексагональная бипирамида, для апатита характерны притупления базисной грани. Для моноклинного ортоклаза характерны резко выраженные грани диэдра, расположенные параллельно оси а. К этим главным граням часто присоединяются специфичные для разных сингоний второстепенные грани, усложняющие форму кристалла. Так, у кристаллов тригонального кварца наряду с гранями тригональной призмы присутствуют грани трапецоэдра, у гексагонального апатита и берилла — многочисленные второстепенные грани и т. д. Все эти кристаллографические признаки минералов имеют особое значение. Они часто позволяют установить, при каких физико-химических условиях образовался тот или иной минерал. Вместе с тем появление определенных граней может быть характерно для минерала из конкретного месторождения и может указывать на определенный минеральный парагенезис.
Эти наблюдающиеся на кристаллах минералов комбинации граней создают его характерную естественную огранку, а общая конфигурация определяет его габитус. Так, например, апатиты, образовавшиеся в диапазоне температур 550—300 °С, кристаллизуются в виде корот-копризматических кристаллов, а апатиты в гранитах, образующиеся при температурах выше 700 °С, имеют тонкоигольчатый габитус. Аналогичная картина наблюдается и в случае калиевых полевых шпатов: полевые шпаты, являющиеся составной частью магматических пород, образуются при температурах выше 700°С (санидин, ортоклаз), пегматитовые калиевые полевые шпаты— примерно при 600—550°С (ортоклаз), а гидротермальные, такие, как адуляр, кристаллизуются в интервале температур 300—100 °С; соответственно различен и облик этих полевых шпатов, возникших в различной геологической обстановке.
КРИСТАЛЛОГРАФИЧЕСКИЕ
СВОЙСТВА
МИНЕРАЛОВ
Важным диагностическим признаком минералов является внешний облик их выделений (морфология). Закономерности кристалломорфологии составляют предмет кристаллографии [Точнее, специального раздела кристаллографии и минералогии — онтогении минералов. — Прим. перев.], которая, отделившись от минералогии в XIX в., развивалась в дальнейшем как самостоятельная наука.
Каковы же различия между кристаллом и минералом? Можно сказать, что, за редкими исключениями, минералы являются кристаллическими веществами. В качестве минералов выступают лишь вещества, устойчивые при нормальных условиях. Неустойчивые соединения через какой-то промежуток времени переходят в более стабильные. Таким образом, число минералов ограничено. Гораздо большее число кристаллов может быть получено искусственным путем и сохранено в условиях изоляции. Очевидно, что законы кристаллографии распространяются и на мир минералов.
Что же характеризует кристалл или кристаллическое состояние вообще? Во-первых, кристаллическое вещество должно иметь однородный химический состав, т. е. быть гомогенным. Вторым его важным свойством является анизотропия, под которой понимается различие физических свойств вдоль разных направлений в кристалле. У некоторых кристаллов различаются даже направления и противонаправления, как, например, у турмалина, концевые грани которого могут в одном направлении постоянно нести положительные электрические заряды, а в обратном — отрицательные [Возникающие при трении или нагревании. — Прим. перев.]. Анизотропия кристаллов обусловлена их атомным строением. В различных направлениях расстояния между атомами различны.