Органическая химия. Органическая+химия. Органическая химия это химия углеводородов и их функциональных соединений
 Скачать 69.21 Kb. Скачать 69.21 Kb.
|
|
Органическая химия – это химия углеводородов и их функциональных соединений. Углеводороды составляют то особенное, специфическое, чего нельзя найти в неорганической химии. Специфика углеводородов заложена в своеобразных и неповторимых свойствах атома углерода – в его электронной структуре. Известно, что у атома углерода в возбуждённом состоянии, в котором он вступает в химические взаимодействия, все четыре валентных электрона находятся на 4-х валентных орбиталях (С* 2s12p3). Атом углерода не имеет на внешнем валентном уровне ни электронных пар, ни свободной орбитали. Иначе говоря у атома углерода на внешнем электронном уровне четыре орбитали и каждая орбиталь заселена одним электроном. Поэтому в соединениях углерода, использовавшего все четыре электрона на образование четырёх σ-связей, возникают устойчивые электронные состояния без свободного химического сродства. Примером являются алканы, они обладают очень низкой химической активностью при обычных условиях. Особое состояние электронной оболочки атома углерода приводит к тому, что атом углерода может образовывать прочные цепи из атомов углерода, причём длина их не ограничена (- С – С – С – С - ). В этих цепях атомы углерода связаны друг с другом прочными ковалентными связями. Образующиеся цепи могут быть неразветвлёнными, разветвлёнными и циклическими. Благодаря этому в органической химии существуют изомеры, которые имеют одинаковый состав, но отличаются по строению и, следовательно, по свойствам. Такого явления нет в неорганической химии. Атомы углерода в отличие от многих других атомов способны образовывать π-связи как между собой, так и с другими атомами. Эта особенность приводит к появлению в органической химии различных классов соединений (алкены, алкины). В молекулах органических соединений могут присутствовать несколько π-связей, которые по разному располагаются в молекулах соединений. Это ещё более расширяет число различных классов органических соединений. Несколько позже, изучая курс органической химии, мы остановимся на этих вопросах более подробно. ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А.М. БУТЛЕРОВА Теория строения органических соединений А.М. Бутлерова базируется на материалистическом подходе к реальной молекуле и исходит из возможности познания её строения экспериментальным путём. Теория строения не тольео объяснила экспериментальные факты но и показала возможность прогнозирования существования новых органических соединений. Основные положения теории строения органических соединений: 1. атомы в молекулах соединены друг с другом химическими связями в соответствии с их валентностью; 2. атомы в молекулах органических веществ соединяются между собой в определённой последовательности, что обусловливает химическое строение молекулы; 3. свойства органических соединений зависят не только от числа и природы входящих в их состав атомов, но и от химического строения молекул; 4. в молекулах существует взаимное влияние атомов как связанных, так и непосредственно друг с другом не связанных; 5. химическое строение вещества можно определить в результате изучения его химических превращений и, наоборот, по строению вещества можно характеризовать его свойства. Важным следствием теории строения был вывод о том, что каждое органическое соединение должно иметь одну химическую формулу, отражающую её строение. Для изображения строения органических соединений используются формулы строения, называемые структурными формулами. В отличие от молекулярных или брутто-формул, в которых записывается число атомов углерода, водорода и т.д., структурные формулы отражают порядок связи атомов в молекуле, их взаимное расположение, т.е. отражают химическое строение молекул. Например: H H H H H H H – C – C – H; H – C – O – C – H H – C – C – O – H H H H H H H Этан диметиловый эфир этиловый спирт Структурные формулы диметилового эфира и этилового спирта позволяют убедиться, что при одном и том же качественном составе вещество может проявлять разные свойства. Это обусловлено строением молекул. Приведём другой пример: вещество имеет брутто-формулу С4Н10, но, если атомы соединены различным образом, то вещества при одинаковом качественном составе пролявляют разные свойства: СН3 – СН2 – СН2 – СН3 СН3 – СН – СН3 н-бутан СН3 изо-бутан Существование нескольких веществ с одинаковым составом и молекулярной массой, но обладающих различными свойствами называется изомерией. Различия эти определяются разным химическим строением или пространственной организацией молекулы (диметиловый эфир и этиловый спирт; бутан и изобутан и т.д.). Только структурные формулы могут показывать различие этих соединений т.е. только углеродный скелет. Алканы Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода. Гомологический ряд алканов Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом. Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H. Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
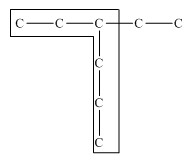
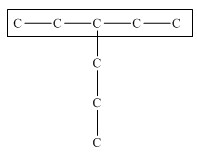
Общая формула гомологического ряда алканов CnH2n+2. Название разветвленных алканов строится по следующим правилам: 1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
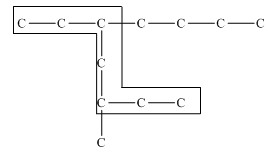
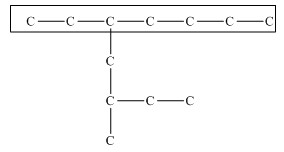
Главная цепь должна быть самой разветвленной. Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи. 3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи. Например, 2-метилпропан: 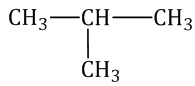 Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д. Например, 2,2-диметилпропан или 2,2,3-триметилпентан. 4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке. Например: 2,2-диметил-3-этилпентан. 5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан. Например, название молекулы на рисунке: 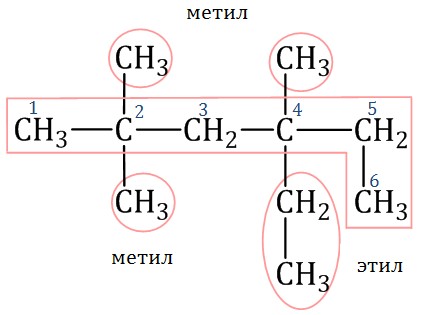 2,2,4-триметил-4-этилгексан |