ОРГАНИЗАЦИЯ ЛАБОРАТОРНОЙ. Организация лабораторной
 Скачать 399.79 Kb. Скачать 399.79 Kb.
|
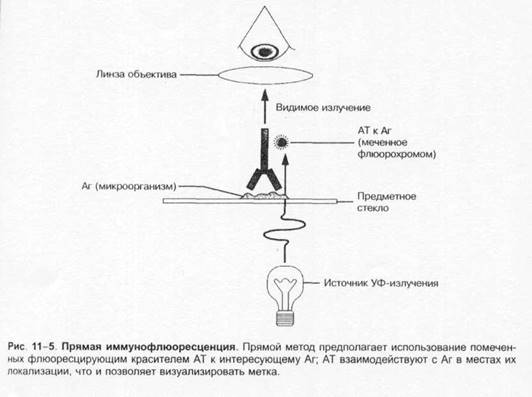
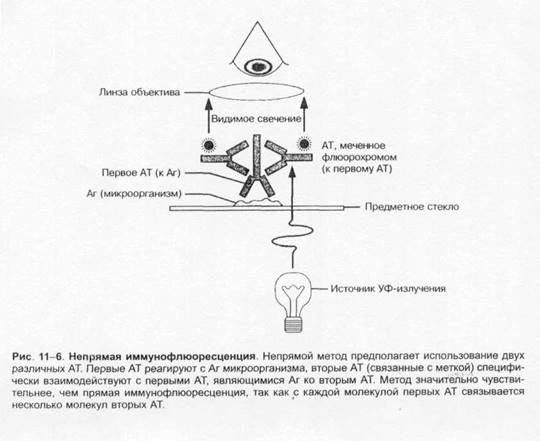
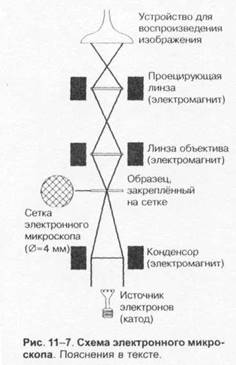
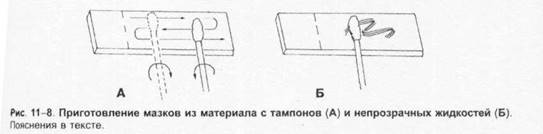
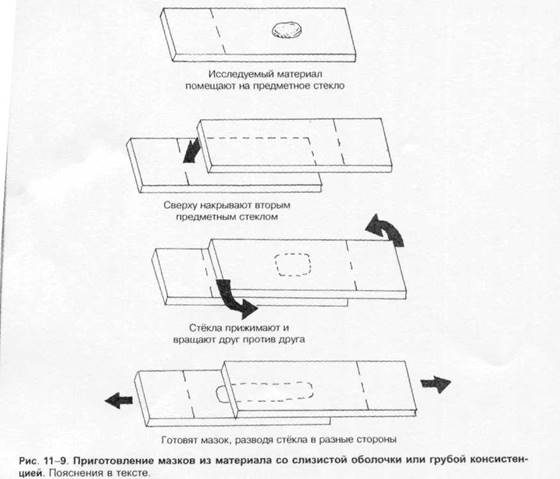
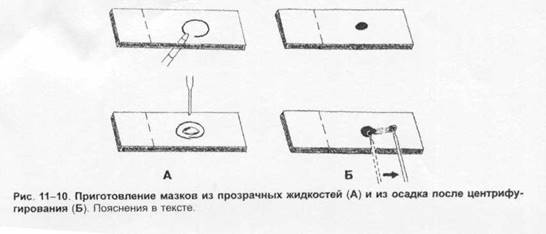
Выбор лабораторных исследованийОснову микробиологической диагностики инфекционных заболеваний составляют микроскопические, микробиологические, биологические, серологические и аллергологические методы. Микроскопические методыМикроскопические методы включают приготовление мазков и препаратов для микроскопирования. В большинстве случаев результаты микроскопических исследований носит ориенти ровочный характер (например, определяют отношение возбудителей к окраске), так как многие микроорганизмы лишены морфологических и тинкториальных особенностей. Тем не менее микроскопией материала можно определить некоторые морфологические признаки возбудителей (наличие ядер, жгутиков, внутриклеточных включений и т.д.), а также установить факт наличия или отсутствия микроорганизмов в присланных образцах. Микробиологические методыМикробиологические методы — «золотой стандарт» микробиологической диагностики, так как результаты микробиологических исследований позволяют точно установить факт нали чия возбудителя в исследуемом материале. Идентификацию чистых культур (до вида микроорганизма) проводят с учётом морфологических, тинкториальных, культуральных, биохимических, токсигенных и антигенных свойств микроорганизма. Большинство исследований включает определение чувствительности к антимикробным препаратам у выделенного возбудителя. Для эпидемиологической оценки роли микроорганизма проводят внутривидовую идентификацию определением фаговаров, биоваров, резистентваров и т.д. Биологические методы Биологические методы направлены на определение наличия токсинов возбудителя в исследуемом материале и на обнаружение возбудителя (особенно при незначительном исходном содержании в исследуемом образце). Методы включают заражение лабораторных животных исследуемым материалом с последующим выделением чистой культуры патогена, либо установлением факта присутствия микробного токсина и его природы. Моделирование экспериментальных инфекций у чувствительных животных — важный инструмент изучения патогенеза заболевания и характера взаимодействий внутри системы микроорганизм-макроорганизм. Для проведения биологических проб используют только здоровых животных определённых массы тела и возраста. Инфекционный материал вводят внутрь, в дыхательные пути, внутрибрюшинно, внутривенно, внутримышечно, внутрикожно и подкожно, в переднюю камеру глаза, через трепанационное отверстие черепа, субокципитально (в большую цистерну головного мозга). У животных прижизненно забирают кровь, экссудат из брюшины, после гибели — кровь, кусочки различных органон, СМЖ, экссудат из различных полостей. Серологические методы Серологические методы выявления специфических АТ и Аг возбудителя – важный инструмент в диагностике инфекционных заболеваний. Особую ценность они имеют в тех случаях, когда выделить возбудитель не представляется возможности. При этом необходимо выявить повышение титров АТ, в связи с чем исследуют парные образцы сыворотки, взятые в интервале 10-20 суток (иногда этот интервал может быть более длительным). АТ обычно появляются в крови на 1-2-ю неделю заболевания и циркулируют в организме относительно долго, что позволяет использовать их выявление для ретроспективных эпидемиологических исследований. Определение классов lg чётко характеризует этапы инфекционного процесса, а также может служить косвенным прогностическим критерием. Особое значение имеют методы выявления микробных Аг. В значимых количествах они появляются уже на самых ранних сроках, что делает их идентификацию важным инструментом экспресс-диагностики инфекционных заболеваний, а количественное их определение в динамике инфекционного процесса служит критерием эффективности проводимой антимикробной терапии. Аллергологические методы Аг многих возбудителей обладают сенсибилизирующим действием, что используют для диагностики инфекционных заболеваний, а также при проведении эпидемиологических исследований. Наибольшее распространение нашли кожно-аллергические пробы, включающие внутрикожное введение Аг (аллергена) с развитием реакции ГЗТ. Кожные пробы нашли применение в дианостике таких заболеваний как сап, мелиодиоз, бруцеллёз. Наиболее известна проба Манту. Используемая как для диагностики туберкулёза, так и для оценки невосприимчивости организма к возбудителю. МЕТОДЫ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ БАКТЕРИЙМикроскопия материала Любое бактериологическое исследование начинается с микроскопии материала и его последующего посева на питательные среды. Эффективность выделения возбудителя в значительной степени обусловлена правильной техникой отбора образцов клинического материала, своевременностью их доставки в лабораторию и правильным хранением образцов. Электронная микроскопия Теоретически разрешение просвечивающего электронного микроскопа составляет 0,002 нм; реальное, разрешение современных микроскопов приближается к 0,1 нм. На практике разрешение для биологических объектов достигает 2 нм. Просвечивающий электронный микроскоп (рис. 1-7) состоит из колонны, через которую в вакууме проходят электроны, излучаемые катодной нитью. Пучок электронов, фокусируемый кольцевыми магнитами, проходит через подготовленный образец. Характер рассеивания электронов зависит от плотности образца. Проходящие через образец электроны наблюдают на флюоресцирующем экране и регистрируют при помощи фотопластинки. Сканирующий электронный микроскоп применяют для получения трёхмерного изображения поверхности исследуемого объекта. Подготовка материала к микроскопии В бактериологической практике микроскопически исследуют неокрашенные образцы (нативный материал) и окрашенные препараты (мазки или мазки-отпечатки), приготовленные из клинического материала или колоний выросших микроорганизмов. Нативные препараты Нативные препараты готовят для исследования живых неокрашенных бактерий. Наибольшее распространение получили метод висячей капли, микрокамеры с плотными средами и негативные методы исследования живых бактерий. Для прижизненного исследования также часто применяются исследование в тёмном поле и фазово-контрас тная микроскопия. Подобные приёмы часто используют для диагностики сифилиса и предварительной диагностики диарей, вызванных кампилобактерами, а также для определения подвижности микроорганизмов. Окрашенные препараты Отбор материала. Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 1-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 1-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 1-9). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 1-10, А), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 1-10, Б). Фиксация. В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светооптической микроскопии используют формалин, спирты, глутаральдегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др. Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия. Окрашивание. Стандартные красители, используемые для окраски бактерий, — карболовый фуксин Циля, фуксин Пфайф-фера и метиленовый синий по Лёффлеру. Для получения болееинформативных результатов в светооптической микроскопии используют специальные и дифференцирующие методы окраски. 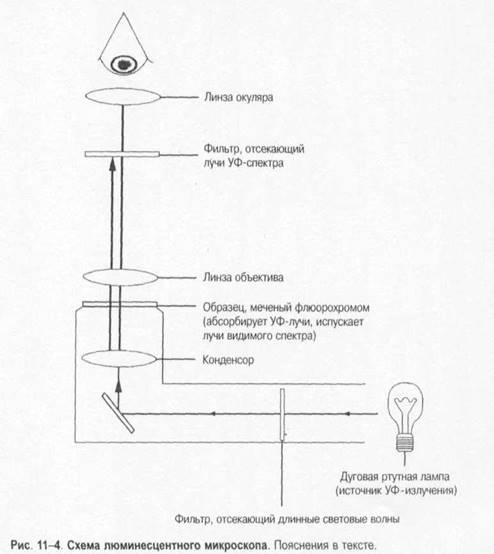
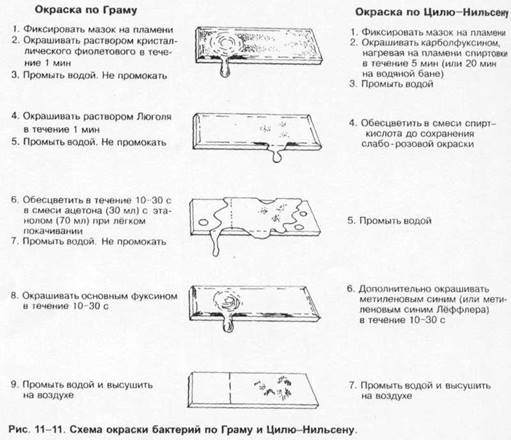
Специальные методы окраски бактерий. Наибольшее распространение нашли методы Грама и Циля-Нильсена (рис. 1-11). Дифференцирующие методы обычно применяют для окрашивания различных морфологических структур. Капсулы. Для окраски капсул бактерий применяют методы Хисса, Лейфсона и Антони; последний метод наиболее прост и включает окраску кристаллическим фиолетовым с последующей обработкой 20% водным раствором CuSO4 . Жгутики. Для окраски жгутиков предложены методы Лёффлера, Бейли, Грея и др. Для этих методов характерны первоначальное протравливание препарата [обычно растворами таннина, KAl(SO4 )2 , HgCl2 ] и последующая окраска (чаще карболовый фуксин Циля). Споры. Окраску спор бактерий проводят после предварительной обработки их стенок. Наиболее прост метод Пешкова, включающий кипячение мазка с синькой Лёффлера на предметном стекле с последующей докраской нейтральным красным. Споры окрашиваются в синий цвет, вегетативные клетки — в розовый. Питательные среды для культивирования бактерий Для выделения чистых культур патогенных бактерий применяют оптимальные для их роста питательные среды с фиксированным рН. Большинство бактерий способно расти на различных питательных средах; исключение составляют хламидии и риккетсии, не растущие in vitro вне клеточных культур. Используемая среда должна содержать
- вещества, утилизируемые бактериями для различных биосинтетических процессов. Универсальные источники азота и углерода — бел- ковые гидролизаты (содержат полный набор аминокис- лот), пептиды и пептоны. Универсальные источники витаминов и микроэлементов — экстракты белков жи- вотного или растительного происхождения и белковые гидролизаты. рН среды. В некоторых случаях жизнедеятельность бактерий сопровождается сдвигом рН в кислую или щелочную сторону, что требует внесения в среды раз- личных буферных систем (обычно применяют фосфат- ный буфер). Сбалансированные среды отличают высо- кая буферность и стабильный оптимум рН. Важно так же создание оптимальной концентрации О2 и СО2 . ; Классификации сред Среды классифицируют по консистенции, составу, происхождению, назначению и загрязнённости материала. По консистенции питательные среды разделяют на плотные (твёрдые), полужидкие и жидкие. По составу выделяют белковые, безбелковые и ми неральные среды. По происхождению среды разделяют на искусственные и естественные (природные). Искусственные среды разделяют на животные [например, мясопептонный агар (МПА) или мясопептонный бульон (МПБ)] и растительные (например, настои сена и соломы, отвары злаков, дрожжей или фруктов, пивное сусло и др.).
 По назначению выделяют консервирующие среды (для первичного посева и транспортировки), среды обогащения (для накопления определённой группы бактерий), среды для культиви рования (универсальные простые, сложные специальные и для токсинообразования), среды для выделения и накопления (консервирующие, обогащения и элективные) и среды для идентификации (дифференциальные и элективно-дифференциальные). По загрязнённости материала . Если материал слабо загрязнён посторонней микрофлорой, то для выделения чистых культур применяют простые (по составу) среды. При обильной контаминации сапрофитами используют специальные или элективные (для отдельных видов), селек тивные (только для отдельных бактерий), дифференциально-диагностические (для облегчения идентификации) среды. Характеристики сред Консервирующие среды предупреждают отмирание патогенов и подавляют рост сапрофитов. Наибольшее применение нашли глицериновая смесь (среда Тига), гипертонический раствор, глицериновый консервант с LiCl2 , раствор цитрата натрия и дезоксихолата натрия (среда Бенгсанга-Эллиота). Среды обогащения (например, среда Китта-Тароцци, селенитовый бульон, тиогликолятная среда) применяют для накопления определённой группы бактерий за счёт создания условий, оптимальных для одних видов и неблагоприятных для других. Наиболее часто в качестве подобных агентов используют различные красители и химические вещества — соли жёлчных кислот, тетратионат Na+ , теллурит К+ , антибиотики, фуксин, генциановый фиолетовый, бриллиантовый зелёный и др. Элективные и селективные среды (например, среды Уйлсона-Блэра, Эндо, Плбскирева, Мак-Конки) предназначены для первичного посева материала или для пересева с консервирующих сред или сред обогащения с целью получения чистой культуры. Среды готовят с учётом биохимических и энергетических потребностей микроорганизмов. Соответственно, выделяют кровяные и сывороточные среды (например, Лёффлера, Бордё-Жангу), яичные среды (например, Лёвенштайна-Йенсена) и др Дифференциально-диагностические среды (например, среды Хисса, Кларка) применяют для изучения и идентификации отдельных типов, видов и групп бактерий. В качестве основы применяют различные органические и неорганические соединения, гидролизаты казеина, пептонную воду, бульон Хоттингера-Мартена, дополненные углеводами, спиртами, мочевиной и другими веществами; при их расщеплении происходит сдвиг рН в кислую (углеводы, спирты, липилы) или щелочную (белки) сторону. Соответственно, выделяют среды с углеводами и спир тами, среды с мочевиной, среды для определения индолообразования, среды для определения протеолитической активности и комбинированные (политропные) среды. В такие среды также часто вносят различные индикаторы (например, бромтимоловый синий, индикатор Андраде, бромкрезоловый пурпурный и крезоловый красный), помогающие визуально определить изменение рН, характерное для различных микроорганизмов. В частности, сдвиг в кислую сторону вызывает покраснение среды с реактивом Андраде или пожелтение при использовании среды с бромтимоловым синим, тогда как при защелачивании реактив Андраде и индикатор бром- тимоловый синий не меняют цвет среды. Все дифференциально-диагностические среды разделяют на четыре основные группы. Среды, содержащие белки, дающие характерные изменения под действием бактериальных ферментов (кровь, желатина, молоко и др.), применяют для определения гемолитических или протеолитических свойств. Наиболее распространены мясопептонная желатина (МПЖ), свернувшаяся лошадиная сыворотка, молоко и кровяной агар (КА). Среды, содержащие углеводы или многоатомные спирты. Ферментативное расщепление субстратов приводит к сдвигу рН и изменению окраски среды, а иногда и образованию газа. Наиболее распространены цветные среды с различными углеводами (например, с бром-тимоловым синим, индикатором ВР), лакмусовое молоко (среда Минкевича) и среды Хисса. Из углеводов наиболее часто используют моносахариды (ксилозу, арабинозу, глюкозу, фруктозу, маннозу, галактозу), дисахариды (лактозу, мальтозу, сахарозу), полисахари ды (крахмал, гликоген, инулин, декстрин), спирты (дульцит, маннит, сорбит, глицерин) и гликозиды (адонит, инозит, салицин, амигдалин). |