основы химической термодинамики, химической кинетики и равновесия
 Скачать 1.2 Mb. Скачать 1.2 Mb.
|
|
«ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ, ХИМИЧЕСКОЙ КИНЕТИКИ И РАВНОВЕСИЯ» Основы химической термодинамики 1. Что изучает химическая термодинамика: 1) скорости протекания химических превращений и механизмы этих превращений; 2) энергетические характеристики физических и химических процессов и способность химических систем выполнять полезную работу; 3) условия смещения химического равновесия; 4) влияние катализаторов на скорость биохимических процессов. 2. Открытой системой называют такую систему, которая: 1) не обменивается с окружающей средой ни веществом, ни энергией; 2) обменивается с окружающей средой и веществом, и энергией; 3) обменивается с окружающей средой энергией, но не обменивается веществом; 4) обменивается с окружающей средой веществом, но не обменивается энергией. 3. Закрытой системой называют такую систему, которая: 1) не обменивается с окружающей средой ни веществом, ни энергией; 2) обменивается с окружающей средой и веществом, и энергией; 3) обменивается с окружающей средой энергией, но не обменивается веществом; 4) обменивается с окружающей средой веществом, но не обменивается энергией. 4. Изолированной системой называют такую систему, которая: 1) не обменивается с окружающей средой ни веществом, ни энергией; 2) обменивается с окружающей средой и веществом, и энергией; 3) обменивается с окружающей средой энергией, но не обменивается веществом; 4) обменивается с окружающей средой веществом, но не обменивается энергией. 5. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле, помещен ной в термостат? 1) изолированной; 2) открытой; 3) закрытой; 4) стационарной. 6. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле? 1) изолированной; 2) открытой; 3) закрытой; 4) стационарной. 7. К какому типу термодинамических систем принадлежит живая клетка? 1) открытой; 2) закрытой; 3) изолированной; 4) равновесной. 8. Какие параметры термодинамической системы называют экстенсивными? 1) величина которых не зависит от числа частиц в системе; 2) величина которых зависит от числа частиц в системе; 3) величина которых зависит от агрегатного состояния системы; 4) величина которых зависит от времени. 9. Какие параметры термодинамической системы называют интенсивными? !) величина которых не зависит от числа частиц в системе; 2) величина которых зависит от числа частиц в системе; 3) величина которых зависит от агрегатного состояния; 4) величина которых зависит от времени. 10. Функциями состояния термодинамической системы называют такие величины, которые: 1) зависят только от начального и конечного состояния системы; 2) зависят от пути процесса; 3) зависят только от начального состояния системы; 4) зависят только от конечного состояния системы. 11. Какие величины являются функциями состояния системы: а) внутренняя энергия; б) работа; в) теплота; г) энтальпия; д) энтропия. 1) а, г, д; 2)6; 3) все величины; 4) а, б, в, г. 12. Какие из следующих свойств являются интенсивными: а) плотность; б) давление; в) масса; г) температура; д) энтальпия; е) объем? 1) а, б, г; 2)в,д,е; 3) б, в, г, е; 4) а, в, д. 13. Какие из следующих свойств являются экстенсивными: а) плотность; б) давление; в) масса; г) температура; д) энтальпия; е) объем? 1) в, д, е; 2) а, б, г; 3) б, в, г, е; 4) а, в, г. 14. Какие формы обмена энергией между системой и окружающей средой рассматривает термодинамика: а) теплота; б) работа; в) химическая; г) электрическая; д) механическая; е) ядерная и солнечная? 1)а,б; 2) в, г,д, е; 3) а, в, г, д, е; 4) а, в, г, д. 15. Процессы, протекающие при постоянной температуре, называются: 1) изобарическими; 2) изотермическими; 3) изохорическими; 4) адиабатическими. 16. Процессы, протекающие при постоянном объеме, называются: 1) изобарическими; 2) изотермическими; 3) изохорическими; 4) адиабатическими. 17. Процессы, протекающие при постоянном давлении, называются: 1) изобарическими; 2) изотермическими; 3) изохорическими; 4) адиабатическими. 18. Внутренняя энергия системы — это: 1) весь запас энергии системы, кроме потенциальной энергии ее положения и кинетической энергии системы в целом; 2) весь запас энергии системы; 3) весь запас энергии системы, кроме потенциальной энергии ее положения; 4) величина, характеризующая меру неупорядоченности расположения частиц системы. 19. Какой закон отражает связь между работой, теплотой и внутренней энергией системы? 1) второй закон термодинамики; 2) закон Гесса; 3) первый закон термодинамики; 4) закон Вант-Гоффа. 20. Первый закон термодинамики отражает связь между: 1) работой, теплотой и внутренней энергией; 2) свободной энергией Гиббса, энтальпией и энтропией системы; 3) работой и теплотой системы; 4) работой и внутренней энергией. 21. Какое уравнение является математическим выражением первого закона термодинамики для изолированных систем? l)AU=0 2)AU=Q-p-AV 3)AG = AH-TAS 22. Какое уравнение является математическим выражением первого закона термодинамики для закрытых систем? 1)AU=0; 2)AU=Q-p-AV; 3) AG = AH - T*AS; 4) AS > 0. 23. Постоянной или переменной величиной является внутренняя энергия изолированной системы? 1) постоянной; 2) переменной. 24. В изолированной системе протекает реакция сгорания водорода с образованием жидкой воды. Изменяется ли внутренняя энергия и энтальпия системы? 1) внутренняя энергия не изменится, энтальпия изменится; 2) внутренняя энергия изменится, энтальпия не изменится; 3) внутренняя энергия не изменится, энтальпия не изменится; 4) внутренняя энергия изменится, энтальпия изменится. 25. При каких условиях изменение внутренней энергии равно теплоте, получаемой системой из окружающей среды? 1) при постоянном объеме; 2) при постоянной температуре; 3) при постоянном давлении; 4) ни при каких. 26. Тепловой эффект реакции, протекающей при постоянном объеме, называется изменением: 1) энтальпии; 2) внутренней энергии; 3) энтропии; 4) свободной энергии Гиббса. 27. Энтальпия реакции — это: 1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно-изотермических условиях; 2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно-изотермических условиях; 3) величина, характеризующая возможность самопроизвольного протекания процесса; 4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы. 28. Химические процессы, при протекании которых происходит уменьшение энтальпии системы и во внешнюю среду выделяется теплота, называются: 1) эндотермическими; 2) экзотермическими; 3) экзэргоническими; 4) эндэргоническими. 29. При каких условиях изменение энтальпии равно теплоте, получаемой системой из окружающей среды? 1) при постоянном объеме; 2) при постоянной температуре; 3) при постоянном давлении; 4) ни при каких. 30. Тепловой эффект реакции, протекающей при постоянном давлении, называется изменением: 1) внутренней энергии; 2) ни одно из предыдущих определений неверно; 3) энтальпии; 4) энтропии. 31. Какие процессы называют эндотермическими? 1) для которых АН отрицательно; 2) для которых AG отрицательно; 3) для которых АН положительно; 4) для которых AG положительно. 32. Какие процессы называют экзотермическими? 1) для которых АН отрицательно; 2) для которых AG отрицательно; 3) для которых АН положительно; 4) для которых AG положительно. 33. Укажите формулировку закона Гесса: 1) тепловой эффект реакции зависит только от начального и конечного состояния системы и не зависит от пути реакции; 2) теплота, поглощаемая системой при постоянном объеме, равна изменению внутренней энергии системы; 3) теплота, поглощаемая системой при постоянном давлении, равна изменению энтальпии системы; 4) тепловой эффект реакции не зависит от начального и конечного состояния системы, а зависит от пути реакции. 34. Какой закон лежит в основе расчетов калорийности продуктов питания? 1) Вант-Гоффа; 2) Гесса; 3) Сеченова; 4) Рауля. 35. При окислении каких веществ в условиях организма выделяется большее количество энергии? 1) белков; 2) жиров; 3) углеводов; 4) углеводов и белков. 36. Самопроизвольным называется процесс, который: 1) осуществляется без помощи катализатора; 2) сопровождается выделением теплоты; 3) осуществляется без затраты энергии извне; 4) протекает быстро. 37. Энтропия реакции — это: 1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно-изотермических условиях; 2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно-изотермических условиях; 3) величина, характеризующая возможность самопроизвольного протекания процесса; 4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы. 38. Какой функцией состояния характеризуется тенденция системы к достижению вероятного состояния, которому соответствует максимальная беспорядочность распределения частиц? 1) энтальпией; 2) энтропией; 3) энергией Гиббса; 4) внутренней энергией. 39. В каком соотношении находятся энтропии трех агрегатных состояний одного вещества: газа, жидкости, твердого тела: I) S (г) > S (ж) > S (тв); 2)S(тв)>S(ж)>S(г); 3)S(ж)>S(г)>S(TB); 4) агрегатное состояние не влияет на значение энтропии. 40. В каком из следующих процессов должно наблюдаться наибольшее положительное изменение энтропии: 1) СН3ОН (тв) --> СН,ОН (г); 2) СH3OH (тв) --> СН3ОН (ж); 3) СН,ОН (г) -> CH3OH (тв); 4) СН,ОН (ж) -> СН3ОН (тв). 41. Выберите правильное утверждение: энтропия системы увеличивается при: 1) повышении давления; 2) переходе от жидкого к твердому агрегатному состоянию 3) повышении температуры; 4) переходе от газообразного к жидкому состоянию. 42. Какую термодинамическую функцию можно использовать, чтобы предсказать возможность самопроизвольного протекания реакции в изолированной системе? 1) энтальпию; 2) внутреннюю энергию; 3) энтропию; 4) потенциальную энергию системы. 43. Какое уравнение является математическим выражением 2-го закона термодинамики для изолированных систем? 1)AU=0; 2)AS>Q\T 3)AS 4) АН = 0. 44. Если система обратимым образом получает количество теплоты Q при температуре Т, то об T; 2) возрастает на величину Q/T; 3) возрастает на величину, большую Q/T; 4) возрастает на величину, меньшую Q/T. 45. В изолированной системе самопроизвольно протекает химическая реакция с образованием некоторого количества продукта. Как изменяется энтропия такой системы? 1) увеличивается 2) уменьшается 3) не изменяется 4) достигает минимального значения 46. Укажите, в каких процессах и при каких условиях изменение энтропии может быть равно работе процесса? 1) в изобарных, при постоянных Р и Т; 2) в изохорных, при постоянных V и Т; З) изменение энтропии никогда не равно работе; 4) в изотермических, при постоянных Р и Т 47. Как изменится связанная энергия системы TS при нагревании и при ее конденсации? 1) при нагревании растет, при конденсации уменьшается; 2) при нагревании уменьшается, при конденсации растет; 3) не происходит изменение T-S; 4) при нагревании и конденсации растет. 48. Какие параметры системы необходимо поддерживать постоянными, чтобы по знаку изменения энтропии можно было судить о направлении самопроизвольного протекания процесса? 1) давление и температуру; 2) объем и температуру; 3) внутреннюю энергию и объем; 4) только температуру. 49. В изолированной системе все самопроизвольные процессы протекают в сторону увеличения беспорядка. Как при этом изменяется энтропия? 1) не изменяется; 2) увеличивается; 3) уменьшается; 4) сначала увеличивается, а затем уменьшается. 50. Энтропия возрастает на величину Q/T для: 1) обратимого процесса; 2) необратимого процесса; 3) гомогенного; 4) гетерогенного. 51 Как изменяется энтропия системы за счет прямой и обратной реакции при синтезе аммиака? 1) прямая реакция идет с уменьшением энтропии, обратная — с увеличением; 2) прямая реакция идет с увеличением энтропии, обрат-лая __с уменьшением; 3) энтропия не изменяется в ходе реакции; 4) энтропия увеличивается для прямой и обратной реакции. 52. Какими одновременно действующими факторами определяется направленность химического процесса? 1) энтальпийным и температурным; 2) энтальпийным и энтропийным; 3) энтропийным и температурным; 4) изменением энергии Гиббса и температуры. 53. В изобарно-изотермических условиях максимальная работа, осуществляемая системой: 1) равна убыли энергии Гиббса; 2) больше убыли энергии Гиббса; 3) меньше убыли энергии Гиббса; 4) равна убыли энтальпии. 54. Какие условия необходимо соблюдать, чтобы максимальная работа в системе совершалась за счет убыли энергии Гиббса? 1) необходимо поддерживать постоянными V и t; 2) необходимо поддерживать постоянными Р и t; 3) необходимо поддерживать постоянными АН и AS; 4) необходимо поддерживать постоянными PиV 55. За счет чего совершается максимальная полезная работа химической реакции при постоянных давлении и температуре? 1) за счет убыли энергии Гиббса; 2) за счет увеличения энтропии; 3) за счет увеличения энтальпии; 4) за счет уменьшения энтропии. 56. За счет чего совершается максимальная полезная работа живым организмом в изобарно-изотермических условиях? 1) за счет убыли энтальпии; 2) за счет увеличения энтропии; 3) за счет убыли энергии Гиббса; 4) за счет увеличения энергии Гиббса. 57. Какие процессы называют эндэргоническими? 1)H<0; 2) AG < 0; 3)AH>0; 4) AG > 0. 58. Какие процессы называют экзэргоническими? 1)AH<0; 2) AG < 0; 3)AH>0; 4) AG > 0. 59. Самопроизвольный характер процесса лучше определять путем оценки: 1)энтропии; 3) энтальпии; 2) свободной энергии Гиббса; 4) температуры. 60. Какую термодинамическую функцию можно использовать для предсказания возможности самопроизвольного протекания процессов в живом организме? 1) энтальпию; 3) энтропию; 2) внутреннюю энергию; 4) свободную энергию Гиббса. 61. Для обратимых процессов изменение свободной энергии Гиббса... 1) всегда равно нулю; 2) всегда отрицательно; 3) всегда положительно; 4) положительно или отрицательно в зависимости от обстоятельств. 62. Для необратимых процессов изменение свободной энергии: 1) всегда равно нулю; 2) всегда отрицательно; 3) всегда положительно; 4) положительно или отрицательно в зависимости от обстоятельств. 63. В изобарно-изотермических условиях в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса: 1) не меняется; 2) увеличивается; 3) уменьшается; 4) достигает максимального значения. 64. Для некоторой химической реакции в газовой фазе при постоянных Р и TAG > 0. В каком направлении самопроизвольно протекает эта реакция? 1) в прямом направлении; 2) не может протекать при данных условиях; 3) в обратном направлении; 4) находится в состоянии равновесия. 65. Каков знак AG процесса таяния льда при 263 К? 1) AG > 0; 2) AG = 0; 3) AG < 0; 4) AG < 0. 66. В каком из следующих случаев реакция неосуществима при любых температурах? 1)AH>0;AS>0; 2)AH>0;AH<0; 3)A#<0;AS<0; 4)AH= 0;AS = 0. 67. В каком из следующих случаев реакция возможна при любых температурах? 1)ДH<0;ДУ>0; 2)AH 3) AH > 0; AS > 0; 4)AH = 0;AS = 0. 68. Если АН < О и AS < О, то в каком случае реакция может протекать самопроизвольно? 1) [АН] > [T4AS]; 2) при любых соотношениях АН и TAS; 3){AH]<[T4AS]; 4) [АН] = [Т-А S]. 69. При каких значениях по знаку АН и AS в системе возможны только экзотермические процессы? 1)AH>0,Д£>0; 2) АН< О, AS > 0; 3) AH#< 0, AS < 0; 4) AH > 0, AS < 0. 70. При каких соотношениях АН и T* AS химический процесс направлен в сторону эндотермической реакции: 1)AH 2)АH> T-AS; 3)АH= TAS; 4)AH\TAS. 71. При каких постоянных термодинамических параметрах изменение энтальпии может служить критерием направления самопроизвольного процесса? Какой знак DH в этих условиях указывает на самопроизвольный процесс? 1) при постоянных S и Р, АН < 0; 3) при постоянных Put, АН < 0; 2) при постоянных 5 и Р, АН > 0; 4) при постоянных Vn t, АН > 0. 72. Можно ли и в каких случаях по знаку изменения энтальпии в ходе химической реакции судить о возможности ее протекания при постоянных Т и Р1 1) можно, если ЛЯ » T-AS; 2) при данных условиях нельзя; 3) можно, если АН « T-AS; 4) можно, если АН = T-AS. 73. Реакция ЗН2 + N2 -> 2NH3 проводится при 110°С, так что все реагенты и продукты находятся в газовой фазе. Какие из указанных ниже величин сохраняются в ходе реакции? 1) объем; 2) энтропия; 3) энтальпия; 4) масса. 74. Какие из следующих утверждений верны для реакций, протекающих в стандартных условиях? 1) эндотермические реакции не могут протекать самопроизвольно; 2) эндотермические реакции могут протекать при достаточно низких температурах; 3) эндотермические реакции могут протекать при высоких температурах, если AS > 0; 4) эндотермические реакции могут протекать при высоких температурах, если AS <0. 75. Каковы особенности биохимических процессов: а) подчиняются принципу энергетического сопряжения; б) как правило обратимы; в) сложные; г) только экзэргонические (AG < 0); д) большинство необратимо. 1) а, б, в, г; 2) б, в, г; 3) а, 6, в; 4) в, д. 76. Экзэргонические реакции в организме протекают самопроизвольно, так как: 1) AG > 0; реакции 2) AG <0; реакции У) AG =0; реакции 4)AG > 0. реакции 77. Эндэргонические реакции в организме требуют подвода энергии, так как: 1)AG >0; реакции 2) AG <0; реакции 3) AG = 0; реакции 4) AG <0. реакции 78. При гидролизе любого пептида АН < 0, AS > 0, будет ли данный процесс протекать самопроизвольно? 1) будет, так как AG > 0; 2) будет, так как AG < 0; 3) не будет, так как AG > 0; 4) не будет, так как AG < 0. 79. Калорийностью питательных веществ называется энергия: 1) выделяемая при полном окислении 1 г питательных веществ; 2) выделяемая при полном окислении 1 моль питательных веществ; 3) необходимая для полного окислении 1 г питательных веществ; 4) необходимая для полного окислении 1 моль питательных веществ. 80. Для процесса тепловой денатурации многих ферментов ЛЯ > 0 и AS > 0. Может ли данный процесс протекать самопроизвольно? 1) может при высоких температурах, так как \T-AS\ > |АД]; 2) может при низких температурах, так как \T-AS\ < |AH); 3) не может, так как \T-AS\ > |AH]; 4) не может, так как \T-AS\ < |AH|. 81. Для процесса тепловой гидратации многих белков АН < 0 и AS < 0. Может ли данный процесс протекать самопроизвольно? 1) может при достаточно низких температурах, так как |AH| > \T-AS\; 2) может при достаточно низких температурах, так как |АЯ| < |T-AH|; 3) может при высоких температурах, так как |АH) < | T-AS[; 4) не может ни при каких температурах. 82. Для процесса фотосинтеза — образование глюкозы из углекислого газа и воды, AH > 0 и AS < 0. Может ли данный процесс протекать самопроизвольно? 1) процесс неосуществим при любых температурах; 2) процесс осуществим при любых температурах; 3) процесс осуществим при высоких температурах. 4) процесс осуществим при низких температурах 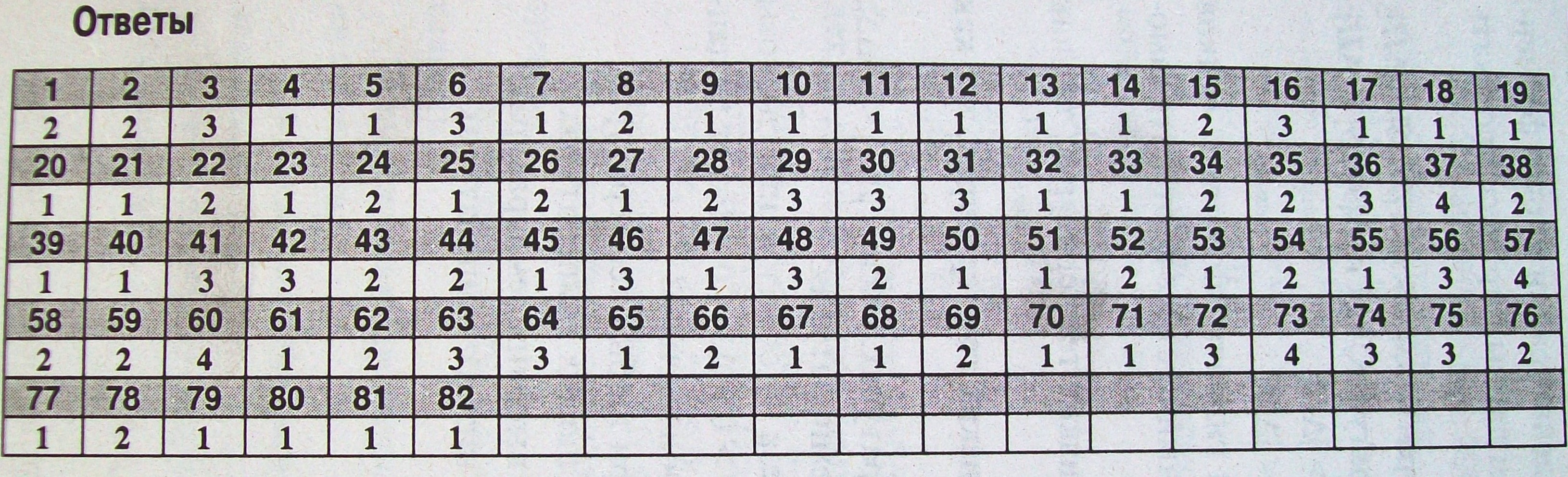 |
