Основные определения Ксенобиотик
 Скачать 0.94 Mb. Скачать 0.94 Mb.
|
|
Абсорбция токсикантов через кожу Кожа представляет собой защитный барьер организма, отделяющий его от окружающей среды. Тем не менее некоторые химические вещества абсорбируются через кожу в значительных количествах, оказывая токсическое воздействие на весь организм. При абсорбции через кожу токсикант должен пройти через эпидермис или придатки кожи (потовые и сальные железы и волосяные фолликулы). Прежде чем попасть в кровеносную или лимфатическую систему, химические вещества проходят через несколько клеточных слоев. Кожную абсорбцию химических веществ лимитирует переход через верхний слой эпидермиса с близко расположенными ороговевшими клетками, потерявшими ядра и поэтому биологически неактивными. Все токсиканты проникают через ороговевший слой путем пассивной диффузии. Полярные вещества, по-видимому, диффундируют через внешнюю поверхность гидратированных белковых молекул рогового слоя. Неполярные молекулы растворяются и диффундируют через липидные слои. Проницаемость кожи определяется как диффузионной способностью токсиканта, так и толщиной ороговевшего слоя. Его толщина больше на ладонях и подошвах (400-600 мкм в загрубевших частях) и меньше на спине и животе (5-15 мкм). Подкожная абсорбция включает диффузию токсиканта через нижние слои эпидермиса и дерму. Эти барьерные слои, располагающиеся глубже рогового слоя, содержат поры, неселективные водно-диффузионные среды. Токсиканты проникают через них путем диффузии и попадают в общий кровоток через многочисленные кровеносные и лимфатические сосуды дермы. ♦ Накопление токсикантов в организме Связывание с белками или депонирование в отдельных органах и тканях препятствует свободному перемещению ксенобиотика из одной жидкостной камеры в другую. ◦ Некоторые плазменные белки способны прочно связывать ксенобиотики. Среди белков плазмы альбумин присоединяет преимущественно кислотные формы токсикантов и катионы d-элементов; глобулин связывает преимущественно токсиканты основной природы. ◦ Печень и почки накапливают значительно больше разнообразных химических веществ, чем другие органы. Белки лигандины и металлотионеины, синтезируемые в печени и почках, имеют высокое сродство к органическим соединениям и ионам металлов и играют роль лигандов при депонировании токсикантов. ◦ Многие липофильные соединения с высоким значением коэффициента распределения ◦ Накопление ксенобиотиков в костной ткани – гетерогенный процесс с участием кристаллов гидроксиапатита Ca10(PO4)6(OH)2 и внеклеточной жидкости, находящейся в контакте с костной тканью. Депонирование и высвобождение токсикантов обратимы: Са10(РО4)6(ОН)2 + AsO43- ↔ Ca10(AsO4)6(OH)2 + РО43- Са10(РO4)6(ОН)2 + 2F- ↔ Ca10(PO4)6F2 + 2ОН- Ca10(PO4)6(OH)2 + 10Cd2+ ↔ Cd10(PO4)6(OH)2 + 10Ca2+ Однако при длительном воздействии значительных доз ксенобиотика на организм эти процессы могут привести к необратимым физиологическим изменениям. Например, свинец не вызывает явных нарушений в костной ткани, но хорошо известны хронические эффекты отложения фтора (скелетный флюороз), кадмия (кадмиевый токсикоз) и радиоактивного стронция (остеосаркома и другие новообразования). ♦ Барьеры при распределении ксенобиотиков Гематоэнцефалический барьер. Энцефалический барьер менее проницаем для токсических агентов, чем другие органы и ткани. Проникновению токсикантов в ЦНС препятствует: - эндотелиальные клетки ЦНС тесно примыкают друг к другу (растворимые и заряженные молекулы могут проходить, если они малого размера); - клетки содержат АТФ-зависимый белок-переносчик, который способен переносить некоторые химические вещества в кровь; - эндотелий капилляров ЦНС покрыт снаружи глиальными клетками (астроцитами), липидные мембраны которых играют роль дополнительной защиты; Плацентарный барьер. Многие ксенобиотики могут преодолевать плацентарный барьер: соединения липофильной природы, вирусы, клеточные патогены (бледная трепонема), глобулиновые антитела и эритроциты. Плацента содержит активную транспортную систему и биотрансформационные ферменты, которые защищают плод от попадания в него ксенобиотиков. Среди веществ, проникающих через плацентарный барьер путем пассивной диффузии, больше веществ с липофильными свойствами, которые быстрее достигают равновесия в системе мать-плод. В условиях устойчивого равновесного состояния концентрации токсичного вещества в плазме крови матери и плода обычно одинаковы. Концентрации в различных тканях плода зависят от их способности накапливать токсикант. Разница концентраций токсиканта в организме матери и плода может быть обусловлена рядом причин. Например, поскольку плод содержит незначительное количество жировой ткани, накопление в нем липофильных веществ ограничено. ♦ Биотрансформация ксенобиотиков Биотрансформация– метаболическое превращение эндогенных и экзогенных химических веществ в более полярные (гидрофильные) соединения.Обычно при биотрансформации свойства ксенобиотика изменяются от липофильных, благоприятствующих абсорбции через липидные мембраны, к гидрофильным, способствующим экскреции. Исключение из этого общего правила – выведение липофильных летучих соединений через органы дыхания. Изменение химической формы ксенобиотика при биотрансформации приводит и к изменению его биологической активности. Биотрансформация ксенобиотика с образованием токсичных продуктов называется метаболической активациейили летальным синтезом. Биотрансформация, сопровождающаяся снижением содержания токсиканта в организме, называется детоксикацией. Процессы биотрансформации многочисленных ксенобиотиков катализируются ограниченным числом ферментов. Реакции, катализируемые ферментами биотрансформации ксенобиотиков, обычно разделяют на реакции: - 1-й фазы: гидролиз, восстановление и окисление. Эти реакции протекают с участием функциональных групп -ОН, -NH2, -SH и -СООН и приводят к незначительному увеличению гидрофильности. - 2-й фазы: Таблица – Характеристика основных реакций конъюгации ксенобиотиков
♦ Выведение ксенобиотиков из организма Выведение токсикантов из кровотока или организма в целом может осуществляться разными способами. Экскреция – это удаление (выведение) ксенобиотиков во внешнюю среду. Снижение содержания токсикантов в системном кровотоке происходит также при биотрансформации или депонировании в отдельных частях организма (депо). Полное выведение токсиканта из организма, включающее биотрансформацию и экскрецию, носит название элиминация. ◦ Токсичные соединения, как и продукты их биотрансформации, поступают в мочу в результате клубочковой фильтрации, экскреции путем пассивной диффузии или активного транспорта. Соединения с относительной молекулярной массой до 60000 фильтруются в клубочках. Степень связывания белков плазмы влияет на скорость фильтрации, так как комплекс белок-ксенобиотик слишком велик, чтобы проникнуть через поры клубочков. Токсикант, прошедший фильтрацию, попадает в канальцевый аппарат нефрона, откуда может реабсорбироваться (т.е. возвратиться в кровоток) или экскретироваться с мочой. Токсиканты с высокими коэффициентами распределения масло/вода подвергаются значительной реабсорбции, тогда как полярные соединения легко экскретируются с мочой. 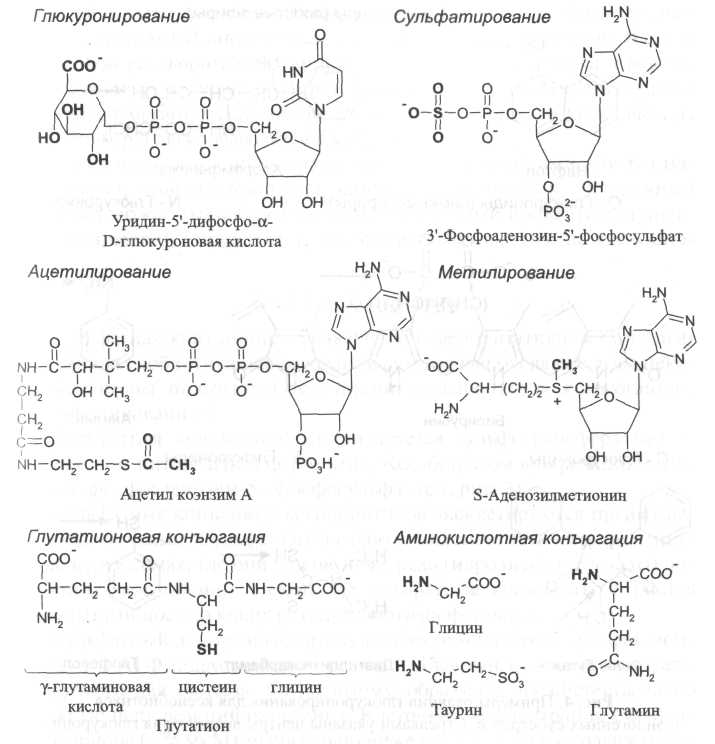 Рис. Структуры косубстратов 2-й фазы биотрансформации ◦ Относительно медленная кишечная экскреция является основным способом выведения соединений, не подвергающихся биотрансформации. Многие химические соединения, подвергающиеся кишечной экскреции, транспортируются из крови в содержимое кишечника путем пассивной диффузии. Значительная доля ксенобиотиков, экскретируемых с фекалиями, связана с кишечными бактериями. При участии бактерий токсиканты могут значительно изменять свою химическую форму. ◦ Вещества, находящиеся при 370С в газовой фазе, и летучие жидкости выделяются из организма преимущественно через легкие. В легких отсутствует специфическая транспортная система экскреции токсичных веществ, и летучие вещества выделяются по механизму простой диффузии. Эффективность выведения газов обратно пропорциональна их абсорбции. ◦ Токсичные продукты экскретируются в молоко простой диффузией. Поскольку молоко имеет рН 6,5, в нем концентрируются вещества, проявляющие основные свойства. Уровень веществ, проявляющих кислотные свойства, в молоке ниже, чем в плазме. Молоко содержит 3-4% жиров, поэтому липофильные ксенобиотики диффундируют с жирами из плазмы крови в молочные железы и экскретируются с молоком при лактации, попадая в организм ребенка. ◦ Экскреция токсичных агентов потовыми и слюнными железами незначительна. Токсичные вещества при выведении с потом могут вызывать дерматиты. ♦ Количественные характеристики токсикокинетики Токсикокинетика(от греч. toxicon– яд, kinetikos– движение) – наука, изучающая кинетические закономерности поступления, распределения, метаболизма (биотрансформации) и выведения токсичных веществ из организма. В классической токсикокинетике поведение токсичных веществ в организме рассматривается как движение между камерами, которые могут не иметь физиологических или анатомических аналогов. Камерапредставляет собой ограниченный в пространстве объем жидкости или ткани с одинаковой концентрацией токсиканта во всех точках ее пространства. Такому определению могут удовлетворять кровь, лимфа, межтканевая жидкость. Как внутри камер, так и между ними происходят процессы распределения, метаболизма и выведения токсичного вещества. Токсикокинетические характеристики ксенобиотика зависят от многих факторов: физических и химических свойств вещества, объема органов и тканей, скорости кровотока, проницаемости капилляров и клеточных мембран, рН биосред и характеристик распределения между кровью и тканями. Формализовать влияние этих факторов удается, используя математический аппарат, описывающий токсикокинетические закономерности. В основе изучения токсикокинетических параметров ксенобиотика лежит закон действующих масс для скорости. Однокамерная токсикокинетическая модель Простейшая токсикокинетическая модель ксенобиотика — это однокамерная (одночастевая) модель без всасывания. Такая модель соответствует, например, внутривенному введению токсиканта в кровь. Роль камеры, или части, в этой модели играет кровь (рис.). При внутривенном введении токсиканта, когда ксенобиотик попадает непосредственно в системный кровоток, стадия всасывания отсутствует. При проведении токсикокинетического исследования после внутривенной инъекции через определенные промежутки времени отбирают пробы и измеряют концентрацию ксенобиотика в плазме. Если при этом в полулогарифмических координатах lgC–t получается прямая линия, то кинетика ксенобиотика может быть описана однокамерной моделью и соответствует первому порядку. 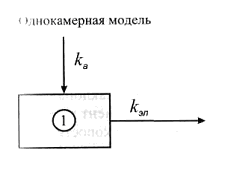 Рис. Однокамерная токсикокинетическая модель: kа – константа скорости первого порядка для процесса абсорбции ксенобиотика из внесосудистого пространства в центральную камеру (1); kэл – константа скорости первого порядка для процесса элиминации из центральной камеры 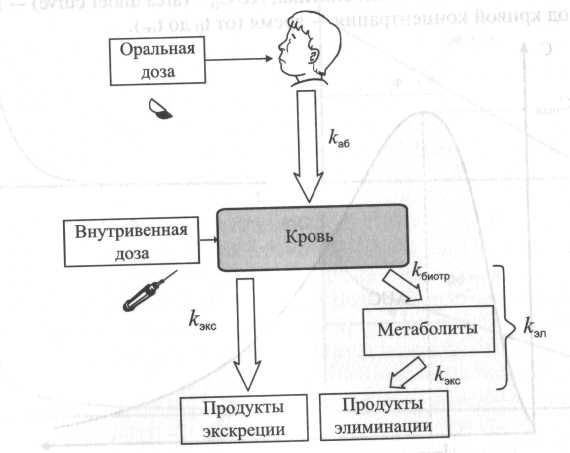 Рис. Однокамерная токсикокинетическая модель: kа6, kбиотр, kэкс, kэл – константы скорости абсорбции, биотрансформации, экскреции и элиминации 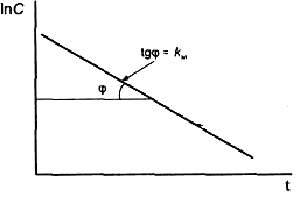 Рис. Кривая концентрация-время для ксенобиотика в однокамерной токсикинетической модели Однокамерную модель можно применять, например, для токсикокинетической характеристики наркотиков при внутривенном введении. При этом учитывают, что токсикант сразу (одномоментно) попадает в камеру – кровь. Для оценки скорости его выведения используют константу элиминации kэл (биотрансформация и экскреция) и период полувыведения t1/2. Эти параметры рассчитывают графически или с использованием выражения закона действующих масс для скорости: для n=1 или: где n – порядок реакции. Концентрация токсиканта в камере в отдельные моменты времени определяется уравнением, получаемым после интегрирования предыдущего: где С – концентрация ксенобиотика в крови (камере) через время t; С0 – начальная концентрация в крови при t=0; После логарифмирования интегрального уравнения получают уравнение: В полулогарифмических координатах lnC – t тангенс угла наклона прямой равен константе скорости элиминации Единицы измерения константы скорости первого порядка Из кинетического уравнения рассчитывают время полувыведения токсиканта из камеры – время достижения концентрации вдвое меньше начальной (1/2Со): Таким образом, для процесса первого порядка полупериод не зависит от начальной концентрации токсиканта. При внесосудистом поступлении ксенобиотика в организм рассматривается модель со всасыванием, что предполагает стадию всасывания ксенобиотика в системный кровоток. Например, при приеме токсиканта внутрь он распределяется между содержимым желудка, кровью и мочой (рис.). Скорость убыли токсиканта из содержимого желудка (скорость абсорбции в кровь) прямо пропорциональна его концентрации в содержимом желудка Поскольку скорость накопления токсиканта в крови представляет собой разницу между скоростью поступления токсиканта из полости желудка в кровь и скоростью элиминации токсиканта из крови: можно рассчитать концентрацию токсиканта в крови в момент t: где V – объем камеры; |
