Основные определения Ксенобиотик
 Скачать 0.94 Mb. Скачать 0.94 Mb.
|
|
Двухкамерная токсикокинетическая модель При внутривенном введении некоторых ксенобиотиков изменение их концентрации в плазме крови во времени в полулогарифмических координатах может быть непрямолинейным (рис.). В таком случае для токсикокинетического анализа используют многокамерные модели, а для характеристики выведения (элиминации) ксенобиотика из плазмы применяют многоэкспоненциальные математические уравнения. Двухкамерная (двухчастевая) модель демонстрирует распределение вещества между центральной и периферической камерами (рис.). 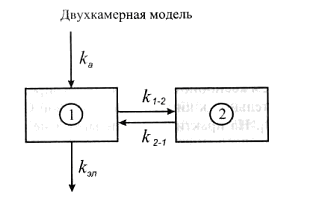 Рис. Однокамерная токсикокинетическая модель: kа – константа скорости первого порядка для процесса абсорбции ксенобиотика из внесосудистого пространства в центральную камеру (1); kэл – константа скорости первого порядка для процесса элиминации из центральной камеры; k1-2, k2-1 – константы скорости первого порядка для распределения ксенобиотика в периферическую камеру (2) и из нее для двухкамерной модели  Рис. Двухкамерная кинетическая модель: kа6, kбиотр, kэкс, kэл – константы скорости абсорбции, биотрансформации, экскрециии, элиминации и перехода из центральной камеры в периферическую и обратно В общем случае токсикокинетическая кривая этого типа может быть описана в виде суммы двух экспонент где А и В – коэффициенты пропорциональности; α и β – константы скорости элиминации первого порядка. Из рис. видно, что ксенобиотик находится в динамическом равновесии между двумя камерами – центральной и периферической.  Рис. Кривые концентрация-время для ксенобиотиков в двухкамерной токсикинетической модели На стадии распределения концентрация химических веществ в плазме крови снижается значительно быстрее (начальный участок кинетической кривой) (рис.). Для установления концентрационного равновесия между кровью и тканями требуется время. После завершения распределения снижение концентрации в плазме крови происходит медленнее и характеризуется константой скорости β. Константа скорости βв двухкамерной модели совпадает по смыслу с константой элиминации Одна из реальных аналогий двухкамерной модели – система, в которой рассматриваются две камеры: кровь и костная ткань. Накопление токсиканта в костной ткани (депо) может увеличиваться с возрастом и зависит от экологических факторов. Квота резорбции (биодоступность) Квота резорбции вещества (КВР), являющаяся количественной характеристикой способности вещества проникать в организм различными путями, представляет собой отношение всосавшегося вещества к общему количеству апплицированного тем или иным способом. КВР может быть рассчитана путем построения диаграмм в координатах «плС-t». Площадь под кривой такой диаграммы (ППК, мг·мин·мл-1) определяет количество всосавшегося токсиканта (количество вещества в плазме крови) (рис.). Если соотнести величину ППК токсиканта для внутривенного введения (ППКiv) c величиной ППКd при ином способе аппликации, то значение коэффициента 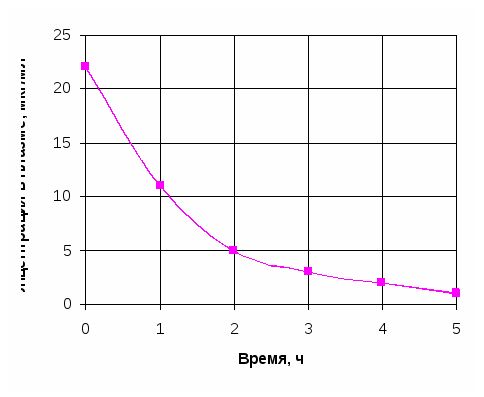 Угол наклона касательной ППК – площадь под кривой    ППК1 ППК2 Рис. Диаграмма в координатах «плС-t» Объем распределения Объем распределения ксенобиотика (Vd) (от англ. distribution) представляет собой постоянную величину, связывающую общее его количество в организме с концентрацией в плазме крови: 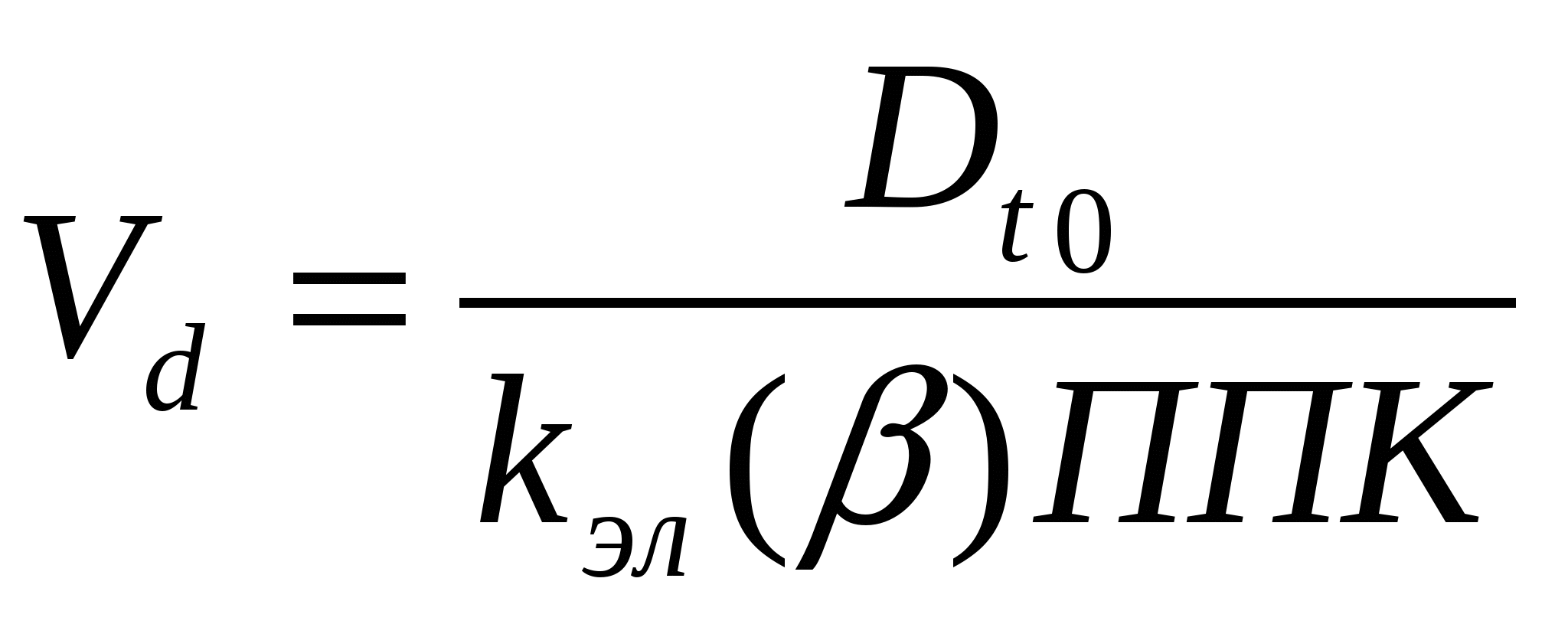 , , где Объем распределения имеет размерность л или л/кг. Значения Vd зависят от природы ксенобиотика и отражают его распределение в разных тканях организма. Для химических веществ с высоким сродством к тканям характерны большие объемы распределения. Напротив, вещества, преимущественно остающиеся в плазме крови, имеют низкие значения Vd, соизмеримые с ее объемом. Для однокамерной модели математическое выражение При известном объеме распределения и данной концентрации ксенобиотика в плазме можно рассчитать количество токсиканта в организме в любой момент времени по формуле: где Клиренс Клиренс CL (от англ. clearance– очищение) – скорость очищения крови или других сред и тканей организма от ксенобиотика в процессе его химических превращений, перераспределения в организме и/или выведения из организма. Клиренс определяется как объем крови (в л, мл), полностью освобождаемой от вещества за единицу времени (с, ч). Таким образом, для процессов элиминации, характеризующихся константой скорости первого порядка, единицы измерения клиренса л/с, л/мин или л/ч) или в расчете на единицу массы тела л/(кг·с), л/(кг·мин) или л/(кг·ч). Например, клиренс 100 мл/мин означает, что 100 мл крови, содержащей ксенобиотик, полностью очищаются от него в течение 1 мин. Общий клиренс организма определяется как: Клиренс можно также рассчитать при известных значениях объема распределения и константы скорости элиминации для одночастевой модели: и для двухчастевой модели: Высокие значения клиренса указывают на эффективность и высокую скорость выведения вещества, низкий клиренс означает медленное и менее эффективное удаление ксенобиотика из организма. Взаимосвязь периода полувыведения ксенобиотика с объемом распределения и клиренсом Период полувыведения (t1/2) – время, необходимое для снижения концентрации ксенобиотика в крови или плазме наполовину, зависит как от объема распределения, так и от клиренса. Его можно рассчитать: За период, равный 7 полупериодам элиминации, ксенобиотик выводится на 99,2%. Это соответствует практически полной элиминации. • Общие механизмы цитотоксичности В основе токсического действия веществ лежит повреждение клеток, сопровождающееся их функциональными либо структурно-функциональными изменениями. Общие механизмы, лежащие в основе цитотоксического действия ксенобиотиков: ▪ нарушение энергетического обмена; Жизнь клеток – это постоянный процесс синтеза сложных молекул. Синтетические процессы, идущие с поглощением энергии, невозможны без одновременного протекания реакций, сопровождающихся ее высвобождением. Основным видом таких реакций в организме является гидролитическое расщепление богатых энергией веществ (макроэрги): АТФ, АДФ. Непрямым механизмом повреждающего действия на энергообмен является повреждение токсикантами систем транспорта кислорода в организме и понижение его парциального давления в тканях. Прямым механизмом является нарушение механизмов биологического окисления субстратов – источников энергии. ▪ активация свободнорадикальных процессов в клетке; Некоторые ксенобиотики, попав во внутренние среды организма, подвергаются метаболическим превращениям, в ходе которых образуются промежуточные продукты. Многие промежуточные продукты существуют в форме свободных радикалов, т.е. в форме молекул, на внешней орбитали которых находится неспаренный электрон. Наличие такого электрона делает метаболит способным к активному взаимодействию с различными структурами-мишенями. Например, хорошо доказана возможность образования радикалов при метаболизме параквата: 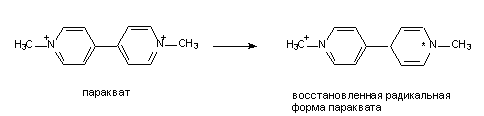 ▪ повреждение клеточных мембран; Липиды – инертные в химическом отношении молекулы. Важнейшая функция липидов – формирование биологических мембран. В результате нарушения структурной целостности мембран развиваются деформация клеток и их гибель. ▪ нарушение гомеостаза внутриклеточного кальция; Нарушение механизмов поддержания гомеостаза внутриклеточного кальция может стать следствием: - повреждения биологических мембран и усиления их проницаемости для ионов; - нарушения биоэнергетики клетки, приводящие к истощению запасов макроэргов; - изменения функционального состояния белковых комплексов, образующих каналы для кальция. Все эти механизмы могут приводить к усилению выхода кальция из внеклеточной жидкости в цитоплазму клетки. Цитотоксический эффект, опосредованный стойким повышением содержания свободного кальция в цитоплазме, в настоящее время связывают с развивающимся при этом повреждением целостности цитоскелета. Цитоплазма клетки помимо цитозоля и клеточных органелл содержит нитевидные белковые структуры, которые формируют скелет. Стойкое увеличение кальция в цитозоле разрушает комплекс актина микрофиламентов с белком, связывающим микрофиламентами цитоскелета с белками плазматической мембраны. Кальций активирует протеазы, которые могут расщеплять актин-связывающие белки, разрушая места прикрепления филаментов цитоскелета к клеточной мембране. ▪ нарушение процессов синтеза белка и клеточного деления. В основе нарушения процессов синтеза белка, клеточного деления и передачи наследственной информации лежит повреждение токсикантами молекул ДНК, РНК и ферментов. Результатом генотоксического действия ксенобиотиков нередко является мутагенез – наследуемые изменения генетической информации, хранящейся в ДНК клеток. Все клетки организма находятся в одной из фаз клеточного цикла:
Далеко не всякая модификация молекулы ДНК (мутация) является опасной для организма. Более того, эволюция была бы не возможна без мутаций, поскольку именно она лежит в основе изменчивости. Опасность представляет случайный, ненаправленный мутагенез, как правило, несущий для организма негативные последствия. Неблагоприятные эффекты мутагенеза определяются тем, в клетках какого типа он реализуется: половых или соматических, стволовых и делящихся или созревающих и зрелых. Результатом грубых мутаций половых клеток и делящихся клеток развивающегося плода являются: стерильность особи, врожденная патология у потомства, тератогенез, гибель плода. Мутации стволовых и делящихся соматических клеток сопровождаются структурно-функциональными нарушениями тканей с непрерывной физиологической регенерацией (система крови, иммунная система, эпителиальные ткани) и канцерогенезом. Повреждение токсикантом ДНК зрелой соматической клетки не приводит к пагубным последствиям для организма. Основными видами мутаций являются: - точечная мутация, связанная с модификацией одного нуклеотида в структуре ДНК (замещение нуклеотида, выпадение из цепи, включение дополнительного в цепь); - хромосомные аберрации – изменение структуры хромосом (разрывы молекул ДНК) или числа хромосом в клетке. Неблагоприятные эффекты мутагенеза определяются также и тем, в клетках какого типа он реализуется: половых или соматических, стволовых и делящихся или созревающих и зрелых. Пример: Результаты грубых мутаций: - половых и делящихся: стерильность особи, врожденная патология у потомства, тератогенез, гибель плода; - стволовых и делящихся соматических: структурно-функциональные нарушения тканей с непрерывной физиологической регенерацией (система крови, иммунная система, эпителий) и канцерогенез. Гибель клеток. Некроз – массовая гибель клеток, обусловленная высокими концентрациями токсических соединений или неблагоприятными условиями. Это неконтролируемый процесс, сопровождаемый разбуханием клеток и беспорядочным распадом ДНК. Время протекания от нескольких часов до нескольких дней. Пример: гангрена, пролежни, застой в венах; покровный эпителий кожи, эпителий пищеварительного, дыхательного, мочеполового трактов непрерывно отмирает и регенерирует. Апоптоз – регулируемый энергозависимый устойчивый процесс, протекающий с целью программируемого уничтожения старых поврежденных предраковых клеток. Действует в более короткие промежутки времени менее 10 часов. При этом ДНК разрушается в определенном порядке сначала на крупные, затем на более мелкие. |
