Билет 1.экзамен по физике. Основные положения ам учения Все вещества состоят из атомов
 Скачать 62.63 Kb. Скачать 62.63 Kb.
|
|
Билет 1 Основные положения А-М учения: Все вещества состоят из атомов Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества) При физических явлениях молекулы не изменяются, при химических происходит изменение их состава Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества Химия - наука о веществах, их строении, свойствах и превращениях, а также о явлениях, сопровождающих эти превращения. Молекула – наименьшая частица данного в-ва, обладающая его хим св-ми. Хим св-ва молекулы определяются ее составом и хим строением. Атом – электронейтральная частица, состоящая из положит заряженного атомного ядра и отриц заряженных электронов. Хим элемент – определенный вид атомов с одинаковым положительным зарядом ядра Ион - частица, образов-ая атомом или группой атомов, электрически заряженная вследствие потери и присоединения электрона. Полож заряж ион - катион, отриц - анион. Хим формула - условная запись состава в-ва с помощью символов элементов и индексов. Хим реакция - превращение в-в, которое сопровождается изменением их состава и строения. Ур-е хим реакции - условная запись хим р-ции с помощью хим формул. Коэффициенты перед формулами в-в в ур-ях хим р-ций наз-ся стехиометрическими. Изотопы – разновидности атомов (и ядер) к-л хим элемента, к-е имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа. Изотопы имеют практически одинаковые химические, но разные физические свойства (например, массы атомных ядер). Простое в-во - в-во, состоящее из атомов одного ХЭ (О2,Н2). Сложное в-во - в-во, состоящее из атомов различных ХЭ (NH3,H2O). Относительная атомная масса химического элемента (Ar) – величина, показывающая отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода 12С; является одной из основных характеристик химического элемента. Хим эквивалент - массовое кол-во элемента или СВ, которое соединяется с 1 массовой частью водорода или 8 весовыми частями. кислорода или замещает их в хим соединениях. Закон эквивалентов: химические вещества реагируют друг с другом в равных количествах эквивалентов В зависимости от расстояния между частицами, составляющими в-во, и от характера и энергии взаимод м/у ними в-во может нах-ся в твердом, жидком, газообразном, плазменном состоянии. Если температура достаточно низкая, силы действующие между частицами удерживают их вблизи равновесных положений - в-во нах-ся в твердом агрег состоянии. При повышении темпер тв в-ва плавятся, увеличивается расстояние между некотор частицами, хотя энергия поступательного движения не настолько велика, чтобы частицы могли оторваться друг от друга. Такое агрегатное состояние в-ва наз-ют жидким. Дальнейшее увеличение темпер приводит к тому, что средняя кинетич энергия превосходит потенц энергию, поэтому силы притяжения между частицами не в состоянии удержать их вблизи друг друга, расстояние между частицами значительно больше их размеров, в-во переходит в газообразное состояние. При сверхвысоких темпер от молекул газа начинают отрываться электроны, появляется большое кол-во положит и отрицат заряж частиц. Происходит термическая ионизация газа и он переходит в состояние плазмы. Стандартные условия — стандартные физ условия, с которыми обычно соотносят свойства веществ; определены IUPAC (Междунар союзом практич и прикладной химии) следующим образом: Атмосферное давление 101325 Па = 760 мм рт. ст.. Температура воздуха 273,15 K = 0°C. При станд условиях объём одного моля идеального газа составляет 22,4 дм³ (следствие из закона Авогадро), а количество молекул в 1 см³ составляет 2,6867×1019 Основные типы структур неорг. соед. Все в-ва делятся на П.В. и С.В. П.В. делят на Ме и нМе. С.В. на Орг. и Неорг. в-ва (их делят на оксиды, кислоты,основания(гидрооксиды) и соли).Оксиды – это СВ, сост. из атомов двух элементов, один из которых О2. Основные оксиды - обр-ся только Ме. Кислотные оксиды – оксиды нМе или переходных Ме высоких СО. Амфотерные оксиды – оксиды, которые обладают двойственной природой и вза-ют как с растворами щелочей, так и с растворами кислот с обр. соли и воды. Кислоты- СВ, которые сост. из атомов H2 способных замещаться на атомы Ме и кислотного остатка. Основания – СВ, при диссоциации которых в водных р-рах обр-ся в качестве анионов только гидроксид-ионы. В-ва с молекулярной структурой сост. из отдельных молекул (NH3,H2O), а в-ва не имеющие отдельных молекул сост. из немолекул структуры(NaCl). В 1806 Пруст сформулировал закон постоянство состава: каждое химически-чистое в-во определенный и постоянный состав. Спустя некот. Время Курнаков доказал, что сущ. Соед-я постоянного и переменного состава (бертоллиды). Закон постоянства состава немолекулярных соед.: состав немол.соед. в данном агрегатном сост. зависит от условий получ. и предыдущей обработки. 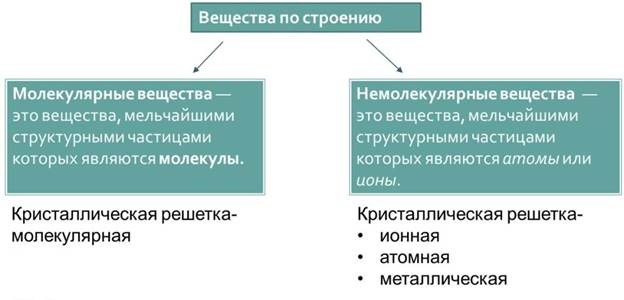 Атомная крист. решетка: в её узлах наход-ся атомы, связ. Друг с другом ков. Связью. В-в облад. АКР сравнительно мало. К ним принадлежат алмаз, кремний, и некотр неорг. соед. Эти в-ва хар-ся высокой твёрдостью, они тугоплавки и не растворимы, практически не в каких растворителях.Такие их св-ва обусловлены прочностью ков.связи.Кол-во ближайших частиц в крист.решетке наз-ся координационным числом. Молекулярная решетка: в ее узлах нах-ся молекулы,связанные друг с другом межмолекулярными силами.В-в с МКР очень много.К ним принадлежат нМе кроме С,Si, все орг.соед-я с неионной связью и многие неорг.в-ва.Силы межмолекулярного вз-я значительно слабее сил ков.связи,поэтому молекулярные кристаллы имеют небольшую твердость,легкоплавки и летучи. В узлах ионных решеток располагаются,чередуясь, полож. и отриц.заряженные ионы, связ. друг с другом силами электростатич.притяжения. К соединениям с ионной связью относятся большинство солей и небольшое число оксидов. Ионные соед-я имеют сравнительно высокие темпер.плавл.,в большинстве случаев их летучесть невелика. Они обладают хрупкостью и явл-ся диэлектриками. В узлах металлической решетки нах-ся атомы Ме,удерживаемые металлической связью.МеКР обр-ет ПВ большинства элементов периодической системы-Ме.По прочности МеКР нах-ся м/у АКР и МКР,т.к.металлической связи присущи хар-рные черты ков.связи. .МеКР представляется в виде полож.заряж.ионов, располагающихся в узлах ее и электронов,двигающихся м/у ними.МКР и АКР присущи в-вам с ков.связью,ИКР-ионным соед-ям, МеКР-сплавам и металлам. Полимеры-неорг.и орг. аморфные и кристал.в-ва,получаемые путем многократного повторения различных групп атомов,наз-ся мономерами,соед. в длинные макромолекулы.В большинстве случаев понятие относят к орг.соед-ям,однако сущ. и множество неорг.полимеров. На их основании изготовляют резины,волокна,пластмассы,все ткани живых организмов представляют высоко-молекулярные соед-я. Кристаллич.состояние в-ва- строгая упорядоченная структура, определенное межмолек. расстояние, пост.темпер.плавл. обладание анизотропией (прочность, теплопроводность,отношение к свету и др. не всегда одинаковы по различным направлениям внутри кристалла). Аморфное состояние в-ва-не имеет строгой крист.структуры, хар-ся интервалом темпер.плавл., обладает изотропностью (теплопроводность,электропроводность, скорость распределения света - одинаковы). Для получения более полной информации о веществе пользуются графическими формулами, которые указывают порядок соединения атомов в молекуле и валентность каждого элемента. Графические формулы веществ, состоящих из молекул, иногда, в той или иной степени, отражают и строение (структуру) этих молекул, в этих случаях их можно назвать структурными. Для составления графической (структурной) формулы вещества необходимо: Определить валентность всех химических элементов, образующих вещество. Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле. Соединить знаки химических элементов черточками. Каждая черточка обозначает электронную пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам. Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента. При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода. Атомы кислорода соединяют друг с другом только при составлении формул пероксидов. При написании графических формул солей исходят из графических формул кислот, заменяя атомы водорода на атомы металла, учитывая его валентность, например:
Общая характеристика р-элементов. К р-блоку относят 30 элементов IIIА—VIIIА-групп периодической системы. Р-элементы входят во второй и третий малые периоды, а также в четвертый — шестой большие периоды. У элементов IIIА-группы появляется первый электрон на р-орбитали. В других группах IVА—VIIIА происходит последовательное заполнение р-подуровня до 6 электронов (отсюда название р-элементы). Строение внешних электронных оболочек атомов элементов р-блока (общая формула ns2npа,где а = 1-6). В периодах слева направо: o уменьшаются атомные и ионные радиусы р-элементов, o возрастают энергия ионизации и сродство к электрону в целом, o увеличивается заряд ядра, o увеличивается электроотрицательность, окислительная активность, o усиливаются окислительная активность элементных веществ и неметаллические свойства В группах: o увеличиваются радиусы атомов и однотипных ионов, o уменьшается энергия ионизации при переходе от 2р-элементов к 6р-элементам, так как по мере возрастания числа электронных оболочек o усиливается экранирование заряда ядер электронами, предшествующими внешним электронам. С увеличением порядкового номера р-элемента в группе: o ослабевают неметаллические свойства, o усиливаются металлические свойства. В Р – элементы образуют двухатомные молекулы Э2, различающиеся по устойчивости. Наиболее устойчивы молекулы Э2 элементов второго периода — N2, О2 и F2. o При переходе от IIIА- к IVА- и VА - группам устойчивость молекул возрастает, o При переходе к VIIIА - группе понижается. В группах при движении вниз: o прочность связи Э—Э уменьшается. Р – элементы второго периода — азот, кислород и фтор — обладают ярко выраженной способностью участвовать в образовании водородных связей. Элементы третьего и последующих периодов эту способность теряют. Сходство р-элементов второго периода с р-элементами последующих периодов заключается в основном только в строении внешних электронных оболочек и тех валентных состояний, которые возникают за счет неспаренных электронов в невозбужденных атомах. Бор, углерод и особенно азот сильно отличаются от остальных элементов своих групп (наличие d- иf-подуровней). При переходе от р-элементов второго периода к р-элементам третьего и последующих периодов сохраняются все типы связей, характерные для элементов второго периода, и появляются новые типы химической связи. При переходе от р-элементов второго периода к р-элементам третьего и последующих периодов: o увеличивается склонность элементов образовывать комплексные соединения, o повышаются координационные числа. Так, если р-элементы второго периода имеют в соединениях координационные числа 2, 3, 4, то р-элементы последующих периодов могут иметь координационные числа 5, 6, 7, 8 и даже 12. При переходе сверху вниз по группе: o уменьшается устойчивость максимальной положительной степени окисления у р-элементов, o возрастает устойчивость низших степеней окисления. Так, например, для углерода устойчивая степень окисления +4, а для свинца +2, для алюминия +3, а для таллия +1. Физические свойства простых веществ р-элементов сильно различаются. Одни вещества — кислород, азот (газы) — кипят и плавятся при очень низких температурах. Другие — бор, углерод — при очень высоких. По группам и периодам физические свойства изменяются немонотонно, и не всегда характер изменений легко связать со строением электронных оболочек атомов, типом химической связи, координационным числом атома. Таким образом, у p-элементов различия в свойствах соседних элементов как внутри группы, так и по периоду выражены значительно сильнее, чем у s-элементов. Все р-элементы и в особенности р-элементы второго и третьего периодов (С, N, Р, О, S,Si, Сl) образуют многочисленные соединения между собой и с s-,d- и f-элементами. Большинство известных на Земле соединений — это соединения р-элементов. Слева направо по периоду: o ослабевают металлические свойства, o усиливаются неметаллические свойства, o ослабевают основные свойства оксидов, o возрастают кислотные свойства оксидов, o увеличивается заряд ядра, o увеличивается притяжение к ядру валентных электронов, o затрудняется отдача валентных электронов Сверху вниз по главной подгруппе: o возрастают основные свойства оксидов, o ослабевают кислотные. Обратите внимание! Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства. При перемещении сверху вниз по группам: o усиливаются металлические свойства элементов (Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.) При переходе от р-элементов второго периода к р-элементам третьего и последующих периодов сохраняются все типы связей, характерные для элементов второго периода, и появляются новые типы химической связи. В этом направлении увеличивается склонность элементов образовывать комплексные соединения и повышаются координационные числа. Так, если р-элементы второго периода имеют в соединениях координационные числа 2, 3, 4, то р-элементы последующих периодов могут иметь координационные числа 5, 6, 7, 8 и даже 12. При переходе вниз по группе устойчивость максимальной положительной степени окисления у р-элементов уменьшается и возрастает устойчивость низших степеней окисления. Так, например, для углерода устойчивая степень окисления +4, а для свинца +2, для алюминия +3, а для таллия +1. |
