Ответы по аналитике. Основные положения качественного анализа
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
Способы выражения концентрации растворов.1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя: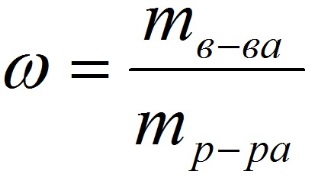 где: ω – массовая доля растворенного вещества; mв-ва – масса растворённого вещества; mр-ра – масса растворителя. Массовую долю выражают в долях от единицы или в процентах. 2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V: 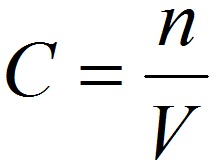 , ,где: C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl); n – количество растворенного вещества, моль; V – объём раствора, л. Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества. 3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m: 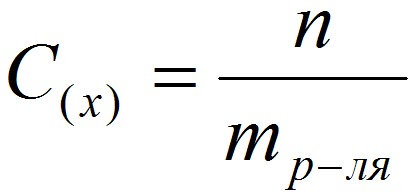 , ,где: С (x) – моляльность, моль/кг; n – количество растворенного вещества, моль; mр-ля – масса растворителя, кг. 4. Титр – содержание вещества в граммах в 1 мл раствора: 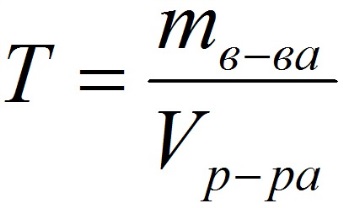 , ,где: T – титр растворённого вещества, г/мл; mв-ва – масса растворенного вещества, г; Vр-ра – объём раствора, мл. 5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе: 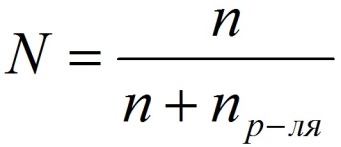 , ,где: N – мольная доля растворённого вещества; n – количество растворённого вещества, моль; nр-ля – количество вещества растворителя, моль. Сумма мольных долей должна равняться 1: N(X) + N(S) = 1. где N(X) - мольная доля растворенного вещества Х; N(S) - мольная доля растворенного вещества S. Иногда при решении задач необходимо переходить от одних единиц выражения к другим: 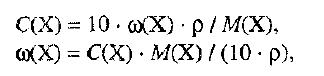 ω(X) - массовая доля растворенного вещества, в %; М(Х) – молярная масса растворенного вещества; ρ= m/(1000V) – плотность раствора.6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора. Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту. Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н. 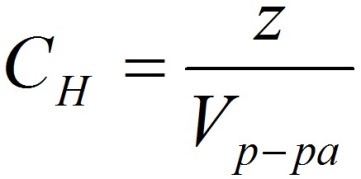 , ,где: СН – нормальная концентрация, моль-экв/л; z – число эквивалентности; Vр-ра – объём раствора, л. Растворимость вещества S - максимальная масса вещества, которая может раствориться в 100 г растворителя: 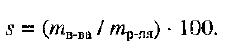 Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя: 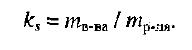 Раство́р — гомогенная (однородная) система (точнее, фаза), состоящая из двух или более компонентов и продуктов их взаимодействия. Гомогенность можно понимать в том смысле, что каждый из компонентов распределен в массе другого в виде своих частиц, то есть атомов, молекул или ионов. Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем условно считается компонент, количество которого в растворе преобладает[1]. Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ. По сравнению с индивидуальными веществами по структуре растворы сложнее. Химическое взаимодействие растворенного вещества с водой приводит к образованию соединений, которые называются гидратами. Их формулы выражают с помощью формул растворенного вещества и воды, соединённых знаком «.» В зависимости от цели для описания концентрации растворов используются разные физические величины.
51. Техника выполнения основных операций в аналит. химии Техника выполнения основных операций Нагревание проводят на водяной бане, помещая в нее пробирки с раствором или с раствором, содержащим осадок. Упаривание растворов проводят для их концентрирования; упаривание проводят в тиглях или фарфоровых чашках, нагревая их на асбестовой сетке. Сухой остаток переносят в пробирку после охлаждения. Осаждение проводят в центрифужных микропробирках, добавляя осадитель по каплям при постоянном перемешивании содержимого пробирки. Исходный объем раствора не должен превышать 2 мл. Центрифугирование применяется для отделения раствора от осадка. Проводят в центрифужных пробирках. Правила работы с центрифугой: а) помещают в гнезда электрической центрифуги не менее 2-х пробирок (исследуемый раствор и противовес); б) центрифугу плотно закрывают крышкой; в) включают в сеть, регулируя число оборотов; г) через 1-2 мин центрифугу выключают, не открывая крышки; д) после полной остановки открывают крышку центрифуги и вынимают пробирки. Проверяют полноту осаждения, для чего к центрифугату (прозрачному раствору над осадком) добавляют 1-2 капли осадителя. Если раствор остается прозрачным, то осаждение полное. В противном случае операцию осаждения повторяют. Прозрачный раствор над осадком сливают в чистую пробирку или отсасывают пипеткой. Промывание осадка. Кристаллические осадки промывают дистиллированной водой, аморфные - раствором сильного электролита (например, NH4NO3). Осадок заливают промывной жидкостью (1-2 мл), перемешивают стеклянной палочкой и центрифугируют. Растворение осадка проводят, добавляя к нему по каплям кислоту, щелочь, раствор аммиака и т.д. Экстрагирование проводят в полумикропробирках, добавляя к содержимому пробирки 5-20 капель органического растворителя; смесь тщательно перемешивают. После отстаивания слои разделяют. Выполнение реакций. Все реакции выполняют в химически чистой посуде. Пробирочные реакции выполняют в полумикропробирках (далее называют «пробирки»). В пробирку помещают 3-5 капель анализируемого раствора, создают условия, рекомендованные в данной методике, осторожно, не касаясь стенок пробирки, добавляют 2-3 капли реагента, перемешивают стеклянной палочкой и через 1-2 мин наблюдают аналитический эффект. Микрокристаллоскопические реакции проводят на чистых, обезжиренных предметных стеклах (обезжиривание проводят смесью спирта и эфира). На предметное стекло стеклянной палочкой помещают каплю исследуемого раствора; рядом помещают каплю реагента. Затем стеклянной палочкой соединяют оба реагента. Если необходимо, раствор слегка упаривают. Если реактив твердый, то крупинку соли помещают на край исследуемого раствора. Через 1-2 мин рассматривают образовавшиеся кристаллы под микроскопом. Капельные реакции проводят на фильтровальной бумаге. Анализируемое вещество капилляром наносится на бумагу. Затем в центр пятна другим капилляром наносят реактив. Диаметр пятна не должен превышать 0,5 см. Каждую последующую каплю реактива добавляют только после впитывания предыдущей. Осадочно-хроматографические реакции выполняют аналогично капельным реакциям на фильтровальной бумаге, только с обязательной операцией «проявления» хроматограммы чистым растворителем (дистиллированной водой). Холостой опыт выполняют, используя все те же реагенты в тех же условиях, что и в основном опыте, но в отсутствие определяемого иона. Контрольный опыт выполняют, используя те же реагенты в тех же условиях, которые применяются для определяемого иона. Холостой и контрольный опыт проводят только в сомнительных случаях, параллельно основному опыту, и сравнивают полученные результаты. 52. Кислотно - основная классификация катионов Кислотно–основная классификация катионов Кислотно-основная классификация катионов основана на различии в свойствах их гидроксидов (основные или амфотерные, растворимые или не растворимые в NH3) и на различной растворимости в воде их хлоридов и сульфатов (хорошо или мало растворимые). Деление катионов на группы по кислотно-основной классификации, групповые реагенты, а также свойства их хлоридов, сульфатов и гидроксидов даны в табл.2. Таблица 2 Кислотно-основная классификация катионов
Систематический анализ смеси катионов I–IV аналитических групп, основанный на кислотно-основной классификации, начинают обычно с дробного обнаружения катионов I аналитической группы, а затем разделяют смесь на группы с помощью групповых реагентов. Вначале осаждают хлориды катионов II аналитической группы, а затем переводят в осадок сульфаты катионов III аналитической группы. При обработке полученного раствора, содержащего катионы I, IV, V и VI аналитических групп, избытком раствора гидроксида натрия в присутствии пероксида водорода в осадок переходят основные по своей природе гидроксиды или гидратированные оксиды катионов V и VI аналитических групп. При этом катионы I и IV аналитических групп остаются в растворе. Гидроксиды катионов IV аналитической группы являются амфотерными и поэтому растворимы в избытке раствора гидроксида натрия. Осадок гидроксидов катионов V и VI аналитических групп растворяют действием разбавленного (2 моль/л) раствора азотной кислоты в присутствии пероксида водорода. Добавление к полученному раствору концентрированного раствора аммиака позволяет выделить в осадок гидроксиды катионов V аналитической группы, тогда как катионы VI аналитической группы остаются в растворе в виде комплексных амминов. 53. правила работы полумикрометодом Наиболее широкое применение в качестве анализа по лучил полумикрометод с элементами микроанализа. Этот метод имеет ряд преимуществ: для выполнения реакции расходуется небольшое количество анализируемого вещества и реактивов; сокращается время, затрачиваемое на выполнение анализа, за счет замены фильтрования осадков центрифугированием; резко сокращается выброс вредных газообразных веществ, тем самым улучшаются санитарно-гигиенические условия работы. Растворы реактивов и жидкие реактивы добавляют к исследуемому раствору по каплям, в строго определенном количестве, так как избыток или недостаток реактива искажает результаты анализа. Раствор реактива отбирают пипеткой, оставляя на месте реактивную склянку. Чтобы избежать загрязнения реактива, нельзя прикасаться кончиком пипетки к внутренней поверхности пробирки, в которой проводится реакция, класть пипетку на стол, опускать ее в склянку с другим реактивом, сливать в реактивную склянку оставшийся в пипетке избыток реактива. Если реактив находится в капельнице или специальной ампуле, то после отбора необходимого количества реактива их следует поставить на соответствующее место в штатив. Твердые реактивы используют в измельченном состоянии и вносят в реакционную смесь шпателем. При анализе кроме реактивов используют реактивную, индикаторную и фильтровальную бумагу, которую хранят в банках с притертыми пробками или в ящиках штативов индивидуального и общего пользования Полумикроанализ, сантиграммовый метод – совокупность приемов, предназначенных для количеств анализируемой пробы около 0,05–0,1 (до 0,5) г и объемов растворов 1–5 (до 10) мл. Выполнение анализа полумикрометодом ускоряет определение, снижает расход реагентов и еще не требует специальной аппаратуры. 54. 4 аналит. группа Реакции катионов хрома Cr3+
Cr3++3NH4OH→Cr(OH)3↓+3NH4Cl Cr(OH)3+6NH4OH→[Cr(NH3)6](OH)3+6H2O Раствор гидроксида аммония осаждает серо-зеленый осадок гидроксида хрома, который растворяется в избытке реактива с образованием комплексного соединения гидроксида гексаммина хрома.
При действии окислителей, например, пероксида водорода, хлора, перманганата калия на катион хрома (3) образуются соли хромовой и дихромовой кислоты. Хроматы желтого цвета образуются в щелочной среде: Cr3++2OH-→CrO2-+2H+ CrO2-+3H2O2+2OH-→2CrO42-+4H2O Дихроматы, имеющие оранжевый цвет, образуются при воздействии окислителей в кислой среде: 10Cr3++6MnO4-+11H2O→5Cr2O72-+6Mn2++22H+ При большом избытке перманганата калия может образовываться бурый осадок дигидроксида оксида марганца (4): KMnO4+3MnSO4+7H2O→5MnO(OH)2↓+2H2SO4+K2SO4 При окислении Cr3+ с персульфатом аммония в кислой среде образуется дихромат ион: 2Cr3++3S2O82-+7H2O→Cr2O72-+6SO42-+14H+ Реакция проходит хорошо в присутствии катализатора – нитрата серебра. При воздействии на образовавшийся дихромат-ион пероксидом водорода образуется пероксид хрома или надхромовая кислота: Cr2O72-+4H2O2+2H+→2CrO5+5H2O Cr2O72-+4H2O2+2H+→2H2CrO6+3H2O Если к реакционной смеси добавить смесь изоамилового спирта с эфиром и взболтать, то верхний слой окрашивается в синий цвет вследствие перехода в спиртоэфирный слой пероксида хрома (надхромовой кислоты). Реакция очень чувствительна и специфична. Реакции катионов цинка Zn2+
ZnCl2+2NH4OH→Zn(OH)2↓+2NH4Cl Zn(OH)2+4NH4OH→[Zn(NH3)4](OH)2+4H2O Раствор гидроксида аммония осаждает белый осадок гидроксида цинка, который растворяется в избытке реактива с образованием комплексного соединения гидроксида тетраминцинка.
3ZnSO4+2K4[Fe(CN)6]→ K2Zn3[Fe(CN)6]2↓+ 3K2SO4 При взаимодействии солей цинка с гексациано(2) ферратом калия образуется белый осадок гексациано(2) феррата калия и цинка. Реакция позволяет отличить катион алюминия от цинка.
При добавлении хлороформного раствора дитизона к водному раствору соли цинка образуется дитизонат цинка, окрашивающий в щелочной среде хлороформный и водный слои в красный цвет.
Zn(NO3)2+Co(NO3)2→CoZnO2+4NO2↑+O2↑ После сжигания кусочка фильтровальной бумаги, смоченной раствором соли цинка и нитрата кобальта образуется зола, окрашенная в зеленый цвет цинкатом кобальта (зелень Ринмана). |
