|
|
химия сессия. Основные понятия химии
41. Степень и константа гидролиза солей.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
Kг=K/Kд(слаб. электролита)
42. Активность и ионная сила растворов. Связь между коэффициентом активности и ионной силой раствора.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе. a=f*c
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. μ= ∑Ci*Zi2 ∑Ci*Zi2
При μ≤0,01 f рассчитывают по уравнению Дебая-Хюккеля: lgf=-0,509Z2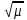
При высоких ионных силах f рассчитывается по формуле Дэвиса:
lgf=Z2[0,2 μ - 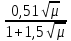 ] ]
43. ОВР. Определение, классификация.
ОВР – реакция, сопровождающаяся перемещением электронов от одних частиц к другим.
Межмолекулярные овр – реакции, протекающие с изменением степени окисления элемента в разных молекулах.
Внутримолекулярные овр – реакции, протекающие с изменением степени окисления разных элементов в одной и той же молекуле. В основном сюда относят реакции термического разложения.
Реакции диспропорционирования (дисмутации) – реакции, протекающие с одновременным увеличением и уменьшением с.о одного и того же элемента.
Реакции конпропорционирования (усреднение с.о) – внутримолекулярная овр, в ходе которой происходит выравнивание с.о атома одного и тго же элемента.
44. Понятие об электродном потенциале.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
45. Электродный потенциал. Уравнение Нернста.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Вывод уравнения Нернста
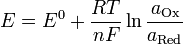 , где , где
E — электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
R— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
T — абсолютная температура;
F — постоянная Фарадея, равная 96485,35 Кл·моль−1;
т — число моль электронов, участвующих в процессе;
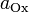 и и 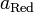 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции. — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при 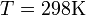 получим получим
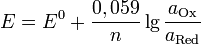
46. Газовые электроды. Уравнение Нернста для расчета потенциалов газовых электродов
Газовые электроды состоят из проводника 1-го рода, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Проводник 1-го рода служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Проводник 1-го рода не должен посылать в раствор собственные ионы. Лучше всего удовлетворяют этому условию платина и платиновые металлы, поэтому они чаще всего используются при создании газовых электродов. Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то электродные потенциалы этих электродов зависят от парциальных давлений газов. Это можно показать на примерах водородного и кислородного электродов. Равновесие на водородном электроде выражается уравнением 2Н++3е↔Н2. Уравнение для расчетов потенциалов водородного электрода можно вывести так же, как было введено уравнение для расчета потенциала металлического электрода. Оно имеет вид: 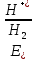 = = 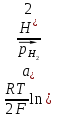 или для 298 К или для 298 К 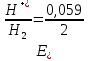 lg lg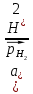
47. Гальванический элемент. Расчет ЭДС гальванического элемента.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ - химический источник тока, в котором лектрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно-восстановительной реакцией. В состав гальванического элемента входят два разнородных электрода (один - содержащий окислитель, другой - восстановитель), контактирующие с электролитом. Различают гальванические элементы одноразового использования (т. н. первичные элементы, напр. Лекланше элемент), многоразового действия (электрические аккумуляторы) и с непрерывной подачей реагентов (топливные элементы). Ранее термин "гальванический элемент" относился только к первичным элементам.
ЭДС гальванического элемента определяется как разность электродных потенциалов.
По уравнению НЕРНСТА
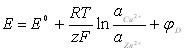
48. Концентрационная и электрохимическая поляризация.
Концентрационная поляризация. Изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока называется концентрационной поляризацией. В свою очередь изменение концентрации реагирующих веществ в приэлектродном слое вызывается замедленностью подвода реагентов к электроду или отвода продуктов реакции от электрода. Так как по уравнению Нернста потенциал электрода пропорционален логарифму активности ионов (в разбавленных растворах-концентрации ионов), то концентрационная поляризация должна быть пропорциональна разности логарифмов активностей (концентраций) ионов в при электродном слое аs и в объеме раствора av:
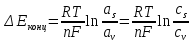
Электрохимическая поляризация. Изменение потенциала, обусловленное замедленностью собственно электрохимических стадий реакций, называется электрохимической поляризацией. Крупный вклад в разработку теории замедленной электрохимической стадии разряда внес российский ученый А.Н.Фрумкин. Замедленность электрохимических стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая больше или равна энергии активации.
49. Электролиз. Законы Фарадея.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений[источник не указан 1303 дня], диоксида марганца[2], пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Примеры Расплавы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): Na+ + 1e = Na0
A"анод"(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2.Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
2) Менее активные металлы
Точно так же
3) Неактивные металлы
Точно так же Растворы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): 2H2O + 2e = H2 + 2OH−
A"анод"(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl + 2H2O(электролиз) → H2 + Cl2 +2NaOH
2.Соль активного металла и кислородсодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
Вывод: 2H2O (электролиз) → 2H2 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2H2O (электролиз) → 2H2 + O2
Законы Фарадея
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
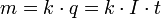
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности k называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
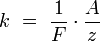
где F — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
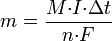
где M — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль; I — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; dt— время, в течение которого проводился электролиз, с; F — постоянная Фарадея, Кл·моль−1; n — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
50. Электролиз. Выход по току. Электролиз с нерастворимым и растворимым анодами.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Выходом по току в гальванотехнике называют выраженное в процентах отношение количества фактически пропущенного через электролит заряда (Qf) к теоретически необходимому (Qt) для осуществления фактически наблюдаемого массопереноса (mf).
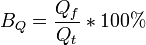
Иногда выход по току рассчитывается как отношение массы при фактическом массопереносе mf к теоретическому массопереносу mt, рассчитанному по закону Фарадея:
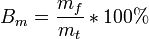
Для случая осаждения массы на электроде выход по току оказывается всегда выше 1. Для случая растворения материала электрода выход по току оказывается всегда ниже 1.
Выход по току связан с электрохимическим эквивалентом.
Электролиз с нерастворимым и растворимым анодами.
Если потенциал металлического анода имеет более отрицательное значение, чем потенциал окисления ионов ОН- или других веществ, присутствующих в растворе, в газовой фазе около электрода или на электроде, то происходит растворение металла. При этом протекает процесс с растворимым анодом. Если потенциал металлического анода близок к потенциалу других электродных процессов, то наряду с растворением металла на аноде протекают также другие процессы, например, разряд ионов ОН-.
При электролизе с нерастворимым анодом на электроде может окисляться или ион ОН-, или другие ионы, или недиссоциированные молекулы восстановителей, присутствующие в растворе.
|
|
|
 Скачать 128.3 Kb.
Скачать 128.3 Kb.