химия сессия. Основные понятия химии
 Скачать 128.3 Kb. Скачать 128.3 Kb.
|
|
26. Скорость химической реакции. Закон действующих масс. Химическая кинетика – раздел химии, изучающий скорость химических реакций и механизм протекания химических реакций. Скорость химической реакции – количество благоприятных столкновений частиц в единицу времени. По характеру взаимодействия реагирующих веществ различают: А) Гомогенные реакции – реакции, протекающие по всему объёму системы, т.к. отсутствует граничная поверхность раздела фаз, реагенты находятся в одном фазовом состоянии. Vгом=Δс/Δt=Δν/VΔt [моль/л*с] Б) Гетерогенные реакции – реакции, в которых реагенты находятся в разных фазовых состояниях, т.к. присутствует поверхность раздела фаз. Vгет=Δν/Δt*S [моль/с*м2] По механизму протекания различают: А) Простые реакции – реакции, протекающие в одну стадию (элементарные). Б) Сложные реакции – реакции, протекающие в несколько стадий, скорость такой реакции будет определяться самой медленной (лимитирующей) стадией. Закон действующих масс: скорость элементарной гомогенной реакции прямо пропорциональна произведению молярных концентраций реагентов в степени их стехиометрических коэффициентов. nA + mB = cD V=k*cn(A)*cm(B) 27. Скорость химической реакции и факторы, влияющие на неё. Скорость химической реакции – количество благоприятных столкновений частиц в единицу времени. Влияние концентрация реагентов Чтобы осуществля лось химическое взаимодействие веществ А и В, их молекулы (части цы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной за кон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ: Скорость химической реакции пропорциональна произведению концентра ций реагирующих веществ. Для реакции ( I ) этот закон выразится уравнением v = kcA cB , (1) где сА и сВ - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс. Из уравнения (1) нетрудно установить физический смысл константы скорости k: она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ сос тавляют 1 моль/л или когда их произведение равно единице. Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций. Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ. Влияние температуры. Зависимость скорости реакции от температу ры определяется правилом Вант-Гоффа: При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза. Математически эта зависимость выражается соотношением vt 2 = vt 1 γ , где vt 1 , vt 2 - скорости реакции соответственно при начальной ( t 1 ) и конечной ( t 2 ) температурах, а γ - температурный коэффициент скоро сти реакции, который показывает, во сколько раз увеличивается ско рость реакции с повышением температуры реагирующих веществ на 10°. Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реак ции. Температура влияет на скорость химической реакции, увеличивая константу скорости. Влияние катализатора. Катализатор – вещество, изменяющее скорость химической реакции, но не вступающее в химическое взаимодействие и выводящееся в конце реакции в чистом виде. Процесс ускорения реакции в присутствии катализатора называют катализом, процесс замедления – ингибированием. 28. Уравнение Аррениуса. Понятие об энергии активации. lnk=lnA-Ea/2.3RT Энергия активации – минимальная энергия, которой должны обладать частицы, чтобы вступить в химическое взаимодействие. 29. Уравнение Аррениуса. Энергия активации, её физический смысл. lnk=lnA-Ea/2.3RT Энергия активации – минимальная энергия, которой должны обладать частицы, чтобы вступить в химическое взаимодействие. Рассмотрим физический смысл энергии активации. При теоретическом обосновании своего закона Аррениус исходил из предположения, что не все столкновения между молекулами приводят к их химическому взаимодействию. Число столкновений, испытываемых каждой молекулой газа в обычных условиях, очень велико. Однако химические реакции протекают не мгновенно, а с конечными скоростями. Это обстоятельство свидетельствует о том, что к химическому взаимодействию приводит лишь небольшая часть всех столкновений. Рассмотрим физический смысл энергии активации. Можно сказать, что эффективными оказываются лишь столкновения между такими молекулами, которые в момент столкновения обладают некоторым избытком внутренней энергии по сравнению со средней (для данной температуры) величиной. 30. Катализаторы. Гомогенный и гетерогенный катализ. Катализатор – вещество, изменяющее скорость химической реакции, но не вступающее в химическое взаимодействие и выводящееся в конце реакции в чистом виде. Процесс ускорения реакции в присутствии катализатора называют катализом, процесс замедления – ингибированием. Гомогенный катализ – реагирующие вещества и катализатор находятся в одном фазовом состоянии. Гетерогенный катализ – газообразные или жидкие исходные вещества взаимодействуют на поверхности твердого катализатора. 31. Обратимые и необратимые реакции. Химическое равновесие. Обратимые реакции – реакции, протекающие одновременно в двух противоположных направлениях. Необратимые реакции – реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ. Химическое равновесие – состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая–обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. 32. Химическое равновесие. Принцип Ле–Шателье. Химическое равновесие – состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая–обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. Принцип Ле–Шателье: если на систему, находящуюся в состоянии равновесия, оказывают внешнее воздействие, то равновесие смещается в направлении ослабления внешнего воздействия. 33. Принцип Ле–Шателье. Условия сдвига химического равновесия. Принцип Ле–Шателье: если на систему, находящуюся в состоянии равновесия, оказывают внешнее воздействие, то равновесие смещается в направлении ослабления внешнего воздействия. Факторы, влияющие на химическое равновесие: 1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. CaCO3=CaO+CO2 -Q t↑ →, t↓ ← N2+3H2↔2NH3 +Q t↑ ←, t↓ → 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся. CaCO3=CaO+CO2 P↑ ←, P↓ → 1моль=1моль+1моль 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации продуктов реакции - в сторону исходных веществ. S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ← Катализаторы не влияют на смещение химического равновесия! 34. Коллигативные свойства растворов. Коллигативные свойства растворов — это те свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения. Четыре свойства разбавленных растворов нелетучего вещества в летучем растворителе традиционно объединяются под названием коллигативных свойств: Понижение давления пара растворителя. Повышение температуры кипения растворителя. Понижение температуры замерзания растворителя. Явление осмотического давления. Эти свойства называются коллигативными (что означает коллективными) потому, что они зависят от количества имеющихся молекул или ионов растворенного вещества, а не от природы растворенных частиц. Уравнения, описывающие коллигативные свойства, выведены из условия, что частицы в растворе не взаимодействуют между собой, то есть ведут себя аналогично идеальным газам. Строго говоря, свойствами идеального раствора не обладает ни один реальный раствор. Но большинство реальных растворов при малых значениях концентраций растворенного вещества практически ведут себя как идеальные, и уравнения, описывающие коллигативные свойства, достаточно точны для большинства разбавленных растворов. Зависимость коллигативных свойств растворов от природы растворителя выражается в криоскопической и эбуллиоскопической константах, индивидуальных для каждого растворителя. 35. Законы Рауля. Температуры кипения и замерзания растворов. Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя. 1 закон Рауля: Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе: p = p0 · χр-ль, где p — давление пара над раствором, ПА; p0 — давление пара над чистым растворителем; χр-ль — мольная доля растворителя. 2 закон Рауля: повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть, ΔTкип/зам= Kэб/кр · mв-ва, где Kэб/кр — соответственно эбуллиоскопическая (от лат. ebullire — «кипеть» и др. греч. σκοπέω — «наблюдаю») и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя; mв-ва — моляльность вещества в растворе. Температура кипения, точка кипения — температура, при которой происходит кипение жидкости, находящейся под постоянным давлением. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как сама жидкость всегда несколько перегрета относительно температуры кипения. Температура замерзания – температура, при которой давление пара над жидкостью становится равным над давлением твердой фазы. 36. Осмос и осмотическое давление. Диффузия – процесс взаимного проникновения молекул. Осмос – процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества Осмотическое давление – давление, которое необходимо приложить к раствору, чтобы прекратить осмос. πV=nRT π=nRT/V π=cRT Закон Вант-Гофф: осмотическое давление прямо пропорционально концентрации растворенного вещества. 37. Растворение газов в жидкостях. Закон Генри. На растворимость веществ влияют температура и давление. Их влияние на равновесие в растворе подчиняется принципу Ле-Шателье. Растворимость газов сопровождается: А) выделением теплоты (ΔH<0), т.к. происходит сольватация молекул. С увеличением температуры равновесие смещается в сторону эндотермической реакции, следовательно, растворимость понижается. Б) уменьшением объёма системы => при увеличении давления растворимость увеличивается. В) Растворимость газов подчиняется закону Генри: при постоянной температуре растворимость газов пропорциональна его давлению. c= k*pk – константа Генри [моль/мПа] 38. Степень и константа электролитической диссоциации. Закон разведения Оствальда. Электролитическая диссоциация – распад молекулы на ионы под действием полярных молекул растворителя. Э.д. подразумевает ионную проводимость раствора. Степень э.д. – величина, равная отношению числа распавшихся на ионы молекул к общему числу молекул электролита. α=(n/N)*100% cдис=α*cобщ По значению α электролиты классифицируются следующим образом: Слабые – α<3%, присутствуют как ионы, так и молекулы Средней силы – 3%< α<30%, присутствуют как ионы, так и молекулы Сильные – α >30%, в растворе только ионы. Если α=1 – протекает процесс полной э.д. Если α=0 – процесс не протекает Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Kд=ПКИ(эл.-та)/с(мол. эл.-та) ПКИ – произведение концентраций ионов К.д. имеет смысл только для растворов слабых электролитов Закон разбавления Оствальда: с уменьшением концентрации электролитов степень э.д. увеличивается. Kд=с* α2 => α= 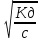 39. Ионное произведение воды. Водородный показатель среды. Ионное произведение воды – величина, равная произведению катионов водорода и гидроксид ионов есть величина постоянная при данной температуре (25°с) и равна 10-14. Kw=[H+][OH-]=10-14 Водородный показатель – мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм активности водородных ионов, выраженной в молях на литр. Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−: 40. Электролитическая диссоциация воды. Водородный показатель среды Вода – слабый амфотерный электролит. Молекулы воды могут как отдавать, так и присоединять катионыH+. В результате взаимодействия между молекулами в водных растворах всегда присутствует ионы OH- и H+, точнее катионы оксония Н3О+: Н2О+Н2О Н3О++ОН- или проще Н2О Н++ОН- Количественно диссоциация воды описывается константой диссоциации  при 250С при 250СЭлектролитическая диссоциация воды в жидком состоянии происходит самопроизвольно. Теплота электролитической диссоциации Н2О - НОН - равна 57150 дж / моль. Водородный показатель – мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм активности водородных ионов, выраженной в молях на литр. Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−: pH + pOH = 14 |
