Раева_Фролкова_Н_2013_end. Основные законы равновесия жидкость пар бинарных систем
 Скачать 1.12 Mb. Скачать 1.12 Mb.
|
|
Министерство образования и науки Российской Федерации Московский государственный университет тонких химических технологий имени М. В. Ломоносова Кафедра химии и технологии основного органического синтеза Раева В.М., Фролкова А.В. ОСНОВНЫЕ ЗАКОНЫ РАВНОВЕСИЯ ЖИДКОСТЬ – ПАР БИНАРНЫХ СИСТЕМ Учебное пособие Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В. Ломоносова в качестве учебного пособия для студентов, проходящих обучение по направлению 240100 «Химическая технология», дисциплина «Теория химико-технологических процессов органического синтеза» Москва Издательство МИТХТ 2013 УДК: 544.344.2:544.015.34 ББК 24.5 Рецензент: проф., д.х.н. Флид В.Р., к.т.н. Илларионов В.В. Рекомендовано к изданию кафедрой химии и технологии основного органического синтеза МИТХТ (протокол заседания кафедры № 12 от 03.07. 2013). План 2013 г. (поз. № 156/13). Раева В.М., Фролкова А.В. Основные законы равновесия жидкость – пар бинарных систем. Учебное пособие. М.: МИТХТ. им. М.В. Ломоносова, 2013. - 40 с. Рассмотрены основные законы фазового равновесия жидкость – пар бинарных систем. Для студентов, проходящих обучение по направлению 240100 «Химическая технология», дисциплина «Теория химико-технологических процессов органического синтеза». УДК: 544.344.2:544.015.34 ББК 24.5 Раева В.М., Фролкова А.В., 2013 МИТХТ им. М. В. Ломоносова, 2013 СОДЕРЖАНИЕ
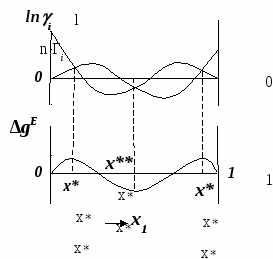
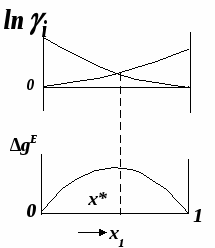
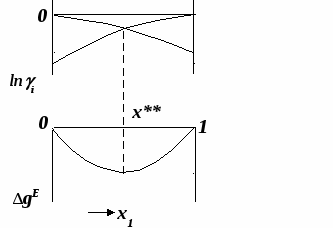
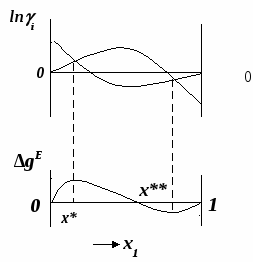
ВВЕДЕНИЕПервым этапом при разработке принципиальных технологических схем разделения многокомпонентных смесей в технологиях органических веществ является анализ физикохимических особенностей поведения систем, в том числе и при варьировании внешних условий (температура, давление). При наличии ограничений термодинамического характера на возможность разделения смесей на практически чистые компоненты или фракции заданного состава применяют специальные методы ректификации, ориентированные на принцип перераспределения полей концентраций между областями разделения. Основным массообменным процессом в непрерывных крупнотоннажных производствах основного органического и нефтехимического синтеза является ректификация. Движущая сила данного процесса различие равновесных составов паровой и жидкой фаз. Ректификационное разделение определяется спецификой парожидкостного равновесия, законы которого для бинарных систем рассмотрены в данном пособии. Уравнение Ван-де-Вааальса – Сторонкина является развернутой формой выражения условий равновесия между фазами. На его основе можно получить законы Коновалова и Вревского, определяющие характер изменения составов фаз гетерогенных равновесных систем при варьировании составов фаз и условий. В учебном пособии рассмотрены бинарные системы. Для них возможно наглядное представление фазовых диаграмм, известна математическая моделью фазового равновесия, имеются массивы экспериментальных данных для анализа и сравнения поведения систем различных классов и при различных условиях, достаточно проста Экспериментальные данные бинарных систем непосредственно используются для моделирования фазовых равновесий многокомпонентных систем. Для расчетов процесса ректификации используются фазовые равновесия жидкость-пар и жидкость-жидкость-пар. 1. Фазовые равновесия бинарных систем 1.1. Основные понятия Фазовое равновесие – это сосуществование термодинамически равновесных фаз гетерогенной системы, которое определяется равенством температуры всех частей системы (термическое равновесие), равенством давления во всем объеме системы (механическое равновесие) и равенством химических потенциалов компонентов (химическое равновесие) во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами: Компоненты – химически индивидуальные вещества, из которых состоит термодинамическая система. В однокомпонентных системах фазы представлены разными агрегатными состояниями вещества. В многокомпонентных системах фазы имеют различный состав и свойства, агрегатное состояние фаз может быть различным или одинаковым. Термодинамическая фаза – однородная по термодинамическим свойствам часть системы, отделенная от других фаз поверхностями раздела, на которых при фазовых переходах скачкообразно меняются некоторые экстенсивные свойства системы. Фаза является гомогенной частью гетерогенной системы. Число степеней свободы системы, находящейся в состоянии термодинамического равновесия, определяется правилом фаз Гиббса: Фазовые диаграммы графически отображают состояния равновесной системы в пространстве термодинамических переменных, например: температуры, давления и состава. Число фаз в бинарных системах может быть различно. Состояние двухфазной бинарной системы жидкость пар ( а) б) в) 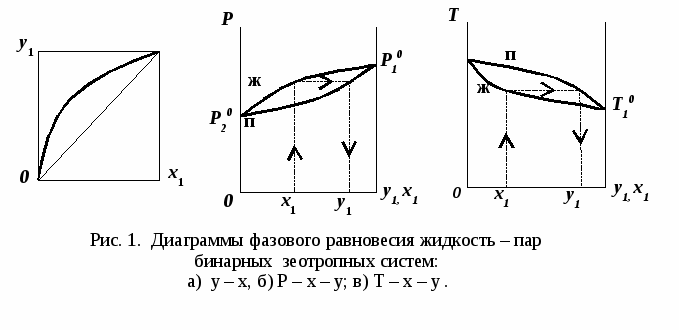 T20 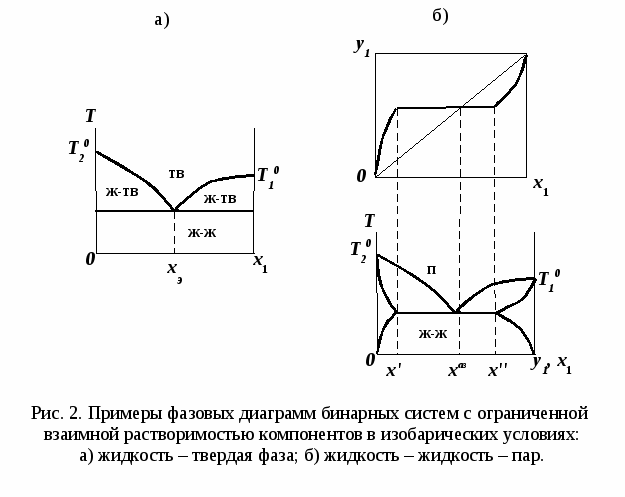 Фазовые равновесия жидкость – жидкость и жидкость – твердое тело экспериментально исследуют при постоянном давлении, в качестве независимых переменных выступают состав и температура (рис. 2). Состояние трехфаз- ной бинарной системы жидкость жидкость – пар в области расслаивания ( На рис. 2 представлены наиболее распространенные примеры фазовых диаграмм жидкость – твердая фаза и жидкость – жидкость – пар. Их полные множества включают большее число типов. На рис. 3 приведены более сложные диаграммы бинарных расслаивающихся систем. Здесь x' ,x'' – составы равновесных жидких фаз. 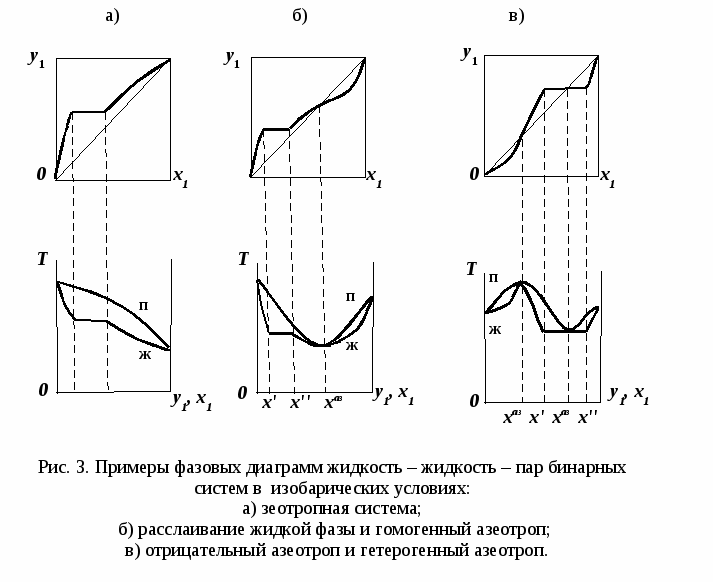 0 x' x'' Диапазоны условий, в которых изучают фазовые равновесия, ограничены критическими точками. Это предельные точки на кривых равновесия фаз, в окрестностях которых фазовое равновесие нарушается, происходит потеря термодинамической устойчивости и фазы становятся неразличимыми. Условие устойчивости фазы приведено ниже: 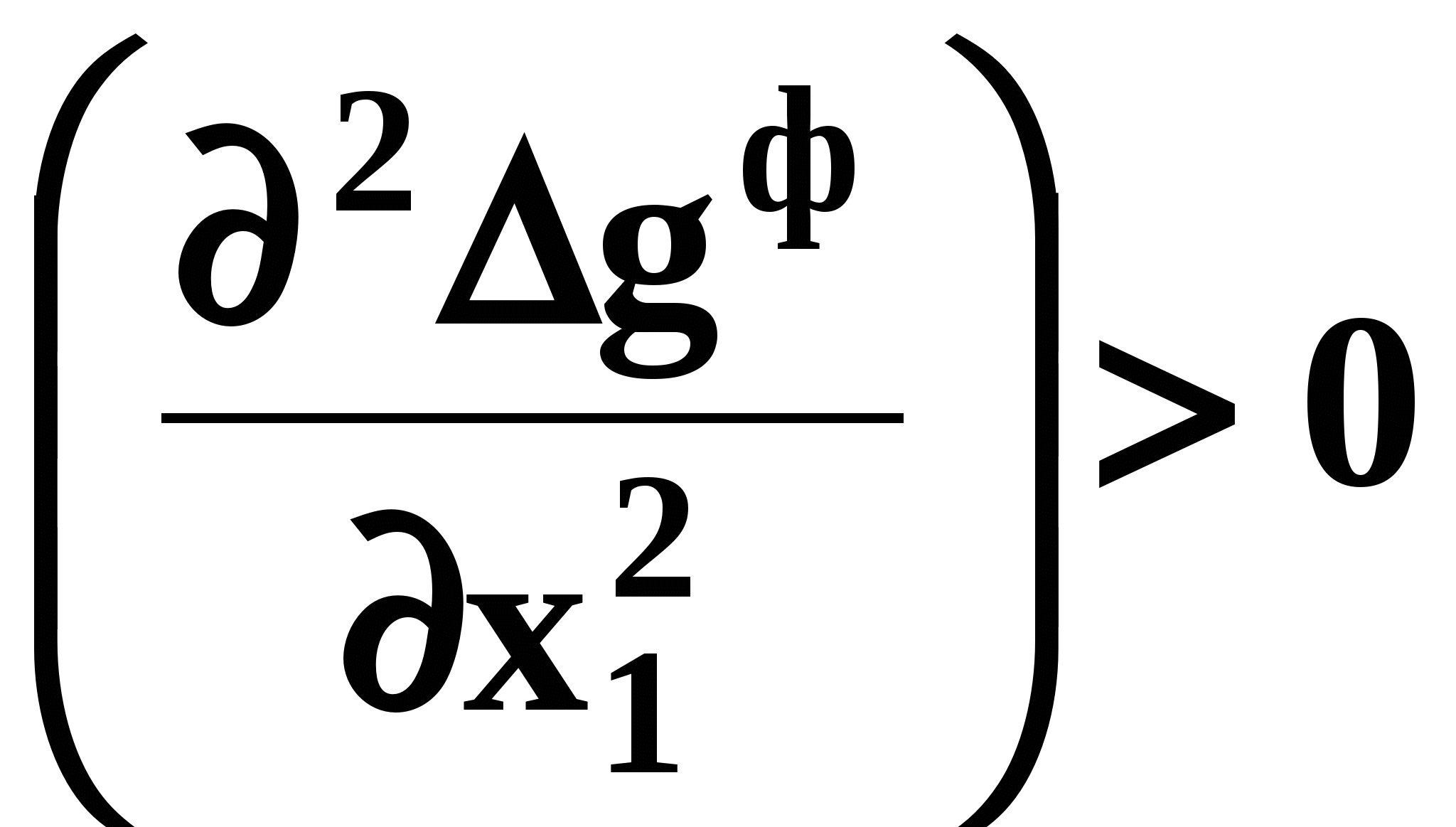 . (3) . (3)Критическая точка фазового равновесии жидкость – пар является конечной точкой на кривой испарения и характеризуется критическими значениями температуры Тс, давления Рс и объема Vc. Фазовый переход твердая фаза – жидкость характеризуется критической температурой плавления. Парожидкостное равновесие существует в диапазоне условий (Р, Т), ограниченном этими критическими точками. На рис. 4 приведены диаграммы фазового равновесия жидкость – жидкость. Линии, соединяющие составы равновесных фаз (x' ,x''), называются нодами жидкость-жидкость. Бинодаль – линия составов равновесных жидких фаз, отделяющая расслаивающуюся часть диаграммы от гомогенной (рис. 4). В большинстве бинарных систем взаимная растворимость компонентов увеличивается при повышении температуры (рис. 4а). В верхней критической точке растворимости (ВКТР) жидкие фазы становятся неразличимыми, при дальнейшем повышении Т смесь является гомогенной. В системах с нижней критической точкой растворимости (НКТР) увеличение температуры приводит к уменьшению взаимной растворимости (рис. 4б). Смеси с двумя критическими точками растворимости встречаются значительно реже (рис. 4в). Данные фазовых равновесий жидкость – пар (гомогенная жидкая фаза) и жидкость – жидкость – пар (ограниченная взаимная растворимость компонентов) используются для расчетов ректификации бинарных смесей. Диаграммы 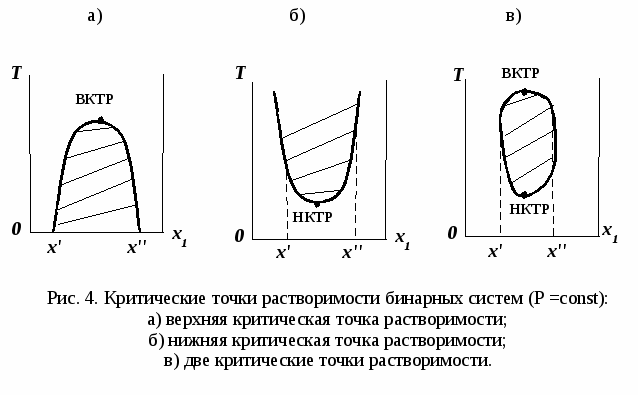 Диаграммы жидкость – жидкость необходимы при разработке экстрак жидкость – жидкость необходимы при разработке экстракционного разделения и комплексов, сочетающих ректификацию и расслаивание жидкой фазы. Диаграммы жидкость – твердая фаза необходимы при разработке комплексов разделения бинарных смесей, сочетающих ректификацию и кристаллизацию. 1.2. Характеристики бинарных систем Бинарные жидкие растворы могут быть классифицированы по характеру и интенсивности межмолекулярных взаимодействий (ММВ) между компонентами в фазах и отклонениям фаз от идеального поведения, по избыточным термодинамическим функциям, а также по наличию или отсутствию расслаивания жидкой фазы (гомогенные и гетерогенные смеси) и др. Степень неидеальности жидкой фазы определяется ММВ в растворе. Принято считать, что при одинаковой интенсивности ММВ между одноименными и разноименными молекулами Бинарные неидеальные растворы характеризуются различными отклонениями от идеального поведения, которые находят отражение в избыточных термодинамических функциях. Функциями смешения фМв термодинамике называют разности между значениями термодинамических функций в образованном растворе (фр) и аддитивными значениями, определяемыми из величин для чистых компонентов при постоянных давлении и температуре: 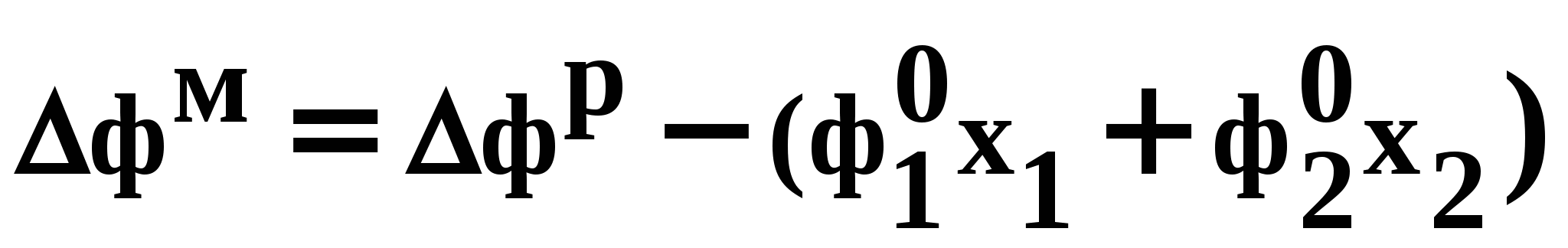 . (4) . (4)Избыточные термодинамические функции – разность между функциями смешения реального и идеального растворов: 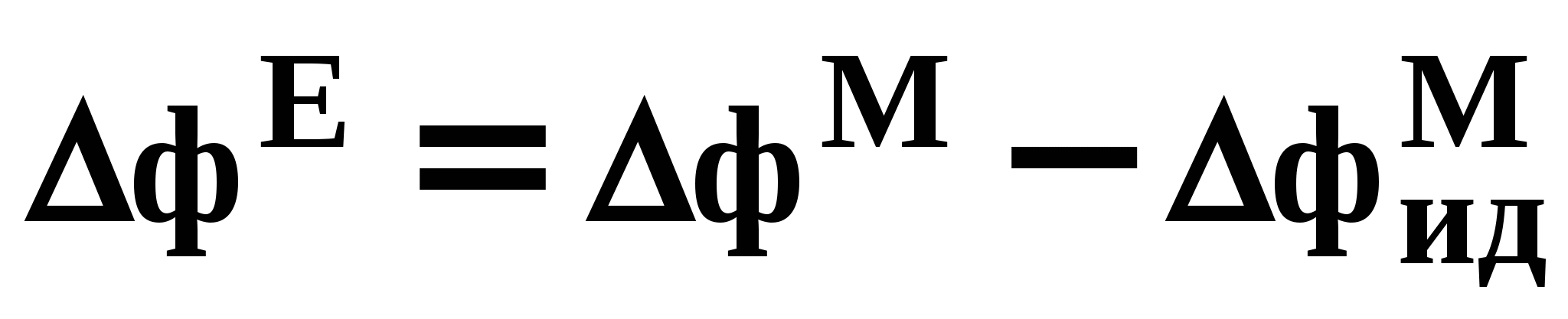 . (5) . (5)Идеальные растворы характеризуются нулевыми значениями всех избыточных термодинамических функций: На рис. 5 приведены примеры концентрационных зависимостей избыточных функций бинарных гомогенных растворов, связанных при P=const и T=const термодинамическим соотношением: Данные состав – избыточное термодинамическое свойство для бинарных растворов регулярно публикуются в специальной и справочной литературе. В подавляющем большинстве случаев они приводятся для атмосферного давления. Компоненты с ограниченной взаимной растворимостью образуют расслаивающиеся смеси (рис. 6). Условие появления критической точки (7) означает, что в области расслаивания 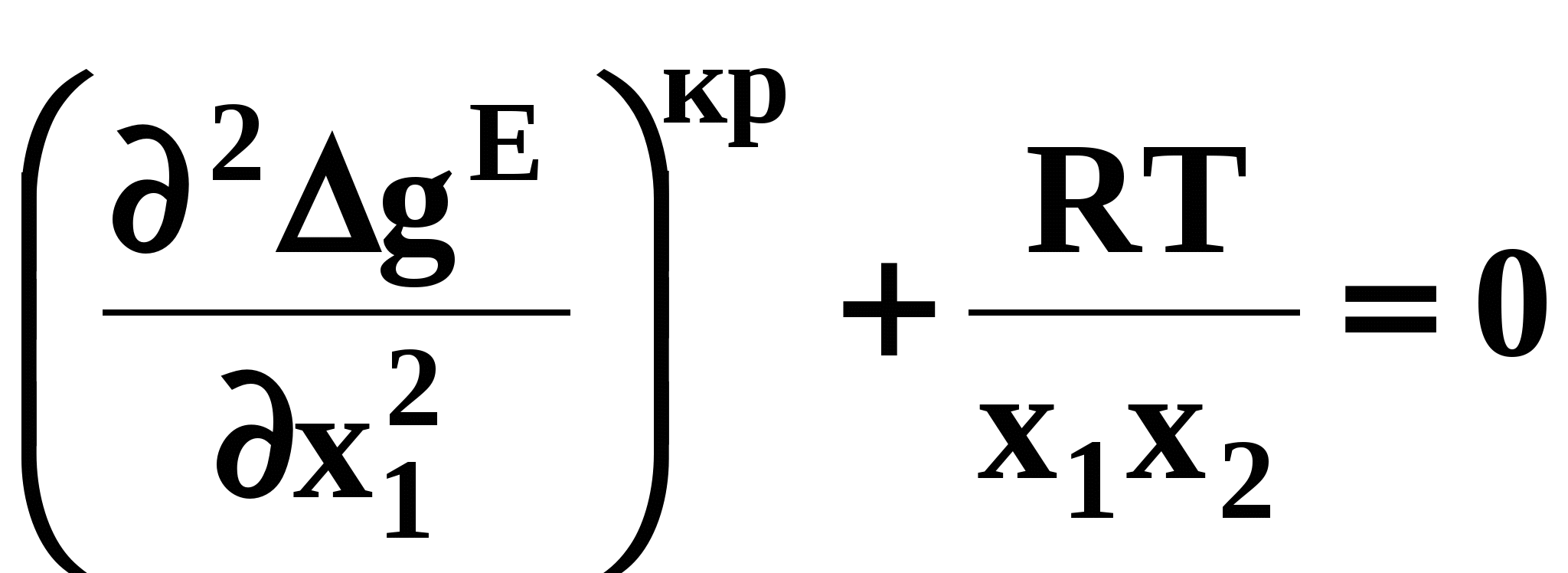 или или 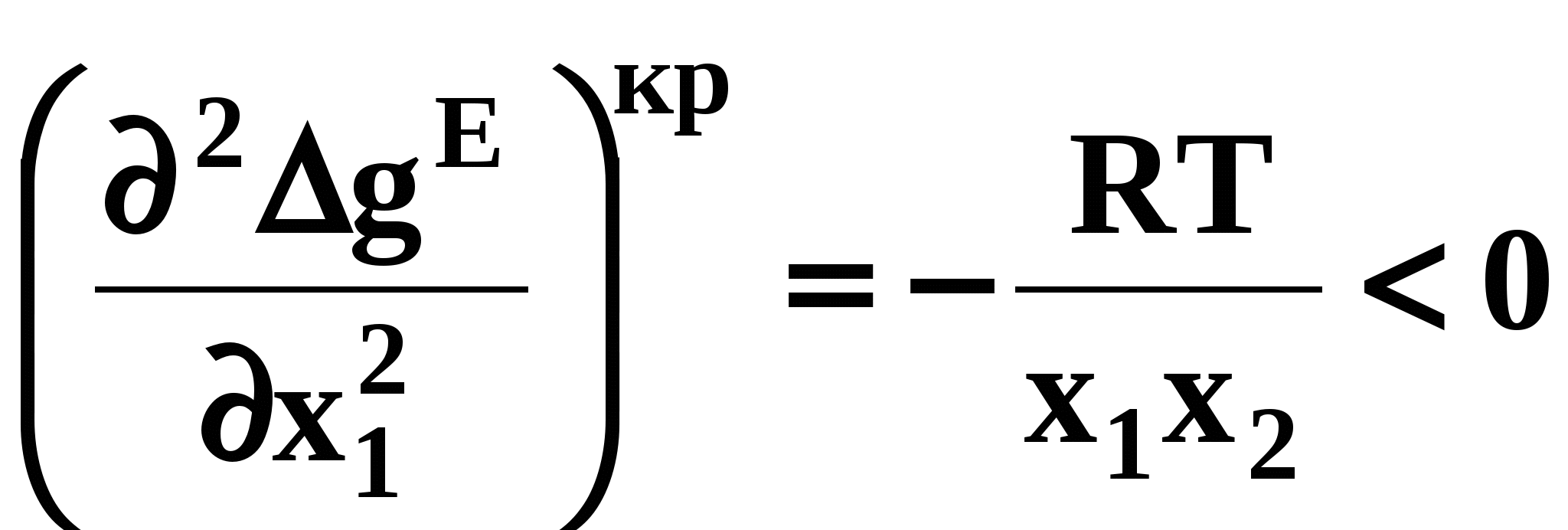 . (7) . (7)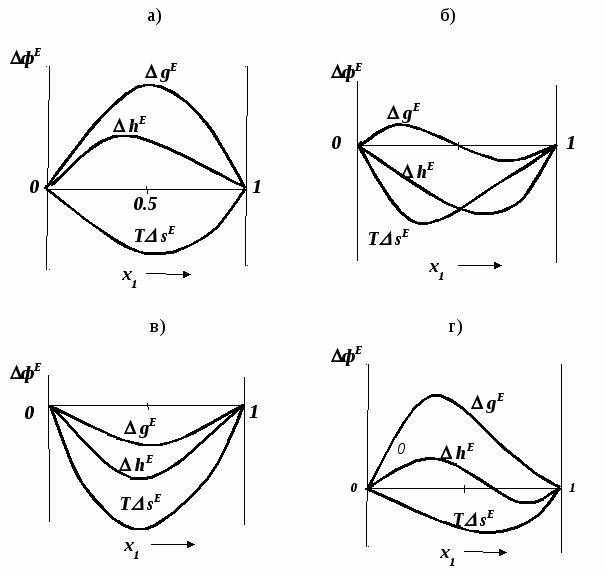 Рис. 5. Примеры концентрационных зависимостей избыточных термодинамических функций бинарных гомогенных растворов. Условие (7) может быть выражено в терминах избыточных энтальпии и энтропии для верхней критической точки растворимости (рис. 4а, 6а, б) в виде: 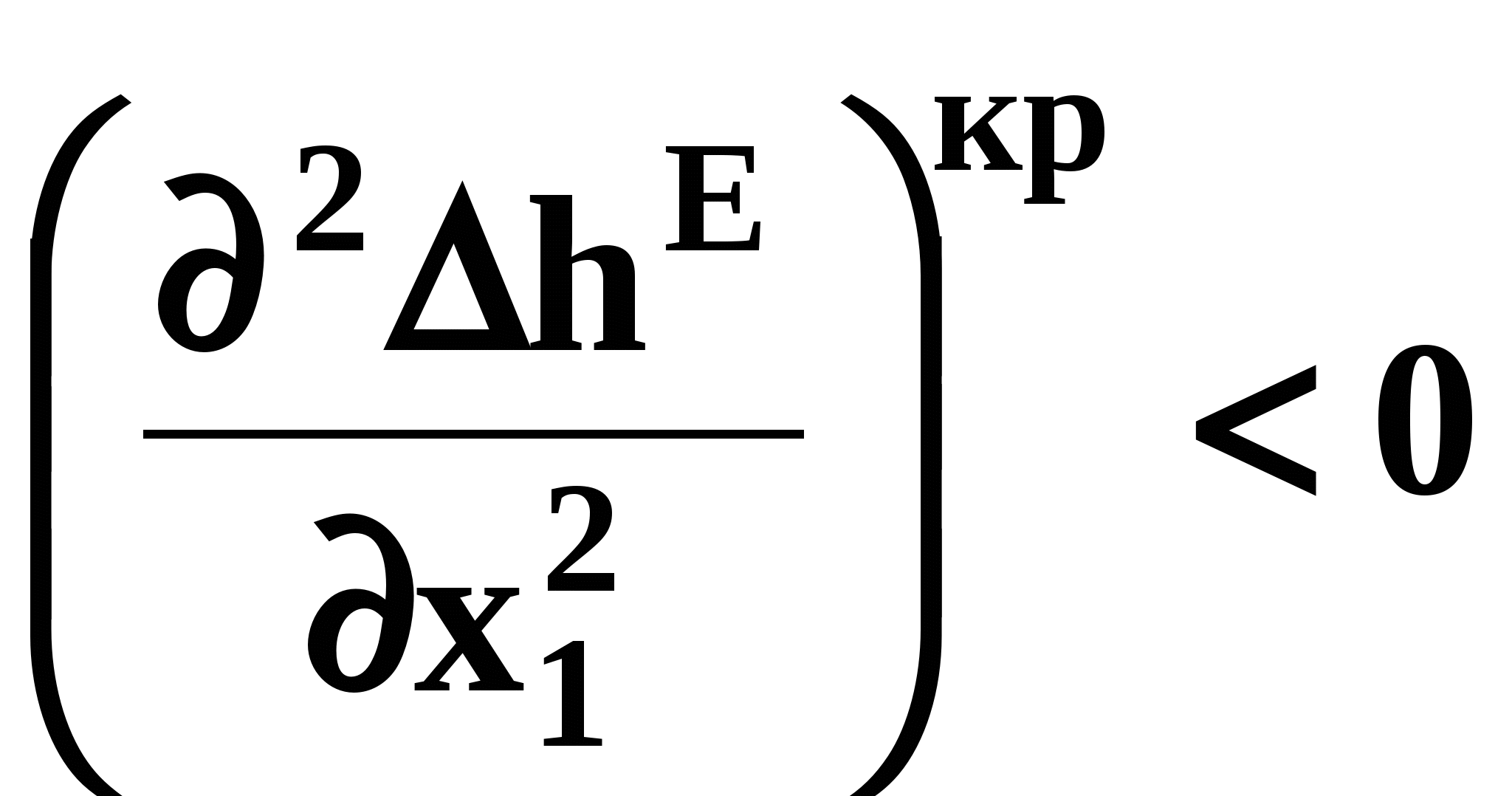 , , 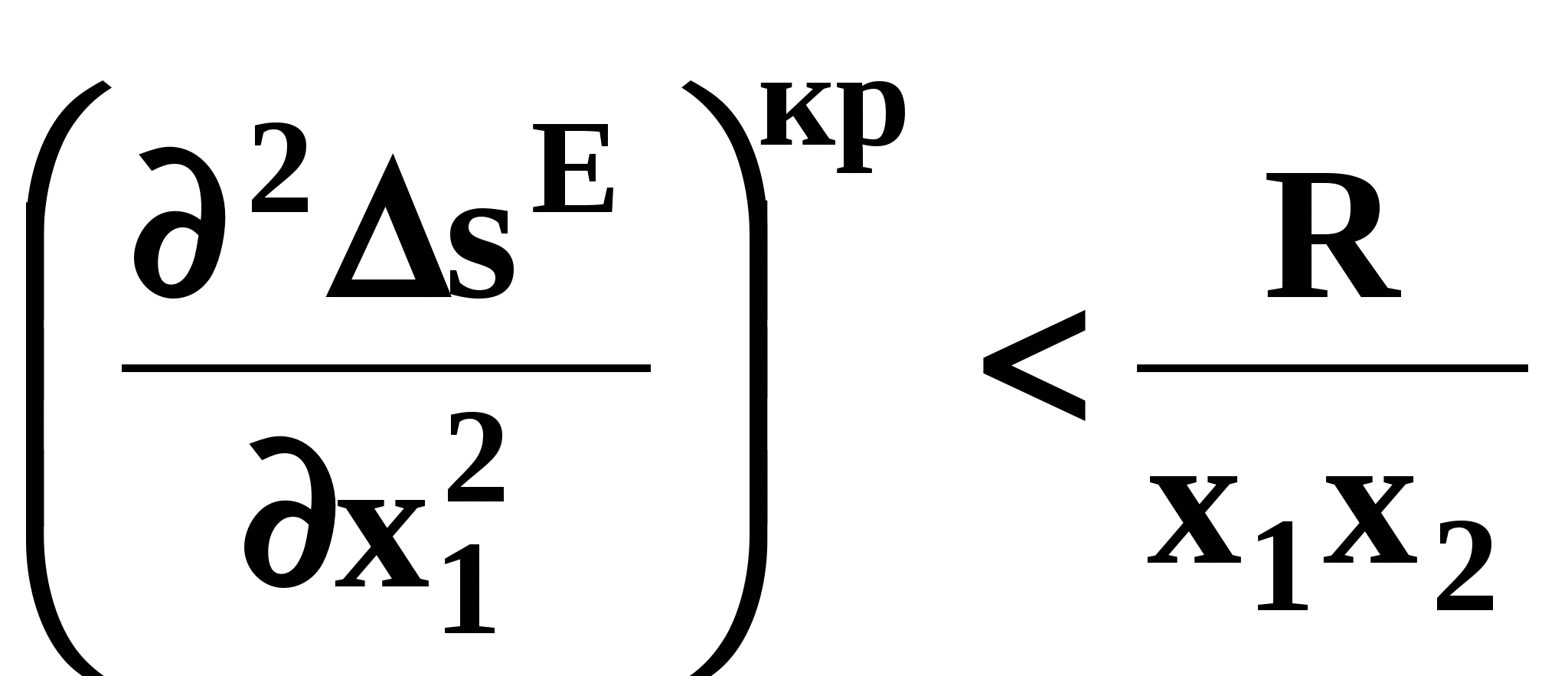 . (8) . (8)В области расслаивания избыточная энтропия может принимать как положительные, так и отрицательные значения, а величина избыточной энтальпии в таких системах должна быть строго положительной. При реализации НКТР (рис. 4б, 6в) выполняются следующие условия: 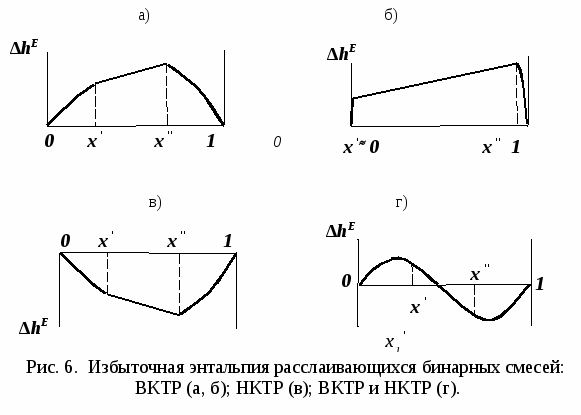 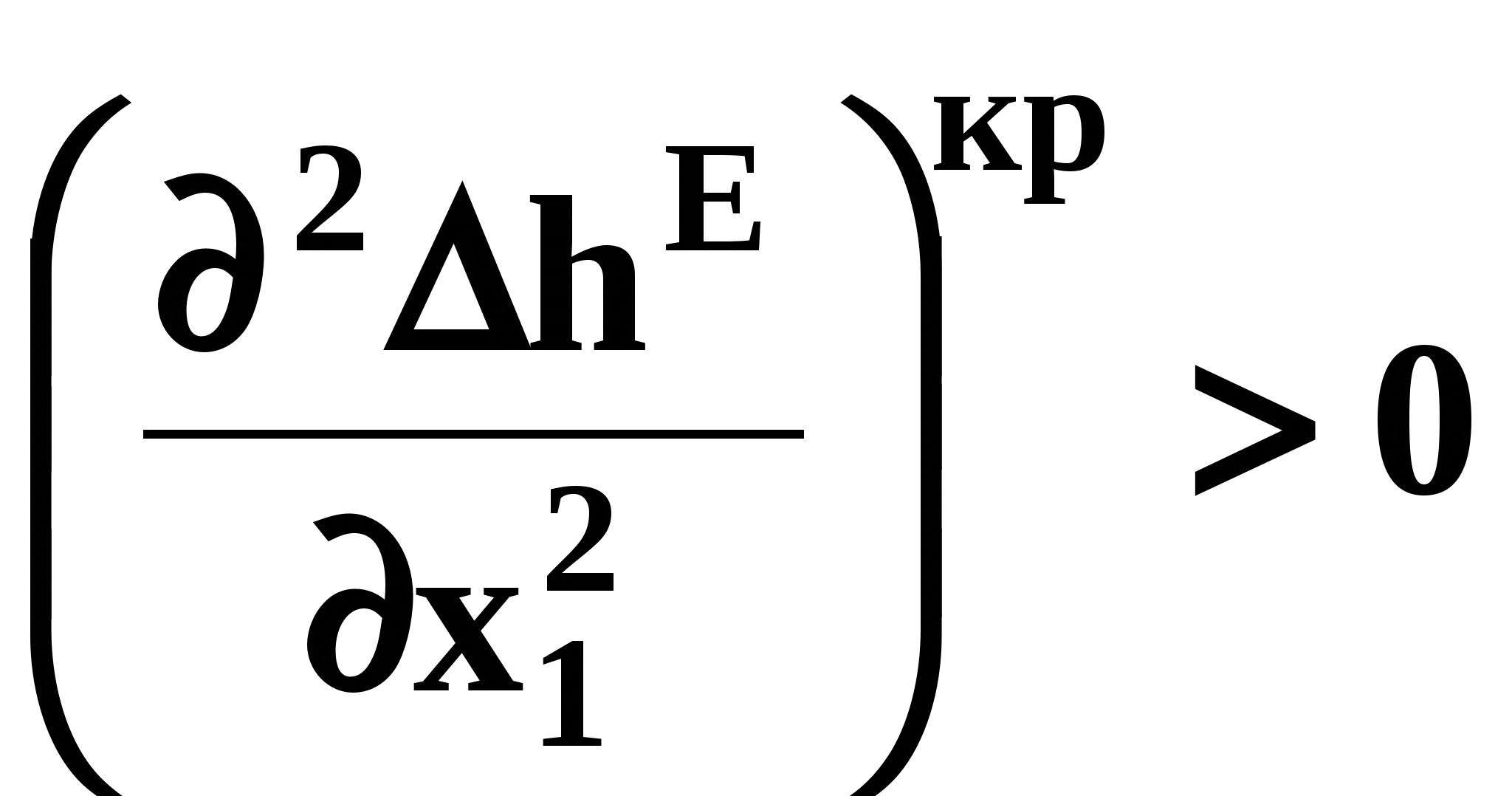 , , 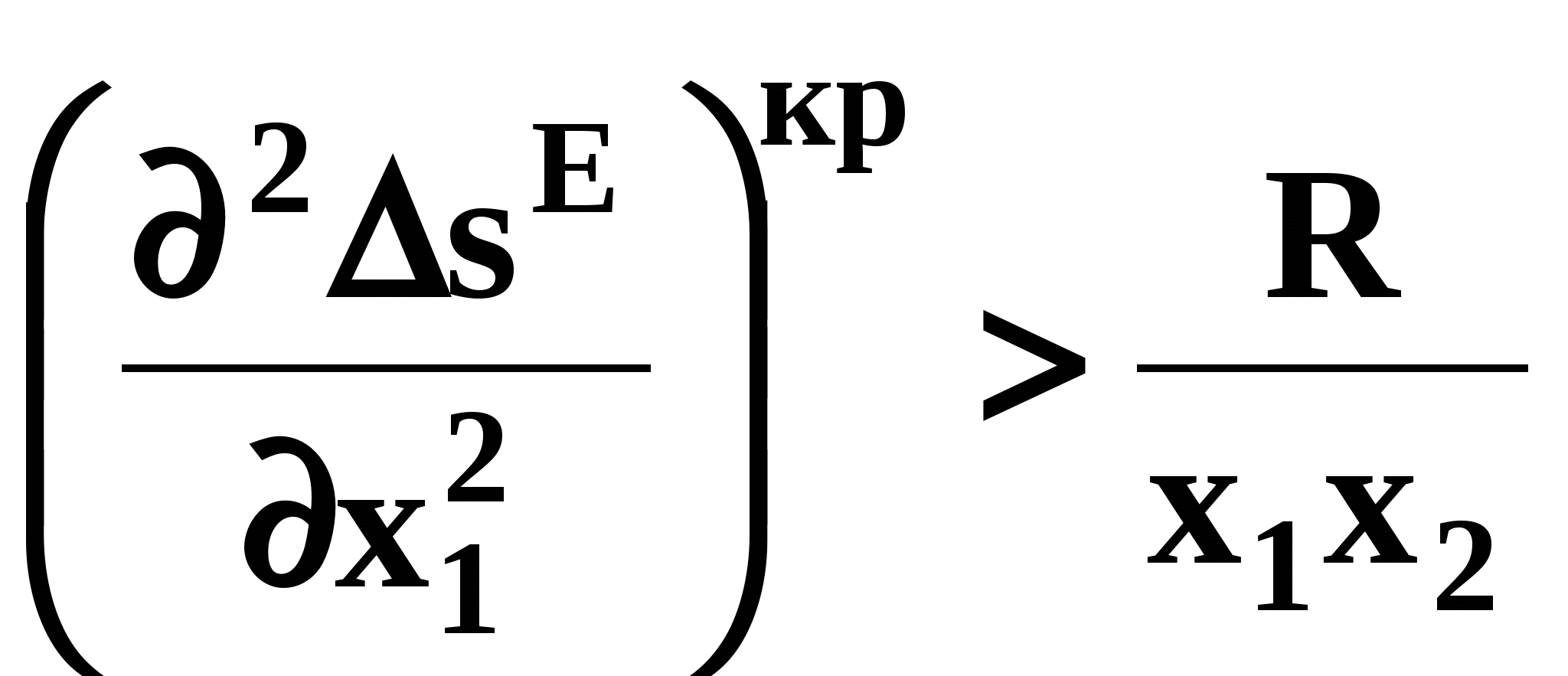 . (9) . (9)Знаки обеих избыточных функций здесь строго отрицательны. Системы с двумя критическими точками растворимости (рис. 4в) характеризуются знакопеременными концентрационными зависимостями избыточной энтальпии (рис. 6г). Смеси идеальных газов представляют собой идеальные газовые растворы. Поведение реальных газов описывают различными уравнениями состояния, в которых характер и степень отклонения от идеального поведения учитываются коэффициентами 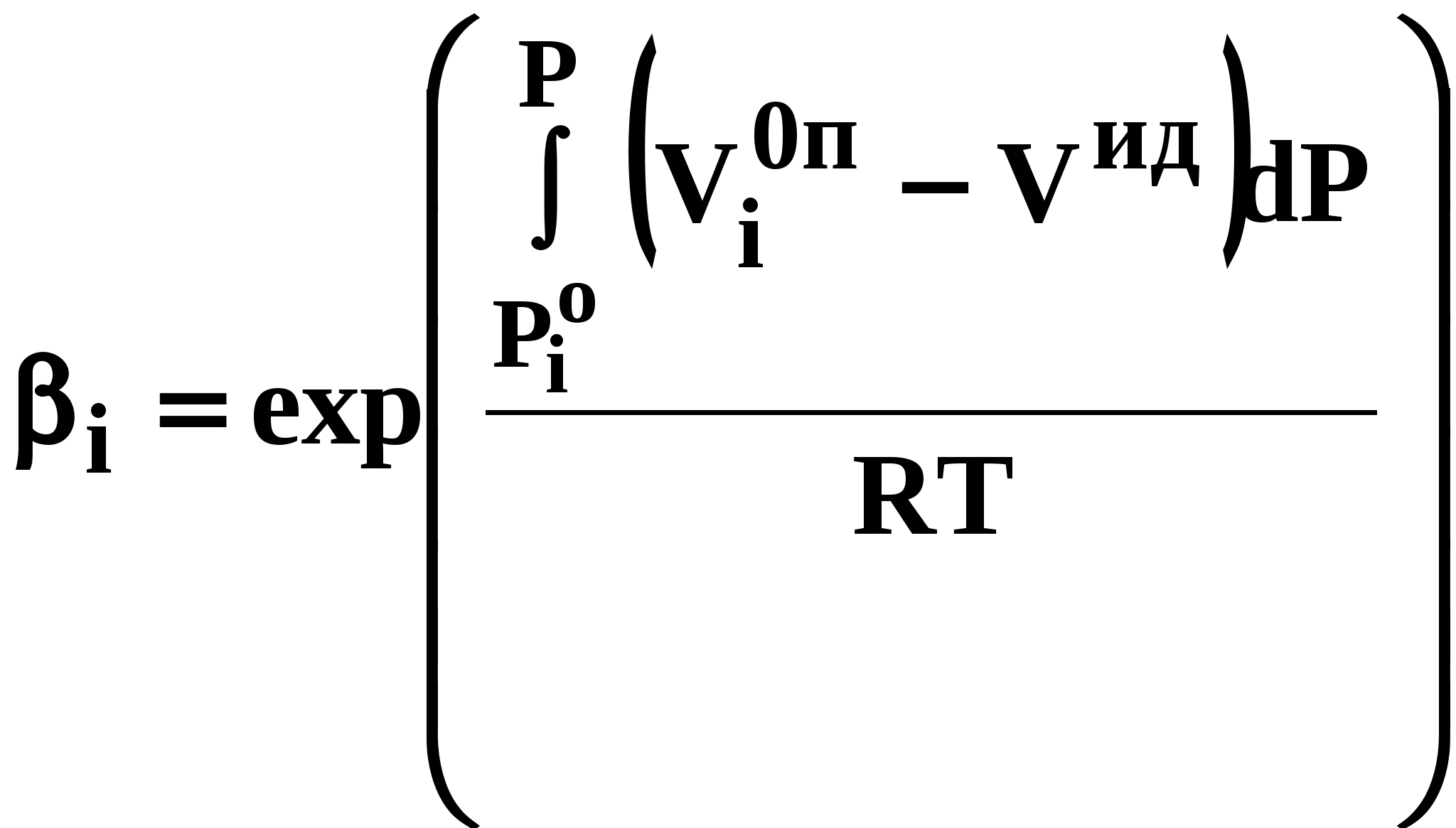 . .Здесь Vi0п – объем реального газа (паровой фазы), Vид – объем идеального газа. В условиях фазового равновесия жидкость – пар одновременно рассматриваются обе фазы системы. Условие (10) записано для компонента, условие (11) – для бинарной системы: Здесь Парожидкостное равновесие идеальной системы (жидкая фаза – идеальный раствор Характер отклонения жидкой фазы от идеального поведения качественно и количественно определяется избыточной энергией Гиббса бинарного раствора (рис. 7): Коэффициенты активности компонентов в жидкой фазе могут быть определены из экспериментальных данных: - паровая фаза неидеальна ( - паровая фаза идеальна ( или рассчитываются с использованием математической модели парожидкостного равновесия. Допущение об идеальном поведении паровой фазы реальной системы ( Точки экстремумов концентрационных зависимостей избыточной энергии Гиббса, в которых выполняется условие (15):
называются псевдоидеальными (рис. 7): х* расположены в области Относительная летучесть компонентов бинарной системы определяется следующим образом: Для случая идеального поведения паровой фазы (14б) имеем: 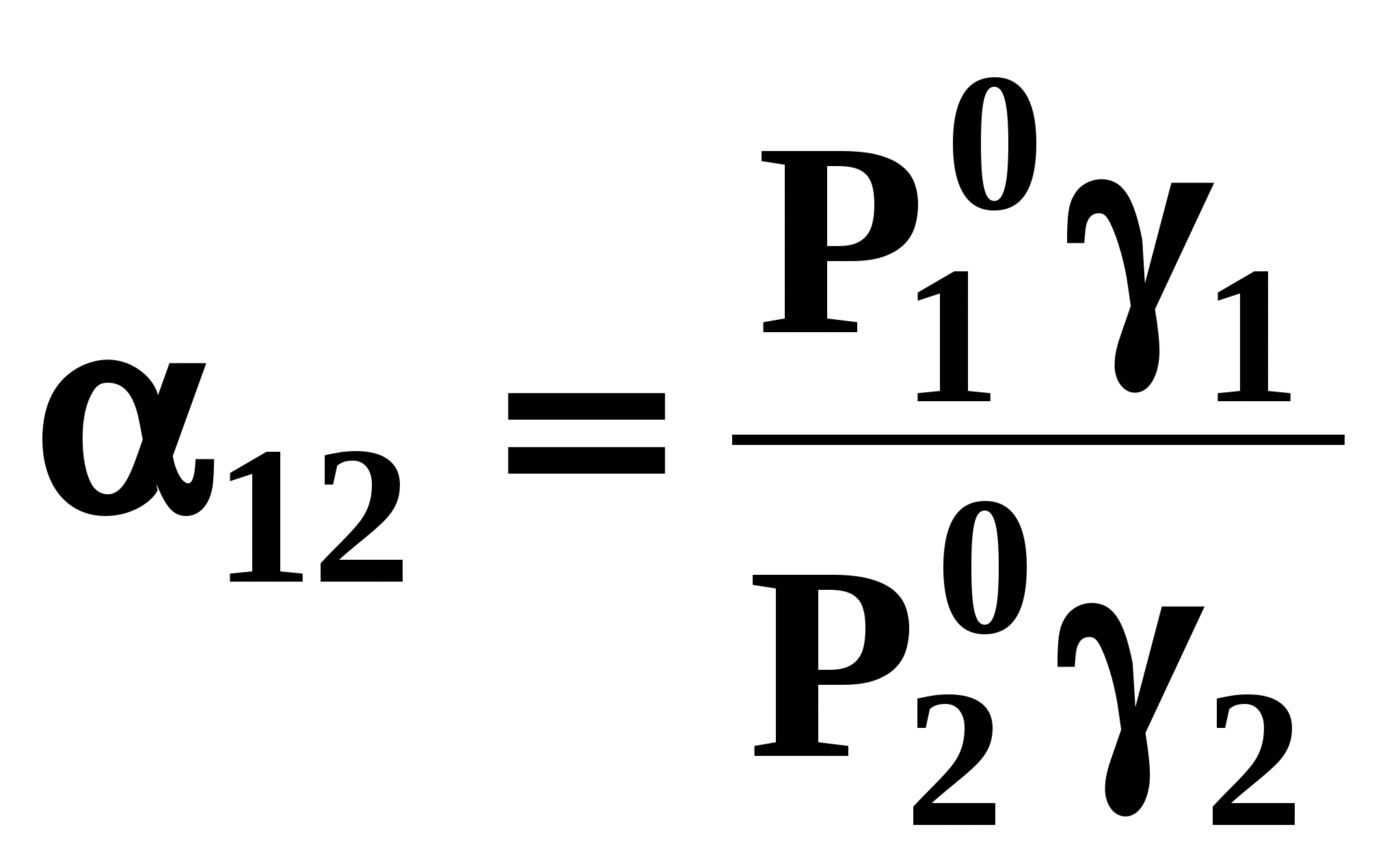 . (17) . (17)В случае идеального аналога (смеси) для любого состава 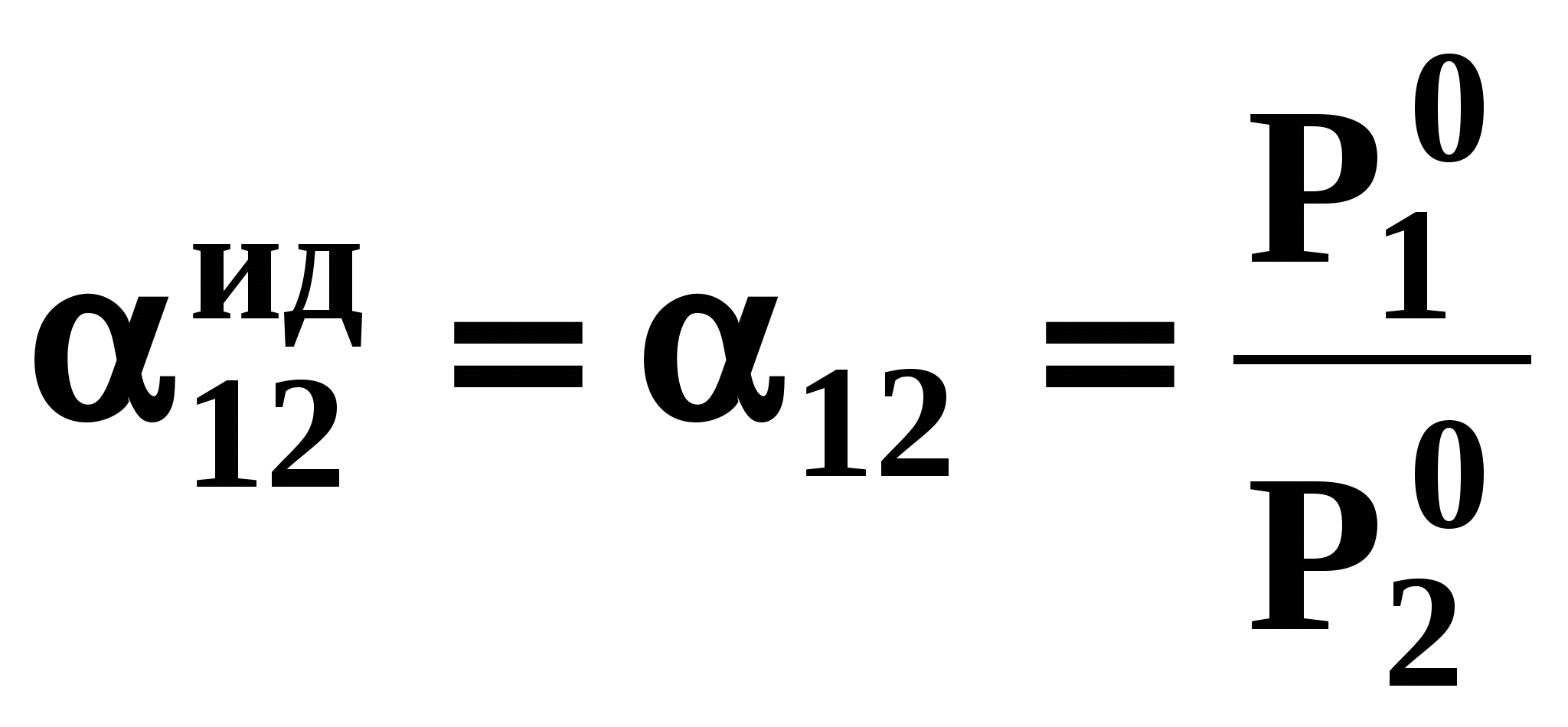 , (18) , (18)которое выполняется также в псевдоидеальных точках (15) реальных (неидеальных) систем (рис. 8, 9). При неидеальном поведении системы На рис. 8 и 9 сплошные линии соответствуют реальным кривым фазового равновесия, пунктирные – их идеальным аналогам, хаз – точки азеотропов, в которых равны составы паровой и жидкой фаз. 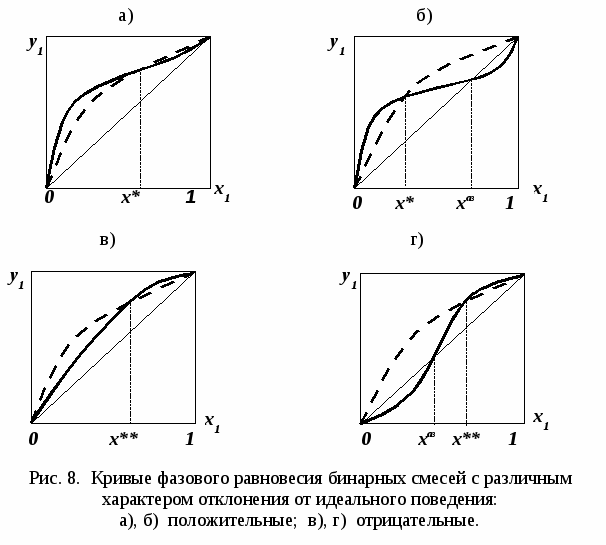 Как будет показано ниже (раздел 3), псевдоидеальные точки играют важную роль при исследовании эволюции бинарных азотропов под воздействием температуры (давления). 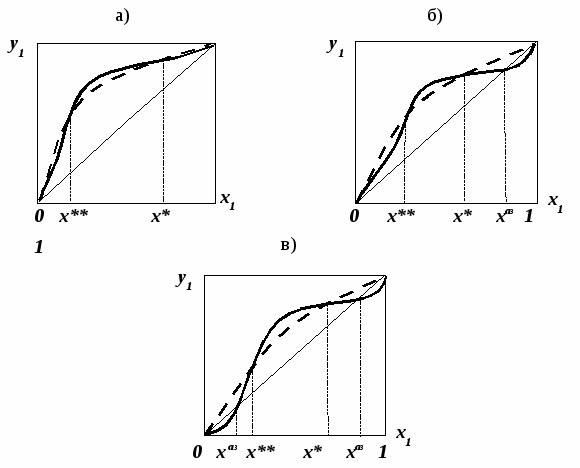 Рис. 9. Примеры кривых фазового равновесия бинарных систем со смешанными отклонениями от идеального поведения: а) зеотропная система; б) моноазеотропная система; в) биазеотропная система. 2. Фазовое равновесие жидкость – пар бинарных систем 2.1. Основное уравнение фазового равновесия бинарных двухфазных систем Для бинарных двухфазных систем уравнение фазового равновесия получено Ван-дер-Ваальсом. Вывод уравнений фазового равновесия жидкость-пар базируется на выражении разности нулевых потенциалов ( Уравнения нулевого потенциала фаз: Уравнения функции Гиббса фаз: Из уравнений (20) с учетом а) а) В общем уравнение парожидкостного равновесия бинарной системы для процесса испарения (фазовый переход жидкость пар) можно записать следующим образом: где множители при дифференциалах температуры и и давления энтропийный и объемный эффекты фазового перехода жидкость пар при образовании 1 моля паровой фазы из бесконечно большого количества жидкой фазы: Здесь и далее необходимо помнить, что производные берутся при постоянных Т и Р. Соответственно, для процесса конденсации (фазовый переход пар жидкость) уравнение равновесия запишем в следующем виде: где Отметим, что фазовые эффекты рассмотренных переходов имеют разные знаки, при этом В случае однокомпонентных систем все концентрационные слагаемые в выражении (23) исчезают, и оно переходит в известное уравнение Клаузиуса-Клапейрона: в котором При идеальном поведении паровой фазы и условии Уравнения Ван-дер-Ваальса содержит информацию о растворе и фазовых переходах и является полной математической моделью фазового равновесия, что позволяет использовать его для математического вывода основных законов ПЖР. Ниже приведены частные формы уравнения Ван-дер-Ваальса для фазового перехода жидкость пар в бинарной системе. Выражение (23) в изотермических условиях (dТ = 0) преобразуется к виду: В изобарических условиях (dP = 0), следовательно: Соответственно, в изотермо-изобарических условиях имеем: Используя уравнения Ван-дер-Ваальса и его частные формы для равновесия жидкость–пар бинарной системы, дадим математическую интерпретацию известных законов Коновалова и Вревского [1]. |

 )
) )
) )
)