Определение теплоты диссоциации слабой кислоты отчет. Lab1 отчет. Отчет по лабораторной работе 1 По дисциплине Термодинамика и кинетика
 Скачать 207.45 Kb. Скачать 207.45 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И высшего ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра физической химии Отчет по лабораторной работе №1 По дисциплине: Термодинамика и кинетика (наименование учебной дисциплины согласно учебному плану) Тема: Определение интегральной теплоты растворения соли и теплоты гидратообразования Автор: студент гр. ГНГ-21-2 ______________ Анненкова М.А. (подпись) (Ф.И.О.) Автор: студент гр. ГНГ-21-2 ______________ Дмитровская Д.П. (подпись) (Ф.И.О.) ОЦЕНКА: _____________ Дата: _________ 2023 г. ПРОВЕРИЛ _______ _____________ /______________/ (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2023 год Цель работы: Определение теплового эффекта процессов растворения соли и гидратообразования. Оборудование и реактивы: Стеклянный стакан объемом 500 мл – 1 шт. Фарфоровый или стеклянный внешний стакан объемом 750 мл – 1 шт. Стеклянная палочка для перемешивания – 1 шт. Кристаллизатор – 1 шт. Штатив с лапками – 1 шт. Термометр Бекмана – 1 шт. Мерный цилиндр объемом 100 мл (для определения объема ртутного баллона термометра Бекмана) – 1 шт. Мерный цилиндр объемом 500 мл – 1 шт. Секундомер – 1 шт. Весы лабораторные – 1 шт. Безводная соль (сульфат меди, никеля или магния). Кристаллогидрат этой соли. Краткое теоретическое содержание Гидратообразование — это процесс, возникающий при падениях температуры и давления, что влечет за собой уменьшение упругости водяных паров и влагоёмкости газа, а, вследствие чего - образование гидратов. Гидраты представляют собой белые кристаллы, похожие на снегообразную кристаллическую массу. Кристаллогидраты состоят из одной или нескольких молекул газа (метан, этан и т.д.) и нескольких молекул воды. Количество энергии, выделяемое или поглощаемое системой в ходе реакции (при Т = const и p = const), отнесённое к количеству молей вещества, указанному в уравнении реакции, называется тепловым эффектом реакции (Q, кДж). Химические реакции, протекающие с выделением теплоты в окружающую среду, называются экзотермическими (Q> 0). Химические реакции, протекающие с поглощением теплоты из окружающей среды, называются эндотермическими (Q< 0). В термодинамике изменение энергетического состояния системы описывается величиной энтальпии Н, изменение которой равно ∆Н = Нкон - Нисх, где Нкон – конечное, а Нисх – исходное энергетическое состояние системы. Положительное значение ∆Н получается в том случае, когда Нкон > Нисх, т.е. когда система поглощает энергию в ходе процесса (эндотермический процесс). В случае, когда система выделяет энергию (экзотермический процесс), т.е. когда Нкон < Нисх, ∆Н имеет отрицательное значение. Соответственно: ∆Н = -Q. Стандартной теплотой (энтальпией) образования сложного вещества называется количество энергии (теплоты), выделяемое или поглощаемое при образовании одного моля сложного вещества из простых при стандартных условиях (p = 105Па, T = 298 K). Значения стандартных энтальпий образования веществ приведены в справочниках. Стандартные энтальпии образования простых веществ (O2, C, Na, Cl2 и др.), устойчивых при стандартных условиях, условно приняты равными нулю. Закон Лавуазье-Лапласа: тепловые эффекты прямой и обратной реакции (изменение энтальпий) численно равны, но противоположны по знаку. Закон Гесса: тепловой эффект химической реакции не зависит от того, протекает ли реакция в одну или несколько стадий, а определяется только начальным и конечным состоянием реагирующих веществ. Следствие 1 из закона Гесса: сумма энтальпий двух или более промежуточных стадий при переходе от исходного состояния к конечному состоянию равна энтальпии реакции, которая непосредственно ведёт от исходного к конечному состоянию системы. Следствие 2 из закона Гесса: тепловой эффект реакции (изменение энтальпии) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учётом стехиометрических количеств всех веществ и их агрегатных состояний. Содержание протокола лабораторной работы
Обработка результатов эксперимента Таблица 1. Зависимость изменения температуры (Т, ◦Б) от времени (t, сек) при опыте с безводной солью.
 ΔT=0,82 ⁰Б 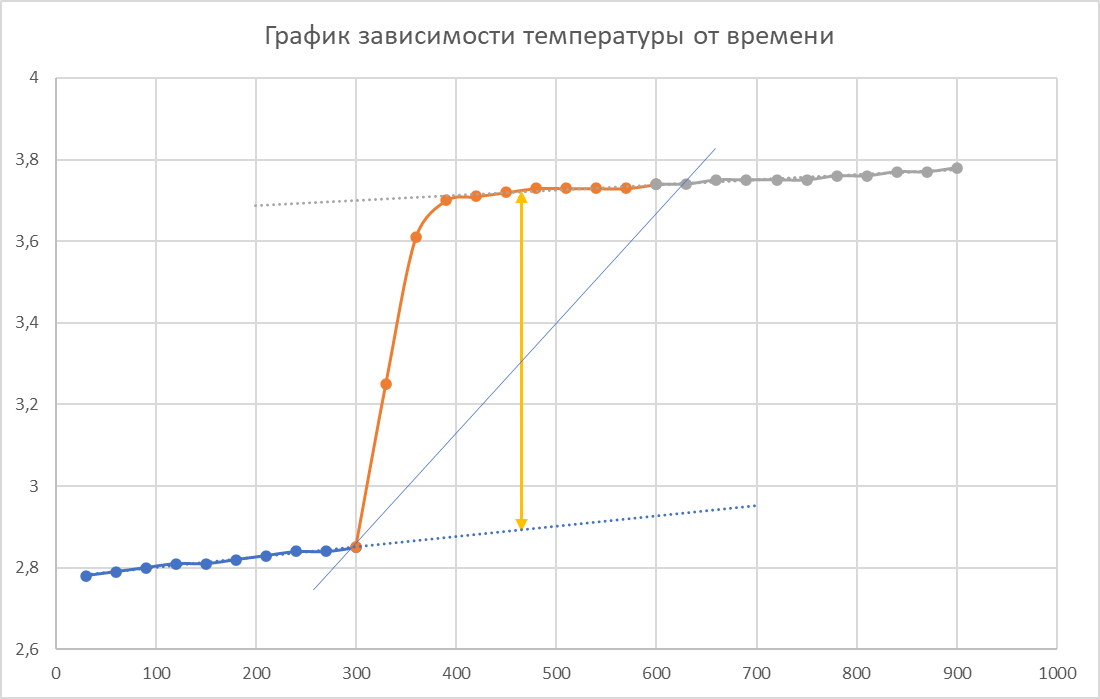 Рисунок 1. График зависимости температуры от времени в опыте с безводной солью. Таблица 2. Зависимость изменения температуры (Т, ◦Б) от времени (t, сек) при опыте с кристаллогидратом.
 ΔT=0,17 ⁰Б 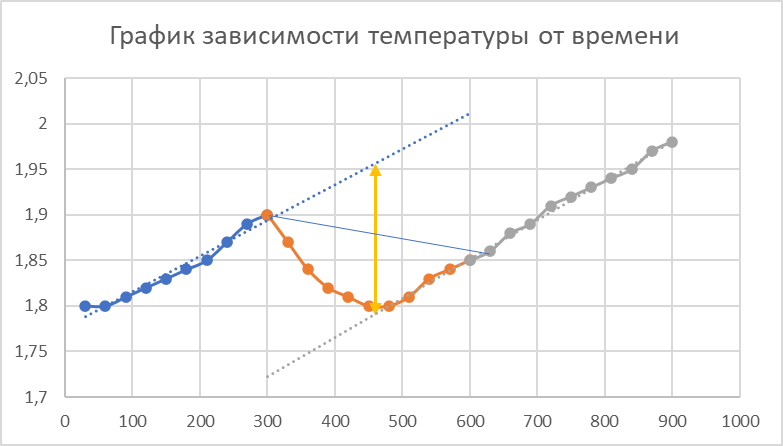 Рисунок 2. График зависимости температуры от времени в опыте с кристаллогидратом. Расчёт теплоёмкости калориметрической установки 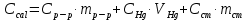 Дж/К, где Дж/К, гдеCр-р – удельная теплоёмкость раствора, 4,18 Дж/г∙К; mр-р – масса раствора во внутреннем стакане, 300 г; CHg – объёмная теплоёмкость ртути и стекла, 1,92 Дж/см3∙К; VHg – объём баллона термометра, содержащего ртуть, 4 мл; Cст – удельная теплоёмкость стекла, 0,79 Дж/г∙К; mст – общая масса стеклянных частей калориметрической установки, 124,5 г; 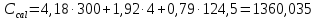 Дж/К Дж/КВычисление интегральной теплоты растворения безводной соли и кристаллогидрата 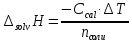 Дж/моль Дж/мольnсоли- количество вещества соли (безводной или кристаллогидрата), моль; 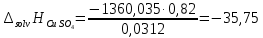 кДж/моль кДж/моль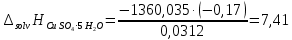 кДж/моль кДж/мольВычисление теплового эффекта процесса гидратации 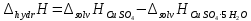 Дж/моль Дж/моль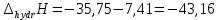 кДж/моль кДж/мольВычисление относительной инструментальной ошибки 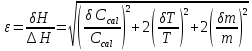 δCcal – относительная погрешность расчётного определения теплоёмкости системы, 0,03 Дж/К; δT – погрешность определения температуры (цена деления термометра Бекмана), 0,005⁰Б; δm – техническая характеристика весов, 0,01 г. 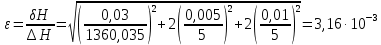 Вычисление абсолютной погрешности измерения теплового эффекта  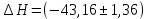 кДж/моль кДж/мольВывод: в ходе лабораторной работы опытным путём были измерены зависимости изменения температуры от времени растворения безводной соли сульфата меди и её кристаллогидрата. По полученным данным посчитаны значения энтальпий реакций растворения соли и её кристаллогидрата в дистиллированной воде, а также рассчитана теплота гидратообразования, которая составила 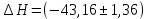 кДж/моль с учётом погрешности, что указывает на экзотермический характер изучаемого явления (т.к. -43,16 < 0, значит, процесс происходил с выделением энергии из внешней среды). кДж/моль с учётом погрешности, что указывает на экзотермический характер изучаемого явления (т.к. -43,16 < 0, значит, процесс происходил с выделением энергии из внешней среды). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
