Лабораторные работы. Отчет по лабораторной работе по физике студент Группа
 Скачать 0.67 Mb. Скачать 0.67 Mb.
|
|
Серия Лаймана n=1, k=2,3,4,5, - ультрафиолетовая область. Серия Бальмера n=2, k=3, 4, 5, - видимая область спектра. Серия Пашена n=3, k=4, 5, 6, - инфракрасная область спектра. На схеме (рис. 1) стрелками показаны переходы электрона с верхних уровней на нижние. Длина стрелок пропорциональна частоте излучения. Первые три частоты в серии Бальмера соответствуют видимому свету (красный, сине-голубой, фиолетовый). Более высокие частоты попадают в ультрафиолетовую область. Легко видеть, что самая малая частота в серии Лаймана (переход со второго уровня на первый) больше самой большой частоты в серии Бальмера (переход с уровня n= на второй), поэтому все переходы в серии Лаймана соответствуют ультрафиолетовому излучению. Точно также самая малая частота в серии Бальмера, соответствующая красному свету и переходу с 3-го уровня на 2-ой, больше самой большой частоты в серии Пашена (n=3, k=), поэтому в серии Пашена, Брэкета и др. имеет место только инфракрасное излучение. ОПИСАНИЕ УСТАНОВКИ 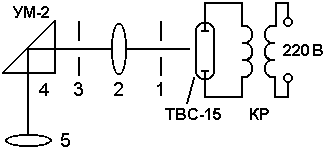 Рис. 2. Схема экспериментальной установки. 1, 3 – щель, 2 – собирающая линза, 4 – призма, 5 – окуляр. Излучение водорода генерируется в газоразрядной лампе ТВС-15, подключенной к источнику высокого напряжения – катушке Румкорфа (рис. 2). Для питания катушки служит понижающий трансформатор, на обмотку которого, в свою очередь, подается пульсирующее напряжение. Пройдя через систему щелей 1 и 3 и собирающую линзу 2, луч света попадает в универсальный монохроматор УМ-2, где с помощью призмы 4 разлагается в спектр. Угол поворота призмы устанавливается с помощью барабана, который проградуирован по длинам волн. Наблюдение спектральных линий водорода производится через окуляр 5. Градуировочный график монохроматора находится на лабораторном столе. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ И ЗАДАНИЯ ВНИМАНИЕ. ПРИ РАБОТЕ НЕ ПРИКАСАТЬСЯ К ИСТОЧНИКУ ВЫСОКОГО НАПРЯЖЕНИЯ. СМЕЩАТЬ ШТАТИВЫ И ВРАЩАТЬ РАЗЛИЧНЫЕ ДЕТАЛИ МОНОХРОМАТОРА НЕ РАЗРЕШАЕТСЯ. Вращая барабан по часовой стрелке до упора, установить бегунок в положение, соответствующее минимальному значению по шкале барабана. Включить установку в сеть и нажать на пусковую кнопку. При этом лампа должна светиться розовым светом. Вращая барабан, совместить красную линию спектра с флажком, видимым в окуляр монохроматора. Снять показания со шкалы барабана. Повторить предыдущий пункт для сине-голубой и фиолетовой линий. По градуировочному графику монохроматора (см. ниже) определить длины волн красного, сине-голубого и фиолетового света в спектре атома водорода. Полученные данные занести в таблицу.
Определить экспериментальные значения постоянной Ридберга для каждой длины волны по формуле: 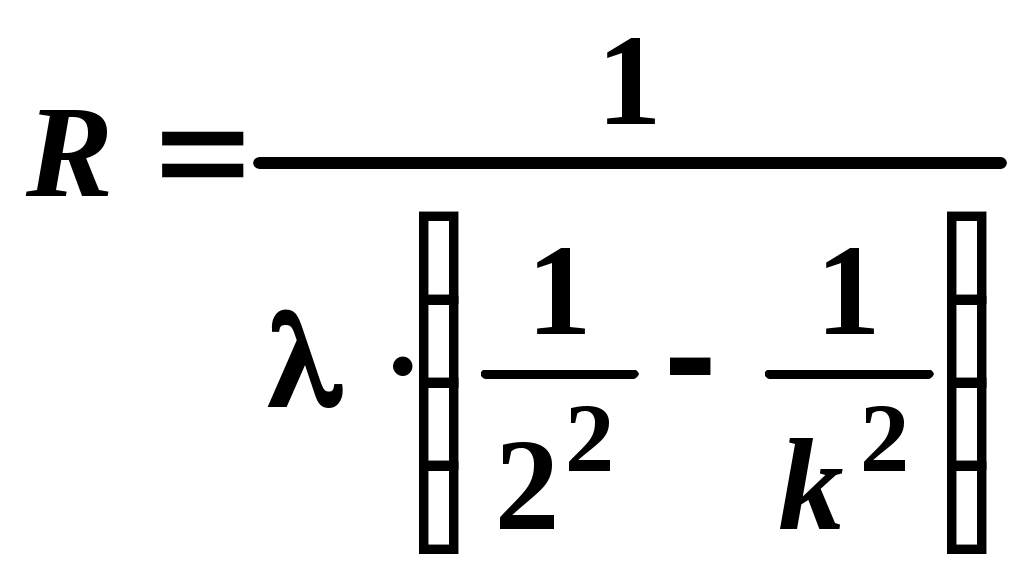 . Данные занести в таблицу. Определить среднее значение Rcр . . Данные занести в таблицу. Определить среднее значение Rcр . Рассчитать теоретическое значение постоянной Ридберга по формуле 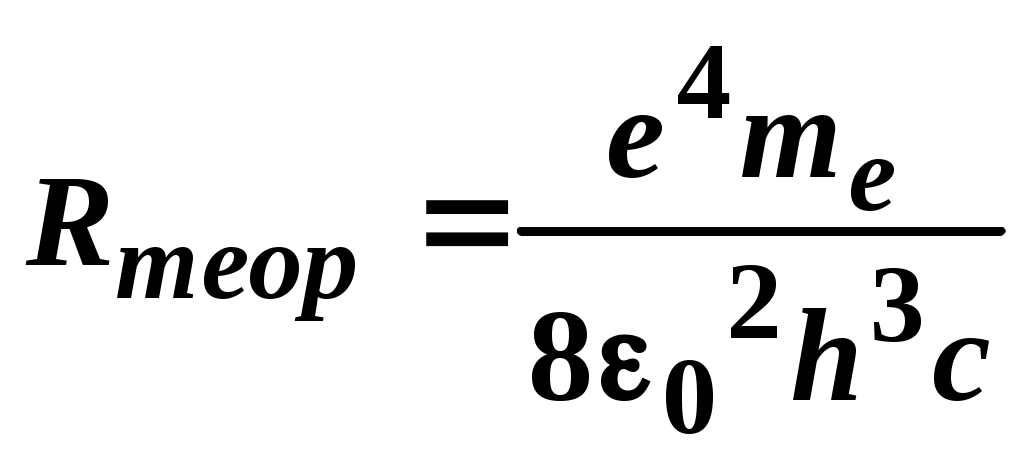 и сравнить его с экспериментально полученным. Рассчитать погрешности измерений. Сделать выводы по работе. и сравнить его с экспериментально полученным. Рассчитать погрешности измерений. Сделать выводы по работе.ГРАДУИРОВОЧНЫЙ ГРАФИК МОНОХРОМАТОРА 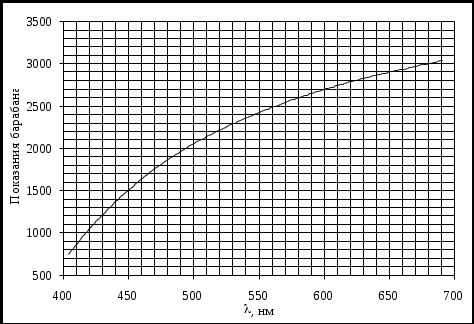 КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ Сформулировать постулаты Бора. Что называется главным квантовым числом? Записать зависимость радиуса орбиты и полной энергии электрона в атоме водорода от n. Что называется серией линий, и как они возникают? Назовите серии спектральных линий для атома водорода. Почему для экспериментального наблюдения выбрана серия Бальмера? ОТЧЕТ Первый постулат Бора Постулат стационарных состояний: атом может находиться в стационарных состояниях, которые являются постоянными во времени, в том случае, если нет внешних воздействий. В таких состояниях атом не излучает электромагнитные волны. Таким состояниям соответствуют стационарные орбиты движения электронов. При этом электроны движутся ускоренно, но электромагнитных волн не излучают. В данном случае появляется противоречие с положениями классической физики, которая утверждает, что ускоренно движущийся заряд является источником излучения энергии. Второй постулат Бора Правило частот. Это правило говорит о том, что в случае перехода атома из одного стационарного состояния в другое, атом поглощает или испускает один квант энергии. Атом излучает, если переходит из состояния с большей энергией в состояние с меньшей энергией. Данному процессу соответствует переход электрона с более удаленной от ядра орбиты на орбиту, которая расположена ближе к ядру. Поглощение атомом энергии происходит при переходе атома из состояния с меньшей энергией, в состояние с большей энергией. Изменение энергии у атома проходит при излучении (поглощении) им электромагнитных волн, причем данное изменение пропорционально частоте волн: Третий постулат Бора Правило квантования. Он утверждает, что электрон, если атом находится в стационарном состоянии, движется по круговым орбитам, имеет дискретные квантовые значения момента импульса. Главное квантовое число — целое число, для водорода и водородоподобных атомов определяет возможные значения энергии. Спектральные серии водорода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее хорошо изучены. Они хорошо подчиняются формуле Ридберга: 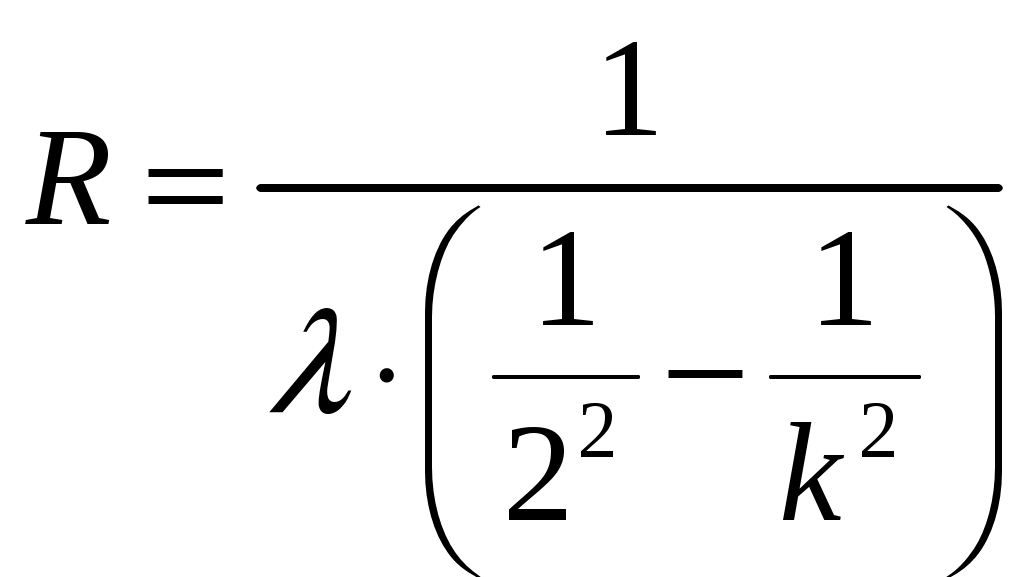 где R = 109 677 см−1 — постоянная Ридберга для водорода, n′ — основной уровень серии. Спектральные линии, возникающие при переходах на основной энергетический уровень, называются резонансными, все остальные — субординатными. Спектральные линии сгруппированы в серии по n′. Линии названы последовательно от самой низкочастотной греческими буквами. Например, линия 2 → 1 называется линией Лаймана-альфа (Ly-α), а 7 → 3 Пашена-дельта(Pa-δ). Для эксперимента выбрана серия Баьмера, т.к. первые три частоты в серии Бальмера соответствуют видимому свету (красный, сине-голубой, фиолетовый). Серия Бальмера: первые четыре линии серии находятся в видимом диапазоне и были известны задолго до Бальмера, который предложил эмпирическую формулу для их длин волн и на её основе предсказал существование других линий этой серии в ультрафиолетовой области. Серия соответствует формуле Ридберга при n′ = 2 и n = 3, 4, 5, …; линия Hα = 6565 Å, граница серии — 3647 Å. По градуировочному графику монохроматора определяем длины волн красного, сине-голубого и фиолетового света в спектре атома водорода. Полученные данные заносим в таблицу. Определяем экспериментальные значения постоянной Ридберга для каждой длины волны по формуле: 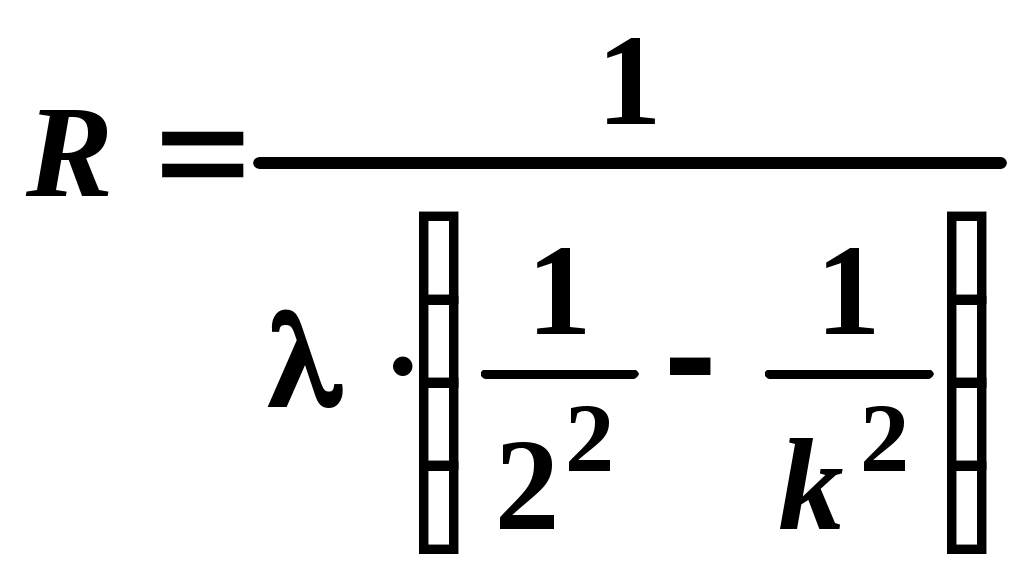 . .Данные заносим в таблицу. Определить среднее значение Rcр . Рассчитываем теоретическое значение постоянной Ридберга по формуле 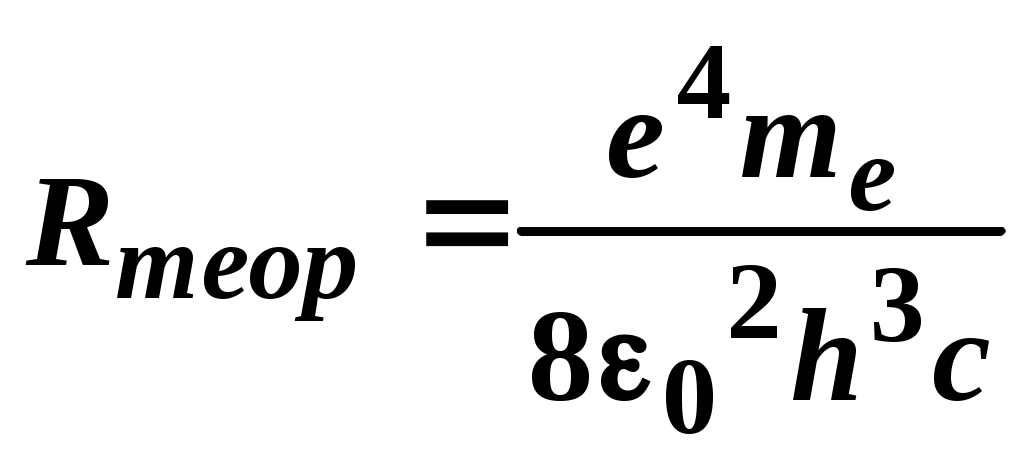 Сравниваем его с экспериментально полученным. Рассчитываем погрешность измерений. Вывод: Излучение водорода генерируется в газоразрядной лампе ТВС-15, подключенной к источнику высокого напряжения – катушке Румкорфа. Произведено снятие экспериментальных данных, произведено сравнение с теоретическим значением. Определена погрешность измерения. | ||||||||||||||||||||||||||||||||||||||||||
