ьрприюо. практика отчет. Отчет по учебной практике техника лабораторных работ практика по получению первичных
 Скачать 2.66 Mb. Скачать 2.66 Mb.
|
|
3. Мытье и сушка химической посуды Умение мыть химическую посуду является той частью лабораторной техники, знание которой обязательно для каждого работника лаборатории. Удалить загрязнения со стенок посуды можно различными методами: механическими, физическими, химическими, физико-химическими или комбинируя их. Механические и физические методы очистки посуды В тех случаях, когда химическая посуда не загрязнена смолой, жировыми и другими не растворяющимися в воде веществами, посуду можно мыть теплой водой. Если на стенках посуды имеется налет каких-либо солей или осадок, посуду очищают (предварительно смочив водой) щеткой или ершом и уже затем окончательно моют водой. Хорошо вымытую в теплой воде посуду обязательно два-три раза споласкивают дистиллированной водой для удаления солей, содержащихся в водопроводной воде. Сухая посуда нужна, когда работу необходимо проводить в отсутствие следов влаги (очень многие органические реакции). Различают: а) методы холодной сушки (без нагревания) б) метод горячей сушки (при нагревании). Методы холодной сушки Самый распространенный способ сушки посуды – сушка на колышках. В лаборатории должна быть специальная доска с колышками, которую обычно помещают над раковиной для мытья посуды. Вымытую посуду надевают на эти колышки и оставляют на них до тех пор, пока она не высохнет. Вымытую посуду можно высушить струей воздуха. Сушить можно как холодным, так и нагретым воздухом. Сушка спиртом и эфиром Обтерев сосуд снаружи чистым полотенцем, ополаскивают его сначала чистым этиловым спиртом, а затем чистым диэтиловым (серным) эфиром. Пары эфира удаляют продуванием холодного воздуха. Сушка в эксикаторе В тех случаях, когда нужно принимать особые меры защиты вымытой посуды от загрязнения веществами, содержащимися в воздухе, мелкие стеклянные изделия следует высушивать в эксикаторе. Быстро высушить посуду можно также в сушильном шкафу. Обыкновенно в сушильный шкаф посуду ставят после того, как она некоторое время постояла перевернутой (на колышках, решетке или сушильном столе) для удаления воды. Сушку проводят при 80-100° С. На полку шкафа следует положить кусок чистой фильтровальной бумаги. 4. Техника работы с пипеткой 1. В соответствии с правилами мытья посуды, хорошо промывают пипетку одной из моющих смесей, а затем водой. После этого дважды ополаскивают ее тем раствором, точный объем которого отбирают для анализа. Для этого берут пипетку правой рукой, держа верхний конец (выше метки) большим и средним пальцами, погружают нижний конец пипетки в раствор и засасывают его с помощью груши до тех пор, пока уровень жидкости не поднимется до расширенной части пипетки. Затем закрывают верхний конец указательным пальцем и вынимают пипетку из колбы. Держа ее над стаканом или над раковиной, придают ей горизонтальное положение и, вращая и чуть наклоняя пипетку (рис. 1, а), смачивают внутреннюю поверхность от нижнего конца до метки и немного выше. После этого жидкость сливают через нижний конец пипетки в раковину или стакан и повторяют ополаскивание. Нельзя сливать раствор через верхний конец пипетки, иначе он попадет в грушу. 2. Для отбора аликвоты раствора используют те же приемы, но всасывают жидкость до уровня, немного превышающего метку (рис. 1, б). Закрывают верхний конец пипетки указательным пальцем и вынимают пипетку с жидкостью из раствора. Левой рукой обтирают снаружи нижнюю часть пипетки полоской фильтровальной бумаги (рис. 1, в). 3. Левой рукой берут мерную колбу с раствором и держат ее в наклонном положении, а правой рукой приставляют нижний конец пипетки к внутренней стенке колбы. При этом пипетка должна находиться в строго вертикальном положении, а метка – на уровне глаз (рис. 1, г). Слегка приоткрывают указательный палец, удерживающий жидкость в пипетке, и дают раствору плавно стечь до тех пор, пока нижний край мениска не будет на уровне метки. Снова быстро прижимают палец к верхнему краю пипетки и переносят отобранную порцию жидкости в другой сосуд. 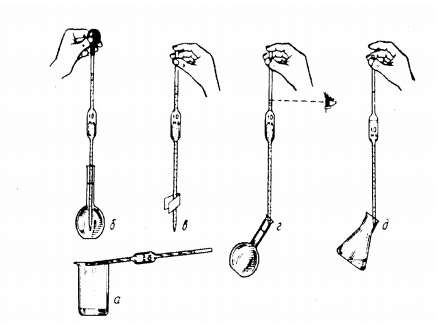 Рис. 1 Приемы работы с пипеткой 4. Держа сосуд в левой руке в наклонном положении, а пипетку вертикально – в правой, прислоняют нижний конец пипетки к стенке сосуда и открывают верхний конец ее (рис .1, д). После того как стечет весь раствор, ждут еще 10-15 с. Небольшую часть раствора, которая остается в пипетке, нельзя выдувать или стряхивать: при строгом соблюдении правил работы с пипеткой эта оставшаяся часть всегда будет одной и той же. Ни в коем случае нельзя засасывать ртом летучие или ядовитые жидкости, а также концентрированные кислоты или щелочи. Для отбора такого рода жидкостей с помощью пипетки следует пользоваться резиновой грушей. 5. Весы и техника взвешивания Взвешиванием называют сравнение массы данного вещества с массой гирь, масса которых известна и выражена в определенных единицах (мг, г, кг). Весы являются важнейшим прибором в химической лаборатории, поскольку практически ни одна работа не обходится без определения массы реагентов и продуктов реакции. В зависимости от точности, с которой проводится взвешивание, весы разделяют на следующие группы: для грубого взвешивания (точность до 1 г); для точного взвешивания (точность от 1 до 10 мг); аналитические (точность от 0,1 мг до 10-9 мг). При выполнении лабораторных работ применяются весы с точностью взвешивания 0,1-0,01 г. Такой точности достаточно для проведения большинства опытов синтезов. Взвешивание на весах всегда проводят с использованием тары. Химические вещества никогда нельзя помещать на чашку весов. В качестве тары необходимо использовать стаканчики для взвешивания и бюксы. Допускается взвешивание на кальке и часовом стекле. Нельзя взвешивать нагретые (даже теплые) и мокрые предметы. Взвешиваемый предмет помещают на левую чашку весов, а разновес - на правую. Вначале взвешивают пустую тару, потом - тару с веществом и по разности определяют массу вещества. Для взвешивания используют разновес - стандартный набор гирь в специальном футляре. Набор составлен так, чтобы минимальным числом гирь можно было взять любую массу от 200 до 0,01 г. При взвешивании сначала грубо оценивают массу предмета, находящегося на чашке весов. На правую чашку весов кладут гирю большей массы, чем предполагаемая масса предмета. При накладывании и снятии гирь весы должны быть арретированы. Затем заменяют гирю меньшей массы, эту операцию повторяют, до тех пор, пока предмет не будет уравновешен. Когда масса гирь начнет приближаться к массе предмета, арретир открывают и наблюдают за качанием стрелки, до её совпадения с нулевым уровнем. Когда равновесие достигнуто, закрывают арретир, записывают массу и убирают разновесы в футляр. Взвешивание на электронных весах. Взвешивание на электронных весах значительно быстрее и проще, поскольку масса вещества сразу высвечивается на табло. Взвешивание проводят следующим образом. Стаканчик для взвешивания помещают на чашку весов и записывают его массу или обнуляют показания весов, нажав кнопку "тара". Затем снимают стаканчик с чашки весов, аккуратно помещают в него взвешиваемое вещество и ставят на весы. Если масса вещества не соответствует заданной, то стаканчик вновь снимают с весов и добавляют (или убирают) необходимое количество вещества. Повторяют операцию нужное число раз. Для взятия точной навески допускается добавлять на весах небольшое количество вещества маленькими порциями. 6. Фильтрование В лабораторной практике очень часто приходится прибегать к операции механического разделения твердых и жидких компонентов какой-либо смеси. Эту операцию осуществляют путем фильтрования. Фильтрование - процесс разделения суспензий или аэрозолей при помощи фильтровальных перегородок, пропускающих жидкость или газ, но задерживающих твёрдые частицы . Фильтрование осуществляется в специальных аппаратах – фильтрах. Жидкость, прошедшая через фильтровальные перегородки, называется фильтратом. Фильтрующие материалы, применяемые в лабораторной практике, могут быть разделены на два класса: сыпучие и пористые. Кроме того, фильтрующие материалы разделяются на неорганические и органические. К первому классу относится, например, кварцевый песок. Неорганические фильтрующие материалы особенно пригодны для жидких веществ и растворов, нагретых до температур, превышающих 1000С. Наибольшим распространением в лаборатории пользуются фильтровальная бумага, целлюлозная масса, асбест, волокнистые материалы (ткани), смешанные фильтры, прессованное стекло, обожженная глина, фарфор и пр. Фильтровальная бумага отличается от обычной тем, что она не проклеена, более чиста по составу и волокниста. Последнее обстоятельство и обусловливает ее фильтрующую способность. Различают бумажные фильтры обычные и беззольные. На каждой пачке указывается масса золы фильтра. Если после запятой стоит четыре нуля, такая фильтровальная бумага считается беззольной. Готовые фильтры различают также по плотности фильтровальной бумаги. Это различие определяется по цвету бумажной ленты, которой оклеивают упаковку готовых фильтров. Фильтры из бумаги, употребляемые в лаборатории, бывают двух родов: простые и складчатые. В качестве оборудования применяются стеклянные фильтровальные воронки. Фильтрование можно проводить различными способами. Выбор способов фильтрования зависит от характера подлежащих фильтрованию жидкостей и свойств осадка, который нужно отделить от жидкости. Фильтрование при обычном давлении - является наиболее простым и применяется очень часто. Необходимой принадлежностью при фильтровании является воронка. Воронку укрепляют в кольце, присоединенном к обыкновенному или специальному штативу, в нее кладут фильтр из фильтровальной бумаги, который слегка смачивают чистым растворителем. Условием быстрого фильтрования является наличие жидкости в трубке воронки. В тех случаях, когда фильтрование нужно провести быстро и, если в обычных условиях оно вызывает затруднения, пользуются фильтрованием под вакуумом. Сущность его заключается в том, что в приемнике создают уменьшенное давление, вследствие чего жидкость фильтруется под давлением атмосферного воздуха. 7. Дистилляция и сублимация Возгонка или сублимация - непосредственное превращение твердого вещества в пар (обычно - при нагревании) минуя жидкое состояние. В дальнейшем пар может быть сконденсирован в кристаллы на охлаждаемой поверхности. Возгонка всегда происходит при температуре ниже температуры плавления вещества. Способностью к возгонке обычно обладают твердые вещества с молекулярной структурой (йод, нафталин, нашатырь, бензойная кислота). Очистка методом возгонки становится возможной в том случае, когда примеси не возгоняются. Перегонка или дистилляция - метод очистки, основанный на превращении жидкости в пар с последующей конденсацией пара в жидкость. Метод обычно используют для отделения жидкости от растворенных в ней твердых веществ или других нелетучих примесей. Этим методом невозможно разделить компоненты с близкими способностями к парообразованию. Вода, полученная в результате перегонки, называется дистиллированной 8. Растворы. Приготовление растворов Если растворителем служит вода, то нужно применять только дистиллированную или диминерализованнную воду. Предварительно приготавливают соответствующий емкости посуды, в которой будут готовить и хранить получаемый раствор. Посуда должна быть чистой. Если есть опасения, что водный раствор может взаимодействовать с материалом посуды, то посуду внутри следует покрыть парафином или другими химически стойкими веществами. Перед приготовлением растворов нужно подготовить по возможности 2 одинаковых сосуда: один - для растворения, а другой - для хранения раствора. Вымытый сосуд предварительно проградуировать. Для растворения следует применять чистые вещества. Готовые растворы обязательно проверяют на содержание нужного вещества и, если это будет необходимо, поправляют раствор. Нужно применять меры для защиты приготовленных растворов от попадания в них пыли или газов, с которыми могут реагировать некоторые растворы. Во время приготовления и во время хранения растворов, бутыли или другая посуда обязательно должны быть закрыты пробками. При особо точных анализах следует принимать во внимание возможность выщелачивания стекла и применять, если это допустимо, кварцевую посуду. 8.1. Техника приготовления растворов солей. Приблизительные растворы. Готовый раствор или отфильтровывают, или дают ему отстоятся от нерастворимых в воде примесей, после чего при помощи сифона отделяют прозрачный раствор. Полезно проверит концентрацию каждого приготовленного раствора. Это легче всего сделать, измерив ареометром плотность и сравнить полученную величину с табличными данными. Если раствор имеет концентрацию меньше заданной, к нему добавляют нужное количество растворяемого твердого вещества . Если же раствор имеет концентрацию больше заданной – добавляют в воду и доводят концентрацию до требуемой. Точные растворы. Точные растворы солей чаще всего готовят для аналитических целей, причем обычно нормальной концентрации. Некоторые из точных растворов недостаточно стойки при хранении и могут изменяться под действием света или кислорода, или других органических примесей, содержащихся в воздухе. Такие точные растворы периодически проверяют. В точном растворе серноватистокислого натрия при стоянии часто наблюдается выпадение хлопьев серы. Это является результатом жизнедеятельности особо вида бактерий. Растворы марганцевокислого калия изменяются при действии на них света, пыли и примесей органического происхождения. Растворы азотнокислого серебра разрушаются при действии света. Поэтому большие запасы точных растворов солей, нестойки к хранению, иметь не следует. Растворы таких солей хранят с соблюдением известных мер предосторожности. От действия света изменяются растворы : AgNO3, KSCN, NH4SCN, KI, I2, K2Cr2O7. 8.2. Техника приготовления растворов кислот. В большинстве случаев в лаборатории пользуются растворами соляной, серной и азотной кислот. В лаборатории поступают концентрированные кислоты; процентное содержание кислот определяют по плотности. Для приготовления раствора колбу объемом 1 литр заливают дистиллированную воду (на половину), добавляют нужное количество вещества с определенной плотностью, размешивают, а после объем добавляют до литра. При разбавлении происходит сильное разогревание колб. Точные растворы готовят точно также, используя химически чистые препараты. Растворы готовят более высокой концентрации, которую далее разбавляют водой. Растворы точной концентрации проверяют титрованием углекислым натрием (Na2CO3) или кислым углекислым калием(KHCO3) и «поправляют». 8.3. Техника приготовления растворов щелочей. Наиболее употребительным является раствор едкого натра (NaOH). Первоначально из твердого вещества готовят концентрированный раствор (примерно 30-40%).При растворении происходит сильное разогревание раствора. Как правило, щелочь растворяют в фарфоровой посуде. Следующим этапом является отстаивание раствора. Затем прозрачную часть сливают в другую емкость. Такую емкость снабжают хлоркальцевой трубкой для поглощения углекислого газа. Для приготовления раствора приблизительной концентрации определяют плотность с помощью ареометра. Хранение концентрированных растворов в стеклянной посуде разрешается, если поверхность стекла покрыта парафином, т.к в ином случае происходит выщелачивание стекла. Для приготовления точных растворов используют химически чистую щелочь. Приготовленный раствор проверяют титрованием щавелевой кислотой, поправляют. 9. Титрование Титриметрический анализ – метод количественного анализа, основанный на измерении объёма раствора реактива точно известной концентрации (титранта), расходуемого для реакции с определяемым (титруемым) веществом. Титрование – процесс определения концентрации исследуемого вещества путем добавления раствора титранта к раствору титруемого вещества по каплям. 3 Титриметрический анализ Титрант – реагент с точно известной концентрацией, добавляемый к исследуемому раствору для количественного анализа содержащихся в нем веществ или их элементов (ионов, функциональных групп). Титрант с известной концентрацией называют стандартным раствором. Первичный стандартный раствор готовят растворением точного количества чистого химического вещества известного состава в определенном объеме растворителя. Вторичный стандарт готовят в виде раствора с приблизительной концентрацией и определяют его концентрацию (стандартизуют) по подходящему первичному стандарту Индикаторами называются вещества, цвет которых меняется в зависимости от концентрации ионов водорода [H+ ] (в кислотно-основном титровании), концентрации ионов металла [Mn+ ] (в комплексонометрическом титровании) и значения окислительно-восстановительного потенциала E титруемой или титрующей системы (в окислительно-восстановительном титровании). Индикаторы позволяют определить конец реакции в титриметрии. Титриметрический анализ может быть основан на различных типах химических реакций: кислотно-основное титрование – реакции нейтрализации; комплексонометрическое титрование – реакции образования комплексных соединений с комплексоном (обычно ЭДТА); окислительно-восстановительное титрование – окислительновосстановительные реакции. По способу выполнения чаще всего используют прямое и обратное титрование. при прямом титровании к раствору определяемого вещества добавляют небольшими порциями раствор титранта; при обратном титровании к раствору определяемого вещества добавляют сначала заведомый избыток реагента и затем титрантом оттитровывают его остаток, не вступивший в реакцию. |
