ьрприюо. практика отчет. Отчет по учебной практике техника лабораторных работ практика по получению первичных
 Скачать 2.66 Mb. Скачать 2.66 Mb.
|
|
10. Определение плотности В химических лабораториях очень часто приходится определять плотность. Плотностью вещества называют отношение массы тела к его объему. 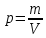 где 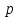 – плотность, г/см3; – плотность, г/см3;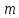 – масса тела, г; – масса тела, г;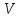 – объем тела, см3. – объем тела, см3.Для быстрого определения относительной плотности жидкости применяют так называемые ареометры в соответствии с рисунком 2. 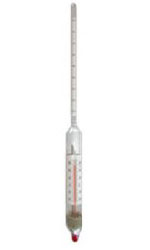 Рис.2 – Ареометр для определения плотности Это – стеклянная трубка, расширяющаяся внизу и имеющая на конце стеклянный резервуар, заполненный дробью или специальной массой, (реже — ртутью). В верхней узкой части ареометра имеется шкала с делениями. Чем меньше относительная плотность жидкости, тем глубже погружается в нее ареометр. Поэтому на шкале вверху нанесено наименьшее значение относительной плотности, а внизу — наибольшее. Промежутки между цифрами разделены на более мелкие деления, позволяющие определять относительную плотность с точностью до третьего десятичного знака. Для определения относительной плотности при помощи ареометра жидкость наливают в стеклянный цилиндр емкостью не менее 0,5 л, сходный по форме с мерным, но без носика и делений. Отсчет проводят по делениям шкалы ареометра. На сегодняшний день невозможно представить себе процесс контроля качества сырья и готовой продукции в лабораторных условиях без определения такого показателя как плотность. Для проведения измерений используются специальные приборы – пикнометры. Самые точные результаты за минимальный промежуток времени можно получить с помощью автоматических устройств, к примеру, гелиевого пикнометра. Принцип работы пикнометра основан на взвешивании его до и после заполнения исследуемым веществом до специальной метки на горловине при определенной температуре. Для определения плотности твердых материалов их погружают в стеклянный сосуд, заполненный жидкостью (как правило, это дистиллированная вода). Плотность определяется путем деления массы исследуемого вещества на его объем. Для определения плотности любого вещества его массу надо разделить на объем. С помощью мерной колбы (пикнометра) можно точно измерить эти показатели. Для определения объема абсолютно чистый и сухой сосуд заполняют исследуемым веществом до определенной метки. Массу вещества рассчитывают как разницу между массой пустой колбы и колбы, заполненной этим же веществом. Плотность твердого вещества рассчитывается немного по-другому. Пикнометр заполняют жидкостью, в которой исследуемый образец не должен растворяться. При определении показателя плотности следует учитывать массу: образца; прибора с жидкостью; прибора вместе с жидкостью и исследуемым образцом. 11. Лабораторные работы Лабораторная работа №1 Тема: «Техника взвешивания. Получение труднорастворимого осадка» Цель: Освоить основные приемы работы в химической лаборатории, овладеть техникой взвешивания, познакомиться с различными видами весов, получить труднорастворимый осадок. Материальная база: технические весы, аналитические весы, Na2SO4, BaCl2, бюксы. Ход работы: Весы по классу точности делятся на: Технические (с точностью измерения до 0,01г.); Технохимические (с точностью измерения до 0,001г.); Аналитические (с точностью измерения до 0,0001 г.). Взвешивание: Подготовить две навески в бюксах (Na2SO4, BaCl2) на разных весах При взвешивании на технохимических весах масса BaCl2 = 2,02г. При взвешивании на технохимических весах масса Na2SO4 = 1,9998г В химический стакан налить 47,5 мл. воды, добавить Na2SO4, перемешиваем до полного растворения. В мерную колбу наливаем 10 г. воды через воронку всыпаем BaCl2, растворяем после, доливаем воду до мениска. После выполнения всех действий, смешиваем получившиеся растворы в одном химическом составе. Образовался белый осадок BaSO4 BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl Вывод: на лабораторной работе я освоил технику взятия навесок на разных химических весах, получил труднорастворимый осадок. Лабораторная работа №2 Тема: «Калибровка мерной посуды». Цель: Ознакомиться с химической посудой, используемой в титриметрическом методе анализа. Освоить технику калибровки мерных колб и пипеток. Материальная база: мерная колба вместимостью 25 мл, пипетка вместимостью 10–25, термометр, технические весы, химический стакан. Ход работы: 1. Калибровка бюкса. Для проверки вместимости тщательно вымытую пипетку наполняют до метки дистиллированной водой. Для заполнения пипетки жидкость засасывают грушей через широкое отверстие пипетки (кончик пипетки должен быть полностью погружен в жидкость) на 2–3 см выше метки, затем быстро закрывают отверстие указательным пальцем. Когда пипетка наполнена, ослабевают нажим указательного пальца, в результате чего жидкость будет медленно вытекать из пипетки (палец должен быть слегка влажным); как только нижний мениск жидкости коснется метки, палец снова плотно прижимают. Выдувать остатки жидкости нельзя. После того как вся жидкость вытечет из носика пипетки, касаются им стенок сосуда 2–3 раза. Воду из пипетки выливают в чистый, предварительно взвешенный стакан. Взвешивание проводят на технических весах. m0 (бюкс) = 48,7624 г. m1 = m0 (бюкс) + m (H2O) = 48,762 г. + 4,2732 г. = 53,0356 г. m2 = m1 + m (H2O) = 58,0263 г. m3 = m2 + m (H2O) = 62,9905 г. Δm3 = m2 – m1 = 4,9907 г. Δm2 = m3 – m2 = 4,9642 г. Δm1 = m1 – m0 = 4,2732 г. 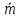 = = 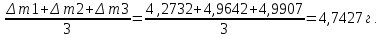 2. Калибровка мерной колбы. В отличие от пипеток, для которых определяют объем выливающейся жидкости, для мерных колб определяют объем жидкости, которая помещается в мерную колбу. Проверку вместимости мерной колбы проводят следующим образом: чистую и сухую мерную колбу с пробкой взвешивают на технических весах с точностью до (±0,01) г. Затем колбу заполняют до метки дистиллированной водой. Сперва наливают воду в мерную колбу на 0,1–1 см ниже метки, после чего доводят до метки, добавляя жидкость по каплям из капельницы. Колбу закрывают пробкой и снова взвешивают. m0 (колба) = 28,9829 г. m1 = m0 (колбы) + m (H2O) = 28,9829 г. + 49,7899 г. = 78,7728 г. m2 = m1 + m (H2O) = 78,7569 г. m3 = m2 + m (H2O) = 76,7569 г. Δm3 = m2 – m1 = 0,0159 г. Δm2 = m3 – m2 = 2 г. Δm1 = m1 – m0 = 49,7899 г. 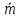 = = 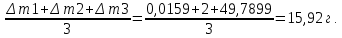 Вывод: на лабораторной работе я познакомился с химической посудой, научился правильно калибровать мерную посуду. Лабораторная работа № 3 Тема: «Фильтрование. Получение труднорастворимого осадка». Цель: получить труднорастворимый осадок BaSO4 и отфильтровать его. Материальная база: реактивы (Na2SO4, BaCl2*2H2O), фильтровальная бумага, установка для вакуумного фильтрования, бюкс, колба коническая, мерный цилиндр. Ход работы: 1. Готовим навеску Na2SO4. Взвешиваем пустой бюкс с крышкой, после, из промежуточной тары насыпаем реактив, взвешиваем. 2,5 г. натрия сернокислого. К нему приливаем 20 мл. воды. Взвешиваем навеску хлорида бария 3г. приливаем 20 мл. воды, растворяем. В раствор хлорида бария опускается стеклянная палочка, по которой происходит смешивание растворов. После изменения цвета и образования осадка, раствор перемешивают палочкой и переносят на фильтр. Осадок следует промыть дистиллированной водой. 2. Можно отфильтровать на вакуумной установке. После отсасывания всей порции фильтруемого вещества, снимают вакуум, добавляют небольшое количество растворителя, перемешивают образовавшиеся кристаллы палочкой. Снова подсоединяют шланг от насоса и повторяют фильтрование. Обычно бывает достаточно двукратной промывки кристаллов холодным растворителем. В некоторых случаях можно после этого промыть продукт растворителем с заведомо низкой растворяющей способностью (однако таким, с которым бы смешивался растворитель, в котором проводилась кристаллизация). После отсасывания и промывки осадок отжимают на воронке, и затем сушат. BaCl2 + Na2SO4→ BaSO4↓ + 2NaCl Вывод: на данной лабораторной работе я научился фильтровать труднорастворимые осадки как при атмосферном давлении, так и под вакуумом. Лабораторная работа № 4 Тема: «Определение плотности». Цель: Определить плотность вещества ареометрическим и пикнометрическими способами. Материальная база: K2Cr2O7, CuSO4, ареометр, пикнометр, весы аналитические. Ход работы: Ареометрический метод. В чистый цилиндр диаметром не менее 5 см налить жидкость. Стараясь не задеть стенки цилиндра. В жидкость внести чистый и сухой ареометр ρ(CuSO4) = 1,045 г/см3 2. Пикнометрический метод. Пикнометр представляет собой стеклянный сосуд с кольцевой щеткой на шейке. Объём от 1 до 100 мл. Это более длительный метод. Состоит из нескольких операций, заключается в тщательном промывании и, непосредственно, определении плотности жидкости. Откалибровать пикнометр. 1. Определить массу пустого пикнометра, предварительно вымыв его, сполоснув дистиллированной водой и тщательно просушив: m(пикнометра пуст.) = 30.8387г 1) Наполнить пикнометр дистиллированной водой до метки и определить массу пикнометра с водой, при этом убрав избыток воды на горлышке при помощи фильтровальной бумаги: m(пикнометра с H2Oдист) = 80.5060г 2) Определить массу воды в пикнометре, а затем посчитать её объём: m(H2Oдист) = m(пикнометра с H2Oдист) - m(пикнометра пуст.) = 80.5060г-30.8387г=49,6673г V= 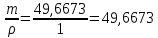 см3 см32. Произвести измерения при помощи пикнометрического метода: 1) Определить массу пустого пикнометра после калибровки m(пикнометра пуст.) = 30.8387г 2) Определить массу пикнометра вместе с веществом (K2CrO7) m(пикнометра с K2Cr2O₇) = 81,3363г 3) Вычислить массу K2Cr2O7 в пикнометре: m(K2Cr2O₇) = m (пикнометра с K2Cr2O₇) – m (пикнометра пуст.) = 50,4976 г 4)Высчитать плотность K2Cr2O7 с помощью формулы: ρ = 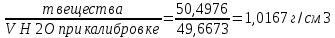 Вывод: На данной лабораторной работе я научился определять плотность вещества ареометрическим и пикнометрическим методом. Лабораторная работа №5 Тема: «Растворы и растворение» Цель: научиться распознавать и рассчитывать концентрацию растворов. Ход работы: 1. Определить концентрацию исследуемого раствора, зная информацию о первом растворе (75 г. и 8%). mр-ра= 70х0,08 = 6; %р-ра = 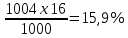 2. Определить массу исследуемого вещества NaOH Составим пропорцию: 15,9 - 100 6 - х хмасса вещества = 37,7г. m H2O = 37,3г. Вывод: На данной лабораторной работе я научился рассчитывать концентрацию веществ для правильного приготовления растворов Лабораторная работа №6 Тема: «Титрование» Цель: Изучить основные методы и приёмы титрования, выполнить титрование 0,1 н раствора NaOH. Материальная база: мерная колба на 1 литр, воронка, пипетки, конические колбы для титрования, бюретка, штатив с зажимом для закрепления бюретки, резиновая груша, маленькая воронка для заполнения бюретки, индикаторы фенолфталеин, метиловый красный, растворы кислоты и щелочи. Ход работы: 1. В коническую колбу для титрования поместить аликвотную часть выданного раствора щелочи (5-10 мл). 2. Прилить 4-5 капель индикатора метилового красного. 3. Чистую бюретку заполнить стандартным раствором кислоты и титровать раствор щелочи до изменения желтой окраски в оранжево-желтую. 4. Титруют 3-4 пробы, находят средний объем раствора титранта. Объём NaOH, понадобившийся для появления постоянного окрашивания HCl равен 10,7 см3 Второй объем для параллельного измерения NaOH равен 10,7см3 CNaOH = 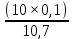 = 0,093н = 0,093нKNaOH = 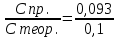 = 0,93 = 0,93NaOH + HCl → NaCl + H2O Вывод: В ходе лабораторной работы познакомился с основами титриметрического анализа, изучил основные методы и приёмы титрования. Лабораторная работа №7 Тема: «Перегонка и дистилляция» Цель: Получить дистиллированную воду методом перегонки Материальная база: нагревательный прибор, круглодонная колба, насадка Вюрца, термометр, прямой холодильник, аллонж, коническая колба (приемник). Ход работы: Подготовка. 1.Собрать перегонную установку. Подключить водоснабжение. Включаем нагревательный прибор. В процессе перегонки необходимо обратить внимание на подачу воды в холодильник (подача воды осущестялется снизу). Не рекомендуется проводить перегонку досуха. На дне колбы должно оставаться немного жидкости. Объем воды для анализа составляет 100 см3. Измерить остаток воды в колбе Вюрца, полученной дистиллированной воды и происходит расчет потерь. Перегонка. Отмеривают или взвешивают очищаемое вещество. В горловину перегонной колбы вставляют химическую воронку, нижний конец которой должен находится ниже бокового отвода колбы. Через воронку наливают жидкость, объем которой должен быть не более 2/3 объёма перегонной колбы. В перегонную колбу вносят «кипелки» (кусочки фарфора или стекла) для равномерного кипения и для предотвращения перегрева жидкости. В горловину перегонной колбы вставляют термометр. Его устанавливают таким образом, чтобы ртутный шарик термометра находился на 0.5 см ниже боковой трубки. Содержимое колбы медленно нагревают до кипения. Начало перегонки фиксируют по падению первой капли в приёмник. Нагревание продолжают так, чтобы скорость перегонки составляла 1-2 капли дистиллята в секунду. Собирают отдельные фракции, фиксируя в журнале начальные и конечные температуры их отбора. Перегонку заканчивают тогда, когда на дне перегонной колбы останется около 0.5мл жидкости. Оставшуюся в колбе жидкость после охлаждения выливают в склянку для отходов, которая находится в вытяжном шкафу. Разборка установки. Взвешивание приемников с веществами. После окончания перегонки выключают нагревательный элемент, ожидают полного остывания установки и разбирают, начиная с приемника. Измеряют объём или вес дистиллята и определяют практический выход в граммах, а затем рассчитывают практический выход в процентах от теоретического. w%(практ.) = 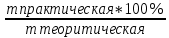 Вывод: На данной лабораторной работе я научился собирать перегонную установку, получать дистиллированную воду путем перегонки. Лабораторная работа №8 Тема: «Перекристаллизация и возгонка» Цель: испарять твердые вещества последующей конденсации паров в твердую фазу, минуя жидкую. Ход работы: Взвесить на аналитических весах химический стакан (mст), поместить в стакан около 0,5 г очищаемого вещества и снова взвесить на аналитических весах (mст+нав). Круглодонную колбу заполнить ледяной водой (для лучшей конденсации паров вещества) и поместить на стакан, как показано на рис. 7. Отверстие носика стакана закройте ватой, чтобы предотвратить попадание возогнанного вещества в атмосферу. 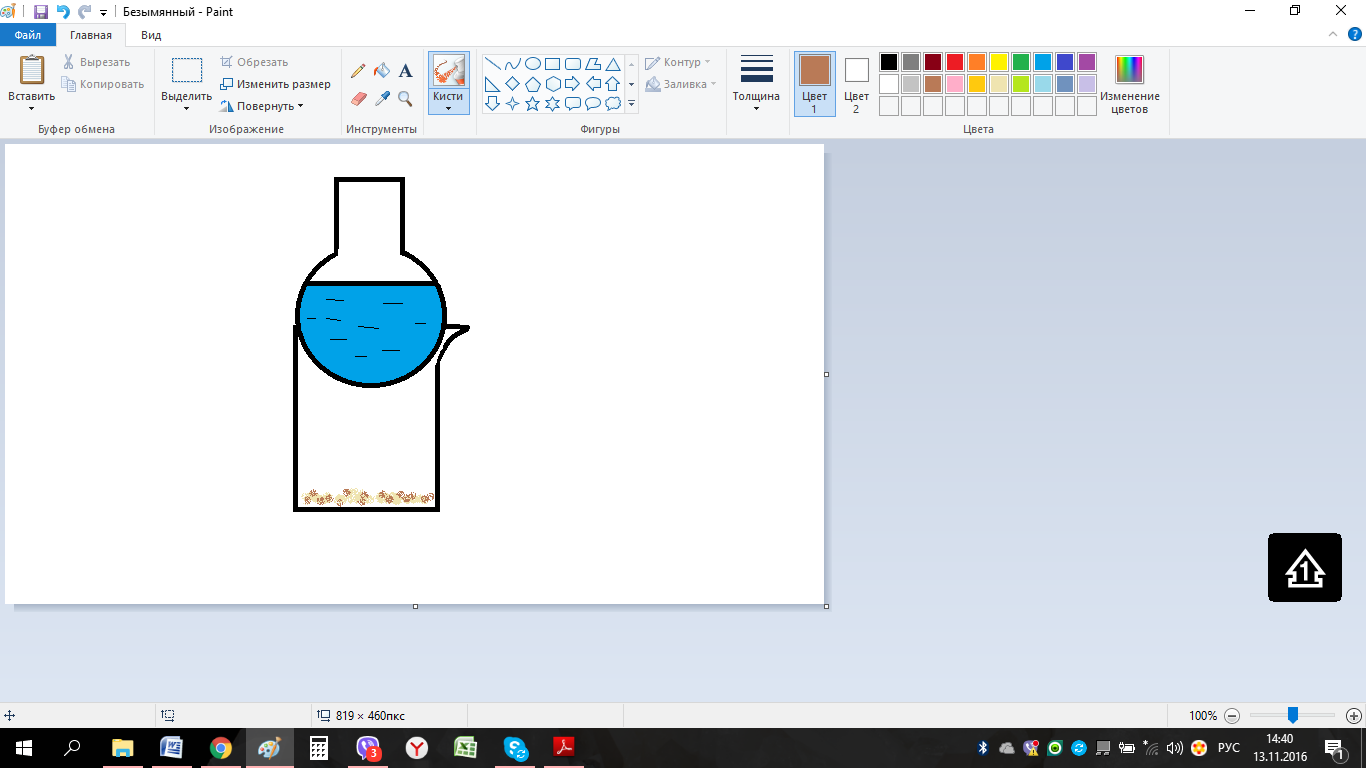 Рис. 7. Схема установки Стакан слабо нагревайте, не допуская плавления вещества. При этом вещество, например, иод возгоняется и, выделяется фиолетовый дым. После окончания процесса возгонки стакан с примесями охладить в эксикаторе до комнатной температуры, после чего взвесить на аналитических весах (mст+прим). Вывод: На данной лабораторной работе я научился испарять твердые вещества с последующей конденсации паров в твердую фазу, минуя жидкость. |
