Отчет по выполнению лабораторных работ по дисциплине физическая и коллоидная химия
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
МИНОБРНАУКИ РОССИИ РГУ НЕФТИ И ГАЗА (НИУ) ИМЕНИ И.М.ГУБКИНА Факультет химической технологии и экологии Кафедра физической и коллоидной химии ОТЧЕТ ПО ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ по дисциплине «физическая и коллоидная химия» ВЫПОЛНИЛ: Студент группы РБ-20-01 Лебедев Максим Москва, 2022 Лабораторная работа № 1 «Определение теплоты реакции нейтрализации» Цель работы: определение количества теплоты, выделившейся при полной устойчивого соединения – жидкой воды. При диссоциации слабого нейтрализации кислоты щелочью, по уравнению теплового баланса для теплового эффекта процесса, с учётом термодинамических знаков, изменения температуры, удельных теплоёмкостей и массы веществ. Краткая теоретическая часть: [2, стр.13-25] Реакции нейтрализации кислот щелочами являются экзотермическими реакциями. В реакциях нейтрализации моль-эквивалента любой сильной кислоты нейтрализуется моль-эквивалентом сильного основания. В достаточно разбавленных водных растворах реакция нейтрализации для удобства проводится при Т=298 К и она сопровождается почти одинаковым экзотермическим тепловым эффектом реакции, равным Ннейтр = –55,9 кДж/моль (теплота образования воды). Реакции нейтрализации слабых кислот сильным основанием или сильных кислот слабым основанием протекают в две стадии, которые включают: - диссоциацию слабого электролита с соответствующим тепловым эффектом реакции (I); 15 - процесс нейтрализации (II) – c образованием электролита может выделяться или поглощаться теплота. Поэтому суммарный тепловой эффект реакции нейтрализации слабого основания сильной кислотой или сильной кислоты слабым основанием зависит от величины и знака Ндисс слабого электролита. Тепловой эффект реакции диссоциации слабого электролита вычисляют по уравнению: прямой шриФТ Ндисс = Ннейтр (слабого электролита)Ннейтр (сильного электролита) (1) Ндисс = Ннейтр (слабого электролита)Ннейтр (сильного электролита) (1) Тепловой эффект реакции нейтрализации рассчитывается по уравнению теплового баланса для теплового эффекта процесса, с учётом термодинамических знаков, изменения температуры, удельных теплоёмкостей и массы веществ: 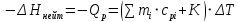 (2) (2)Где 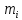 – массы веществ, г; – массы веществ, г;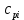 – удельные теплоемкости веществ, Дж/г – удельные теплоемкости веществ, Дж/г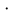 K; K;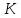 – постоянная калориметра; – постоянная калориметра;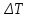 – изменение температуры в результате выделения теплоты нейтрализации, К. – изменение температуры в результате выделения теплоты нейтрализации, К.В данной лабораторной работе мы использовали калориметр простейшего типа, в котором роль изотермической оболочки выполнял стеклянный стакан. Для расчета постоянной калориметра (К) воспользуемся формулой: 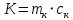 (3) (3)С уменьшением концентрации кислот и оснований (или с увеличением разведения раствора) теплоемкости растворов возрастают, и их усредненное значение приближается к величине удельной теплоемкости воды, поэтому при изучении реакций нейтрализации удельные теплоемкости растворов приравняем к величине удельной теплоемкости воды. Имеем: 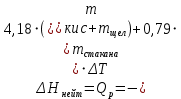 (4) (4)Полученное значение Hнейт имеет размерность Дж/г-экв. . Полученное значение теплового эффекта реакции нейтрализациипо уравнению (1.4) пересчитывают на 1 моль вещества (кислоты или основания), взятого в меньшем количестве (в недостатке) по уравнению (1.5) и сравнивают с табличной величиной Нº298 (стандартным значением теплового эффекта реакции образования воды) по формуле: 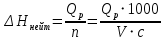 (5) (5)где 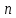 – число моль вещества, взятое в недостатке, равное – число моль вещества, взятое в недостатке, равное 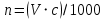 ; ;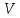 – объем раствора, см3; – объем раствора, см3;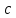 – концентрация вещества, моль/дм3; – концентрация вещества, моль/дм3;Для вычисленных значений Hнейт рассчитывают погрешность проведённого эксперимента в сравнении с табличной величиной. Неполная теорчасть, нет вывода уравнения для расчета теплоты, не рассмотрена теплоемкость, не привиден алгоритм определения теплоты Для химического процесса при Т,V=const тепловой эффект равен изменению внутренней энергии: QvU . (1) Вследствие этого, теплота приобретает свойства термодинамической функции. При p,T = const получаем, что тепловой эффект равен изменению энтальпии. При химических превращениях происходит изменение внутренней энергии системы или энтальпии. Внутренняя энергия (энтальпия) продуктов реакции отличается от внутренней энергии (энтальпии) исходных веществ. Теплоты химических реакций, протекающих при Т, V = const или p, T = const не зависят от числа промежуточных стадий, а определяются начальным и конечным состояниями системы [3]. При экспериментальном и расчетном определении тепловых эффектов реакции используют величины удельной и молярной теплоёмкостей. Удельная (массовая) теплоёмкость обозначается прописной буквой (с). Она равна количеству теплоты, необходимой для нагревания единицы массы вещества на 1 градус (Дж/г К): 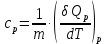 и и 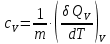 где m – масса, г; T –температура. Молярная теплоёмкость обозначается заглавной буквой (С). Она равна количеству теплоты, необходимой для нагревания одного моля вещества на 1 градус (Дж/моль К): 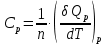 и и 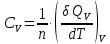 где n = m/M – число молей вещества, М – молекулярная масса вещества. Теплоту процесса определяют с помощью интегральных уравнений: 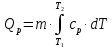 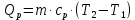 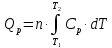 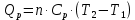 Средние теплоёмкости определяют, как правило, при р = const по уравнениям: 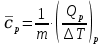 и и 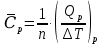 а теплоту процесса определяют по средним значениям теплоёмкостей с помощью интегральных уравнений: 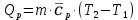 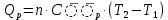 Тепловой эффект реакции нейтрализации рассчитывается по уравнению теплового баланса для теплового эффекта процесса, с учётом термодинамических знаков, изменения температуры, удельных теплоёмкостей и массы веществ: Экспериментальная часть Приборы и реактивы: 1.Учебно-лабораторный комплекс "Химия" в следующем комплекте: - центральный контроллер, - модуль "Термостат" в комплекте со стеклянным стаканчиком (150 см3), мешалкой, термодатчиком и устройством для размещения кислоты в термостате, 2. Растворы кислот, оснований, дистиллированная вода. Не приведены основные этапы работы  Полученные эксперементальные данные: Полученные эксперементальные данные:
 Ход работы: Предварительно взвесили калориметры Залили в калориметры по 100 мл гидроксида натрия. Запустили учебно-лабораторный комплекс "Химия" – elsms2.exe на компьютере, выставили необходимые настройки Поместили в калориметры магниты Спустя 3-5 минут влили в стаканы 5 мл серной и уксусной кислоты. Получили показания в виде графиков в комплексе "Химия". Обработка полученных экспериментальных данных: Обработка полученных экспериментальных данных: Полученные графические зависимости проведённых экспериментов в предыдущем разделе, представлены в форме кривых в координатах "Температура – Время". 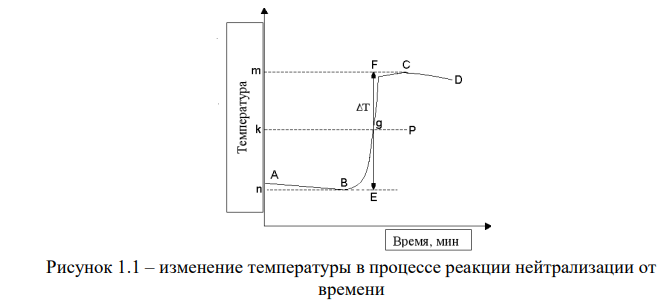 Качественная зависимость термохимического исследования процесса нейтрализации представлена на рисунке 1.1. Время, относящееся к участку АВ, называется "начальным периодом", к участку ВС – "главным периодом", к участку СD – "конечным периодом". Для определения действительного изменения температуры (ΔТ) от времени проводят линии через точки, фиксирующие равномерное изменение температуры "начального периода" АВ и "конечного периода" СD. Качественная зависимость термохимического исследования процесса нейтрализации представлена на рисунке 1.1. Время, относящееся к участку АВ, называется "начальным периодом", к участку ВС – "главным периодом", к участку СD – "конечным периодом". Для определения действительного изменения температуры (ΔТ) от времени проводят линии через точки, фиксирующие равномерное изменение температуры "начального периода" АВ и "конечного периода" СD.За начало главного периода принимают момент начала реакции нейтрализации, которая сопровождается резким подъёмом температуры, в виде скачка (т. В). За конец главного периода принимают точку (т. С), которая определяет начало протекания "конечного периода", то есть первой ложиться на линию СD. Точки В и С проецируют на ось ординат, находят середину отрезка mn в виде точки k и проводят через эту точку линию kp до пересечения с кривой ВС в точку g. Через точку g проводят вертикаль (перпендикуляр). Экстраполируют линейные участки АВ и СD до пересечения с вертикалью в точках E и F. Отрезок EF, выраженный в градусах, соответствует изменению температуры, в калориметрическом эксперименте с учётом поправки на теплообмен. Крутизна линии ВС зависит от характера и условий протекания процесса нейтрализации. Угол наклона АВ и СD зависит от степени теплообмена калориметра с окружающей средой. По виду кривой АВСD можно судить о качестве проведённого эксперимента. 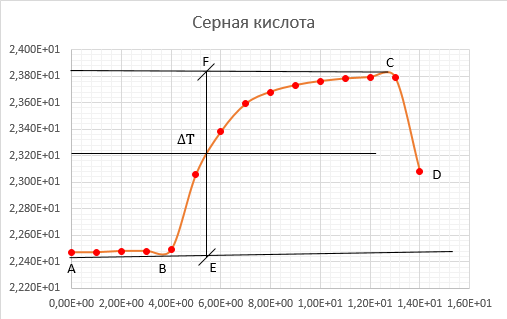 Из графика видно, что для серной кислоты T = 1,31 ˚С. 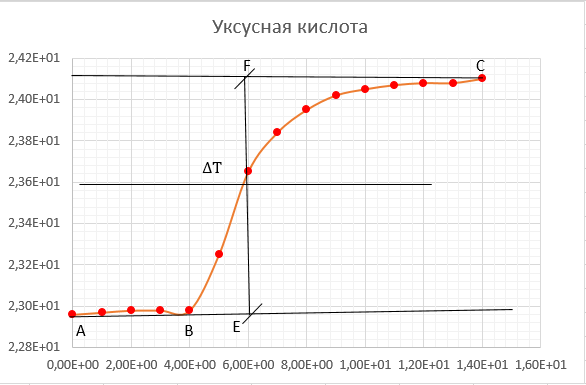 Из графика видно, что для серной кислоты T = 1,12 ˚С. Воспользуемся формулой для нахождения удельной теплоемкости и затем пересчитаем на 1 моль вещества, взятого в недостатке.: 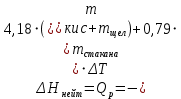 и и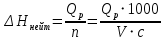 Тогда для серной кислоты получаем, что тепловой эффект реакции по формуле 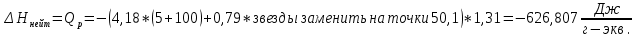 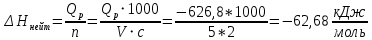 А для уксусной, по тем же формулам: 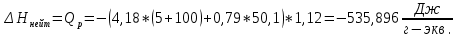 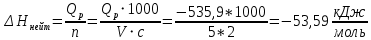 Сравним со стандартным значением теплового эффекта реакции образования воды в кДж/моль, абсолютная погрешность будет равна: 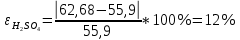  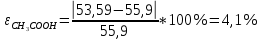 Вывод: в ходе лабораторной работы были проведены эксперименты по нейтрализации серной и уксусной кислоты, взятых в недостатке в объёме 5 мл, гидроксидом натрия в объёме 100 мл, измерен тепловой эффект реакций нейтрализации, пересчитанный на один моль вещества, взятого в недостатке, и сопоставлен со стандартным значением теплового эффекта реакции образования воды, было подтверждено постоянство значений теплоты реакций нейтрализации различных по составу сильных кислот и оснований, полностью диссоциированных в водных растворах, связанное с тем, что в системах протекают одинаковые процессы, завершающиеся образованием воды. Некорректный вывод, нет погрешностей при опр теплоты Рассчитали отклонения от справочных величин ε1 =12% ε2 = 4,1% ε1 >ε2 , но CH3COOH слабый электролит, и в тепловой эффект реакции дополнительно будет включаться ΔHдис , выделяющееся при диссоциации слабого электролита CH3COOH. 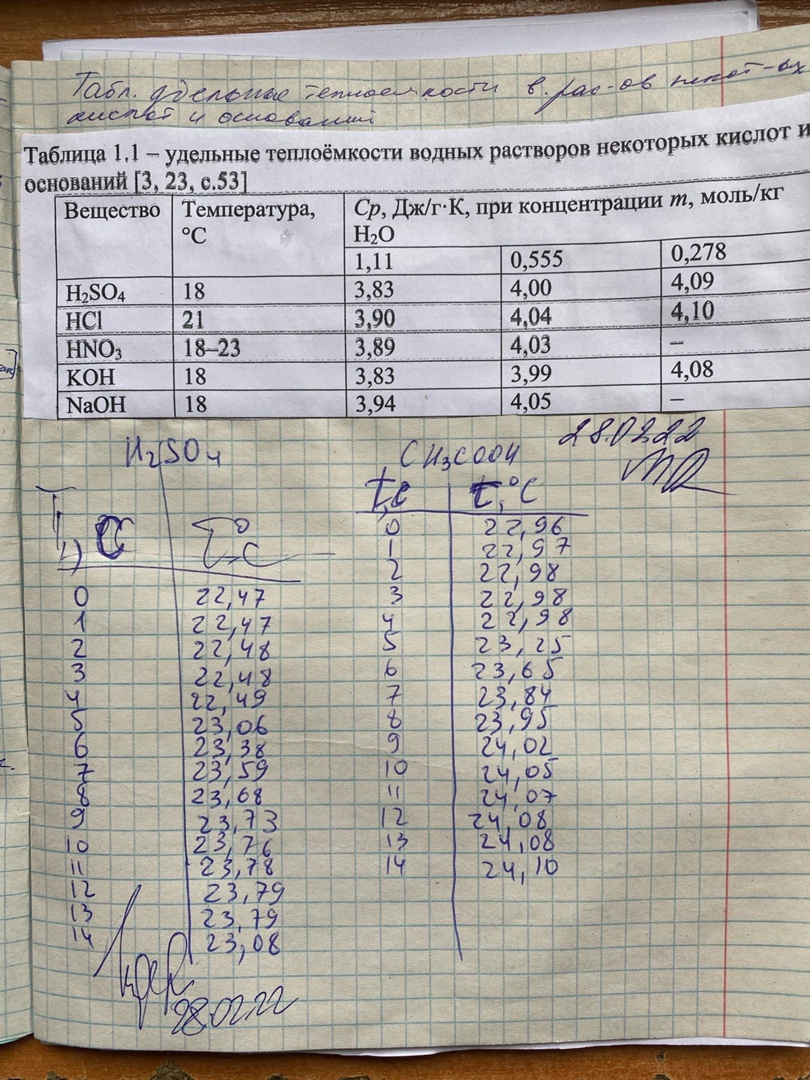 Оценка ЛР – 0,7Б Лабораторная работа № 2 «Определение теплоты растворения соли в воде» Цель работы: определение количества теплоты, выделившейся при растворении неизвестной неорганической соли в воде. Краткая теоретическая часть: ссылка? [2, стр. 25-37] при растворении неорганической соли неограниченно растворяющейся в воде в ней протекают два основных процесса – разрушение кристаллической решётки твёрдого тела (эндотермический процесс), сольватация ионов молекулами воды (экзотермический процесс). В зависимости от соотношения тепловых эффектов этих двух процессов, теплота растворения соли может выделяться системой (ΔHразр < ΔHсольв) или поглощаться (ΔHразр > ΔHсольв). Теплота растворения соли в воде, то есть её знак и количество, определяются природой растворённого вещества и растворителя. Растворение многих солей (KCl, KBr, KI, KClO, NaCl) в воде – экзотермические физикохимические процессы, а некоторые соли: LiCl, LiBr, NaBr, NaI при растворении в воде поглощают теплоту извне и являются эндотермическими физикохимические процессами. При растворении твёрдого вещества в жидкости различают интегральную и дифференциальную (парциальную) теплоты растворения. Интегральная теплота растворения определяется как изменение энтальпии при растворении 1 моль вещества в определённом (конечном) количестве растворителя, чистой жидкости. Другими словами, под интегральной теплотой растворения понимается величина теплового эффекта процесса растворения 1 г (удельная) или 1 моль вещества (молярная) в таком количестве растворителя, который образует раствор определённой моляльной концентрации m. Изменение энтальпии при растворении 1 г или 1 моль вещества в бесконечно большом количестве растворителя, таком, при котором изменение его концентрации при растворении соли можно считать равным нулю, называют дифференциальной теплотой растворения. В калориметрических опытах определяют только интегральные теплоты растворения веществ в воде. Дифференциальные теплоты растворения находят расчётным путем по зависимости интегральных теплот растворения от концентрации раствора. Процесс растворения соли в жидкости зависит от природы растворяемого вещества, природы растворителя, температуры, давления и присутствия в растворе посторонних веществ, особенно электролитов. Природа растворяемого вещества – Растворимость твёрдого тела зависит как от природы аниона, так и природы катиона Природа растворителя – Как показывает опыт, неполярные вещества лучше растворяются в неполярных растворителях, а полярные в полярных, в соответствии с принципом подобия: "Подобное лучше растворяется в подобном". Так, сера хорошо растворяется в неполярном сероуглероде, а фенолы, пиридин, мочевина – в полярной воде. Температура – Температура по-разному влияет на растворимость твердых тел в жидкостях. Как показано на рисунке всё зависит от знака величины Hраст. 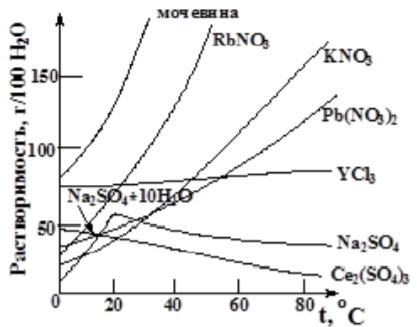 Рисунок 1. – Растворимость твёрдых тел в воде Растворимость твёрдого тела зависит как от природы аниона, так и от природы катиона. Природа различной растворимости твердых веществ в различных растворителях еще недостаточно выяснена. Как показывает опыт, неполярные вещества лучше растворяются в неполярных растворителях, а полярные в полярных, в соответствии с принципом подобия: "Подобное лучше растворяется в подобном". Величины интегральных теплот растворения зависят как от температуры, так и от концентрации растворённого вещества. Поэтому при расчёте численного значения интегральной теплоты растворения необходимо указывать температуру и концентрацию раствора. При проведении опыта давление в калориметрической системе остаётся постоянным и равным атмосферному давлению, поэтому расчёт теплоты растворения проводят на основе уравнения теплового баланса: Теплоёмкости разбавленных растворов неорганических солей в воде практически одинаковы и равны теплоёмкости воды, поэтому при изучении реакций растворения хорошо растворимых неорганических солей в воде за удельные теплоёмкости растворов можно с достаточной точностью принять величину удельной теплоёмкости воды. Величина К равна произведению удельных теплоемкостей частей калориметра, участвующих в теплообмене и их массы. Точно определить теплоёмкость составных частей калориметра не представляется возможным. Величину К (постоянная калориметра) определяют экспериментально по изменению температуры при растворении определённого количества соли с известной теплотой растворения. В качестве соли с известной теплотой растворения можно использовать KCl или NH4Cl. С учетом вышесказанного уравнение теплового баланса запишется в виде: Теплота процесса растворения соли в воде (тепловой эффект реакции) величина экстенсивная, то есть её значение зависит от массы раствора. Поэтому удельную энтальпию растворения ΔHраст необходимо перевести в молярную, пересчитывая её величину на 1 моль вещества KCl или NH4Cl по формуле: 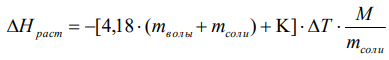 Экспериментально определяют изменение температуры в результате выделения теплоты в процессе растворения соли в воде и, зная табличное значение молярной интегральной теплоты растворения для заданной концентрации раствора, рассчитывают величину К по уравнению: 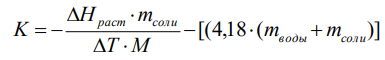 Зная постоянную калориметра можно рассчитать теплоту растворения неизвестной соли. Приборы и реактивы: 1.Учебно-лабораторный комплекс "Химия" в следующей комплектации: - центральный контроллер; - модуль "Термостат" в комплекте со стеклянным стаканчиком (150 см3), мешалкой, термодатчиком и устройством для размещения кислоты в термостате. 2. Навеска соли с известной теплотой растворения ( 2 г) и навеска неизвестной соли ( 2 г). Полученные экспериментальные данные: График зависимости температуры от времени растворения известной соли (KCl): График зависимости температуры от времени растворения неизвестной соли: 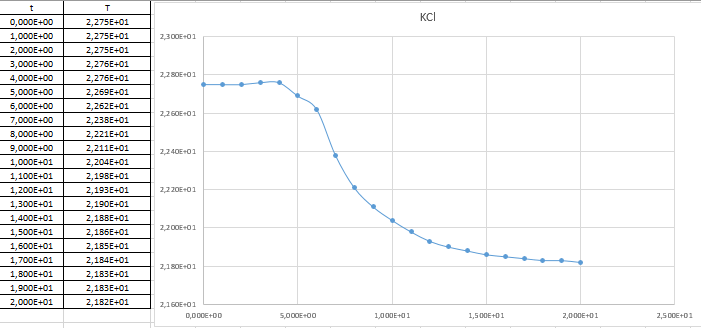 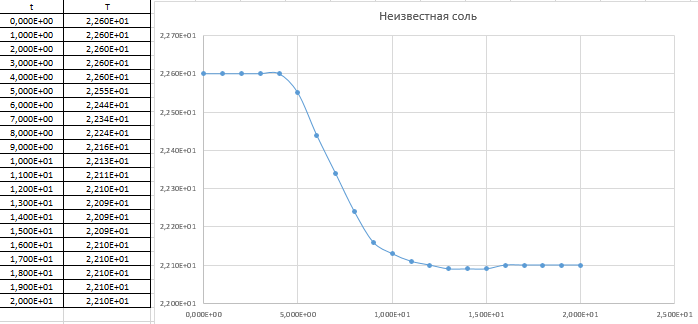 График зависимости температуры от времени растворения неизвестной соли: График зависимости температуры от времени растворения неизвестной соли:Изменение температуры известной соли KCl: ΔT= - 0,92 Изменение температуры неизвестной соли: ΔT= - 0,51 Таблица 2.1 – Значения интегральных теплот растворения KCl и NH4Cl в воде.
Интегральная теплота растворения соли KCl(берем из таблицы): 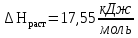 при моляльной концентрации С=0,3 при моляльной концентрации С=0,3С= 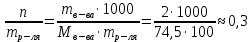 Рассчитываем константу калориметра К: 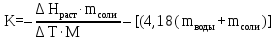 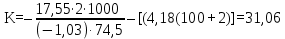 Определяем интегральную теплоту растворения неизвестной соли: ΔHраст = -[4,18 ∙(mводы +mсоли) + К] ∙ΔT ΔHраст = -[4,18 ∙ (100 + 1,9 ) + 31,06] ∙ (-0,50)=244,03 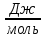 Определяем удельную интегральную теплоту растворения 1г неизвестной соли ΔH1раст ΔH1раст = ΔHраст /mсоли ΔH1раст = 244,03 /1,9=128,4 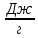 = 0,1284 = 0,1284 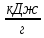 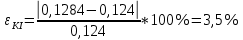 По значению величины ΔH1раст устанавливаем название неизвестной соли, сравнивая вычисленное значение с табличными данными при концентрации C=0,3. Полученное значение удельной интегральной теплоты растворения соответствует йодиду калия (KI). Таблица – Значения удельных интегральных теплот растворения солей в воде.
Вывод: Определили интегральную теплоту растворения неизвестной соли ΔH1раст. Неизвестной солью является йодид калия (KI). Результаты оказались адекватными, поскольку их погрешность оказалась невелика по сравнению с табличными данными. В ходе выполнения работы, мы определили количество теплоты, выделившейся при растворении неизвестной неорганической соли KI в воде, по итогам работы можно сказать о том, что данный метод достаточно эффективный, т. к. он имеет высокую точность измерений, т.е. погрешность проведённого нами эксперимента 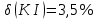 , оказалась достаточно мала. , оказалась достаточно мала. Некорректный вывод, не приведенны полученные значения теплот и погрешности определения  Оценка 0,7б Лабораторная работа № 13 (вариант 2) «Фотометрическое изучение кинетики разложения комлексного триоксалата марганца» Цель работы: определение константы скорости реакции разложения триоксалата марганца. Краткая теоретическая часть: [2, стр. 225-231] Реакция разложения комплексного иона триоксалата марганца выглядит следующим образом- Хотя механизм реакции сложен, зависимость ее скорости подчиняется уравнению первого порядка и, следовательно, ее константу скорости при заданной температуре можно определить по уравнению- 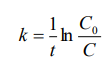 При проведении работы проводится реакция восстановления перманганата калия с образованием комплекса триоксалата марганца (III). Далее образовавшийся комплекс разлагается до бесцветного соединения марганца (II). Изменение окраски раствора при этом обусловлено различием в спектрах поглощения перманганат-ионов и триоксалата марганца (III). Спектры поглощения показаны на рисунке: не указано, на какой длине волны надо работать 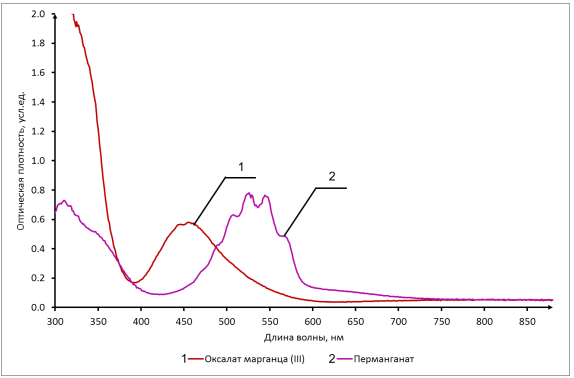 Согласно закону Бугера-Ламберта-Бера, оптическая плотность раствора пропорциональна его концентрации: Так как оптическая плотность пропорциональна концентрации: 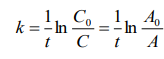 Таким образом, константу скорости разложения триоксалата марганца при фиксированной температуре можно определить, измеряя оптическую плотность раствора в разные моменты времени. Неполная теорчасть, не описаны методы определения порядка реакции Приборы и реактивы: 1. Фотоколориметр «Экрос» или модуль «Фотоколориметр» комплекса УЛК «Химия». 2. Кюветы шириной 10 мм. 3. Раствор 0,1 N щавелевой кислоты. 4. Раствор 0,1 N сульфата марганца. 5. Раствор 0,01 N перманганата калия 6. Дистиллированная вода. 7. Синий светофильтр. 8. Секундомер. Ход работы: 1) Приготовили реакционную смесь 2) Замерили начальную температуру 3) Налили раствор в кювету и включили секундомер 4) Измерили и записали температуру после измерений Не приведены основнвые этапы работы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
