Отчет Севиль. Отчет производственной практики (по профилю специальности) пм03 Планирование и организация работы
 Скачать 81.79 Kb. Скачать 81.79 Kb.
|
ОТЧЕТ производственной практики (по профилю специальности) ПМ03 Планирование и организация работы персонала подразделения 1. Специальность 19.02.01 Биохимическое производство 2. Курс ___IV_____ Группа 19ПБ1т 3. Студент (а-ка) Байрамова Севиль Габилевна 4. Место практики ____ПАО «Биосинтез»______________________ (предприятие, организация) 5. Время прохождения практики с 12.12.2022 г. по 24.12.2022 г. 6. Оценка ________________________________________________ Руководитель практики от подразделения ____________ ФИО, подпись Руководитель практики от колледжа Серёгина Ж.А. ФИО, подпись СОДЕРЖАНИЕ
1.Характеристика ПАО «Биосинтез» (вид и специализация). ПАО «Биосинтез» (группа компаний Sun Pharma) - один из крупнейших производителей лекарственных средств на фармацевтическом рынке России. Главная задача компании– разработка, внедрение и производство высокоэффективных, качественных и доступных по цене лекарственных средств. Предприятие производит более 180 наименований востребованных российским потребителем препаратов основных фармакотерапевтических групп. В составе обширной номенклатуры представлены препараты различных фармакотерапевтических групп: Антибиотики Антимикробные средства разных групп Бронхолитические средства Витамины Гипогликемические средства Желчегонные средства и ферменты Противовирусные средства Сердечно-сосудистые средства и др. Предметом деятельности предприятия является: - производство, реализация и сбыт лекарственных средств; - оптовая и розничная реализация лекарственных средств, медицинской техники и изделий медицинского назначения; - определение потребности в медикаментах с привлечением для этого профессионального потенциала аптечных, медицинских и научных работников здравоохранения, создание неснижаемых запасов медикаментов по установленной номенклатуре, спецпрепаратам; - организация закупки, заготовки и сбыта сырья (в том числе растительного) для производства лекарственных средств; - Проведение качественных, количественных, товароведческих, химико-физических, радиологических и других анализов и экспертиз, проведение анализов на соответствие требованиям безопасности лекарственных средств по заказам граждан и юридических лиц всех форм собственности и организационно-правовых форм; 2. Составление схемы управления ПАО «Биосинтез». 1. Администрация Осуществляет системное руководство предприятием Представляет предприятие в сообществе Определяет общую политику предприятия и ее составляющих (кадровую, экономическую, финансовую политику качества и др.) Формирует структуру предприятия Руководит ресурсным обеспечением предприятия Структура административного аппарата Во главе высшее звено, его поручения выполняет исполнительный директор, а дальше обязанности распределяются между директорами по: производству, по качеству, по науке, финансовый и технический директора. Директору по производству подчиняются: ● главный технолог ● начальники производственных участков ● заведующие складами Директору по качеству (уполномоченное лицо по качеству) подчиняются: ● Подразделение по обеспечению качества ● подразделение по контролю качества Директор по науке имеет в подчинении: ● начальника отдела по инновациям ● начальника отдела по регистрации ● начальника отдела доклинических исследований ● начальника отдела клинических исследований Директору по развитию подчиняются руководители: ● научно-исследовательской лаборатории ● подразделений по маркетинговому и экономическому анализу ● подразделения по связям с общественностью ● PR подразделений (отдел прикладных задач) Финансовый директор руководит: ● Главный бухгалтер ● Начальник планового отдела ● Начальник коммерческого отдела ● Начальник отдела расчета заработной платы Технический директор: ● Главный инженер ● Начальник транспортно-логистического отдела ● Начальник отдела эксплуатации помещений и оборудования 2. Производство Функции: Производство ЛС Подготовка и очистка оборудования Упаковка и маркировка ЛС Хранение ЛС Логистика перемещений средств продуктов в процессе производства 3. Система управления качеством производства Функции: Контроль качества производства Контроль климатических показателей помещений Контроль санитарных норм помещений, оборудования, персонала Контроль качества сырья Контроль качества упаковочных и маркеровочных материалов Обеспечение качества производства Проведение комплекса мероприятий, направленных на предупреждение отклонений производства от установленных норм Разработка документации по системе управления качеством Проверка выполнения инструкций по использованию помещений, оборудования, стандартных операционных процедур Обучение персонала 4. Коммерческая служба Функции: Оснащение предприятия Сырьем упаковочными, маркировочными и другими материалами оборудованием материалами для поддержания помещений предприятия в соответствии установленными нормами Сбыт готовой продукции Поиск и анализа рынка сбыта 5. Вспомогательные структуры Функции транспортно-логистического подразделения: ● Доставка грузов от поставщиков ● Доставка готовой продукции потребителям ● Экономический анализ логистических связей “поставщик-предприятие-потребитель” ● Экономическое планирование логистических связей “поставщик-предприятие-потребитель” ● Договорная деятельность с транспортными компаниями ● Договорная деятельность с охранными компаниями Функции технико-инженерного подразделения: ● Обеспечение надлежащей эксплуатации зданий помещений оборудования производственного предприятия ● Обеспечение работы оборудования в установленном режиме ● Своевременный ремонт и устранение отклонений в работе оборудования ● Постоянное обслуживание производственного и непроизводственного оборудования ● Предупредительные меры, направленные на исключения отклонений в использовании помещений и оборудования К вспомогательным отделам относятся такие структуры как: ● плановый отдел предприятия ● отдел труда и заработной платы ● отдел кадров ● бухгалтерия ● отдел регистрации ЛП ● отдел работы по внешним связям ● отдел логистики ● Юр.отдел ● отдел строительства и ремонта помещений ● охрана ● служба безопасности ● и множество других 3. Анализ производственной деятельности участка приготовления препарата Хлосоль раствор для инфузий V= 200 мл (рабочие места, их количество, виды выполняемых работ, техническая оснащенность, учет сырья и материалов). Состав хлосоля:
Краткая технология. Раствор готовят в асептических условиях массо-объемным способом. Соли последовательно растворяют в 2/3 объема воды для инъекций. Затем объем раствора доводят водой для инъекций до требуемого объема и перемешивают. Раствор фильтруют, разливают в бутылки для крови по 200 мл, укупоривают резиновыми пробками, обкатывают металлическими колпачками и стерилизуют насыщенным водяным паром под давлением при 120 °С в течение 12 мин. Описание. Бесцветная прозрачная жидкость. Стерильность. Препарат должен быть стерильным (ГФ, изд.XI, вып.2, с.187 "Испытание на стерильность"). Как внутривенные препараты, инфузии должны производиться в чистых помещениях, в которых контролируется концентрация взвешенных в воздухе аэрозольных частиц и поддерживается температурно-влажностный режим. Чистые помещения проектируются и строятся так, чтобы при эксплуатации обеспечивать проведение соответствующих производственных операций. Все элементы конструкций системы надлежащим образом исполняют ограждающе-изолирующие функции для чистых помещений, не создают загрязнений, не выделяют микрочастицы и микроорганизмы, исключают скопление пыли и накопление статического электричества. Системы вентиляции и кондиционирования воздуха в производствах с чистыми помещениями предназначены для обеспечения заданных классов чистоты воздуха. Система вентиляции и кондиционирования обуславливает восстановление класса чистоты, если были внесены загрязнения в чистое помещение, поддерживает необходимый перепад давления воздуха и параметры микроклимата в соответствии с техническими требованиями и санитарными нормами, удаляет вредные вещества и, конечно, служит для подачи наружного воздуха. Как видите, задач у системы воздухоподготовки много. Решить их помогает трехступенчатая, а в некоторых случаях и четырехступенчатая система очистки воздуха. Заданные параметры воздуха поддерживаются в рабочем режиме системой автоматизации для обеспечения надежного и эффективного функционирования вентиляции. Чистые помещения для производства стерильных лекарственных средств классифицируются в соответствии с требованиями к окружающей среде. Каждая производственная операция требует определенного уровня чистоты окружающей среды в эксплуатируемом состоянии. Для обеспечения соответствия чистых помещений требованиям, предъявляемым к эксплуатируемому состоянию, их проект должен предусматривать достижение заданных классов чистоты воздуха в оснащенном состоянии. Чистые зоны при производстве стерильных лекарственных средств подразделяются на четыре типа: А - локальная зона для проведения операций, представляющих высокий риск для качества продукции, например: зоны наполнения, укупорки, вскрытия ампул и флаконов, соединения частей оборудования в асептических условиях; В - зона, непосредственно окружающая зону А и предназначенная для асептического приготовления и наполнения; С и D - чистые зоны для выполнения менее ответственных стадий производства стерильных лекарственных средств. Помещения 1-го класса чистоты предназначаются для выгрузки и наполнения стерильных ампул. В помещениях 2-го класса проводится приготовление растворов, фильтрование, мойка флаконов, сушка и стерилизация. Помещение 3-го класса - для мойки и стерилизации вспомогательных материалов. В помещениях 4-го класса осуществляется мойка дрота, выделка ампул и др. 4. Оперативное планирование работ персонала цеха №3. Надлежащее производство лекарственных средств зависит от персонала. Поэтому на предприятии должно быть достаточное количество квалифицированного персонала для решения всех задач, находящихся в сфере ответственности производителя. Каждый сотрудник должен понимать индивидуальную ответственность, которая должна быть документирована. Весь персонал должен знать принципы GMP, касающиеся его деятельности, а также пройти первичное и последующее обучение в соответствии с его обязанностями, включая инструктаж по выполнению гигиенических требований. Общие требования. Производитель должен иметь достаточное количество сотрудников с необходимой квалификацией и практическим опытом работы. Высшее руководство должно определять и обеспечивать достаточные и надлежащие ресурсы (человеческие, финансовые, материальные, а также помещения и оборудование) для внедрения и поддержания системы управления качеством и постоянного повышения ее эффективности. Обязанности любого сотрудника не должны быть чрезмерными, чтобы исключить возможность возникновения рисков для качества продукции.На предприятии должна быть схема организационной структуры, в которой отношения между руководителями производства, контроля качества и, где это применимо, руководителем подразделения обеспечения качества или подразделения по качеству. Обязанности руководящих работников и соответствующие полномочия для их выполнения должны быть определены и прописаны в должностных инструкциях. Их обязанности могут быть переданы назначенным заместителям, обладающим достаточным уровнем квалификации. Круг обязанностей персонала должен охватывать все стороны GMP, однако не должно быть необоснованного дублирования сфер ответственности. Высшее руководство несет основную ответственность за обеспечение эффективной системы управления качеством для достижения целей в области качества, а также за то, что роли, обязанности и полномочия определены, доведены до сведения персонала и осуществляются в рамках всей организации. Высшее руководство должно установить политику в области качества, которая описывает общие намерения и направления деятельности компании, связанные с качеством и должно обеспечить постоянную пригодность и эффективность системы управления качеством и соответствие GMP путем участия в анализе со стороны руководства. Ключевой персонал. Высшее руководство должно назначить ключевой руководящий персонал, включая руководителя производства и руководителя подразделения контроля качества, и достаточное количество, но, по крайней мере, одно Уполномоченное лицо, если руководитель производства и/или руководитель подразделения контроля качества не отвечает за обязанности, предусмотренные для Уполномоченного лица. Ключевой руководящий персонал, как правило, должен работать полный рабочий день. Руководители производства и подразделения контроля качества должны быть независимы друг от друга. В больших организациях может возникнуть необходимость передать другим сотрудникам отдельные функции. Кроме того, в зависимости от размера и структуры организации может быть отдельно назначен руководитель подразделения обеспечения качества или руководитель подразделения качества. Обязанности Уполномоченного лица: a) для лекарственных средств, произведенных на территории государств-членов Союза, Уполномоченное лицо должно убедиться, что каждая серия была произведена и проверена в соответствии с законодательством, действующим в данном государстве-члене и в соответствии с требованиями регистрационного досье Уполномоченное(ые) лицо(а) перед выпуском любой серии должно(ы) документально подтвердить, что все необходимые операции выполнены, и что каждая серия соответствует установленным требованиям. Образование, обучение и стаж работы Уполномоченных лиц должны соответствовать установленным требованиям Союза. Они должны постоянно и непрерывно находиться в распоряжении владельца лицензии на производство для выполнения своих обязанностей. Обязанности Уполномоченного лица могут быть переданы только другому Уполномоченному(ым) лицу(ам). 5. Выполнение правил техники безопасности, производственной и трудовой дисциплин, трудового распорядка в цехе №3. Оборудование, используемое для производства и контроля качества лекарственных средств сконструировано и размещено так, чтобы максимально облегчить его подготовку к работе, эксплуатацию и обслуживание. Вид, размер и характеристики оборудования соответствуют проводимым технологическим процессам. К конструкции оборудования предъявляются определенные требования: Поверхности оборудования, соприкасающиеся с исходным сырьем, полупродуктами или готовым продуктом, гладкие и изготовлены из нетоксичного, стойкого к коррозии материала, который не реагирует с используемым сырьем или материалами и выдерживает обработку дезинфицирующими средствами и/или стерилизацию; Все детали оборудования, контактирующие с используемыми сырьем, материалами и полупродуктами, съемные для облегчения их мойки, обработки дезинфицирующими средствами или стерилизации; Оборудование не загрязняется материалами, используемыми для его эксплуатации (например, смазочными веществами) во избежание ухудшения качества и загрязнения готовых продуктов; Все передающие устройства (транспортеры, цепные передачи, приводы трансмиссии) закрыты или отгорожены; Бункеры, емкости и аналогичное оборудование закрыто. Кроме того, конструкция оборудования должна: • минимизировать риск ошибок, предусматривать проведение эффективной уборки и обслуживания с целью предотвращения перекрестного загрязнения, появления пыли и грязи и, в общем случае, устранения любого фактора, ухудшающего качество продукции; обеспечивать удобство и возможность его очистки. Операции по очистке оборудования должны выполняться в соответствии с подробными письменными инструкциями. Оборудование необходимо содержать в сухом и чистом виде, инвентарь и материалы для очистки не должны быть источниками загрязнения. Оборудование размещено таким образом, чтобы: оптимизировать потоки исходного сырья, материалов и свести к минимуму перемещение персонала; предотвратить возможность загрязнения лекарственных средств в процессе их производства; предотвратить риск смешивания разных продуктов или исключения какой-либо из стадий производственного процесса; облегчить мойку, обработку, эксплуатацию и обслуживание оборудования. Неисправное оборудование должно быть удалено из производственных помещений и помещений отдела контроля качества или, в крайнем случае, должно быть отделено и четко соответствующим образом промаркировано до его удаления из помещения. Технологическая линия в цехе №3 включает весовую и комнату прокаливания, отделение водоподготовки и получения воды для инъекций, отделения накопления упаковки, мойки, розлива, укупорки, стерилизации полупродукта, термальной обработки и обеззараживания. Среди вспомогательных помещений (помимо помещения персонала) - передаточные камеры и шлюзы, отделения стирки и сушки спецодежды, моечные, весовые, приборные и дозовочные комнаты, боксы и прочее. Также были оборудованы химическая и бактериологическая лаборатории. Конструкция, установка и расположение оборудования, мест соединения и зон обслуживания должны предусматривать возможность работы с оборудованием, его техническое обслуживание и ремонт снаружи чистой зоны. В случае необходимости проведения стерилизации ее следует выполнять после максимально полной разборки оборудования. Если при проведении технического обслуживания или ремонта оборудования, находящегося в чистой зоне, был нарушен уровень чистоты (стерильности), то перед возобновлением производства следует выполнять соответствующую очистку, дезинфекцию и/или стерилизацию этого оборудования (зоны). Получение воды требуемого качества должно гарантироваться проектом, конструкцией, монтажом и техническим обслуживанием систем подготовки и распределения воды. Не допускается эксплуатация оборудования подготовки воды сверх проектной мощности. Приготовление, хранение и распределение воды для инъекций следует выполнять так, чтобы исключить рост микроорганизмов, например, за счет постоянной циркуляции воды при температуре выше плюс 70°С. 6. Выводы и рекомендации по совершенствованию организации работы цеха №3. Вывод: изучила особенности промышленного изготовления инфузионных лекарственных средств, познакомилась с должностными инструкциями, провела анализ системы организации труда в подразделении и конкретного рабочего места, приняла участие в расчете цеховой и полной себестоимости готовой продукции. Совершенствование технологического процесса происходит благодаря использованию современных производственных модулей, разработке новых современных приборов и аппаратов (мерники-смесители, фильтрующие установки, установки ламинарного потока воздуха, стерилизующие аппараты, приборы для контроля отсутствия механических включений и др.); Список используемой литературы. 1.И.И. Краснюк, Г.В. Михайлова «Фармацевтическая технология» Москва, «Академия» 2006г.Для высшего профессионального образования 2.И.И. Краснюк, Г.В. Михайлова «Практикум по технологии лекарственных форм» Москва, «Академия» 2006г. Для высшего профессионального образования 3.И.А.Муравьев. Технология лекарств. В 2х томах. М.Медицина.1980г. 4.Т.С.Кондратьева «Технология лекарственных форм» в 2х томах М. Медицина 1991г. 5.Т.П. Прищеп, В.С. Чухалин «Основы фармацевтической биотехнологии» Ростов-на-Дону, Издательство НТЛ, Сибирский Государственный Медицинский Университет, 2006 год. 6.Руководство к лабораторным занятиям по аптечной технологии лекарственных форм. Под редакцией Т.С. Кондратьевой. М.Медицина 1986. 7. Меньшутина Н.В., Мишина Ю.В. и др. «Инновационные технологии и оборудование фармацевтического производства» - в 2-х Т., М.: Издательство БИНОМ, 2013. 8. https://www.business.ru/article/2254-ustav 9. https://studfile.net/preview/7668645/ 10.https://www.gd.ru/articles/8037-normirovanie-truda Приложение 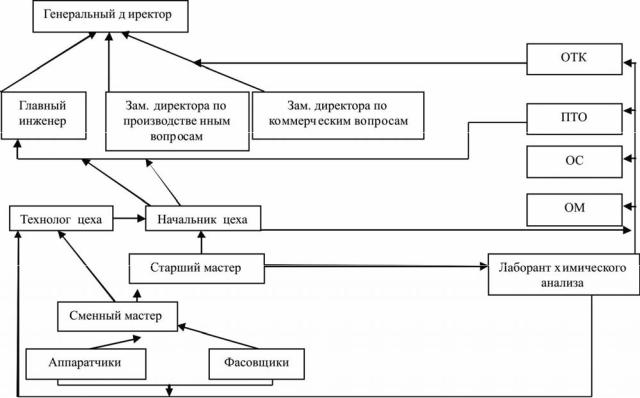 |
