Ответы по химии!
 Скачать 1.34 Mb. Скачать 1.34 Mb.
|
|
Методы диспергирования Физический метод конденсации –– метод замены растворителя Химические методы конденсации основаны на реакциях гидролиза, окисления, восстановления, обмена. Эмульсии (и среда, и фаза – нерастворимые друг в друге жидкости). Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т.д. Суспензии ( среда – жидкость, фаза – нерастворимое в ней твердое вещество).Чтобы приготовить суспензию , надо вещество измельчить до тонкого порошка, высыпать в жидкость и хорошо взболтать. Со временем частица выпадут на дно сосуда. Очевидно, чем меньше частицы, тем дольше будет сохраняться суспензия. Это строительные растворы, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде – планктон, которым питаются гиганты – киты, и т.д. Аэрозоли взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различаются пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях) Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия (“растворимого стекла”) с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (III) в горячей воде. 33. Устойчивость дисперсных систем. Седиментационная , агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей. Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время. Устойчивость дисперсных систем может быть: 1.К осаждению дисперсной фазы - характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость. 2.К агрегации ее частиц. Агрегативная или конденсационная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность. Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). Седиментационная (кинетическая) устойчивость – это способность системы противостоять осаждению частиц дисперсной фазы под действием силы тяжести (седиментация). Она находится в зависимости от размеров частиц в системе, осаждению которой противодействуют силы диффузии. Высокодисперсные системы устойчивы к седиментации, в то время как грубодисперсные системы седиментационно не устойчивы. Факторы, влияющие на устойчивость .
34. Коагуляция.Порог коагуляци и нго определение,правило Шульце-Гарди.Взаимная коагуляция. Коагуляция (от лат. coagulatio — свертывание, сгущение), также старение — объединение мелких частиц дисперсных систем в более крупные под влиянием сил сцепления с образованием коагуляционных структур. Коагуляция — физико-химический процесс слипания коллоидных частиц. Коагуляция ведёт к выпадению из коллоидного раствора хлопьевидного осадка или к застудневанию. Коагуляция — естественный, самопроизвольный процесс расслаивания коллоидного раствора на твёрдую фазу и дисперсионную среду. Таким образом дисперсная система стремится достигнуть состояния минимальной энергии. Взаимная коагуляция – смешивание двух коллоидных р-ов с разноименно – заряженными частицами, ведущая к образованию осадка. Взаимная коагуляция происходит тогда, если суммарный заряд частиц одного золя нейтрализует суммарный заряд другого. При коагуляции золи смесями электролитов наблюдаются разные закономерности коагуляции: 1) вычитание коагулирующего действия (антогонизм). При этом происходит образование пептизаторов, которые хорошо адсорбируются или образование из исходных ионов слабо диссоциирующих молекул; 2) суммированием коагуляции – его действие (аудетивность); 3) усиление коагулирующего действия (синергизм 35. Поверхностные явления и адсорбция. Адсорбционные равновесия и процессы на подвижных границах раздела фаз.Уравнение Гиббса 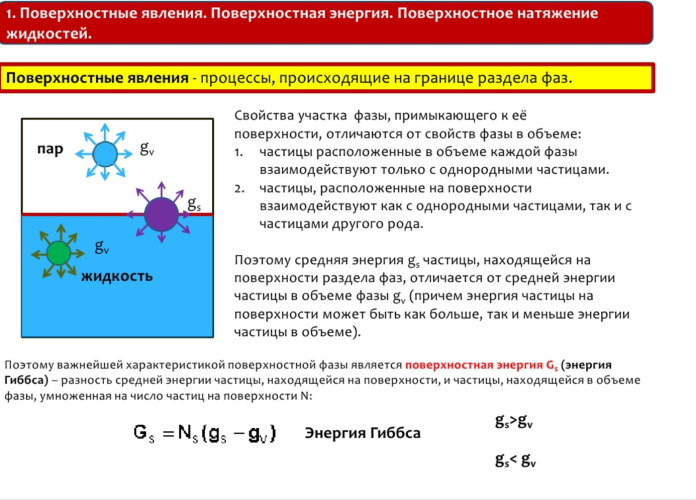 . .Адсорбцией называется самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению с его концентрацией в объеме фазы. Более плотную фазу (определяющую форму поверхности) принято называть адсорбентом, вещество, молекулы которого могут адсорбироваться -- адсорбтивом, уже адсорбированное вещество -- адсорбатом. Процесс, обратный адсорбции, называют десорбцией. Адсорбционные равновесия Адсорбционное равновесие в системе «газ - жидкость». Закон Генри. Мономолекулярная адсорбция в системах «газ - жидкость», «жидкость - жидкость», «газ - твердое». Изотерма адсорбции Ленгмюра. Уравнение Фрейндлиха. Теория полимолекулярной адсорбции БЭТ. Уравнение БЭТ Предположим, что имеются компоненты-неэлектролиты. Будем считать, что адсорбат образует на поверхности адсорбента мономолекулярный слой. Мономолекулярная адсорбция с точки зрения термодинамики процесса выражается химическим потенциалом в адсорбционном слое и объемной фазе: где - химический потенциал вещества в адсорбционном слое; - химический потенциал вещества в объемной фазе. При равновесии потенциалы равны: . Преобразуем: - адсорбция; аi = c. , где D - коэффициент распределения. Выражение - константа Генри. Она не зависит от концентрации, определяется при постоянной температуре, A/a=Kг, А=аКг- закон Генри, т.е. при разбавлении системы коэффициент распределения стремится к постоянному значению, равному константе Генри. Если концентрация в сорбционном слое стремится к нулю, то а с; а = ?с; ? 1. Поэтому на практике закон Генри используют в следующем виде: а=Кгсi. Если одна из фаз - газ, то имеем следующий вид: a = КгРi, Кг = Кг/RT. Эти уравнения представляют собой уравнения изотермы адсорбции при малых концентрациях. В соответствии с этими уравнениями можно по другому сформулировать закон Генри: величина адсорбции при малых давлениях газа (малых концентрациях вещества в растворе) прямо пропорциональна давлению (концентрации. При адсорбции на твердых телах область действия закона мала из-за неоднородности поверхности, но даже на однородной поверхности при увеличении концентрации обнаруживается отклонение от закона. При малых концентрациях распределенного вещества отклонения обусловлены в основном соотношением между взаимодействием молекул друг с другом и с поверхностью адсорбента. При дальнейшем увеличении концентрации происходит уменьшение свободной поверхности, снижается реакционная способность и кривые загибаются к оси абсцисс. Константу Генри получают экстраполяцией коэффициента распределения на нулевую концентрацию. В соответствии с правилом фаз Гиббса в гетерогенных системах равновесные параметры зависят от дисперсности или удельной поверхности. Для адсорбционных систем эта зависимость выражается в уменьшенных концентрациях вещества в объемной фазе с увеличением удельной поверхности адсорбента. Если в такой системе содержание распределяемого вещества постоянно, то Из соотношения следует, что с увеличением удельной поверхности при постоянной концентрации адсорбата концентрация уменьшается и тем сильнее, чем больше константа Генри . Теория Ленгмюра позволяет учесть наиболее сильные отклонения от закона Генри, что связано с ограничением адсорбционного объема или поверхности адсорбента. Ограниченность этого параметра приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации распределяемого вещества Физический смысл С: характеризует разность энергии Гиббса в процессах чистой адсорбции и конденсации. Это уравнение получило название БЭТ (Бранауэр-Эммет- Теллер). Уравнение Гиббса. 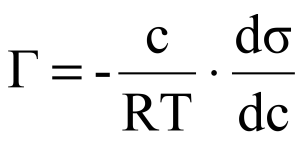 36. Поверхностно-активные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе). Пове́рхностно-акти́вные вещества́ (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела термодинамических фаз, вызывают снижение поверхностного натяжения. Основной количественной характеристикой ПАВ является поверхностная активность — способность вещества снижать поверхностное натяжение на границе раздела фаз — это производная поверхностного натяжения по концентрации ПАВ при стремлении С к нулю. Однако, ПАВ имеет предел растворимости (так называемую критическую концентрацию мицеллообразования или ККМ), с достижением которого при добавлении ПАВ в раствор концентрация на границе раздела фаз остается постоянной, но в то же время происходит самоорганизация молекул ПАВ в объёмном растворе (мицеллообразование или агрегация). В результате такой агрегации образуются так называемые мицеллы. Отличительным признаком мицеллообразования служит помутнение раствора ПАВ. Водные растворы ПАВ, при мицеллообразовании также приобретают голубоватый оттенок (студенистый оттенок) за счёт преломления света мицеллами. Поверхностно-неактивные вещества стремятся уйти с поверхности в объем жидкости. Это явление называется отрицательной адсорбцией. Они обладают хорошей растворимостью в воде и более высоким поверхностным натяжением. К поверхностно-инактивным веществам относятся все неорганические электролиты – кислоты, щелочи, соли. Вещества, поверхностное натяжение которых равно поверхностному натяжению растворителя, равномерно распределяются между поверхностным слоем и объемом раствора. К таким веществам относится сахар. Поверхностная активность вещества зависит от только от его природы, но и от природы растворителя. Вода обладает большим поверхностным натяжением, и поэтому по отношению к ней многие вещества проявляют поверхностную активность. Спирт обладает значительно меньшим поверхностным натяжением, чем вода. Поэтому некоторые вещества, поверхностно-активные в отношении воды, являются инактивными в отношении спирта. Многие ПАВ, обладающие дифильностью, могут образовывать как истинные, так и коллоидные растворы. Для таких систем существует обратимый переход и соответствующее термодинамическое равновесие . Адсорбция ПАВ из воды на неполярных адсорбентах подчиняется правилу Траубе. Отсюда следует, что чем меньше растворимость вещества в к.-л. среде, тем больше его поверхностная активность на границе с этой средой. 37. Поверхностное натяжение и методы его определения Поверхностное натяжение : сила, отнесенная к единице длины, или работа, затрачиваемая на создание единицы площади поверхности раздела фаз при постоянной температуре. (размерность Дж/м2).
Величина поверхностного натяжения чистой жидкости при данной температуре на данной границе раздела есть величина строго определенная. Величина поверхностного натяжения растворов зависит от:
Существуют два типа методов определения поверхностного натяжения: статические и динамические. Динамические методы, например метод колебания струи, вытекающей из отверстия неправильной формы, позволяют измерить поверхностное натяжение вновь образованной поверхности сразу после ее образования. Статическими методами измеряют поверхностное натяжение на границе раздела фаз, пришедших в равновесие. Если равновесие между фазами устанавливается достаточно быстро, то статическое поверхностное натяжение можно измерить достаточно просто. Если же равновесие устанавливается за очень длительный промежуток времени, особенно при переходе одного из компонентов системы через границу раздела фаз, то ни один из методов не дает истинного значения равновесного поверхностного натяжения. В этом случае говорят о полустатических значениях поверхностного натяжения и в обязательном порядке следует оговаривать продолжительность образования новой поверхности раздела фаз. Наибольшее распространение получили следующие методы определения поверхностного натяжения жидких межфазовых границ:
38. Адсорбция из раствора на твёрдом адсорбенте Явление адсорбции из растворов твердыми адсорбентами было открыто и изучено в 1785 г. русским химиком и фармацевтом Т. Е. Ловицем. Адсорбция растворенных веществ твердыми адсорбентами — более сложный процесс, чем адсорбция газов твердыми телами. Осложняющими факторами являются: 1) присутствие третьего компонента — растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на поверхности адсорбента; 2) взаимодействие между молекулами адсорбата и растворителя; 3) электростатическое взаимодействие между поверхностью адсорбента и ионами адсорбата, если он является электролитом. Неэлектролиты и слабые электролиты адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией. В результате адсорбции концентрация растворенного вещества в растворе уменьшается. Адсорбцию определяют по разности концентраций исходного и равновесного растворов адсорбата: а = (с0- с)У/т, где с0 — исходная концентрация адсорбата; с — равновесная концентрация адсорбата; V— объем раствора адсорбата, из которого происходила адсорбция: т — масса адсорбента; а — адсорбция. Адсорбция зависит от природы и удельной поверхности адсорбента, концентрации и природы адсорбтива, природы растворителя, а также температуры. Удельная поверхность адсорбента обратно пропорциональна размеру частиц и зависит от их формы. Реальные частицы имеют сложную форму, поэтому для расчета величины удельной поверхности приходится учитывать так называемый коэффициент формы. Адсорбция наблюдается на всех твердых телах, но эффективные адсорбенты представляют собой вещества с сильно развитой поверхностью (пористые или порошкообразные). При дроблении и измельчении твердых тел величина их удельной поверхности увеличивается вплоть до значений, достигающих тысячи квадратных метров на кубический сантиметр твердого тела. Чем больше удельная поверхность адсорбента, тем больше имеется активных центров и, следовательно, больше величина адсорбции. Величина адсорбции зависит от природы адсорбента и адсорбтива: чем ближе по полярности адсорбент и адсорбтив, тем полнее происходит адсорбция. Под полярностью в данном случае понимают способность вещества к образованию водородных связей и участию в неспецифическом межмолекулярном взаимодействии за счет слабых сил без определенных центров локализации. При адсорбции из растворов большое значение имеет и полярность растворителя. Наибольшей склонностью к адсорбции обладают вещества с полярностью, промежуточной между полярностями контактирующих фаз. Из водных растворов ПАВ хорошо адсорбируются неполярными адсорбентами (в том числе и активированным углем), а на по лярных адсорбентах (карбонаты, алюмосиликаты, оксиды) ПАВ хорошо адсорбируются из неполярных сред. В основе этих явлений лежит конкуренция между молекулами адсорбтива и растворителя за активные центры адсорбента (рис. 19.16 и 19.17). Влияние природы растворителя на адсорбцию может быть также сформулировано в виде правила: чем лучше в данном растворителе растворяется данный адсорбат, тем он хуже из него адсорбируется; чем хуже растворяется, тем лучше из него адсорбируется. Адсорбция является экзотермическим процессом, поэтому с повышением температуры адсорбция из растворов уменьшается. Молекулярно-кинетические представления также подтверждают справедливость подобного заключения, однако в ряде случаев наблюдают обратную зависимость. В узком температурном интервале при достаточно большом температурном коэффициенте растворимости адсорбция с ростом температуры может увеличиваться, если при этом растворимость адсорбата в данном растворителе уменьшается. С ростом концентрации раствора адсорбция на поверхности раздела адсорбент — раствор возрастает до некоторого предельного значения (рис. 19.18). Анализ экспериментально наблюдаемой изотермы аналогичен анализу, приведенному выше. Для математического описания изотермы адсорбции на границе твердый адсорбент — раствор используют уравнение Ленгмюра, которое в данном варианте имеет следующий вид: c  a=a a=a max α + c При адсорбции ПАВ из неполярных растворителей полярными адсорбентами наблюдается обращение правила Траубе: с ростом длины углеводородного радикала адсорбция уменьшается. Также смотр. Этот вопрос в «Коллоквиум по химии» 39. Адсорбционные равновесия на неподвижных границах раздела твёрдых фаз. Физическая адсорбция и хемосорбция Все поверхности раздела в зависимости от агрегатного состояния граничных фаз делят на два класса:
Граница раздела фаз газ-твердое тело Внутри твердого тела, частицы, образующие его решетку правильно чередуются в соответствии с его кристаллической структурой, причем силы их взаимодействия уравновешены. Состояние частиц на поверхности твердого тела иное, вследствие чего поверхность твердого тела притягивает молекулы вещества из соседней газовой фазы. В результате концентрация этого вещества на поверхности становится больше, чем в объеме газа, т.е. газ адсорбируется поверхностью твердого тела. Типы адсорбционных взаимодействий Взаимодействие между частицами адсорбата и адсорбента может иметь различный характер, в зависимости от этого различают несколько видов адсорбции. Физическаяадсорбция обусловлена силами Ван-дер-Ваальса, возникающими между частицами адсорбата и адсорбента. Она обратима и уменьшается с ростом температуры. Химическая адсорбция (хемосорбция) обусловлена химическими силами. Она необратима и увеличивается с ростом температуры (например, адсорбция кислорода на поверхности металла) Адсорбция происходит на поверхности раздела газ/твердое тело, раствор/твердое тело, газ/жидкость, жидкость/жидкость. Адсорбция бывает мономолекулярная (на поверхности раздела образуется слой адсорбата толщиной в одну молекулу) и полимолекулярная (на поверхности раздела образуется полимолекулярный слой адсорбата) Вещество, на поверхности которого происходит Адсорбция, называется адсорбентом, а поглощаемое из объёмной фазы — адсорбатом. В зависимости от характера взаимодействия между молекулой адсорбата и адсорбентом А. принято подразделять на физическую А. и хемосорбцию. Менее прочная физическая А. Она обусловлена силами межмолекулярного взаимодействия, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто А. обусловлена и физическими и химическими силами, поэтому не существует чёткой границы между физикой А. и хемосорбцией. Адсорбированные молекулы рано или поздно покидают поверхность молекулы — десорбируются. Время, в течение которого молекула находится на поверхности, называется временем Адсорбции Времена А. могут колебаться в очень широких пределах. Скоростью А. (соответственно скоростью десорбции) называется количество молекул, адсорбирующихся (или десорбирующихся) за единицу времени, оба значения величин относят к единице поверхности или массы адсорбента. Скорость хемосорбции, как и скорость любого химического процесса, чаще всего увеличивается с повышением температуры. Если скорости А. и десорбции равны друг другу, то говорят, что установилось адсорбционное равновесие. В состоянии равновесия количество адсорбированных молекул остаётся постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и др.). 40.Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов. Уравнение Ленгмюра описывает количественно адсорбцию на подвижной и неподвижной ганицах раздела сред. 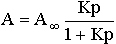 Зависимость величины адсорбции от: 1. присутствие третьего компонента- растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на поверхности адсорбента 2. взаимодействие между молекулами адсорбата и растворителя 3. электростатическое взаимодействие между поверхностью адсорбента и ионами адсорбата, если он является электролитом. Значение адсорбции Адсорбция — всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ и адсорбция примесей из газа либо жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее распространённая форма — активированный уголь), силикагели, цеолиты а также некоторые другие группы природных минералов и синтетических веществ. Адсорбция (особенно хемосорбция) имеет также важное значение в гетерогенном катализе. 41. Применения десорбциооных процессов в медицине Применение адсорбционных процессов в медицине Адсорбция лежит в основе клинического анализа крови на СОЭ (скорость осаждения эритроцитов). Так, при инфекционных заболеваниях в крови происходит обменная адсорбция: вместо ионов электролитов поверхность эритроцитов занимают молекулы белков. При этом заряд эритроцитов понижается и они быстрее объединяются и оседают. Адсорбционная терапия применяется для удаления токсинов и вредных веществ из пищеварительного тракта. Такие адсорбенты, как гидроксид алюминия, оксид магния, фосфат алюминия, входят в состав препаратов альмагель, фосфалюгель. Активированный уголь давно применяется как адсорбент газов (при метеоризме), токсинов (при пищевых токсикоинфекциях), алкалоидов и тяжелых металлов (при травлениях). Хорошей адсорбирующей способностью обладает клетчатка. Содержание клетчатки у больных сахарным диабетом должно быть не меньше 25 г/1000 ккал: клетчатка замедляет всасывание сахаров, компенсируя повышение концентрации глюкозы в плазме после приема пищи. На основе оксида кремния создан препарат полисорб – неселективный полифункциональный энтеросорбент. Его применяют для выведения из организма патогенных бактерий и их токсинов, пищевых аллергенов, солей тяжелых металлов, радионуклидов, этанола, а также ядов различного происхождения. 42. Хроматография Хроматография – метод разделения веществ при прохождении раствора или газа через колонку с адсорбентом. Метод хроматографии широко используется для веществ, в том числе и неокрашенных. Для этого длинные тонкие капилляры с пористыми стенками или заполняют более широкие трубки зернами пористого адсорбента (оксида алюминия, оксида магния, древесного угля и др.). Это приводит к возникновению большой поверхности раздела фаз, следовательно, при медленном прохождении газа осуществляются многократно повторяющиеся процессы адсорбции и десорбции молекул компонентов газовой смеси. Это позволяет получить разные времена выходов компонентов из колонки или т.н. разные времена удерживания. Такой вид хроматографии называют газоадсорбционной хроматографией. Если же крупные поры адсорбента заполнить неподвижной жидкостью, то вместо различий в адсорбируемости можно использовать различия в растворимости отдельных компонентов газовой смеси – газожидкостная хроматография. Хроматографическое разделение смесей веществ может осуществляться разными способами: 1 способ:в колонку с адсорбентом вводят газовую смесь с постоянной концентрацией компонентов. У выхода из колонки появляются наименее адсорбирующийся или наименее растворимый компонент, затем смесь этого компонента с несколько более легко адсорбирующимся компонентом, затем смесь двух компонентов с еще более легко адсорбирующимся и т.д. вплоть до исходной газовой смеси. Такой анализ называют фронтальным. Недостатком его является то, что в чистом виде можно получить только первый компонент. 2 способ: через колонку с адсорбентом пропускают непрерывный поток практически неадсорбирующегося газа (газ-носитель), в который у входа в колонку вносят небольшую порцию анализируемой смеси. В этом случае у выхода из колонки в токе газа-носителя сначала появляется наименее адсорбирующийся компонент газовой смеси, затем газ-носитель, затем смесь первого компонента с более легко адсорбирующимся газом, затем газ-носитель и т.д. Таким образом, зоны выхода компонентов на хроматограмме оказываются разделенными газом-носителем. Такой анализ называется проявительнойхроматографией. 43. Специфические свойства ВМС. Высокомолекулярные соединения обладают специфическим комплексом физико-химических и механических свойств. Важнейшие из них: 1) способность образовывать высокопрочные анизотропные волокна и пленки; 2)способность к большим обратимым, так называемым высокоэластическим, деформациям; 3) способность набухать перед растворением и образовывать высоковязкие растворы. Эти свойства обусловлены высокой молекулярной массой высокомолекулярных соединений, цепным строением макромолекул, их гибкостью и наиболее полно выражены у линейных высокомолекулярных соединений.. Трехмерные высокомолекулярные соединения с очень большой частотой сетки нерастворимы, неплавки и неспособны к высокоэластичным деформациям. По фазовому состоянию высокомолекулярные соединения могут быть кристаллическими или аморфными. Необходимое условие кристаллизации - регулярность достаточно длинных участков молекулярной цепи.. Кристаллические высокомолекулярные соединения обычно являются пластиками. Свойства отдельных высокомолекулярных соединений определяются химическим составом, строением, конформацией и взаимным расположением макромолекул (надмолекулярной структурой). В зависимости от этих факторов свойства высокомолекулярных соединений могут изменяться в широких пределах. Так, цис-1,4-полибутадиен, построенный из гибких углеводородных цепей, при температурах около 20°С представляет собой эластичный материал, который ниже -90°С переходит в стеклообразное состояние, тогда как полиметилметакрилат, построенный из более жестких цепей, при температурах около 20°С - твердый стеклообразный продукт, переходящий в высокоэластичное состояние лишь выше 100°С. Целлюлоза - полимер с очень жесткими цепями, соединенными межмолекулярными водородными связями, - вообще не может существовать в высокоэластичном состоянии до температуры ее разложения. Большие различия в свойствах высокомолекулярных соединений могут наблюдаться даже в том случае, когда различия в строении макромолекул на первый взгляд и невелики. Так, изотактический полипропилен - кристаллическое вещество, плавящееся около 175°С, а атактический полипропилен вообще не способен кристаллизоваться и размягчается около —40°С. В данном случае различия в микроструктуре макромолекулярной цепи определяют качественные различия и в характере надмолекулярной структуры. Bысокомолекулярные соединения могут вступать в следующие реакции: 1) соединение макромолекул поперечными химическими связями (так называемое сшивание), происходящее, например, при вулканизации каучуков, отверждении реактопластов, дублении кож; 2) распад молекулярных цепей на более короткие фрагменты; 3) реакции макромолекул с низкомолекулярными соединениями, при которых изменяется природа боковых функциональных групп, но сохраняются длина и строение скелета основной цепи (так называемые полимераналогичные превращения), например, омыление поливинилацетата с образованием поливинилового спирта; высокомолекулярные соединения, образующиеся в результате таких реакций, называются полимераналогами; 4) внутримолекулярные реакции между функциональными группами одной макромолекулы, например внутримолекулярная циклизация. 44. Понятие биогенности химических элементов. Биогенные элементы, химические элементы, постоянно входящие в состав организмов и имеющие определённое биологическое значение. Прежде всего это кислород (составляющий 70% массы организмов), углерод (18%), водород (10%), кальций, азот, калий, фосфор, магний, сера, хлор, натрий, железо. Эти элементы входят в состав всех живых организмов, составляют их основную массу и играют большую роль в процессах жизнедеятельности. Успехи аналитической химии и спектрального анализа расширили перечень Б. э.: находят всё новые элементы, входящие в состав организмов в малых количествах (микроэлементы), и открывают биологическую роль многих из них. В. И. Вернадский считал, что все химические элементы, постоянно присутствующие в клетках и тканях организмов в естественных условиях, вероятно, играют определенную физиологическую роль. Многие элементы имеют большое значение только для определённых групп живых существ (например, бор необходим для растений, ванадий - для асцидий и т.п.). Содержание тех или иных элементов в организмах зависит не только от их видовых особенностей, но и от состава среды, пищи (в частности, для растений - от концентрации и растворимости тех или иных почвенных солей), экологических особенностей организма и других факторов. При нарушении поступления в организм того или иного Б. э. возникают заболевания - биогеохимические эндемии, например зоб у человека при недостатке иода в воде и пище или чёрная пятнистость свёклы при нехватке бора. Элементы, постоянно содержащиеся в организмах млекопитающих, по их изученности и значению можно разделить на 3 группы: элементы, входящие в состав биологически активных соединений (ферменты, гормоны, витамины, пигменты) (I - макроэлементы), они являются незаменимыми; элементы, физиологическая и биохимическая роль которых мало выяснена (II - микроэлементы) или неизвестна (III - ультрамикроэлементы). 45. Химия биогенных элементов s-блока. S-элементы – элементы, у атомов которых электроны заселяются на s подуровни внешнего уровня. Свойства:
H2, Na, K, Mg, Ca – жизненно необходимые для растений и животных. По содержанию в организме H2, Mg, K относят к макроэлементам, остальные к микроэлементам. 46. Химия биогенных элементов d-блока. D-элементы – элементы, у атомов которых электроны заселяются на d подуровни внешнего уровня. Данный блок представляет собой часть периодической таблицы; в него входят элементы от 3 до 12 группы. Элементы данного блока заполняют d-оболочку d-электронами, которая у элементов начинается s2d1 (третья группа) и заканчивается s2d10 (двенадцатая группа). Однако существуют некоторые нарушения в этой последовательности, например, у хрома s1d5 (но не s2d4) вся одиннадцатая группа имеет конфигурацию s1d10 (но не s2d9). Одиннадцатая группа имеет заполненные s- и d-электроны. D-блок-элементы также известны как переходные металлы или переходные элементы. Однако точные границы, отделяющие переходные металлы от остальных групп химических элементов, еще не проведены. Хотя некоторые авторы считают, что элементы, входящие в d-блок, являются переходными элементами, в которых d-электроны являются частично заполненными либо в нейтральных атомах или ионах, где степень окисления равна нулю. Большинство элементов данного блока относятся к ультрамикроэлементам. 47. Химия биогенных элементов p-блока. P-элементы – элементы, у атомов которых электроны заселяются на d подуровни внешнего уровня. К ним относятся 30 элементов с IIА по VIIА группы периодической системы; входят во 2 и 3 малые периоды, также 4-6 большие периоды. Свойства:
Большинство элементов данного блока относятся к микроэлементам. 48. Поли- и гетерофункциональность как один из характерных признаков органических соединений, участвующих в процессах жизнедеятельности и используемых в качестве лекарственных веществ. Особенности химического поведения поли- и гетерофункциональных соединений: кислотно-основные свойства (амфолиты), циклизация и хелатообразование. Взаимное влияние функциональных групп. Полифункциональные органические соединения – соединения, в молекулах которых есть несколько одинаковых функциональных групп. Наиболее часто встречаются карбоксильная и гидроксильная группы. Гетерофункциональные органические соединения – соединения, в молекулах которых есть несколько разных функциональных групп. Наиболее часто встречаются аминоспирты, аминокислоты, оксокислоты и аминокарбоксиллы. Эти два типа органических соединений активноучаствуют в процессах жизнедеятельности (Например: некоторые соли щавелевой кислоты присутствуют в почках; малиновая и фумаровая кислоты участвуют в обменных процессах организма; оланин входит в состав сложных липидов) и используются в качестве лекарственных веществ (Например: бензольная кислота используется в отхаркивающих препаратах; солициловая кислота и её производные – антигрибковае и жаропонижающие препараты). Кислотно-основные свойства: у полифункциональных соединений кислотность больше, чем у одноатомных; у гетерофункциональных кислотно-основные свойства от природы и положения в молекуле меньше или больше, чем у полифункциональных. Циклизация - реакция внутри- или межмолекулярного образования (замыкания) цикла из ацикличных молекул либо фрагментов карбо- или гетероцикла. Циклизация с образованием гетероцикла называется также гетероциклизацией, циклизация с замыканием нового цикла на уже существующем - аннелированием. Некоторые полифункциональные и гетерофункциональные соединения образуются путём циклизации: из гидроксикислот путём внутренней циклизации образуются амины лактаны. Хелатообразование - химический процесс, в котром к иону или к атому металла посредством двух или более ковалентных связей присоединяются органические молекулы, охватывающие его как бы клешнями (назв. процесса произошло от лат. chele - "клешня"). Природные хелаты (напр., в почвах) устойчивы в кислых средах, но разрушаются в щелочной среде с высвобождением иона металла. Они хорошо растворимы в воде и окрашены. Их используют для определения спиртов. 49.ПОЛИФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ Общая характеристика Полифункциональными называют соединения, в молекулах которых имеется несколько одинаковых функциональных групп. Среди полифункциональных соединений, участвующих в процессах жизнедеятельности, наиболее широко представлены соединения с гидроксильными и карбоксильными функциональными . Многоатомные спирты и фенолы Двухатомные спирты, т. е. спирты, содержащие две гидроксильные группы, имеют общее название диолы, или гликоли;трехатомные спирты называют триолами. Представителями таких спиртов являются этиленгликоль и глицерин соответственно. Общее название многоатомных спиртов - полиолы. В состав многих природных соединений входят в виде фрагментов двухатомные фенолы - пирокатехин, резорцин, гидрохинон. 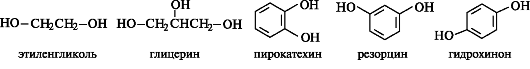 Пирокатехин (о-дигидроксибензол), называемый также катехолом, является структурным фрагментом многих биологически активных веществ, в частности катехоламинов (см. 9.2.1). Монометиловый эфир пирокатехина - гваякол - применяется как компонент в составе лекарственных средств при катаре верхних дыхательных путей. Резорцин (м-дигидроксибензол) используется как антисептик и дезинфицирующее средство при кожных заболеваниях. Гидрохинон (п-дигидроксибензол), обладающий восстановительной способностью, является структурным фрагментом ряда соединений. В организме восстановительная способность замещенного гидрохинонового фрагмента делает его участником важного процесса транспорта электронов от окисляемого субстрата к кислороду. К спиртам высшей атомности относятся пентиты и гекситы, т. е. соответственно пяти- и шестиатомные спирты с открытой цепью. Накопление гидроксильных групп в молекуле ведет к появлению сладкого вкуса. Представители пентитов и гекситов - ксилит и сорбит (см. 11.1.5) - заменители сахара для больных диабетом. Многоатомный циклический спирт миоинозит (см. 7.2.2) относится к витаминоподобным соединениям (витамины группы В) и является структурным компонентом сложных липидов - фосфатидилинозитов (см. 10.4.1). В растениях широко распространена фитиновая кислота, представляющая собой гексафосфат миоинозита. Кальциевая или смешанная кальций-магниевая соль фитиновой кислоты, называемая фитином, улучшает состояние нервной системы при заболеваниях, связанных с недостатком фосфора в организме. 50 Полиамины: этилендиалин.путресцин.кадоверин. Полиамины- полимеры содержащие в повторяющемся звене макромолекулы первичные, вторичные, третичные или четвертичные аминогруппы. Нек-рые П.-физиологически активные соед.; обладают высокой токсичностью при введении в кровь, поскольку вызывают агрегацию форменных элементов крови-эритроцитов, тромбоцитов, лимфоцитов; эффективно взаимод. с клеточными мембранами, изменяя их проницаемость. П. получают всеми известными р-циями, используемыми для синтеза полимеров: ионной и радикальной полимеризацией (ур-ния 1 и 2), поликонденсацией (3) и полимеранало-гичными превращ. (4) Этилендиамин (1,2-диаминоэтан) H2NCH2CH2NH2 — органическое соединение класса аминов. Это широко используемый строительный блок в химическом синтезе Жидкость без цвета с запахом аммиака, испаряется при контакте с влажным воздухом. tkип 116,5 °C, tпл 8,5 °C, плотность 0,899 г/см³ (20 °C); Этилендиамин хорошо растворяется в воде (с разогреванием раствора), этаноле, хуже — в эфире, нерастворим в бензоле и других углеводородах. Является сильным основанием. Имея в своей молекуле две аминогруппы, образует с кислотами два ряда солей. С некоторыми металлами (например, Cu, Mn, Co) образует комплексные соединения. Путресцин вместе с кадаверином впервые были описаны в 1885 году берлинским врачом Людвигом Бригером (1849-1919)[1] в продуктах гнилостного распада белков . Бесцветное кристаллическое вещество с чрезвычайно неприятным запахом, плохо растворимое в воде, имеет низкую темперературу плавления (tпл= 27—28 °C), является сильным основанием. В тканях организма путресцин — исходное соединение для синтеза двух физиологически активных полиаминов — спермидина и спермина. Эти вещества наряду с путресцином, кадаверином и другими диаминами входят в состав рибосом, участвуя в поддержании их структуры Кадавери́н (от лат. cadaver — труп), α, ε-пентаметилендиамин — химическое соединение, имеющее формулу NH2(CH2)5NH2. Бесцветная жидкость с плотностью 0,870 г/см3 и tкип 178—179 °C. Кадаверин легко растворим в воде и спирте, даёт хорошо кристаллизующиеся соли. Замерзает при +9 °C. Имеет очень сильный трупный запах — отсюда название. Содержится в продуктах гнилостного распада белков; образуется из лизина при его ферментативном декарбоксилировании. Ранее кадаверин относили к т. н. трупным ядам (птомаинам), однако ядовитость кадаверина относительно невелика. Обнаружен у растений |
