Ответы по химии!
 Скачать 1.34 Mb. Скачать 1.34 Mb.
|
|
Энтропия вещества, как функция термодинамической вероятности. Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность (W) состояния системы S = klnW. Изменение энтропии мира как критерий самопроизвольности процессов. Факторы, влияющие на изменение энтропии в ходе химической реакции Процессы могут протекать самопроизвольно (ΔG<0), если они сопровождаются уменьшением энтальпии (ΔH<0) и увеличением энтропии системы (ΔS>0). Если же энтальпия системы увеличивается (ΔH>0), а энтропия уменьшается (ΔS<0), то такой процесс протекать не может (ΔG>0). При иных знаках ΔS и ΔН принципиальная возможность протекания процесса определяется соотношением энтальпийного (ΔH) и энтропийного (ТΔS) факторов. Если ΔН>0 и ΔS>0, т.е. энтальпийная составляющая противодействует, а энтропийная благоприятствует протеканию процесса, то реакция может протекать самопроизвольно за счет энтропийной составляющей, при условии, что |ΔH|<|TΔS|. Если, энтальпийная составляющая благоприятствует, а энтропийная противодействует протеканию процесса, то реакция может протекать самопроизвольно за счет энтальпийной составляющей, при условии, что |ΔH|>|TΔS|. 5.Изобарный потенциал реакции (свободная энергия Гиббса). Критерий самопроизвольности реакций. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида: Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) Понятие энергии Гиббса широко используется в термодинамике и химии. Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшениемэнтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж) 6.Скорость химической реакции (средняя и истинная). Методы наблюдения и измерения скорости. Закон действующих масс. Порядок и молекулярность. Экспериментальное определение порядка реакции по одному из веществ и общего. Факторы, влияющие на скорость химической реакции (природа веществ, концентрация, температура). Энергия активации. Экспериментальное определение энергии активации. Катализ (гомогенный, гетерогенный). Автокатализ. Скоростью химической реакции называют изменение концентрации какого-либо из реагирующих веществ в единицу времени в определённом объёме или на определённой поверхности. (Концентрация - содержание вещества в единице объёма). Если реакция протекает идеально, то для оценки скорости достаточно пользоваться понятием средняя скорость. Если реакция протекает сложно, то для оценки протекания химического процесса пользуются понятием истинная скорость химической реакции. Её можно определить математически и графически. Истинная скорость – это скорость реакции в данный момент времени. Причём в разные моменты она разная. Чем меньше рассматриваемый промежуток времени, тем точнее определяется скорость химической реакции. Математическое выражение скорости представляет собой производную концентрации во времени: Vист=± dc/dτ. В этом случае концентрация контролируемого вещества вполне определённа и её выражают в моль/л. Скорость реакции зависит от многих факторов. Основными параметрами, которые приходится учитывать почти во всех процессах, являются концентрация реагентов (площадь соприкасающихся фаз), температура, давление и действие катализаторов. Влияние концентрации на скорость химической реакции выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. Молекулярность и порядок реакций. Число молекул, участвующих в элементарном акте химического взаимодействия, определяет молекулярность реакции. По этому признаку различают мономолекулярные, бимолекулярные и тримолекулярные реакции. Реакции с молекулярностью больше трех практически не встречаются, так как вероятность столкновения даже трех молекул уже очень мала. Порядок реакции — это сумма показателей степеней концентрации веществ в уравнении закона действующих масс. Так, реакция СuО(к) + Н2 (г) = Сu (к) + Н2О (г) относится к реакциям первого порядка, так как уравнение закона действующих масс запишется следующим образом: v=kC(H2), а реакция H2 + I2 = 2HI относится к реакциям второго порядка, так как уравнение закона действующих масс имеет вид v =kC(H2)C(I2). Молекулярность реакции - этомолекулярно-кинетическая характеристика системы, а порядок реакции определяет зависимость скорости от концентрации. Если при многостадийном процессе уравнение реакции отражает лишь исходное: и конечное состояние системы, не раскрывая механизм процесса, то порядок реакции не совпадает с ее молекулярностью. Так, разложение N2O5 происходит согласно стехиометрическому уравнению 2N2O5=4NO2+O2, где для соблюдения баланса масс необходимо иметь две молекулы исходного соединения. Но экспериментально подтверждено, что данная реакция имеет первый порядок. На основании этого можно представить следующие стадии реакции: N2O5=N2O3+O2 N2O3 + N2O5=4NO2 При этом скорость реакции в первой стадии значительно меньше, чем во второй. Молекулярность реакции не совпадает с порядком и в тех случаях, когда разница между концентрациями реагирующих веществ весьма велика (например, гидролиз сахарозы в присутствии воды). Встречаются также реакции нулевого порядка (например, разложение аммиака на поверхности вольфрама), когда скорость не зависит от концентрации вещества в объеме, а также реакции дробного порядка (многостадийные процессы, где самые медленные стадии имеют разный порядок, однако их скорости соизмеримы). Поэтому нулевой или дробной молекулярности быть не может, так как эта характеристика относится к механизму реакции, а не к выражающему ее уравнению. Зависимость скорости реакции от температуры. Скорость химических реакций, как правило, при повышении температуры возрастает. Рассмотрим это на примере взаимодействия водорода с кислородом. При 20 °С скорость реакции практически равна 0 и понадобилось бы 54 млрд. лет, чтобы взаимодействие прошло на 15 %. При 500 °С для образования воды потребуется 50 мин, а при 700 °С реакция протекает мгновенно. Зависимость скорости реакции от температуры выражается в приближенной форме правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10°С скорость реакции увеличивается примерно в 2—4 раза.Число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры на 10°, называется температурным коэффициентом реакции γ, т. е. выражается отношением константы скорости при температуре t + 100 к константе при температуре t: γ (Δt/10)=kt+10/kt. 7Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации. Молекулы, обладающие такой энергией, называются активными молекулами. С ростом температуры число таких молекул возрастает, поэтому скорость реакции тоже должна увеличиваться. Более точно температурную зависимость скорости химических процессов выражает уравнение Аррениуса, которое имеет вид ln k = - (Ea/RT) + C (или k = Aexp(-Ea/RT). В этом уравнении константа скорости kсвязана с экспоненциальным выражением exp(-Ea/RT). Символ еxpозначает основание натуральных логарифмов; R- универсальная газовая постоянная; Т — температура по шкале Кельвина; Еа — энергия активации, которая обычно предполагается постоянной величиной, не зависящей от температуры; А — коэффициент пропорциональности, иначе называется частотным множителем. Он указывает долю числа столкновений между молекулами, которая оканчивается реакцией. Катализ Скорость химических реакций может возрастать не только при увеличении концентрации реагирующих веществ или температуры системы, но и под влиянием катализаторов. Вещества, которые увеличивают скорость химической реакции, оставаясь в конечном итоге неизменными по химическому составу и количеству, называют катализаторами. Процесс увеличения скорости реакции с помощью катализатора называется катализом, а реакции, в которых скорость изменяется в результате введения в реакционную смесь катализаторов, называются каталитическими. В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, различают гомогенный и гетерогенный катализ. Гомогенными катализаторами обычно могут быть растворы кислот, оснований, солей (прежде всего d-элементов — Сr, Mn, Fe, Со, Ni и др.). Примером гомогенного катализа может служить каталитическое разложение пероксида водорода в водном растворе на воду и кислород в присутствии ионов Cr2O72- , WO42- , МоО42- . При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах и разделены между собой поверхностью раздела (в качестве примера можно привести окисление SO2, до SO3 в присутствии катализатора, находящегося в твердой фазе). Катализаторы отличаются избирательностью, что зависит не только от природы катализатора, но условий его применения. Таким образом, роль катализатора сводится к снижению энергии активации. Автокатализ — катализ химической реакции одним из её продуктов или исходных веществ. Одним из наиболее широко известных примеров автокатализа является окислениещавелевой кислоты перманганатом калия: 2MnO4− + 5C2O42− + 16H+ = 2Mn2+ + 10CO2 + 8H2O Автокатализ играет ключевую роль в эволюционной химии, поскольку реакция, катализируемая собственными продуктами, получает преимущество перед реакциями, получающими катализатор извне (тем более - перед некаталитическими реакциями), что создает условия для естественного отбора. Ферментативный катализ. Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности: 8НЕОБРАТИМЫЕ И ОБРАТИМЫЕ РЕАКЦИИ Все химические реакции, в принципе, обратимы. Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ). Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты. Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу: Пример. Реакция синтеза аммиака является обратимой:
ПРИНЦИП ЛЕ-ШАТЕЛЬЕ.СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ. Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:
1. Влияние температуры.
2. Влияние давления.
3. Влияние концентрации
9Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной среды. Простейшие составные части раствора, которые могут быть выделены в чистом виде, называются компонентами раствора. Обычно компонент, находящийся в избытке, считают растворителем, а остальные – растворенными веществами. Если один из компонентов – вода, то ее обычно принимают за растворитель. Фазой называют однородные (гомогенные) составные части системы, имеющие одинаковый состав, кристаллическое строение и свойства, одного и то же агрегатное состояние, и отделенное от остальных частей поверхности раздела. Гомогенная система — система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем. Примеры гомогенных систем: лед, жидкие или твердые растворы, смесь газов и др. Гетерогенная система — неоднородная система, состоящия из однородных частей (фаз), разделенных поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и степеней свободы связаны правилом фаз. Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный раствор с осадком; многие сплавы. Твердый катализатор в токе газа или жидкости тоже гетерогенная система (гетерогенный катализ). 10 Способы выражения концентраций растворов Массовая доля вещества Массовая доля обозначается греческой буквой "омега" и равна отношению массы растворенного вещества к общей массе раствора 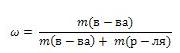 Выражают обычно в массовых долях или процентах (для этого в формуле правую часть домножают на 100%). Молярная концентрация показывает, сколько моль вещества содержится в 1 литре (1000 мл.) раствора. Обозначается См. Единица измерения - [моль/л] (часто пишут просто М) 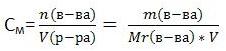 , ,где n - количество вещества в молях, V - объём раствора, m - масса вещества, Mr - молярная масса вещества. Моляльная концентрация число молей растворенного вещества в 1 килограмме (1000 г.) расторителя. Единица измерения - [моль/кг] Нормальная концентрация это число эквивалентов в 1 литре раствора. Обозначают символом Сн 0,1 нормальный раствор - децинормальный. Титр количество вещества (в граммах), растворённое в 1 мл. раствора. Различают титр по растворённому веществу (например, титр раствора соляной кислоты — THCl) или титр по определяемому веществу (например, титр раствора соляной кислоты по едкому натру — THCl/NaOH) где Т - титр в г/мл, Р - масса навески, V - объём мерной колбы. 11Растворимость веществ в воде зависит от температуры. Как правило, растворимость твердых веществ в воде увеличивается с повышением температуры, а растворимость газов уменьшается, поэтому воду можно полностью освободить от растворенных в ней газов кипячением. Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется. Ненасыщенным называют такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе. Пересыщенным называют такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях. Прочитайте в учебнике §34 стр. 190 о приготовлении пересыщенных растворов. Классификация веществ по их растворимости в воде.
 12Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят: 1) понижение давления насыщенного пара растворителя над раствором, 2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей. 3) осмотическое давление. Идеальным раствором называют раствор, для которого выполняется первый закон Рауля. Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Реальные растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области бесконечно малых концентраций. Закон Рауля. Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента. барометрическая формула Больцмана. Следствия из закона Рауля: 1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы. 2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества. 3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения. ?tкип=Э x Смоляльн, где Э – эбуллиоскопическая константа, +0,52. ?tзам=К x Смоляльн, где К – криоскопическая константа, равная –1,86. Эбуллиоскопическая константа – разница между температурой кипения раствора и температурой чистого растворителя. Криоскопическая константа – разница между температурой замерзания раствора и температурой чистого растворителя. Для решения задач об этих константах необходимо знать массу растворенного вещества и массу раствора. Например, масса хлороформа (трихлорметан CHCl3) рассчитывается по формуле: ОСМОС (от греч. 13 Процесс электролитической диссоциации как взаимодействие веществ. Самоионизация. Электролитическая диссоциация – распад некоторых веществ на ионы в растворе под действием молекул растворителя или в расплаве. Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно ковалентной связью: кислоты, основания, соли. остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью; например, многие органические соединения. Теория Электролитической диссоциации: 1. при растворении в воде электролиты распадаются на положительные ионы (катионы) и отрицательные ионы (анионы). ионы в растворе взаимодействуют с молекулами воды (гидратация). Процесс диссоциации является обратимым. 2. под действием постоянного электрического тока катионы движутся по катоду, анионы – к аноду. 3. степень диссоциации зависит от природы электролита и растворителя, концентрации электролита и температуры. Степень диссоциации (а) – отношение числа молекул, распавшихся на ионы (N’) к общему числу растворенных молекул (N): а = N’/ N; Сильный электролит – вещество, степень диссоциации которого больше 30%.. к сильным электролитам относят все соли , сильные кислоты, сильные основания. Слабый электролит – вещество, степень диссоциации которого меньше 3%. к слабым электролитам относят слабые кислоты, слабые основания. степень диссоциации зависит от концентрации вещества в растворе, поэтому некоторые слабые электролиты при разбавлении могут стать сильными. константа диссоциации – константа равновесия электролитической диссоциации. она равна отношению произведений концентраций ионов, образующихся при диссоциации, к концентрации исходных частиц. Тщательно очищенная от посторонних примесей вода обладает определённой, хотя и незначительной, электрической проводимостью, заметно возрастающей с повышением температуры. Наличие электрической проводимости может быть объяснено только тем, что молекулы воды, частично распадаются на ионы, т.е. H2O является слабым электролитом. Процесс диссоциации воды может быть записан H2O + H2O ↔ H3O+ + OH¯. Этот процесс называется самоионизацией. Реакцию воды часто записывают в более простом виде:H2O ↔ H+ + OH¯. Константа диссоциации воды может быть вычислена по уравнению Кд = (aH aOH)/aH2O (1). Учитывая, что при комнатной температуре на ионы распадается лишь одна из примерно 108 молекул воды, активности ионов в уравнении могут быть заменены их концентрациями , а концентрацию нераспавшихся молекул воды можно считать равной общей концентрации молекул воды. Концентрацию молекул можно рассчитать, разделив массу 1 л воды на массу её моля: 1000/18 = 55,5 моль/л. Считая эту величину постоянной, можно уравнение (1) записать в виде: [H+] [OH¯] = Кд 55,5 = Кв, где Кв – ионное произведение воды. При расчётах связанных с водными растворами электролитов, используют не концентрации, активности ионов: aH·aOH = Кв. Водородным показателем, или pH, называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе: pH = - lg aH. Водородный показатель определяет характер реакции раствора. При pH<7 реакция раствора кислая, при pH>7 – щелочная, при pH=7 – реакция нейтральная. Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы H+ и OH¯ непосредственно участвуют во многих из этих процессов. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина pH может служить критерием силы кислоты или основания. Водородный показатель играет важную роль в жизнедеятельности организма, так в норме pH сыворотки крови равен 7,40 ± 0,05, слёз – 7,4 ± 0,1. отклонение pH от нормальных значений приводит к расстройству деятельности организма. Существенно влияние на урожайность оказывает pH почвы, на экологию водоёма – pH воды. 14. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации. Влияние концентрации на скорость химической реакции выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. Вещества, которые растворяются в воде с образованием растворов, проводящих электрический ток, называются электролитами. Процесс распада веществ на ионы называется электролитической диссоциацией. Электролитическая диссоциация — процесс обратимый. Степень диссоциации Для количественной оценки процесса диссоциации важное значение имеют степень диссоциации и константа диссоциации. Степень электролитической диссоциации α равна отношению распавшихся на ионы молекул (n) к общему числу молекул (N) электролита, введенных в раствор: α=(n/N)*100% Степень диссоциации электролитов зависит от концентрации растворов: с уменьшением концентрации она растет. Процесс электролитической диссоциации удобнее характеризовать константой диссоциации . В отличие от степени диссоциации константа диссоциации зависит только от природы электролита и температуры. Константа и степень электролитической диссоциации количественно взаимосвязаны. закон разбавления Оствальда даёт возможность определить степень диссоциации при различных концентрациях электролита, если известно значение К. По степени диссоциации в не очень разбавленных растворах электролиты принято делить на сильные, слабые и средней силы. Сильные электролиты имеют α>ЗО%; слабые — α<3%, а электролиты средней силы —α в пределах от 3 до 30 %. Эти значения α относятся к 0,1 н. раствору. Следует иметь в виду, что деление электролитов на слабые, средние и сильные носит условный характер и зависит от природы растворителя, концентрации электролита и других факторов. Степень диссоциации и константа диссоциации связаны с концентрацией раствора: К≈α2С или α=√К/С 15. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности. При увеличении концентрации растворов электролитов создаются условия, когда за счет электростатического взаимодействия становится возможным образование новых соединений – ассоциатов. На вероятность образования ассоциатов указал Н. Бьеррум, им определено то минимальное расстояние между ионами, при котором становится возможным образование ассоциатов. Различают несколько видов ионных пар, находящихся в растворе: 1) константная K+, An–; 2) гидратно (сольватно)-ионная пара K+(H2O)An–; 3) гидратно (сольватно)-разделенная пара K+(H2O)N An–; 4) ионные тройники K+An–K+, An–K+An–. Образование ионных пар в растворе сказывается на величине проводимости раствора, причем появление и образование нейтральных ассоциатов снижает проводимость растворов электролитов. Для сильных электролитов, когда степень ионизации велика, константа ионизации зависит от концентрации, так как при накоплении в растворе большого числа ионов сказывается их взаимное влияние. Когда растворитель обладает малой диэлектрической проницаемостью (величина, показывающая, во сколько раз ослабевают силы взаимодействия электрических зарядов при расположении этих зарядов в диэлектрике по сравнению с силами в вакууме), создаются условия для электростатического взаимодействия сольватированных ионов противоположного знака. При этом последние подходят друг к другу на близкое расстояние и образуют ионную пару – сложный агрегат, состоящий из двух противоположно заряженных ионов, окруженных молекулами растворителя, в котором электрические заряды взаимно компенсированы, это – ассоциация. Ассоциация ионов – образование из противоположно заряженных ионов (в растворах электролитов) особого рода частиц-ассоциатов, в которых ионы удерживаются за счет электростатического взаимодействия их электрических зарядов в соответствии с законом Кулона. Процессы ассоциации ионов подчиняются закону действующих масс, термодинамическим соотношениям. Степень ассоциации ионов зависит от природы растворителя, электролита, температуры, концетрации раствора. Она возрастает с уменьшением диэлектрической проницаемости растворителя вследствие увеличения кулоновского притяжения ионов. Ассоциация – объединение однородных частиц в растворе. Коэффициент активности – коэффициент, связывающий реальную концертрацию электролита с его термодинамической активностью в уравнении a = γc (a – активность; с – концентрация; γ – коэффициент активности). Необходимость введения активностей обусловлена отклонениями термодинамических уравнений от идеальности за счет электростатических сил и сил межмолекулярного взаимодействия. В этом случае при использовании концетраций результаты расчета не сответствуют экспериментальным данным. Чтобы уравнения для идеальных растворов не меняли вид, в них используются активности. Для определения коэффициентов активности используются различного вида приближения, в основе которых лежит предельный закон Дебая-Хюккеля. Сам по себе предельный закон Дебая-Хюккеля имеет ограниченное применение в области сильно разбавленных растворов, поэтому чаще пользуются различными усовершенствованными приближениями. Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона и ионной силы раствора.  где ci — молярные концентрации отдельных ионов (моль/л), zi заряды ионо.Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора. 16. Протолитическое равновесие. Кислоты, основания, амфолиты по Бренстеду. ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ На практике наиболее часто имеют дело с протолитическими равновесиями, т. е. реакциями, связанными с переносом про¬тона (реакции нейтрализации, гидролиза и диссоциации). Для рассмотрения протолитических равновесий коротко остановимся на теории кислот и оснований *. По этой теории кислотой называют всякое вещество, молекулы которого (в том числе и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют всякое вещество, молекулы которого (в том числе и ионы) способны присоединять протон, т.е. быть акцептором протонов; амфолитом называют всякое вещество, которое является и донором, и акцептором протонов. Данная теория объясняет кислотно-основные свойства не только нейтральных молекул, но и ионов. Кислота, отдавая протон, превращается в основание, которое является сопряженным этой кислоте. Понятия «кислота» и «основание» являются относительными понятиями, так как одни и те же частицы - молекулы или ионы - могут проявлять как основные, так и кислотные свойства в зависимости от партнера. \ При протолитическом равновесии образуются кислотно-основные пары. Согласно протонной теории, гидролиз, реакции ионизации и нейтрализации не рассматриваются как особое явление, а считаются обычным переходом протонов от кислоты к основанию. Реакции гидролиза, нейтрализации и ионизации являются частными случаями протолитических равновесий и называются реакциями протолиза. Равновесия, установившиеся в растворах между кислотами и сопряженными основаниями, называются протолитическими. Многие гидроанионы, например HCO3-, являются в водном растворе амфолитами: Приведем примеры записи уравнений гидролиза солей, включающих анион-амфолит: (1) Na2HPO4= 2 Na+ + HPO42- 17. Вода как растворитель. Дифференцирующие и нивелирующие растворители. Самым распространенным растворителем на нашей планете является вода. Тело среднего человека мас–сой 70 кг содержит примерно 40 кг воды. При этом около 25 кг воды приходится на жидкость внутри клеток, а 15 кг составляет внеклеточная жидкость, в которую входят плазма крови, межклеточная жидкость, спинно-моз-говая жидкость, внутриглазная жидкость и жидкое содержимое желудочно-кишечного тракта. У животных и растительных организмов вода составляет обычно бо–лее 50%, а в ряде случаев содержание воды достигает 90—95%. Вследствие своих аномальных свойств вода – уни–кальный растворитель, прекрасно приспособленный для жизнедеятельности. Прежде всего вода хорошо растворяет ионные и мно–гие полярные соединения. Такое свойство воды связа–но в значительной мере с ее высокой диэлектрической проницаемостью (78,5). Другой многочисленный класс веществ, хорошо раст–воримых в воде, включает такие полярные органиче–ские соединения, как сахара, альдегиды, кетоны, спир–ты. Вследствие высокой полярности во–да вызывает гидролиз веществ. Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме. Необходимо отметить, что вода является конечным продуктом биологического окисления веществ, в частно–сти глюкозы.Важны и другие аномальные свойства воды: высо–кое поверхностное натяжение, низкая вязкость, высо–кие температуры плавления и кипения и более высокая плотность в жидком состоянии, чем в твердом. Для воды характерно наличие ассоциатов – групп молекул, соединенных водородными связями. В зависимости от сродства к воде функциональные группы растворяемых частиц подразделяются на гид–рофильные (притягивающие воду), легко сольватируе-мые водой, гидрофобные (отталкивающие воду) и ди-фильные. По характеру влияния на относительную силу кислот, оснований и солей растворители также делят на дифференцирующие и нивелирующие. Дифференцирующие растворители увеличивают различия в силе электролитов. К этой группе растворителей принадлежат: метил-этилкетон, ацетон. В нивелирующих растворителях электролиты хорошо и примерно одинаково диссоциируют, потому эти растворители уравнивают различия в силе кислот или оснований. Основные растворители (например, жидкий аммиак) являются нивелирующими для кислот. 18. Автопротолиз. Ионное произведение воды. Рн Автопротолиз — гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов. Наиболее важное значение имеет автопротолиз воды. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись: При стандартных условиях ионное произведение воды равно 10−14. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток. На основе ионного произведения воды вычисляются водородный показатель и константа гидролиза солей. Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Практическое значение ионного произведения воды Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH). 19. Гидролиз по катиону и аниону. Необратимый гидролиз. Константа и степень гидролиза. Расчёт pH. Гидролиз - это химическая реакция ионного обмена между водой и растворённым в ней веществом с образованием слабого электролита. (В общем случае обменное взаимодействие растворённого вещества с растворителем носит название - сольволиз). В большинстве случаев гидролиз сопровождается изменением pH раствора. Гидролиз по катиону. Соли слабого основания и сильной кислоты гидролизуются по катиону Гидролиз по аниону. Соли, образованные сильным основанием и слабой (ассоциированной) кислотой гидролизуются по аниону: Гидролиз по катиону и аниону. Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону и по аниону: +  Степень гидролиза. Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр); α = (cгидр/cобщ)·100 % Является количественной характеристикой гидролиза. Константа гидролиза.Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов. Расчёт pH.Величина pH используется для характеристики кислотности раствора. Если концентрация ионов водорода равна [H+], то pH = -lg [H+] В чистой воде [H+] = [OH-] = 10-7 В кислых растворах pH < 7 В щелочных растворах pH > 7 Для более точного определения значения pH растворов используют сложную смесь нескольких индикаторов, нанесенную на фильтровальную бумагу (так называемый "Универсальный индикатор Кольтгоффа"). Полоску индикаторной бумаги обмакивают в исследуемый раствор, кладут на белую непромокаемую подложку и быстро сравнивают окраску полоски с эталонной шкалой для pH:   20. Буферные растворы, природные буферные системы. Расчёт pH буферных систем, буферная ёмкость. БУФЕРНЫЕ РАСТВОРЫ – растворы, концентрация ионов водорода (рН) которых не изменяется от прибавления ограниченных количеств сильной кислоты или щелочи (см. водородный показатель). Б.р. состоят из смеси раствора слабой кислоты и ее соли сильного основания или, наоборот, — слабого основания и его соли сильной кислоты. Многие природные жидкости обладают буферными свойствами. Примером может служить вода в океане, буферные свойства которой во многом обусловлены растворенным углекислым газом и гидрокарбонат-ионами НСО3–. Источником последних, помимо СО2, являются огромные количества карбоната кальция в виде раковин, меловых и известняковых отложений в океане. Интересно, что фотосинтетическая деятельность планктона – одного из основных поставщиков кислорода в атмосферу, приводит к повышению рН среды. Происходит это в соответствии с принципом Ле Шателье в результате смещения равновесия при поглощении растворенного углекислого газа. Когда в ходе фотосинтеза из раствора удаляется СО2, равновесие смещается вправо и среда становится более щелочной. В клетках организма гидратация СО2 катализируется ферментом карбоангидразой. Клеточная жидкость, кровь также являются примерами природных буферных растворов. Так, кровь содержит около 0,025 моль/л углекислого газа, причем его содержание у мужчин примерно на 5% выше, чем у женщин. Примерно такая же в крови концентрация гидрокарбонат-ионов (их тоже больше у мужчин). Расчет рН буферных систем. для кислотных буферных систем: рН = рК(кислоты) + lg Для основных буферных систем: рН =14 – рК(основания) – lg где рК(кислоты), рК(основания) - отрицательный десятичный логарифм константы электролитической диссоциации слабой кислоты; слабого основания. Из этих уравнений видно, что рН кислотной (основной) буферной системы зависит от природы слабого электролита (рК(кислоты), рК(основания)) и от соотношения концентраций соли и кислоты (основания). Буферная ёмкость раствора — способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+). 21. Кислоты и основания по Льюису. Определение Льюиса. Льюис предложил более общее определение: кислота — это вещество, которое акцептирует электронную пару; основание — это вещество, которое предоставляет электронную пару. Взаимодействие между кислотой и основанием, согласно этому определению, заключается в возникновении ковалентной связи по донорно-акцепторному механизму: На основании определений Льюиса все обычные лиганды (NH3, CN-, F-, Cl- и др.) можно рассматривать как основания, а все ионы металлов — как кислоты. Степень сродства иона металла к лиганду называют льюисовской кислотностью, а тенденция лиганда образовывать связи с ионом металла называется льюисовской основностью. Силы кислот и оснований Льюиса могут меняться в зависимости от природы партнера. 22. Гетерогенные равновесия. Произведение растворимости. Равновесие в гетерогенной системе в системе при условиях возможен переход вещества из одной фазы в другую. Признаком того, что система также находится в равновесии, т. е. не происходит перехода какого-либо компонента из одной фазы в другую, является равенство удельных химических потенциалов данного компонента в рассматриваемых фазах. Одним из важнейших законов гетерогенного равновесия является правило фаз. Оно оперирует с основными понятиями о компоненте, фазе и числе степеней свободы. Два первых понятия определены выше. Под термодинамическими степенями свободы подразумеваются независимые параметры системы, находящиеся в термодинамическом равновесии, которые могут принимать произвольные значения в определенном интервале, причем число фаз не изменяется. Число степеней свободы (вариантность системы) – это число, указывающее, скольким параметрам, характеризующим состояние равновесной системы, можно давать произвольные значения без того, чтобы число фаз в системе изменилось. Правило фаз: В изолированной равновесной системе число фаз плюс число степеней свободы равно числу компонентов плюс 2 φ + V = k + 2 Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная. 23. Химическая связь: типы связи, механизмы образования, характеристики. Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами). Основные характеристики химической связи — прочность, длина, полярность. Типы связи
Механизмы образования химической связи В методе валентных связей различают обменный и донорно-акцепторный механизмы образования химической связи. Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Особенностью образования соединений по обменному механизму является насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество связей. Основные характеристики химической связи: Энергия связи (ЕСВ ) – минимальная энергия, необходимая для разрушения связи. Измеряется в электронвольтах . Энергия связи является характеристикой прочности связи – чем выше энергия связи, тем прочнее связь. Длина связи (LСВ )– расстояние между ядрами связанных атомов. Измеряется в нанометрах (нм) или в ангстремах (А). Чем короче связь, тем она, как правило, прочнее. Насыщаемость связи – если атом образует конечное число связей с другими атомами (обычно не более 8) – связь насыщаема, если бесконечно большое (больше 1000) – ненасыщаема. Направленность связи – если в пространстве существуют определенные направления, вдоль которых распространяется действие связи, то связь направлена, если таких направлений нет – то ненаправлена. Энергия и длина связи характерны для любой химической связи, насыщаемость и направленность зависят от вида связи. 24. Комплексные соединения (КС). Строение КС. Номенклатура КС. Классификация КС. Характер связи в КС. Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером. Комплексные соединения, имеющие внешнюю сферу, в водном растворе полностью диссоцируют на комплексный малодиссоцирующий катион ([Ag(NH3)2]+) или анион ([Fe(CN)6]3−). Комплексные соединения без внешней сферы в воде нерастворимы (например, карбонилы металлов). Комплексные соединения разнообразны и многочисленны. Строение комплексных соединений Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами.  . Номенклатура 1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион. 2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил. 3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д. 4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя. 5) После обозначения состава внутренней сферы называют внешнюю сферу. Примеры: K3[Fe(CN)6] — гексацианоферрат(III) калия (NH4)2[PtCl4(OH)2] — дигидроксотетрахлороплатинат(IV) аммония [Сr(H2O)3F3] — трифторотриаквахром [Сo(NH3)3Cl(NO2)2] — динитритохлоротриамминкобальт [Pt(NH3)4Cl2]Cl2 — хлорид дихлоротетраамминплатины(IV) [Li(H2O)4]NO3 — нитрат тетрааквалития |
