Ответы по химии!
 Скачать 1.34 Mb. Скачать 1.34 Mb.
|
КлассификацияСуществует несколько классификаций комплексных соединений в основу которых положены различные принципы. По заряду комплекса1) Катионные комплексы [(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II) [Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II) 2) Анионные комплексы K2[BeF4] — тетрафторобериллат(II) калия Li[AlH4] — тетрагидридоалюминат(III) лития K3[Fe(CN)6] — гексацианоферрат(III) калия 3) Нейтральные [Ni(CO)4] — тетракарбонилникель [Pt(NH3)2Cl2] — дихлородиамминплатина(II) По числу мест, занимаемых лигандами в координационной сфереСтруктура комплексного иона, образованного катионом металла и анионом ЭДТА 1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, и др.). 2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−, тиосульфат-ион S2O32−. 3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.). По природе лиганда1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др. 2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др. 3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4]. 4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6]. 5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др. Химическая связь в комплексных соединениях. Метод валентных связей является весьма наглядным способом описания комплексных соединений. В его основе лежат следующие положения:
25.Диссоциация комплексных ионов. Константа нестойкости. Комплексообразование в организме. 1)При растворении комплексных ионов в воде происходит распад (диссоциация), причем внутренняя сфера ведет себя как единое целое: K[Ag(CN)2] = K+ + [Ag(CN)2]- Происходит диссоциация внутренней сферы: [Ag(CN)2]- = Ag+ + 2CN- 2)Для характеристики комплексного соединения (иона) вводится константа нестойкости: [Ag+][CN-](числитель) Kнестоикости= [Ag(CN)2]- (знаменатель) =10-22 Чем константа нестоикости меньше, тем комплексное соединение более прочное. 3) Комплексообразование в организме: в живом организме d-элементы представлены в основном, как микроэлементы. «Свободных» ионов Me в организме нет, т.к. они либо гидролизуются, либо гидратитированы, либо существуют в виде К.С.. Чаще всего в биохимических реакциях d-элементы участвуют в качестве биоорганических комплексов Me. Их лигандами могут быть аминокислотные остатки, пептиды, белки, гормоны, нуклеиновые кислоты и некоторые другие. Биоорганические комплексы d-элементов называют биокластерами. В них входят Me, которые взаимодействуют с донорными атомами связывающих групп: ОН, сульфогидрильные – SH, NH2 белков или аминов, COO-. 26.Изомерия КС. Комплексообразование в организме. Изомерия КС:
[Cr(H2O)6]Cl3 (фиолетовый) и [Cr(H2O)5Cl]Cl2H2O (зеленый)
[Pt(NH)4Cl2]Br2 и [Pt(NH)4Br2]Cl2
[Co(NH3)6][Fe(CN)6] и [Fe(NH3)6][Co(CN)6]
[clclPtNH3NH3] [clNH3PtclNH3]
[Cr(en)2Cl2]+ 27.Строение гемма Наиболее известным переносчиком кислорода является гемоглобин. Он присутствует в организмах позвоночных, а также и ряда беспозвоночных (например, двустворчатых моллюсков, морских многощетинковых червей, голотурий). Молекула гемоглобина состоит из белковой части - глобина и гсма - комплекса Fe(II) с одним из порфиринов -так называемым протопорфирином IX. Порфирин - это циклическая молекула, в состав которой входит 4 пиррольные группы. Так выглядит молекула гема: 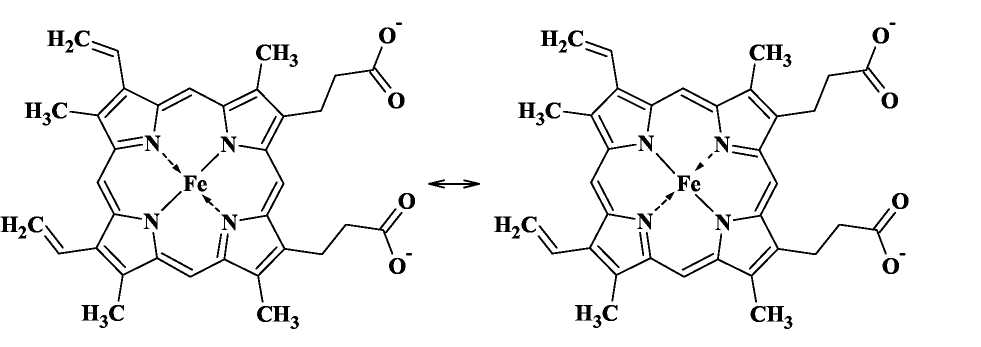 Атом железа образует с атомами азота две ковалентные и две координационные (донорно-акцепторные) связи. В действительности же все 4 связи Fe-N почти равноценны (как и 4 связи N-H в катионе аммония), поэтому вклад резонансных структур примерно одинаков. С трех сторон порфириновый цикл гема содержит гидрофобные заместители -метальные и винильные группы, а с четвертой стороны - две гидрофильные карбоксильные группы, которые в нейтральной среде находятся в анионной форме СОО-. Координационное число атома железа в геме равно 4, поэтому он может образовывать еще две координационные связи, дополняя свое окружение до октаэдрического. 28. ОВР и их биологическая роль. Окисли́тельно-восстанови́тельные реа́кции, также редокс — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Вещества, содержащие атомы, которые понижают свою степень окисления, называют окислителями, а вещества, содержащие атомы, которые повышают степень окисления, - восстановителями.
2. Внутримолекулярные окислительно-восстановительные реакции характеризуются тем, что атомы, изменяющие свои степени окисления, находятся в одной и той же молекулярной частице: -3 +6 О +3 (NH4)2Cr2O7 = N2 + Cr2O3 + 4Н2О Биологическая роль: Окислительно-восстановительные реакции играют огромную роль в природе. Без этих реакций невозможна жизнь. Дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды - все это окислительно-восстановительные процессы. Большинство химических реакций, происходящих в природе - окислительно-восстановительные. 29.Классификация дисперсных систем. Классификация дисперсных систем по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсной средой. Дисперстные системы – системы, состоящие из частиц одной фазы, которые распределены в другой фазе. 1) 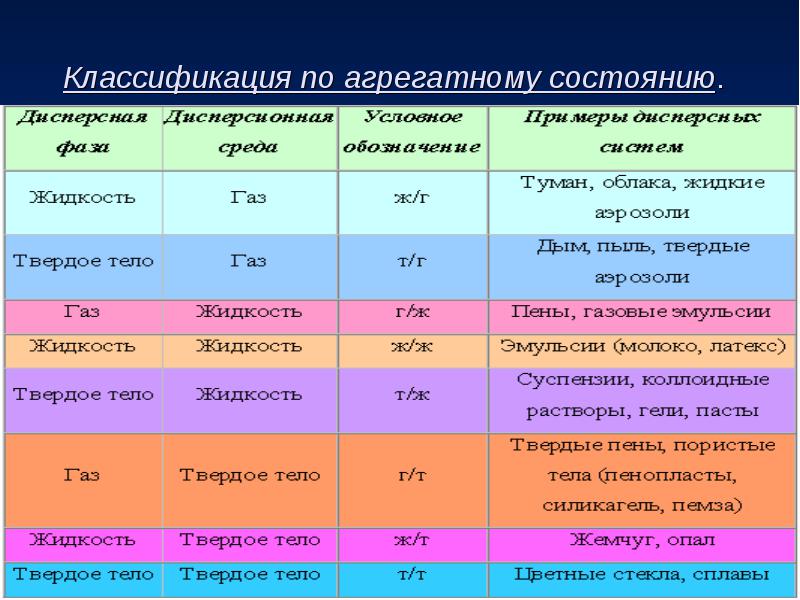 2)По степени раздробленности (дисперсности) Коллоидная дисперсность: Т1/Г2 – пыль в верхних слоях атмосферы, аэрозоли. Т1/Ж2 – лиозоли, дисперсные красители вводе, латексы синтетических полимеров. Грубая дисперсность: Т1/Г2 – дымы Ж1/Г2 – туманы Т1/Ж2 – суспензии Ж1/Ж2 – жидкие эмульсии Г1/Ж2 – газовые эмульсии 3)По силе взаимодействия между дисперстной средой и дисперстной фазой: Лиофильные: сильное межмолекулярное взаимодействие веществ фазы и среды с образованием сольватных оболочек из молекул дисперстной среды (мыла, глины). Лиофобные: слабое взаимодействие вещества дисперстной фазы со средой (пены, лиозоли, аэрозоли, эмульсии). 30. Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления. Коллоидные системы, коллоиды (др.-греч. κόλλα — клей + εἶδος — вид; «клеевидные») — дисперсные системы, промежуточные между истинными растворами и грубодисперсными Специфической особенностью коллоидных растворов по сравнению с истинными является их агрегативная неустойчивость, т.е. способность разделяться на фазы под влиянием незначительных внешних воздействий. Но главной причиной устойчивости коллоидных систем считают наличие одноименного заряда на поверхности коллоидных частиц. Частицы не могут подойти близко друг к другу из-за электростатического отталкивания одинаковых по знаку зарядов. С современной точки зрения, заряд на коллоидных частицах обусловлен наличием на их поверхности двойного электрического слоя (ДЭС) из ионов, возникающего либо в результате избирательной адсорбции одного из ионов электролита, находящегося в растворе, либо за счет ионизации поверхностных молекул вещества. Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ, группа явлений, наблюдаемых в дисперсных системах, мембранах и капиллярах; включает электроосмос, электрофорез, потенциал течения и потенциал оседания (седиментационный потенциал, или эффект Дорна). Электроосмос - течение жидкости в капиллярах и пористых телах, вызванное внеш. электрич. полем; обратное ему электрокинетическое явление - потенциал течения - появление электрич. разности потенциалов на концах капилляра или мембраны при протекании жидкости. Электрофорез - движение твердых частиц или капель, взвешенных в электролите, при наложении электрич. поля. Обратное электрокинетическое явление-появление электрич. разности потенциалов на границах облака оседающих (седиментирующих) частиц, взвешенных в электролите (эффект Дорна). 31. Методы очистки коллоидных растворов. Диализ, электролиз, ультрафикация. При получении коллоидных растворов тем или иным методом, особенно с помощью химических реакций, практически невозможно точно предусмотреть необходимое количественное соотношение реагентов. По этой причине в образовавшихся золях может присутствовать чрезмерный избыток электролитов, что снижает устойчивость коллоидных растворов. Для получения высокоустойчивых систем и для изучения их свойств золи подвергают очистке как от электролитов, так и от всевозможных других низкомолекулярных примесей. Очистку коллоидных растворов можно проводить либо методом диализа, либо ультрафильтрацией. Диализ заключается в извлечении из золей низкомолекулярных веществ чистым растворителем с помощью полупроницаемой перегородки (мембраны), через которую не проходят коллоидные частицы. Периодически или непрерывно сменяя растворитель в приборе для диализа — диализаторе, можно практически полностью удалить из коллоидного раствора примеси электролитов и низкомолекулярных неэлектролитов. Недостатком метода является большая длительность процесса очистки (недели, месяцы). Электродиализ — это процесс диализа, ускоренный путем применения электрического тока. Прибор для его осуществления называют электродиализатором. Простейший электродиализатор представляет собой сосуд, разделенный двумя мембранами на три камеры. В среднюю камеру наливают подлежащий очистке коллоидный раствор. В боковые камеры помещают электроды от источника постоянного тока и обеспечивают подвод и отвод растворителя (воды). Под действием электрического поля происходит перенос катионов из средней камеры в катодную камеру, анионов — в анодную. Раствор в средней камере может быть в течение корот-кого времени (минуты, часы) очищен от растворенных солей. Ультрафильтрация — фильтрование коллоидного раствора через полупроницаемую мембрану, пропускающую дисперсионную среду с низкомолекулярными примесями и задерживающую частицы дисперсной фазы или макромолекулы. Для ускорения процесса ультрафильтрации ее проводят при перепаде давления по обе стороны мембраны: под разрежением (вакуумом) или под повышенным давлением. Вакуум создают откачиванием воздуха из расположенного под фильтром сосуда, повышенное давление — нагнетанием воздуха в сосуд, расположенный над фильтром. Для предотвращения разрыва мембраны ее помещают на твердую пористую пластинку. Ультрафильтрация позволяет скорее отделить от коллоидного раствора электролиты и другие примеси (низкомолекулярные органические соединения), чем это происходит при диализе. При ультрафильтрации достигают высокой степени очистки золя, периодически разбавляя последний водой. На конечной стадии путем отсасывания дисперсионной среды можно сконцентрировать коллоидный раствор. Ультрафильтрация может применяться в сочетании с электродиализом (электроультрафильтрация), благодаря чему значительно ускоряется удаление солей из коллоидного раствора. Поскольку поры обычной фильтровальной бумаги легко пропускают коллоидные частицы, при ультрафильтрации в качестве мембраны применяют специальные фильтры (целлофан, пергамент, асбест, керамические фильтры и т. п.). Применение мембраны с определенным размером пор позволяет разделить коллоидные частицы на фракции по размерам и ориентировочно определить эти размеры. Так были найдены размеры некоторых вирусов и бактериофагов. Все это говорит о том, что ультрафильтрация является не только методом очистки коллоид» ных растворов, но может быть использована для целей дисперсионного анализа и препаративного разделения дисперсных систем. 32.. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов. Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого(Вещество, которое присутствует в меньшем количестве, диспергирует и распределено в объеме другого, называют дисперсной фазой.Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсной средой) 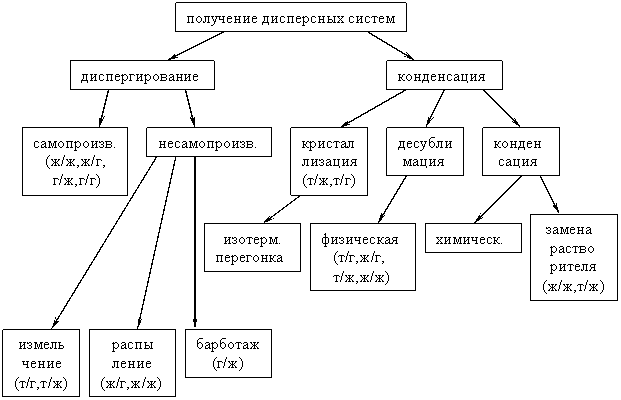 |
