Коллоидная химия. Коллоидная химия Коллоидная химия наука о поверхностных явлениях и дисперсных системах. Поверхностное явление
 Скачать 1.77 Mb. Скачать 1.77 Mb.
|
|
| Система | Признак | Тип |
| Трехмерные | 3 | Объемные |
| Двумерные | 2 | Тонкие пленки |
| Одномерные | 1 | Капилляры |
по кинетическому состоянию ДФ
кинетическое состояние ДФ
 свободнодисперсные связнодисперсные
свободнодисперсные связнодисперсные
 (капиллярные тела)
(капиллярные тела)
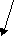 Золи суспензии макропористые
Золи суспензии макропористые микропористые (>200 нм)
(<2 нм) переходнопористые
Гели пасты (2 – 200 нм)
-
ДФ
ДС
Тип
Тв
Тв
Минералы
Тв
Ж
Коллоидные растворы
Тв
Г
Дым
Ж
Тв
Сок растений, почва
Ж
Ж
Эмульсии (молоко)
Ж
Г
Туман
Г
Тв
Твердые пены (капиллярно – пористые тела)
Г
Ж
Пены (мыльная)
Г
Г
Для коллоидной химии нет
по энергии взаимодействия ДС и ДФ:
Лиофильные (сильное взаимодействие).
Лиофрбные (слабое взаимодействие).
по величинам удельной поверхности:
 - для частиц сферической формы (м-1)
- для частиц сферической формы (м-1)Поверхностная энергия GS:
Поверхностная энергия может преобразовываться в энергию Гиббса, тепловую работу, механическую работу, в работу химическую, в электрическую энергию.
Свойства дисперсных систем:
Молекулярно – кинетические (диффузия, осмос, седиментация).
Оптические (светопоглощение и светорассеяние).
Электро-кинетические (электрофорес, электроосмос, потенциал седиментации, потенциал течения).
Молекулярно – кинетические свойства
МКТ рассматривает дисперсные системы с позиции истинных растворов, т. е. ДС – это растворитель, а ДФ – растворенное вещество. Выделяют следующие свойства: броуновское движение, осмос, седиментация. Для дисперсионных систем характерны два вида устойчивости:
Агрегативное – устойчивость по отношению к слипанию.
Седиментационная – по отношению к силе тяжести.
Седиментация.
Седиментация – это движение частиц под действием силы тяжести. Потеря седиментационной устойчивости ведет к расслаиванию системы.
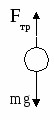 В начальный момент времени mg>Fтр (равноускоренное движение).
В начальный момент времени mg>Fтр (равноускоренное движение).В момент времени t, который соответствует установлению равновесие:
Закон Стокса:
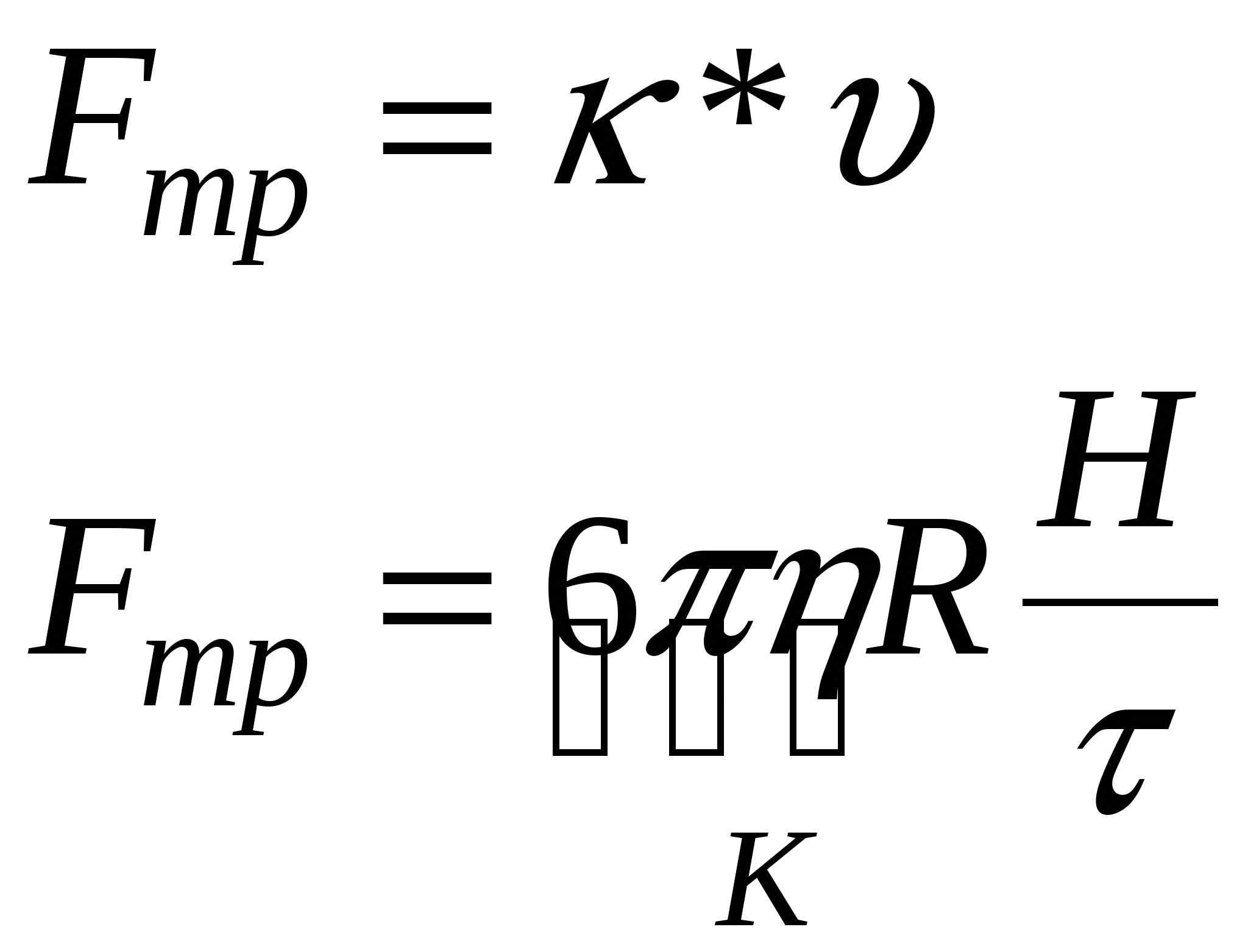 , где
, где 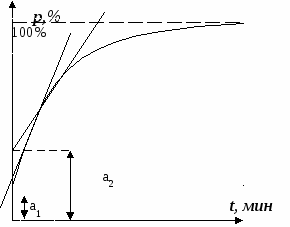
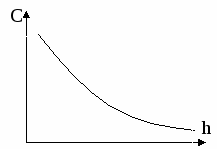
Кривая накопления (относительно изменения массы)- по ней находят кумулятивную фракцию - это доля частиц, осевших к данному моменту времени:
Э
 то отрезок, который отсекает на оси ординат касательная, проведенная к данной точке кривой накопления.
то отрезок, который отсекает на оси ординат касательная, проведенная к данной точке кривой накопления. После диффиренцирования:
Максимум и точка перегиба совпадают:
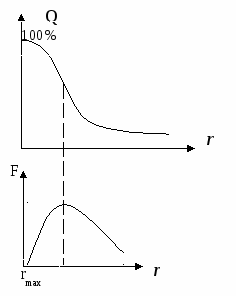
Система называется монодисперсной, если в ней преобладают частицы одного размера; если двух размеров – бидисперсная:
П
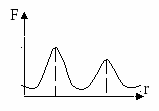 оли дисперсная:
оли дисперсная: 
Диффузия.
Диффузия – это процесс, направленный на выравнивание концентраций в первоначально неоднородной среде. По своей сути противоположен седиментации.
S
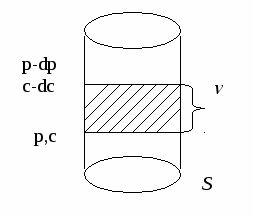 – площадь поперечного сечения, p-dp, c-dc.Давление и концентрация меньше, ν - расстояние
– площадь поперечного сечения, p-dp, c-dc.Давление и концентрация меньше, ν - расстояниеДва уровня. Движущей силой процесса диффузии выступает градиент осмотического давления:
N – число частиц (Na), С – концентрация, ν – высота
Получаем диффузионный поток:
- уравнение Эйнштейна (коэффициент диффузии).
Поскольку все направления движения равновероятны, была предложена проекция среднеквадратичного сдвига:
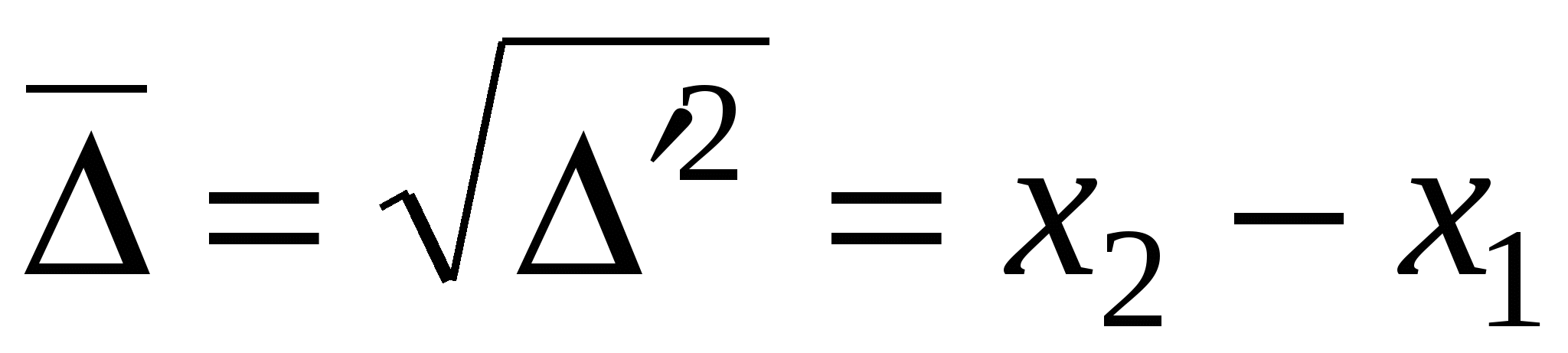 ,
, 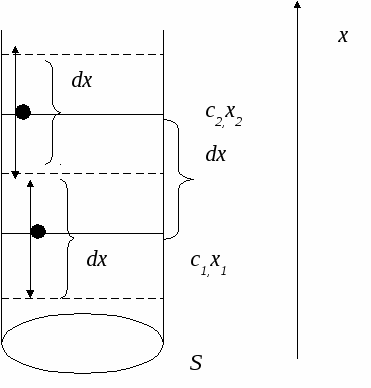 дут вверх:
дут вверх: Переносимая масса:
диффузионный поток в единицу времени через единицу поперечного сечения.
- уравнение для среднеквадратичного сдвига
D 10-11 – 10-14 м2/с, [D]=[м2/с]
Коэффициент диффузии – это поток вещества, переносимый через цилиндр с единичной площадью поперечного сечения в единицу времени.
Седиментационное диффузионное равновесие.
При условии постоянства Р и Т, т.е. при P=const, T=const.
Для системы, находящейся в состоянии равновесия справедливо:
Если система находится в поле действия постоянной силы, то
Согласно уравнению Гиббса-Дюгема
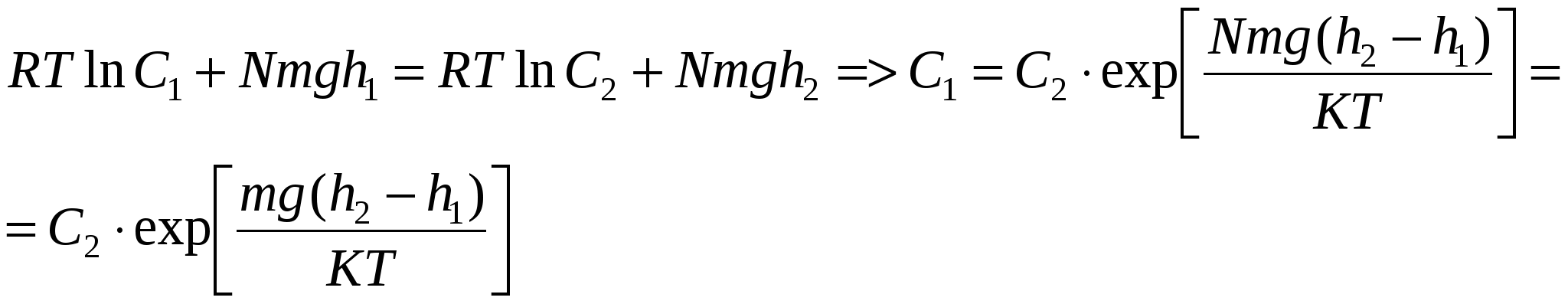
Пусть существует какой-то нулевой уровень, когда h2=0, h1=h.
С1
Осмос.
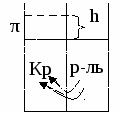
Осмосом называется движение растворителя (дисперсионной среды) к коллоидному раствору через полупроницаемую мембрану. Движущей силой осмотического процесса является неравенство химического потенциала по обе стороны от перегородки.
Кр = р-ль + ДФ, т.к. V1 = V2 = >
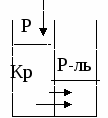
Чистка воды обратным осмосом:
Осмотическое давление рассчитывается по уравнению Вант-Гоффа:
Консервирс:
60 г/моль
30 г/моль 0,5 моль/л
Вирус:
Сm1≠Cm2, r1 = r2. Если растворы разной концентрации.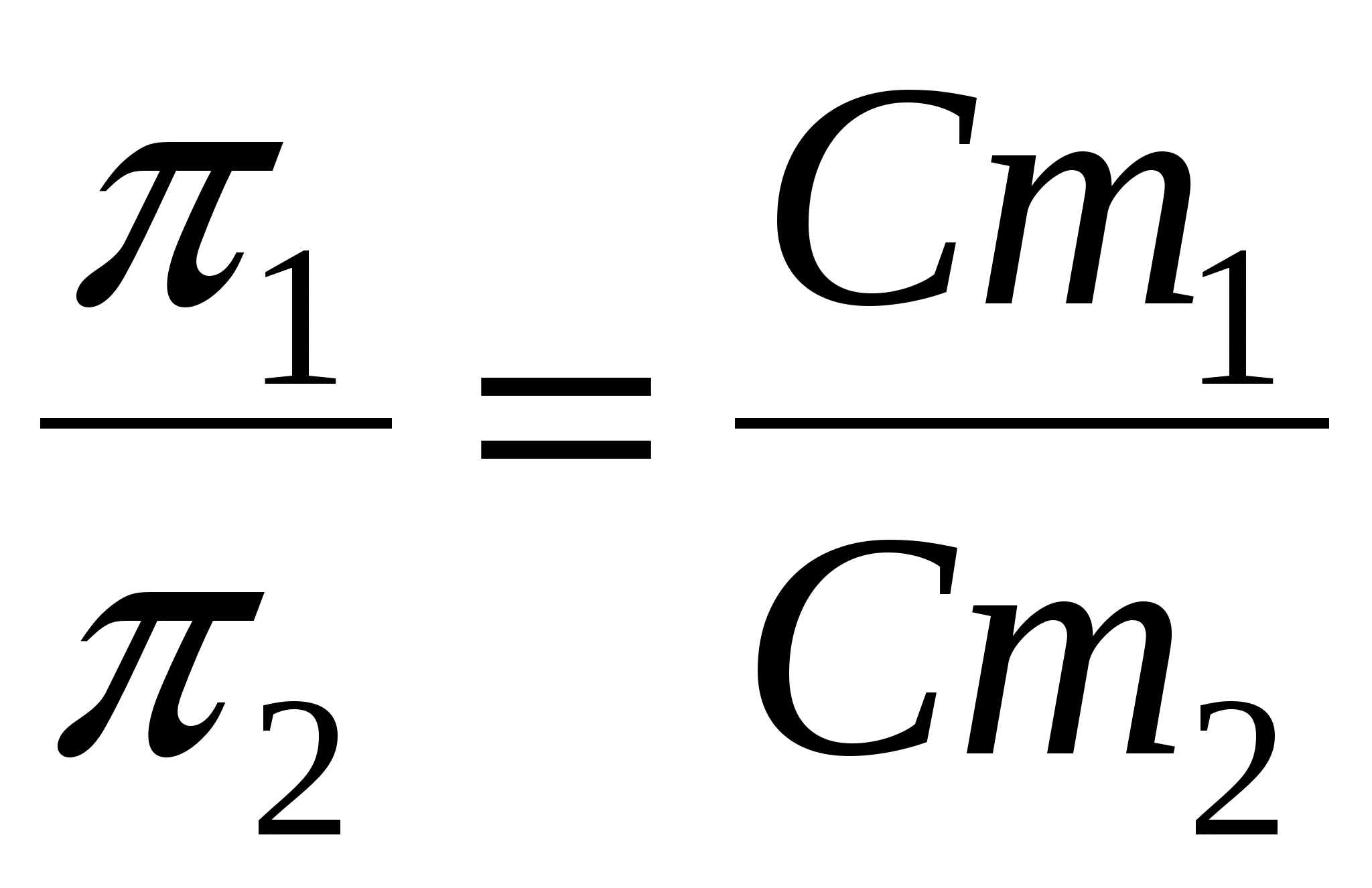
Cm1 = Cm2, но r1≠r2. =>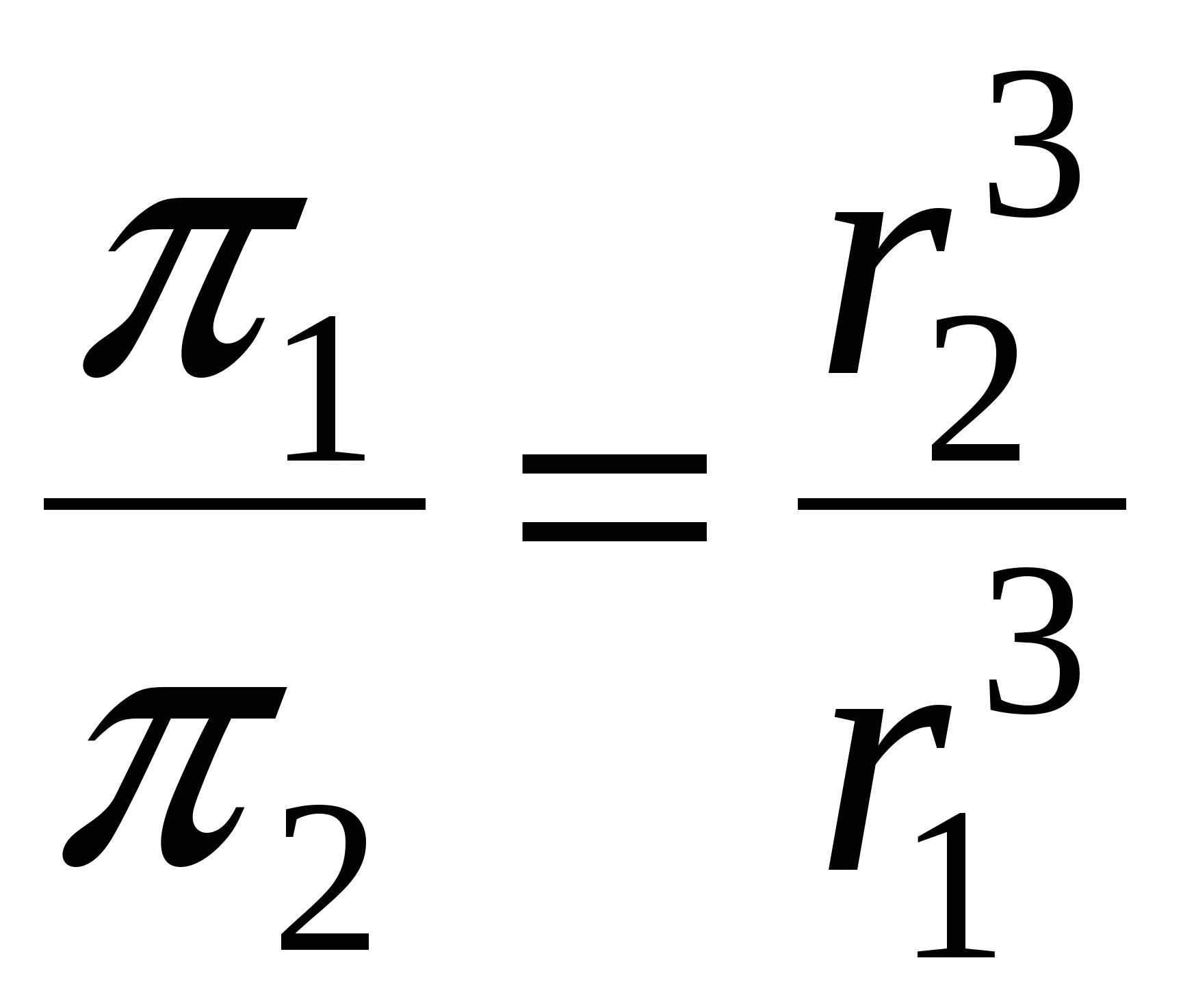 , т.к.
, т.к. 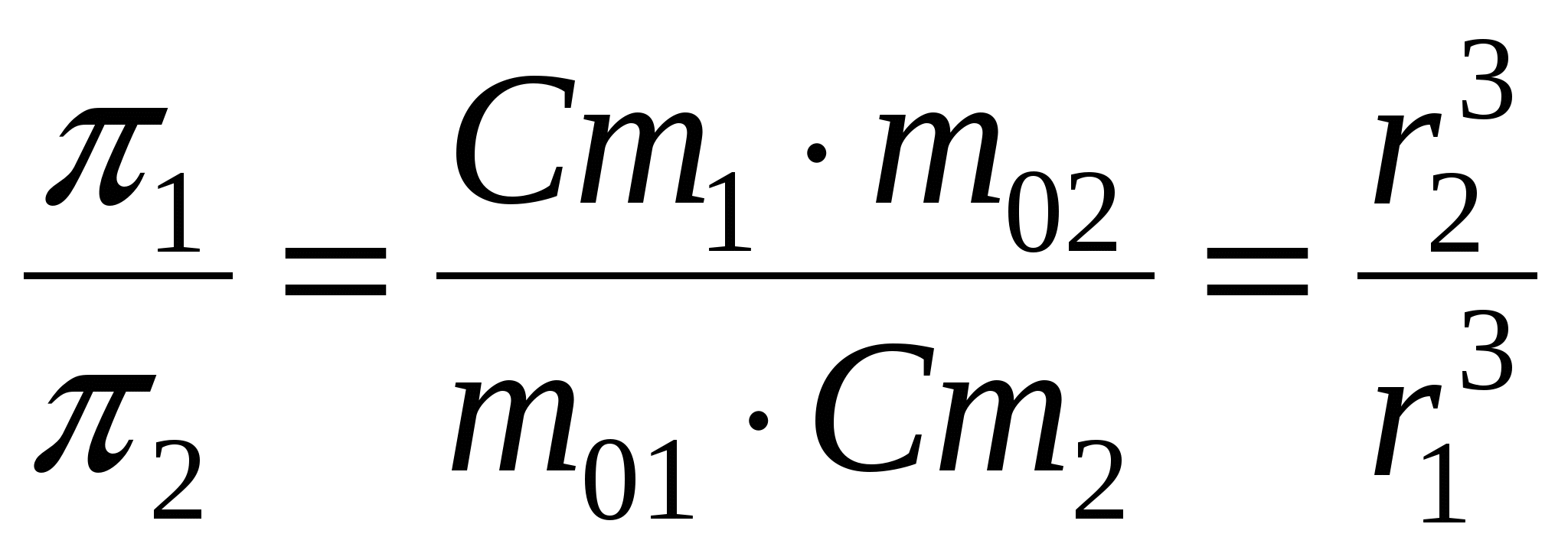 ;
; 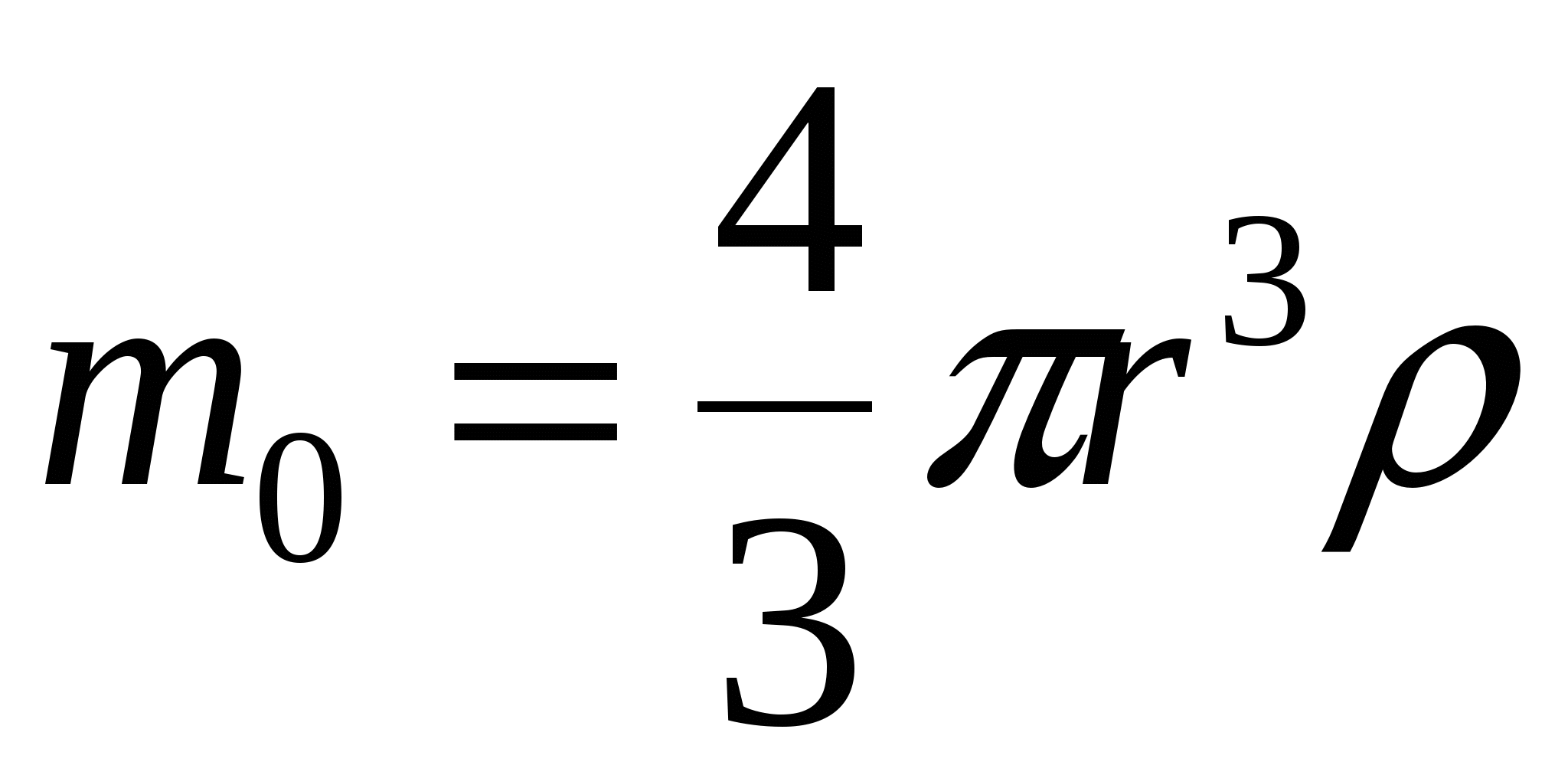 , т.е. где r1(ДФ) = 10-7н и r2(р-ль) = 10-3 = >
, т.е. где r1(ДФ) = 10-7н и r2(р-ль) = 10-3 = > 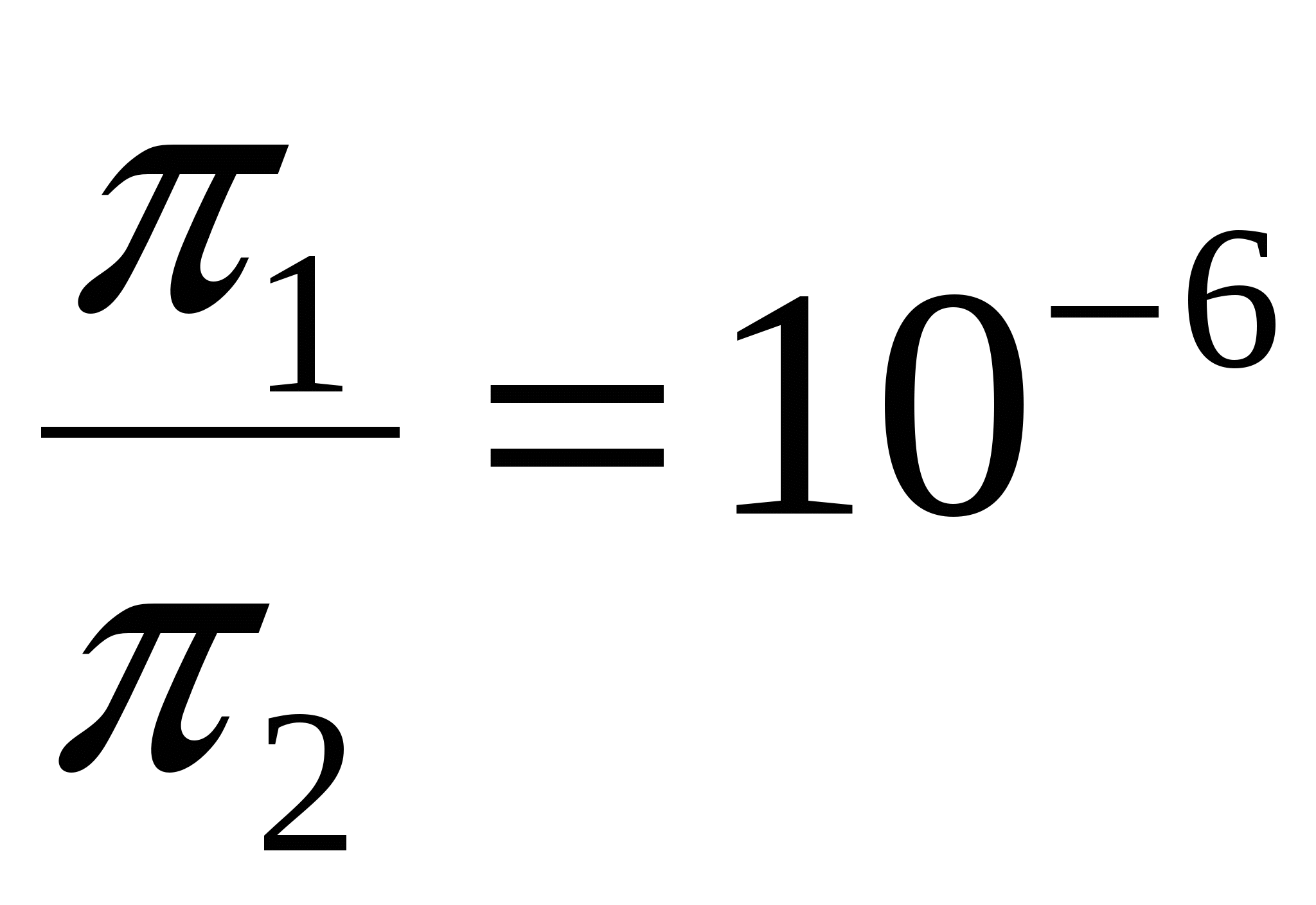
В коллоидных системах осмотическое давление много ниже, чем в истинных растворах.
Эндоосмос и эктоосмос: внутрь ограниченного объема; наружу.
Оптические Свойства. Светорассеяние и Светопоглощение.
В зависимости от типа поверхности можно рассматривать следующие ситуации:
1)
2)
3)
Для коллоидных систем характерно релеевское светорассеяние.
Условия:
1.
2. изотропная среда
3. «белый золь»: а) частицы не окрашены; б) частицы не электропроводны; в) сферическая форма.
4. концентрация мала
5. объем системы мал.
Световой поток с напряженностью
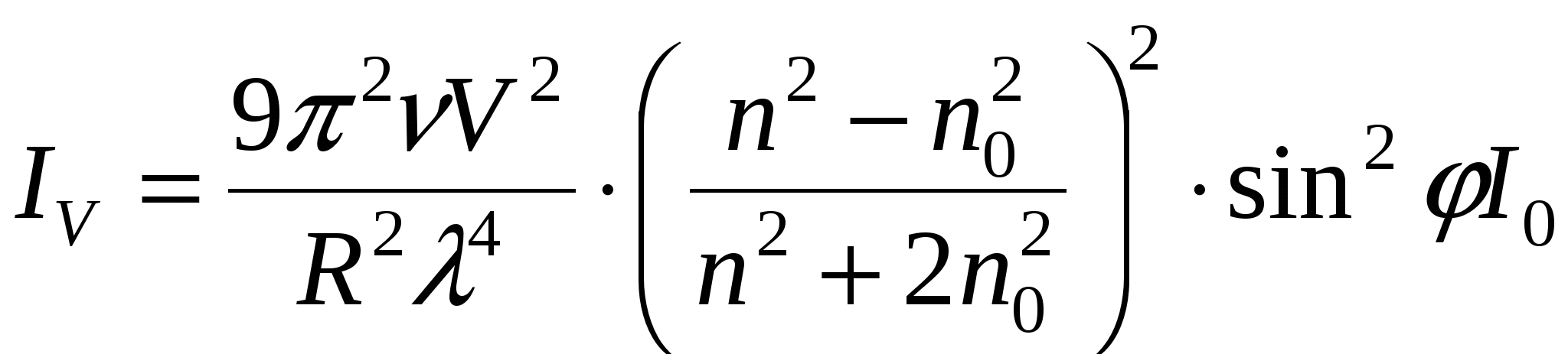 ,
,При светорассеянии света (световой поток) меняет направление, но не длину волны.
Не заштрихованная часть – неполяризованный свет, заштрихованная – поляризованный.
Сечение фигуры
Закон Релея:
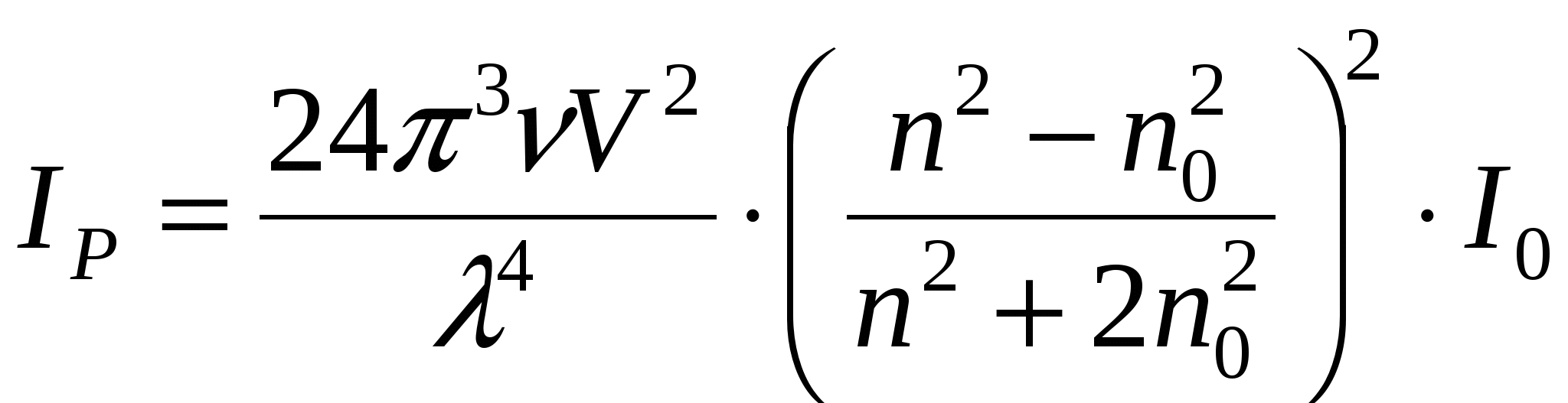 .
. Интенсивность рассеянного света пропорциональна числу частиц, их объему и обратно пропорциональна
Д
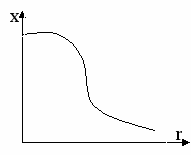 ля частиц сложной формы интенсивность рассеянного света IP
ля частиц сложной формы интенсивность рассеянного света IP 
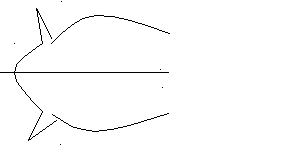
Индикатриса для частиц сложной формы
Светопоглощение.
Интенсивность проходящего света уменьшается на величину интенсивности света рассеянного во всех направлениях. Поэтому интенсивность поглощенного системой света будет зависеть от толщины слоя дисперсной системы через которую прошел свет.
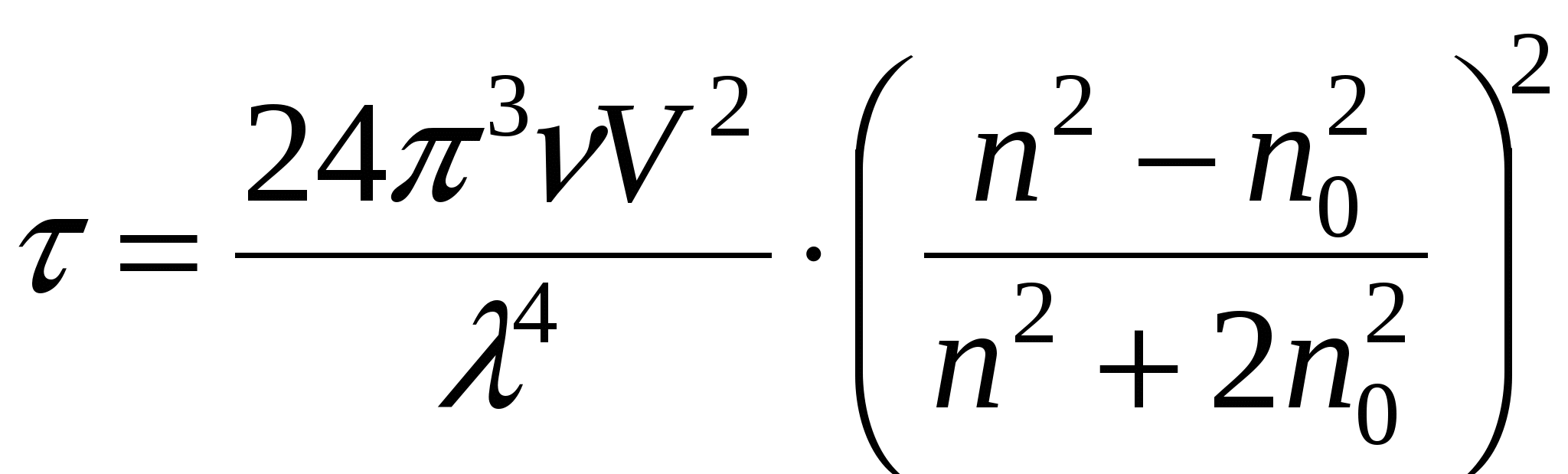 - мутность системы [м-1]
- мутность системы [м-1]Мутность – это величина, обратная расстоянию, на котором интенсивность падающего света ослабляется в е раз.
Для дисперсных систем окраска растворов – функция от размеров частицы, для молекулярных нет.
Увеличение размера частицы сдвигает максимум светопоглощения в сторону больших длин волн.
