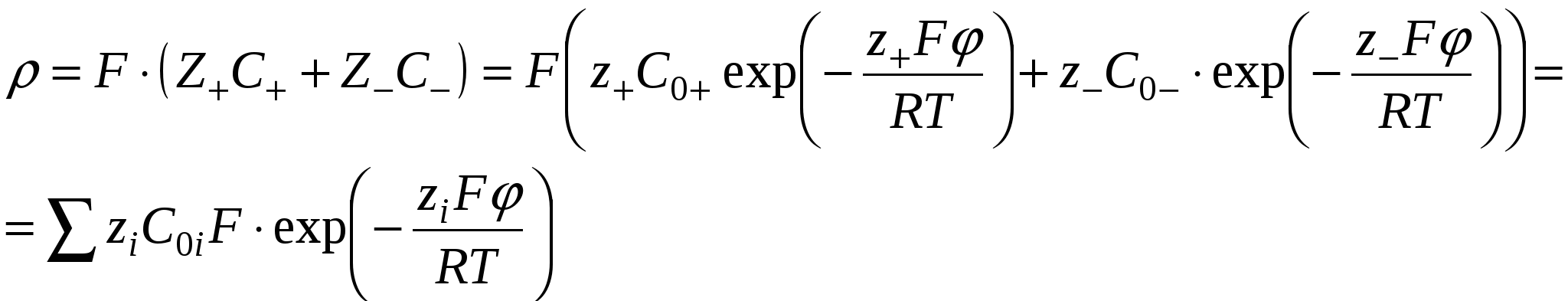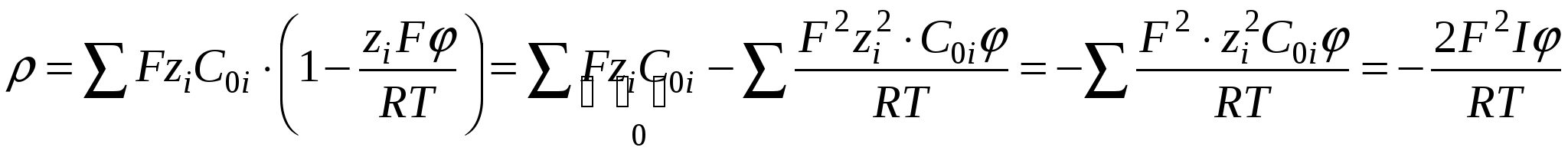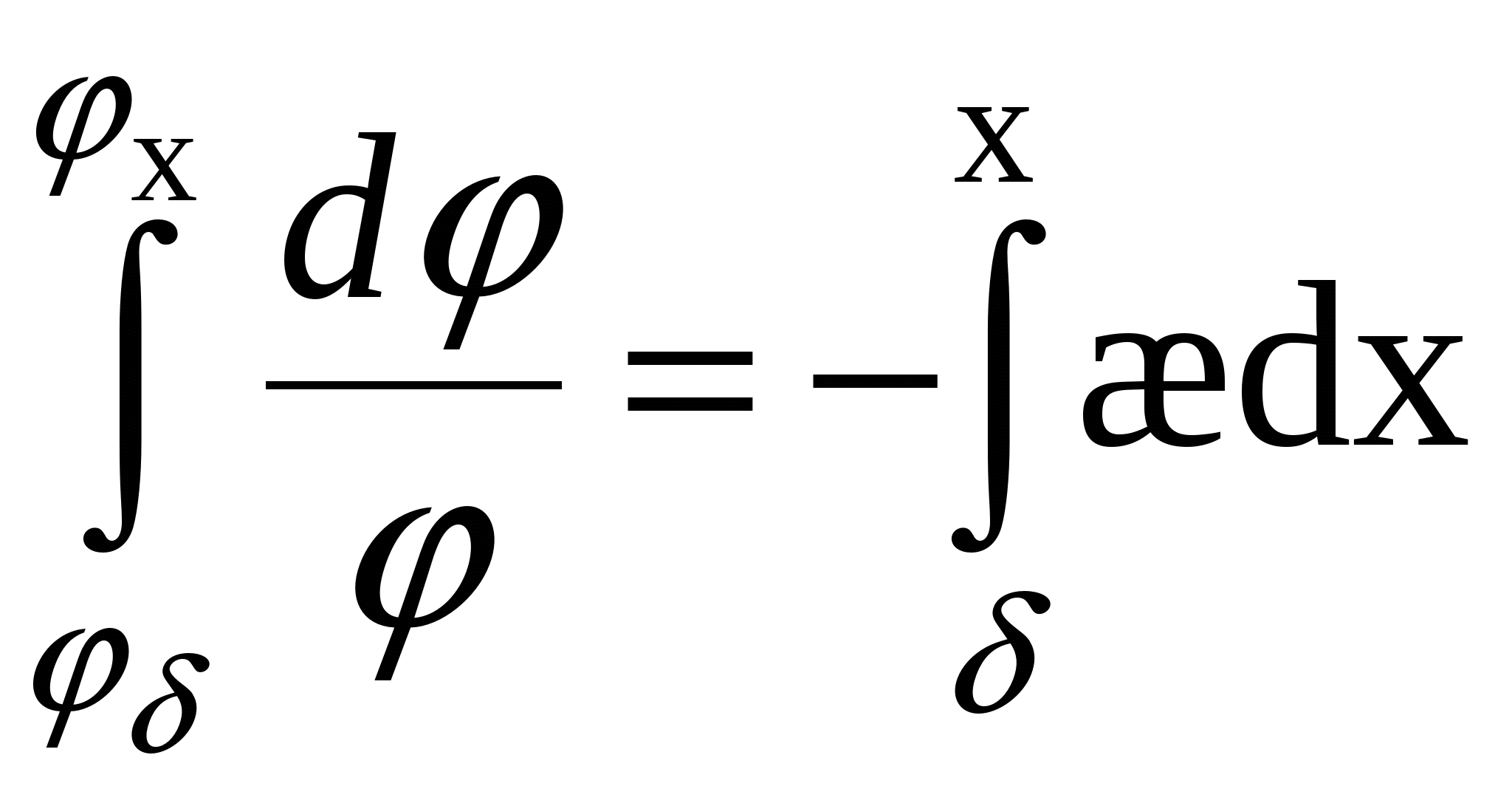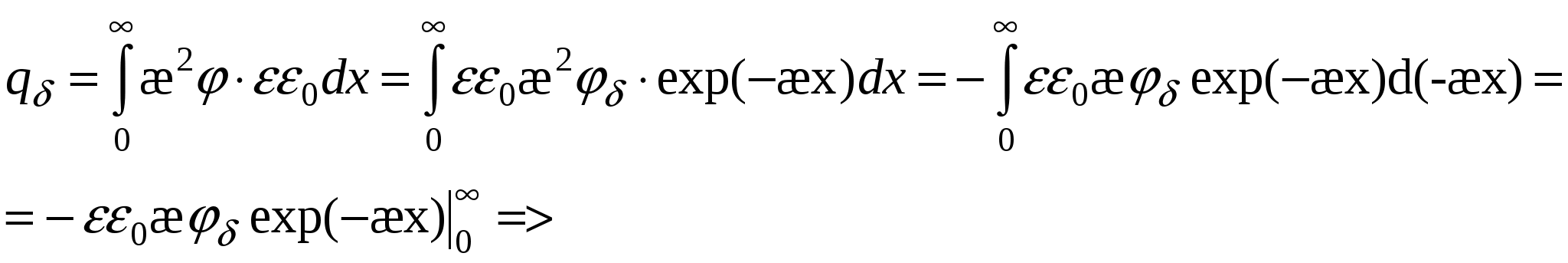|
|
Коллоидная химия. Коллоидная химия Коллоидная химия наука о поверхностных явлениях и дисперсных системах. Поверхностное явление
Адсорбция на границе твердое тело – жидкость.
В случае адсорбции на границе твердое тело – газ, мы пренебрегали одним компонентом. В случае адсорбции на границе твердое тело – жидкость адсорбат вытесняет с поверхности адсорбента молекулы растворителя.
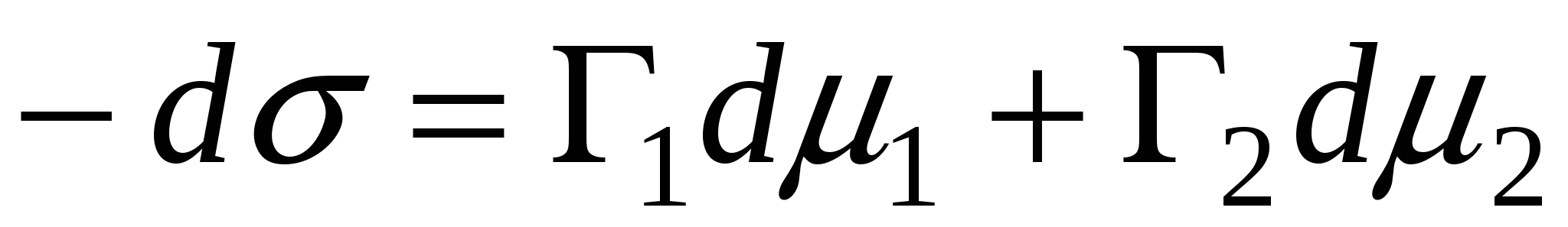
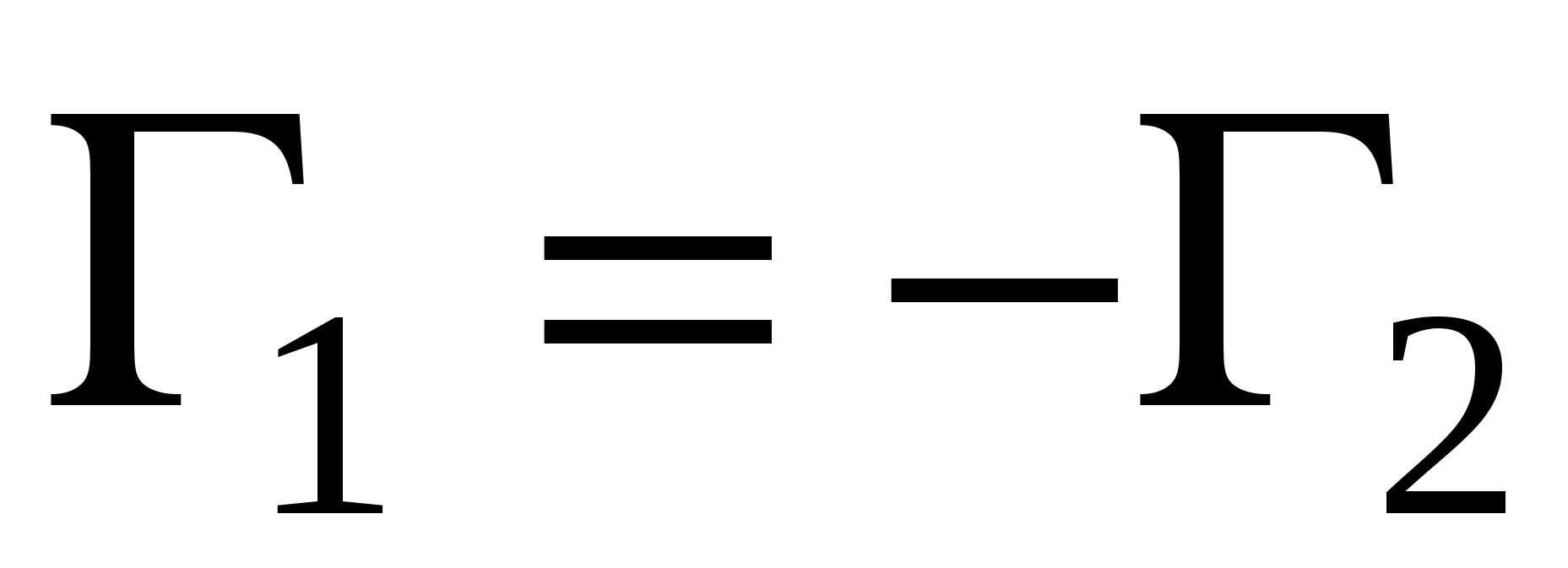 , ,
Справедливо уравнение:
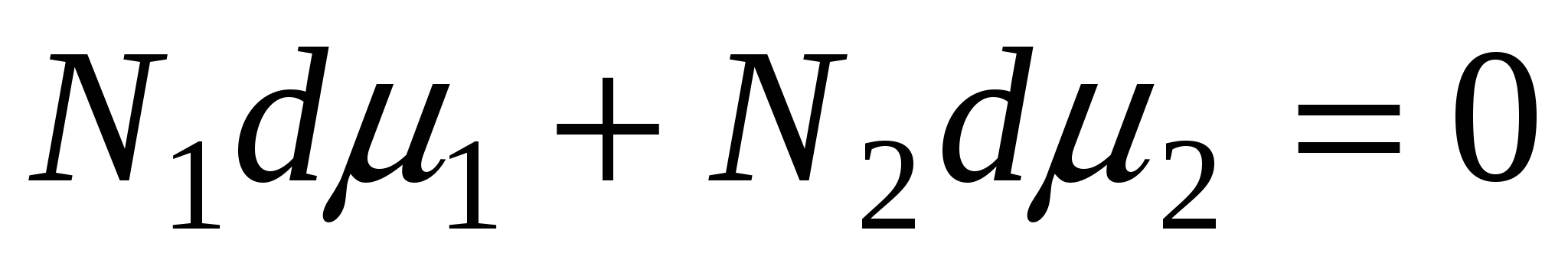
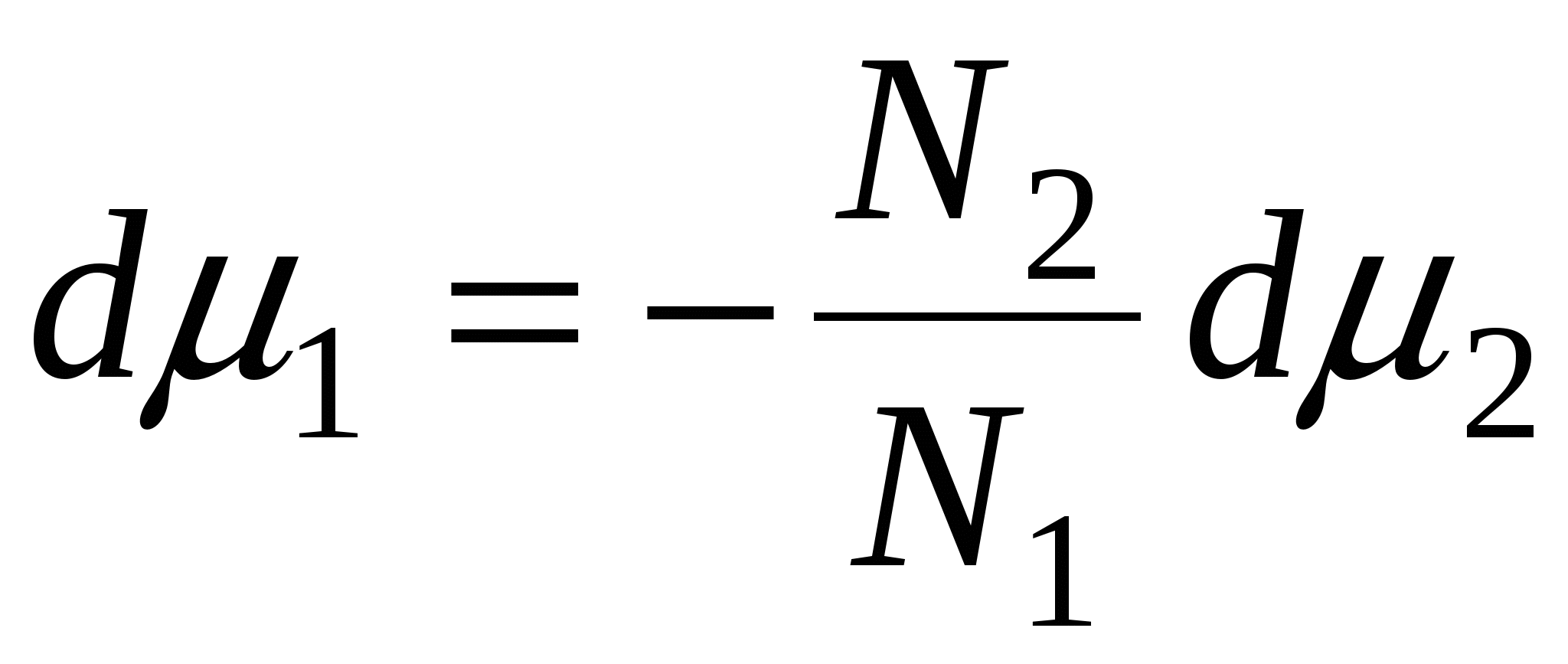
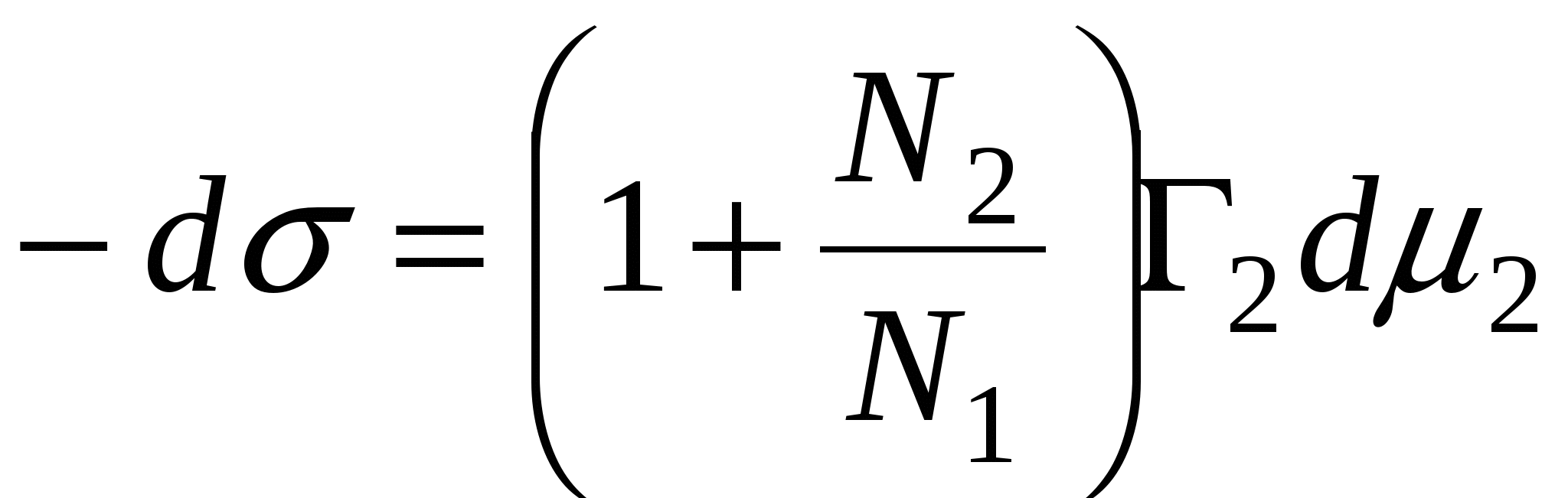 , ,
N1, N2 – мольные доли растворителя и компонента, N1 + N2 = 1, тогда
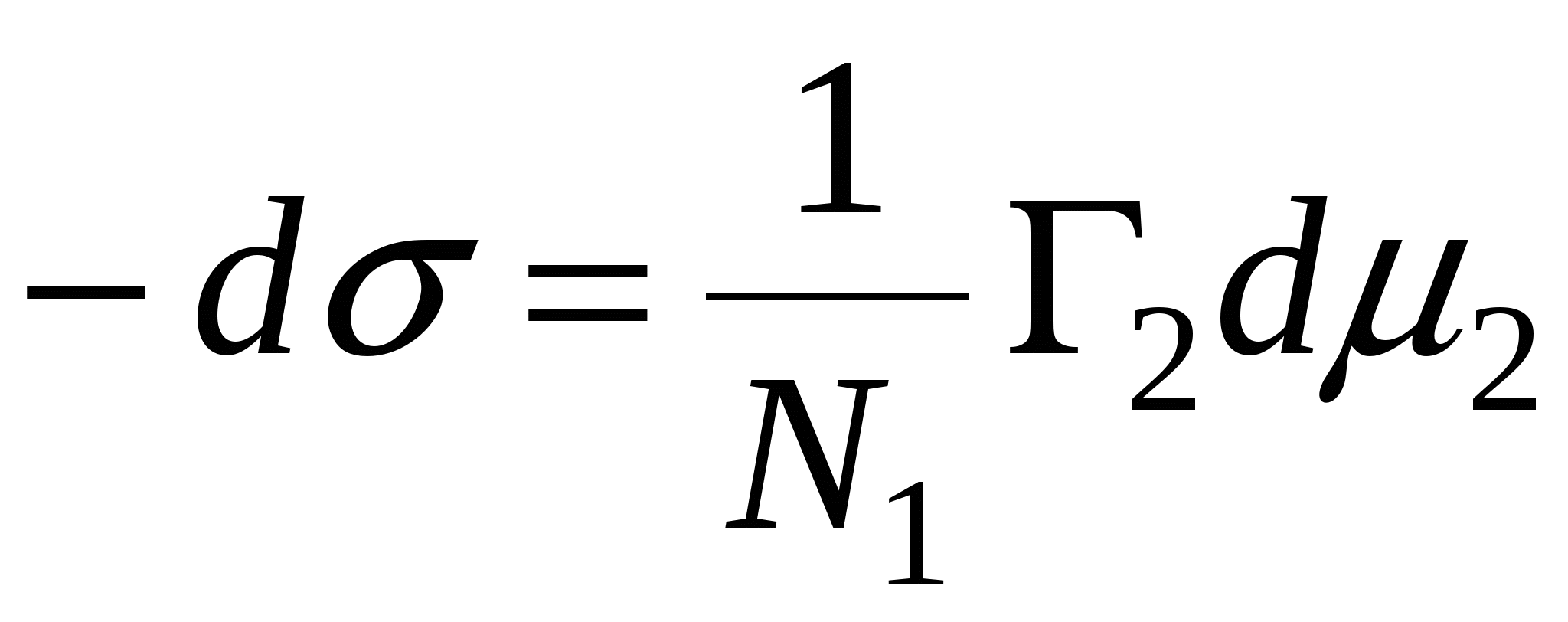 , => , => 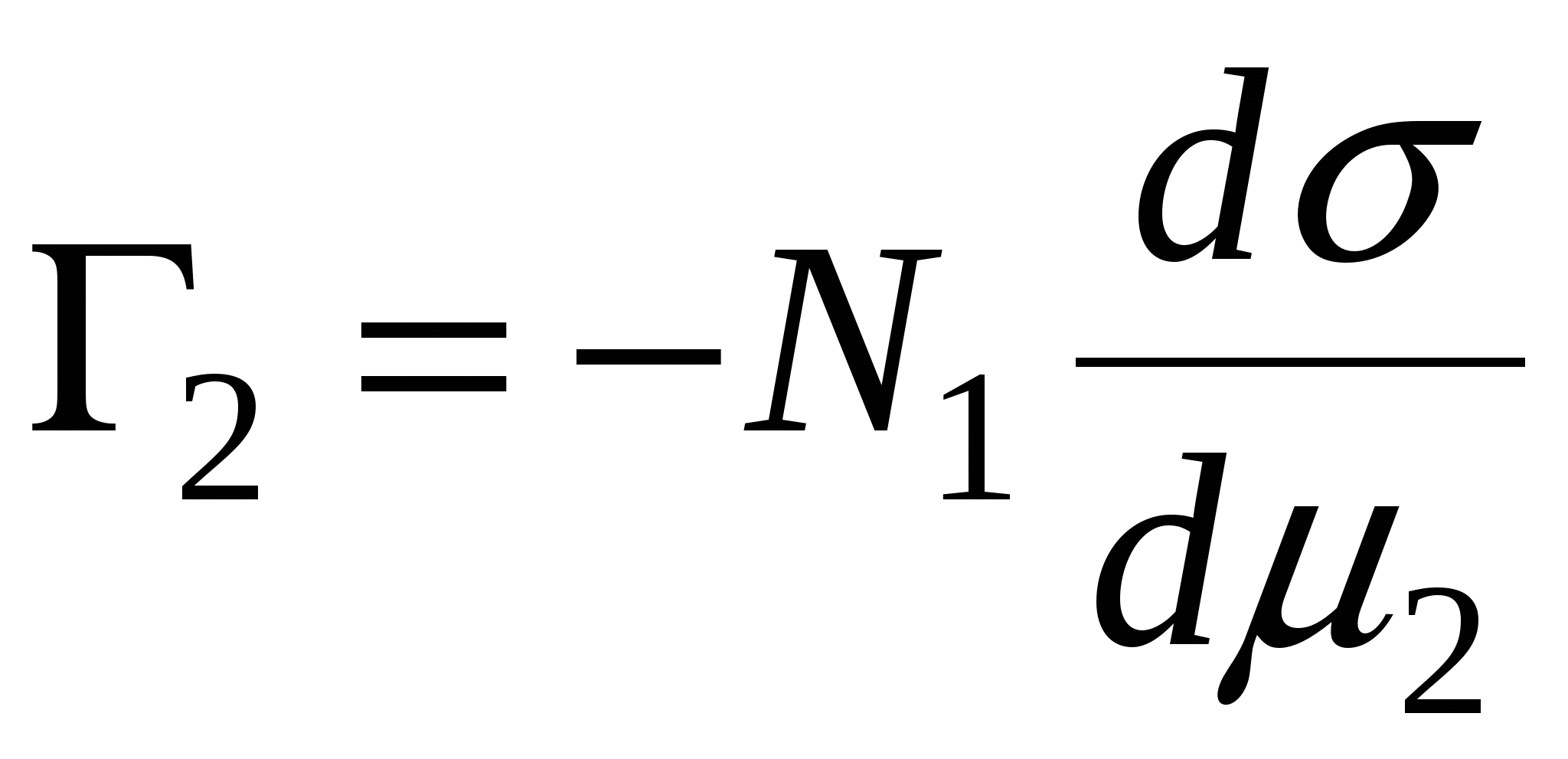 , тогда , тогда 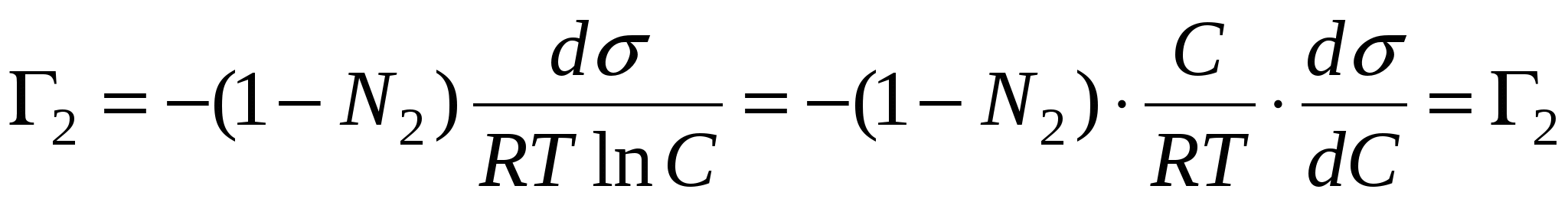 - уравнение адсорбции для границы раздела фаз твердое тело – жидкость. - уравнение адсорбции для границы раздела фаз твердое тело – жидкость.
Адсорбция (Г) > 0 при 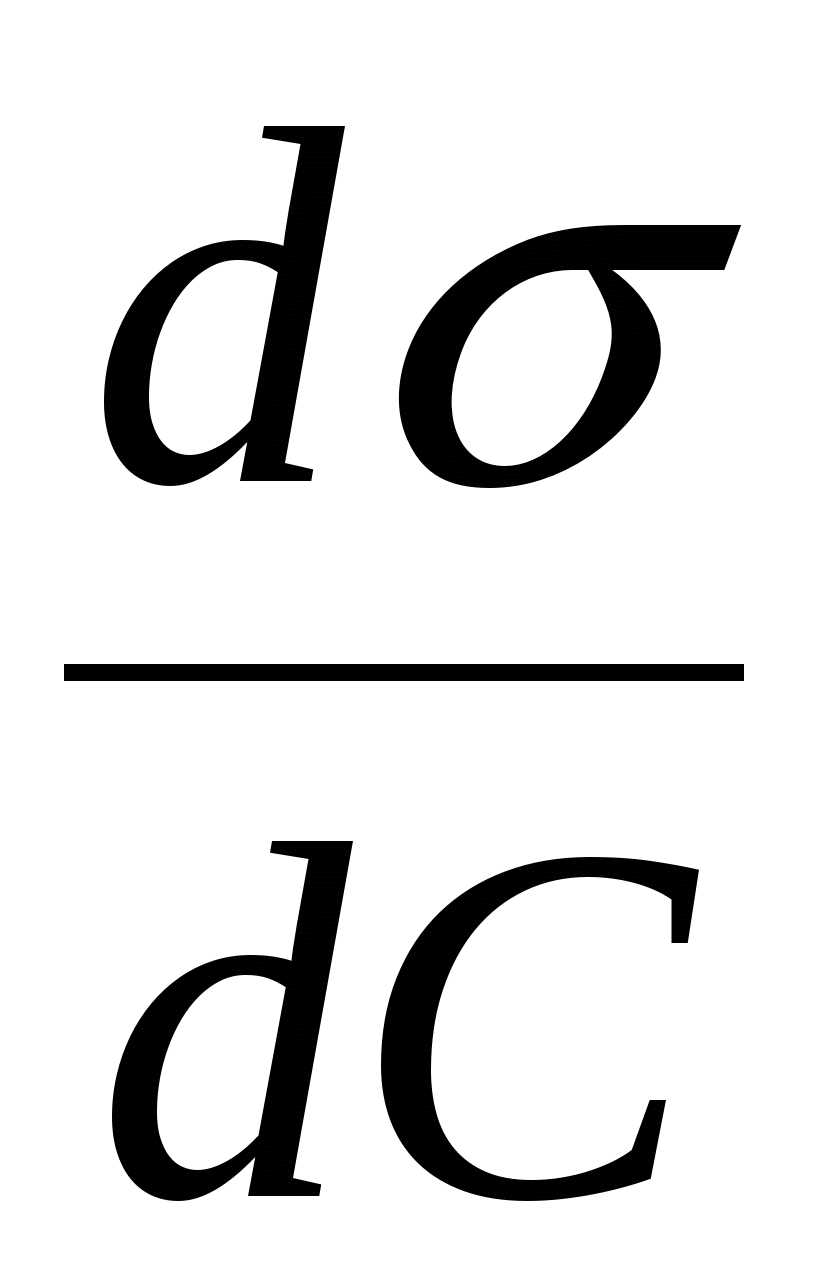 < 0 < 0
Е сли значения сли значения 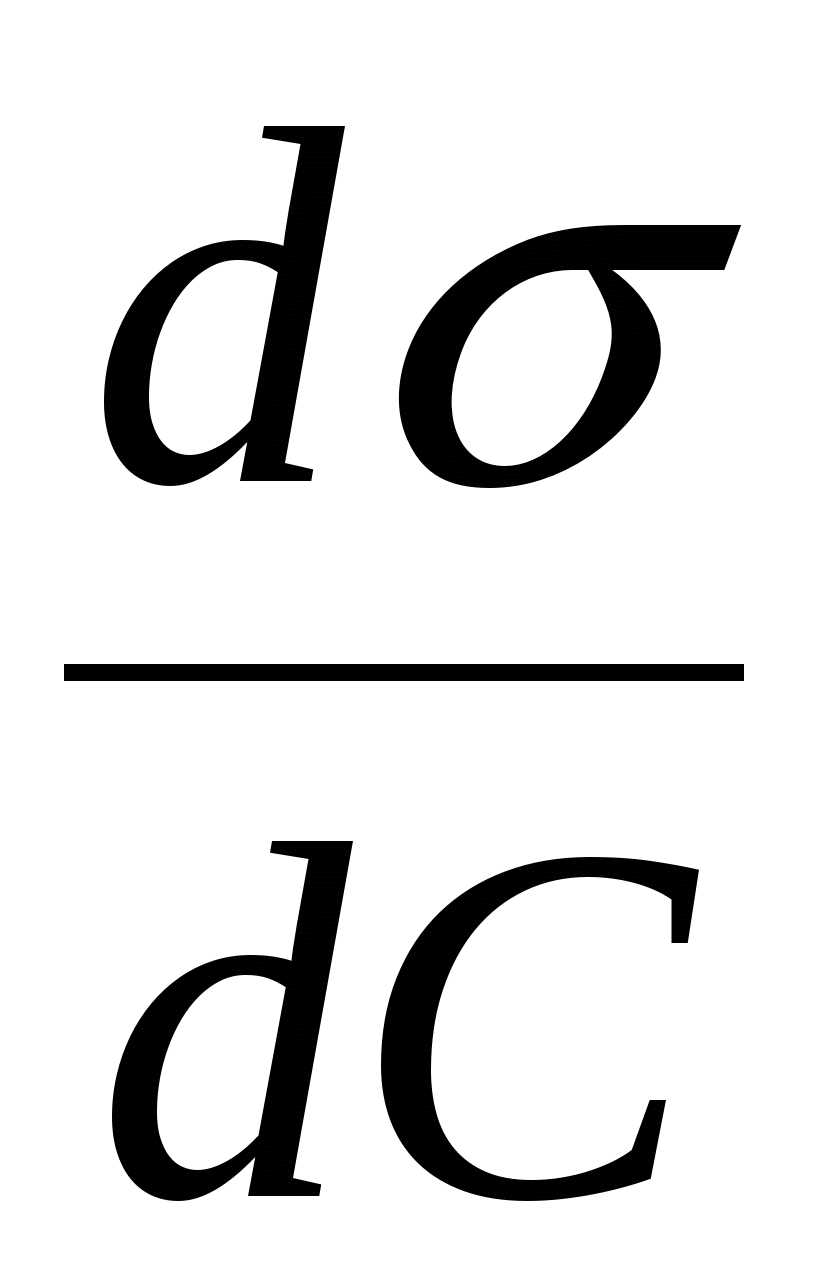 для компонента и растворителя сильно различны, в этом случае зависимость Г от N имеет экстремум при значении N для компонента и растворителя сильно различны, в этом случае зависимость Г от N имеет экстремум при значении N
0,5.
Е сли сли 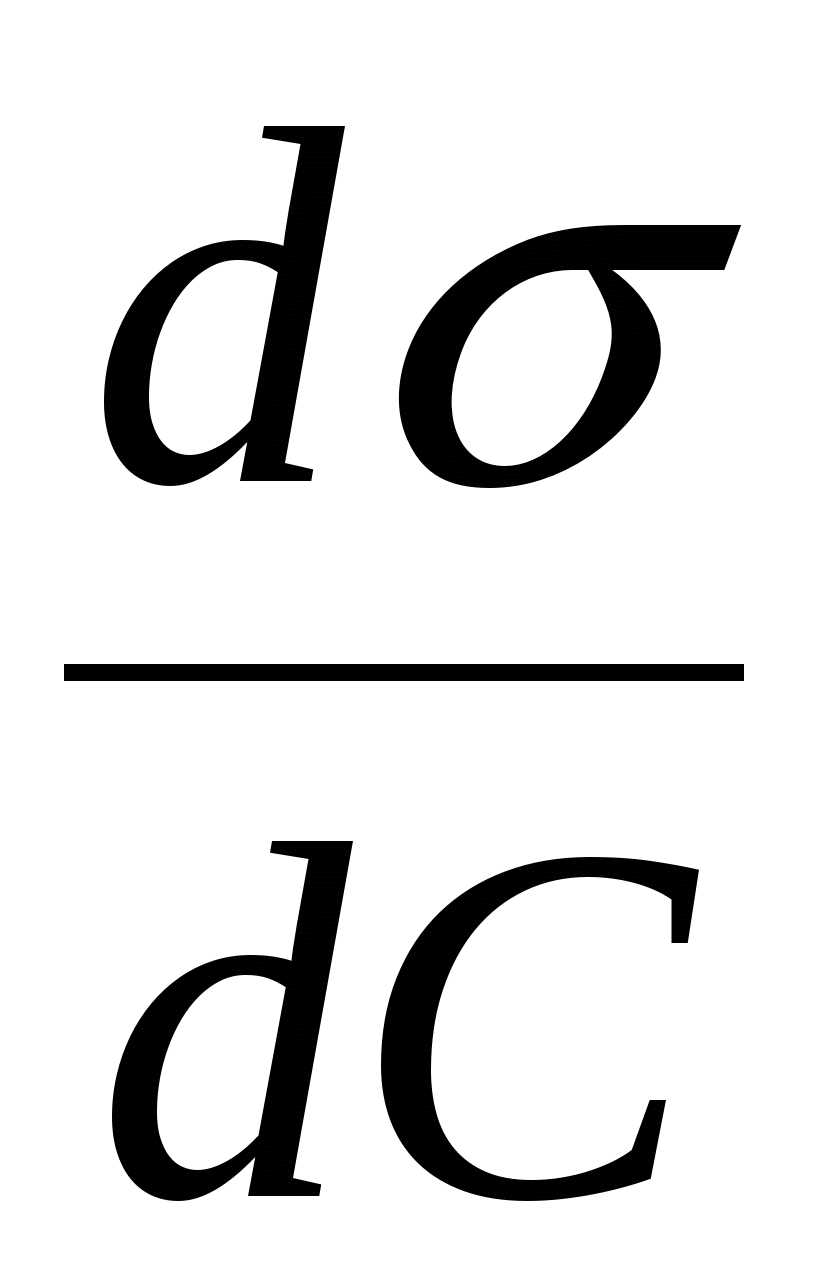 имеют близкие значения, в этом случае возможно изменение знака адсорбции. Зависимость Г от N пересекает ось абсцисс имеют близкие значения, в этом случае возможно изменение знака адсорбции. Зависимость Г от N пересекает ось абсцисс
Точка пересечения функции Г(N) с осью абсцисс называется адсорбционным азеотропом. Это значит, что два компонента не могут быть разделены на данном адсорбенте.
Уравнение изотермы адсорбции с константой обмена.
При адсорбции на границе твердое тело – жидкость постоянно происходит перераспределение компонентов между поверхностью адсорбента и объемом раствора.
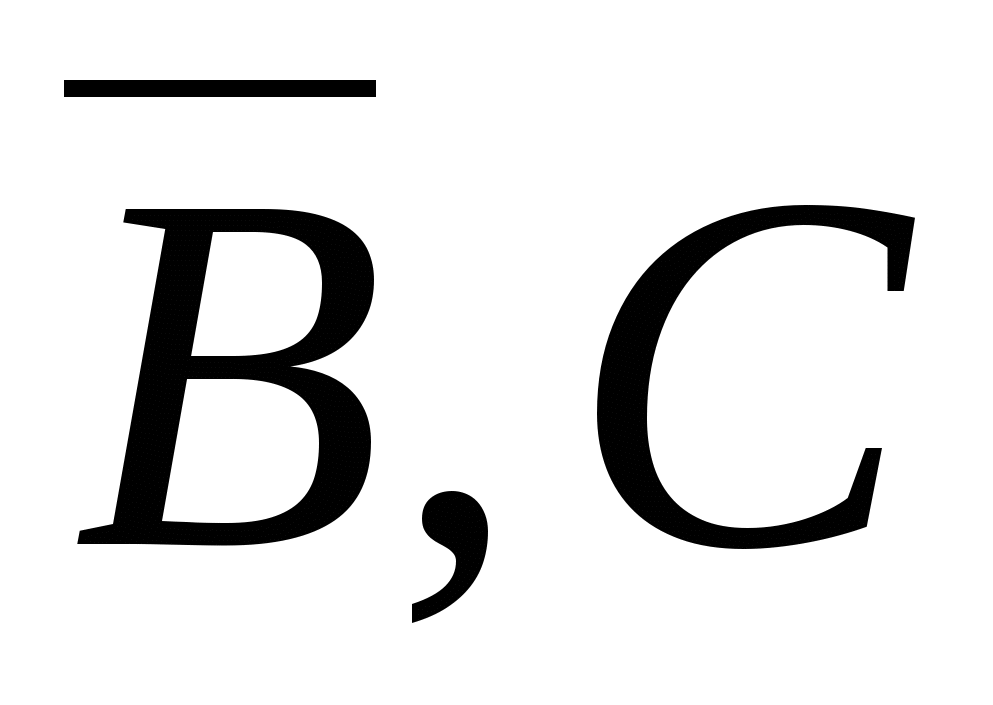 - компоненты (- - относятся к поверхности) - компоненты (- - относятся к поверхности)
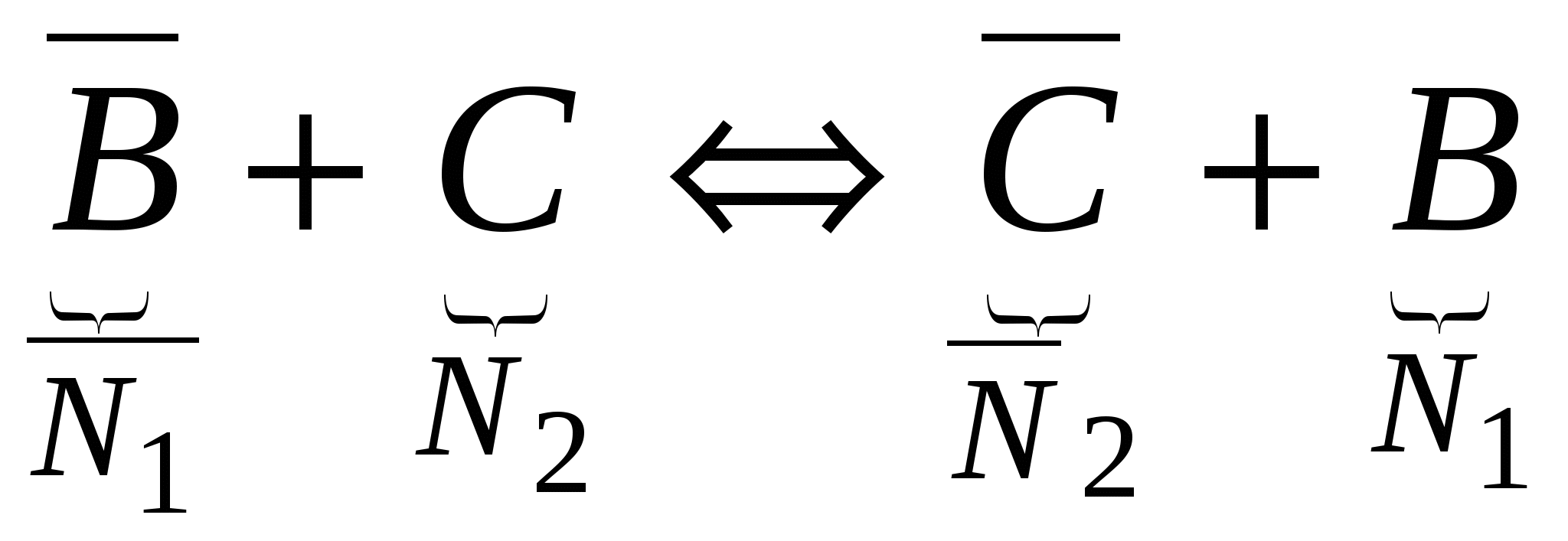
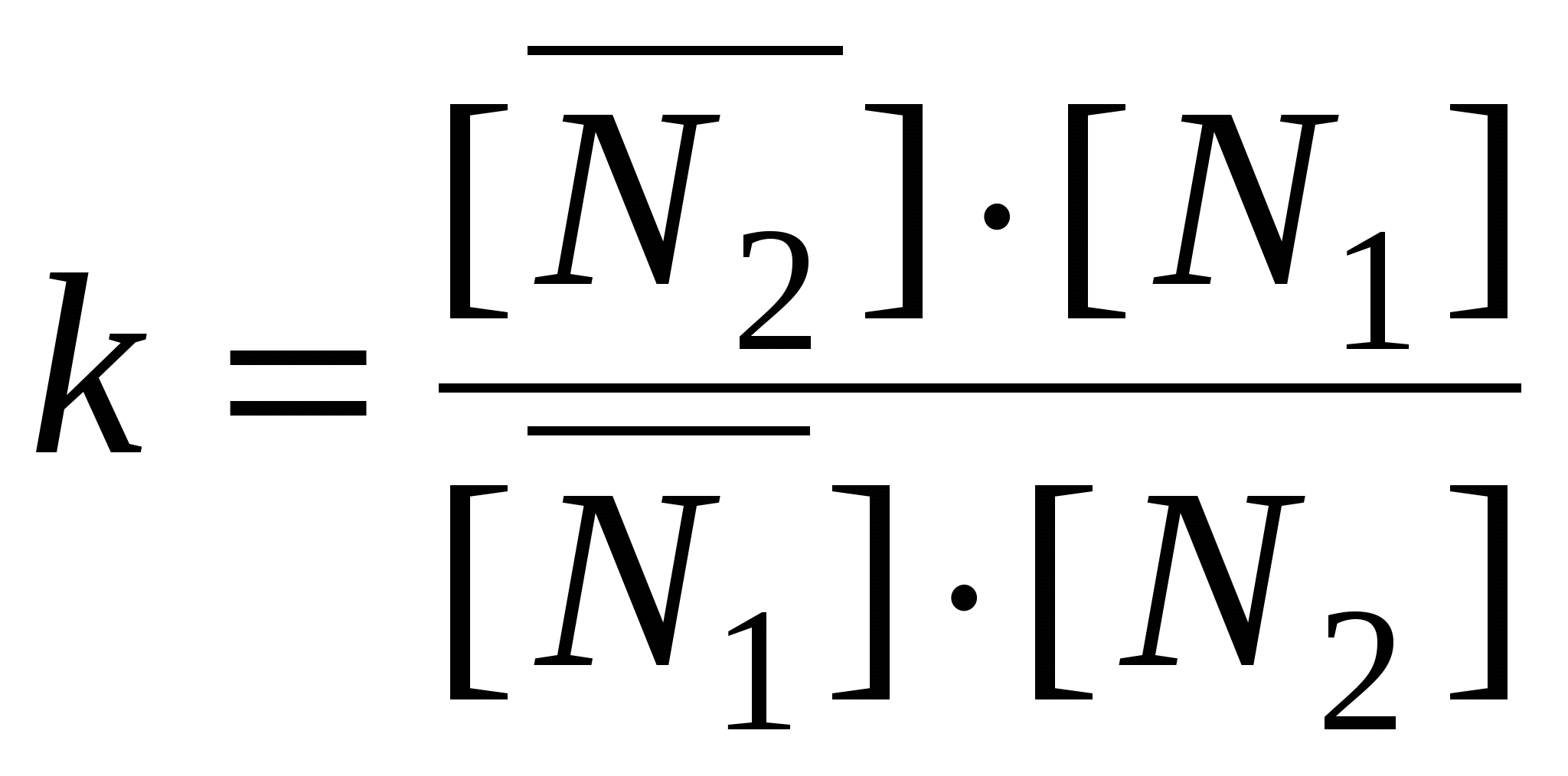 , , 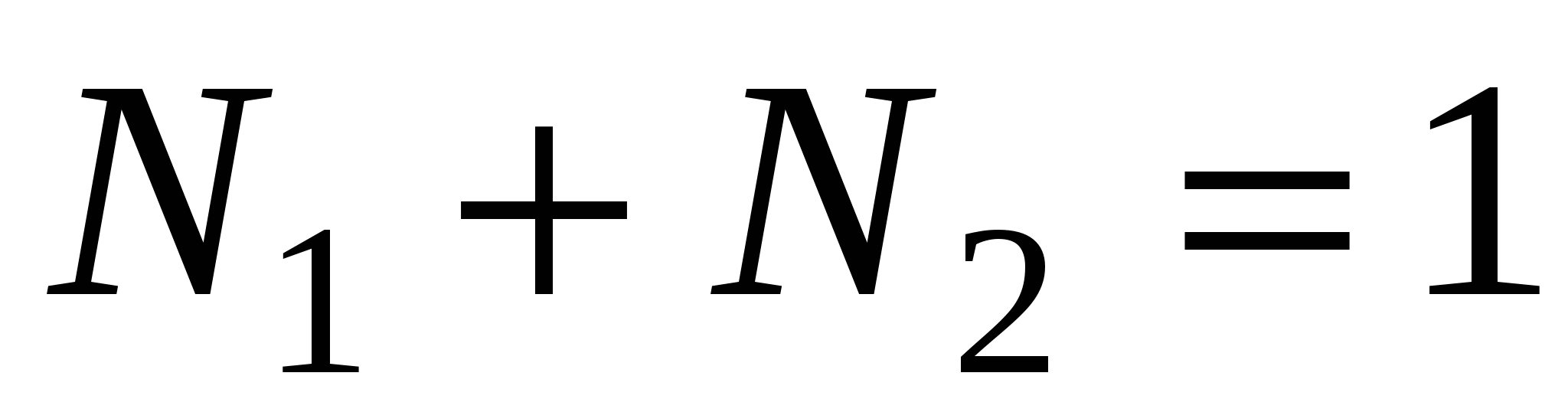 , , 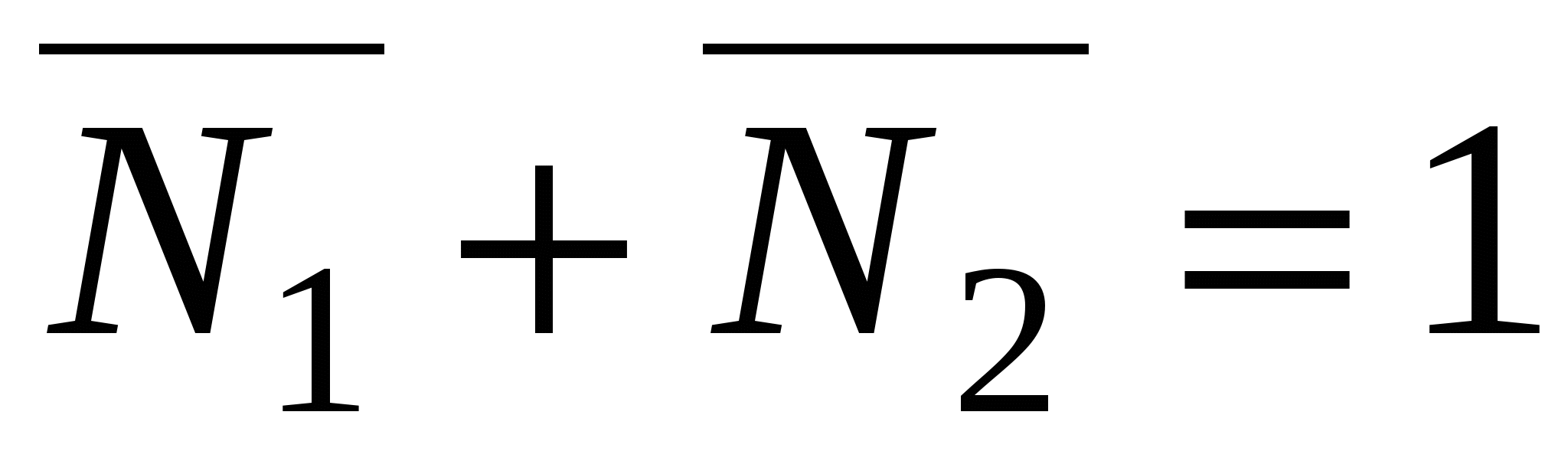 . .
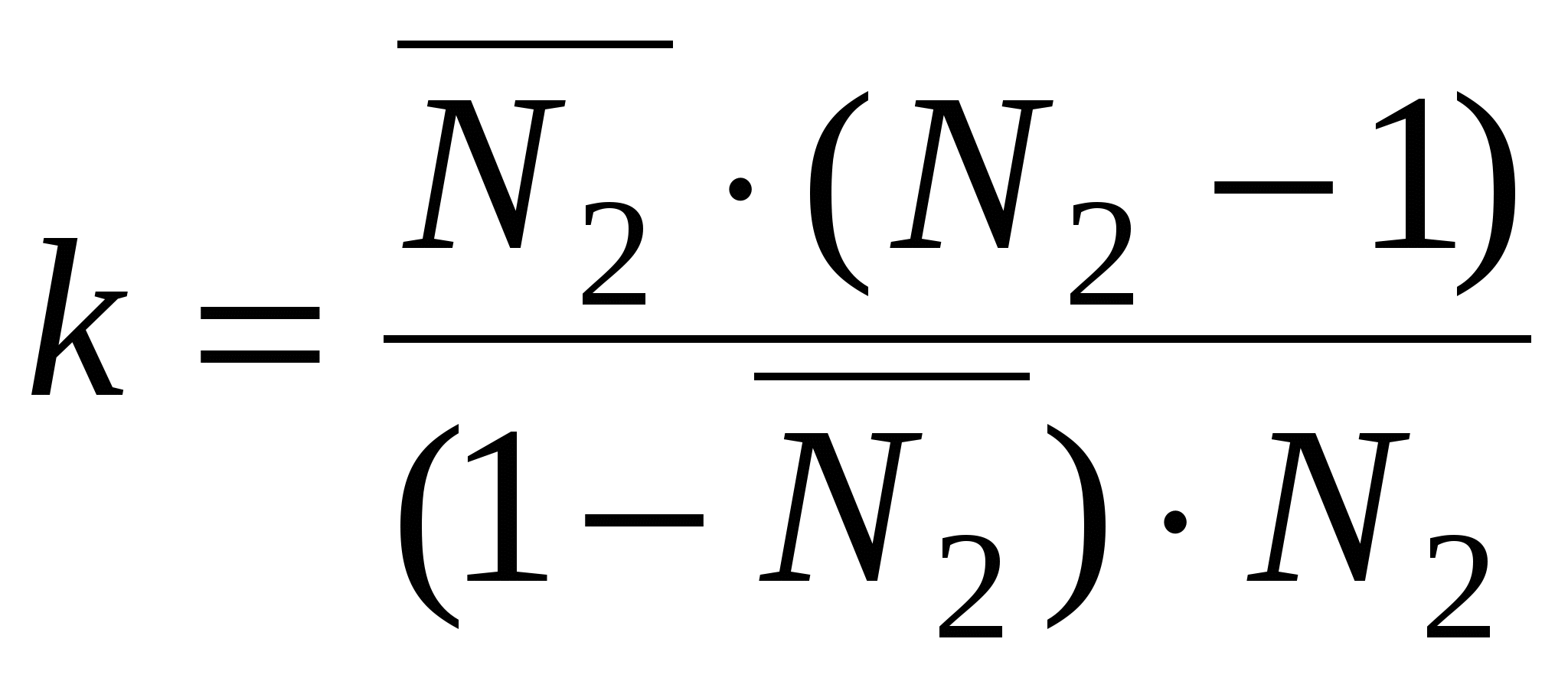 , , 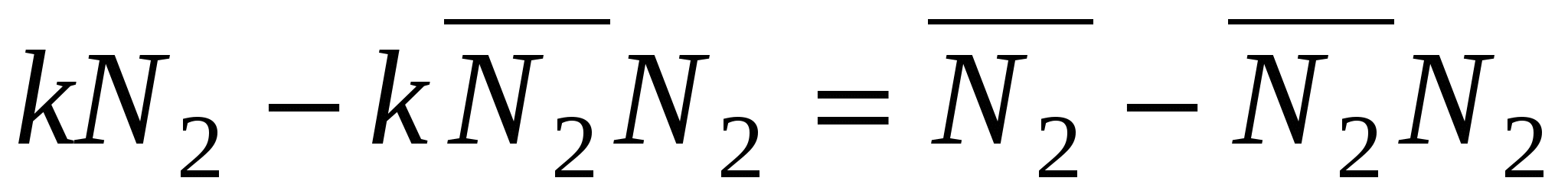
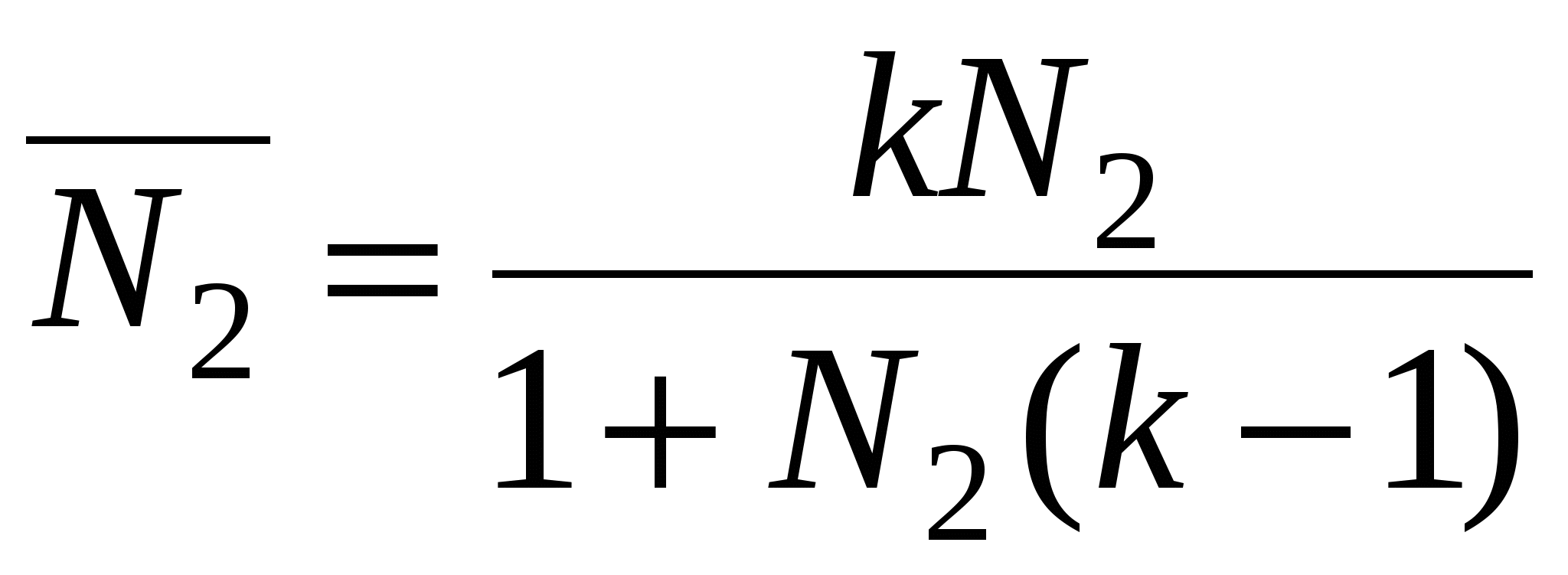
N2 0 – уравнение Генри
k >> 1 – уравнение Лангмюра
k >1, k < 1 >1, k < 1
Адсорбция на границе жидкость-газ
Р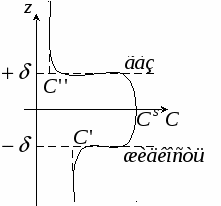 ассмотрим изменение концентрационного профиля по мере пересечения границы раздела жидкость-газ. Пусть компонент 2 летуч. ассмотрим изменение концентрационного профиля по мере пересечения границы раздела жидкость-газ. Пусть компонент 2 летуч.
Cs – концентрация в поверхностном слое.
Исходя из определения избыточной адсорбции
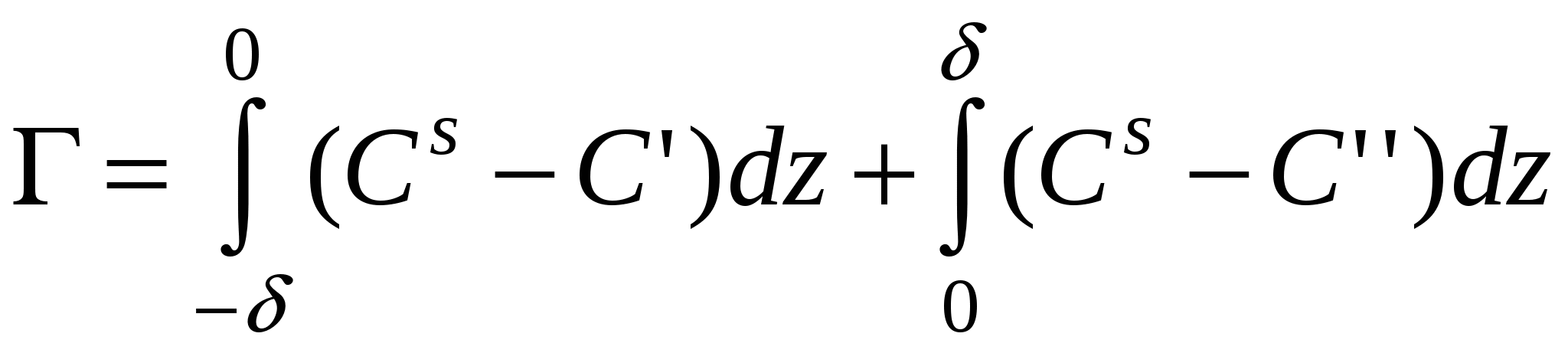
Если компонент не летуч, то величина адсорбции запишется следующим образом:
П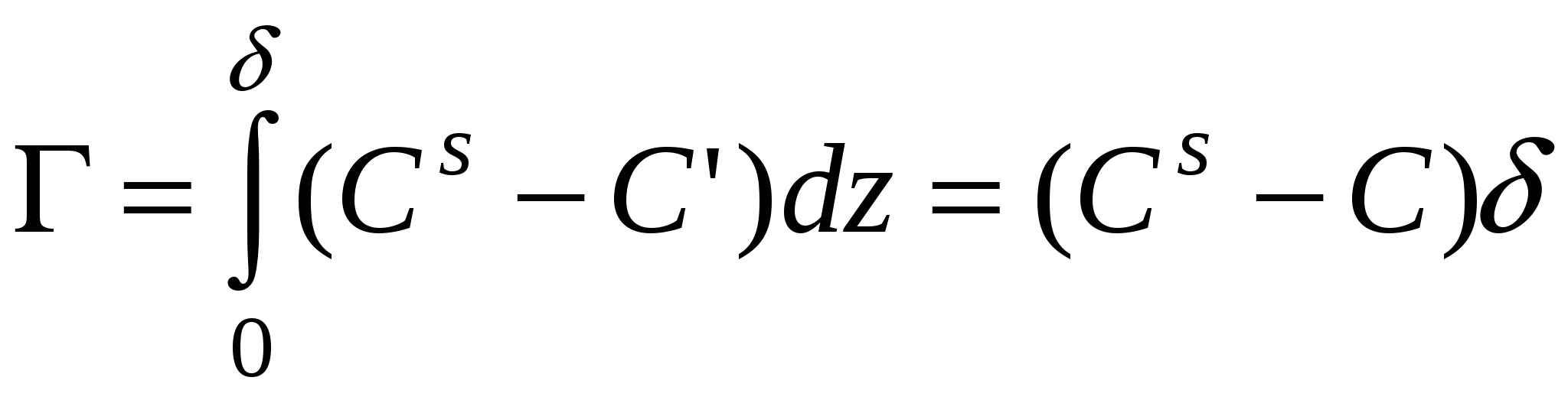 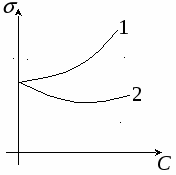 ри ри  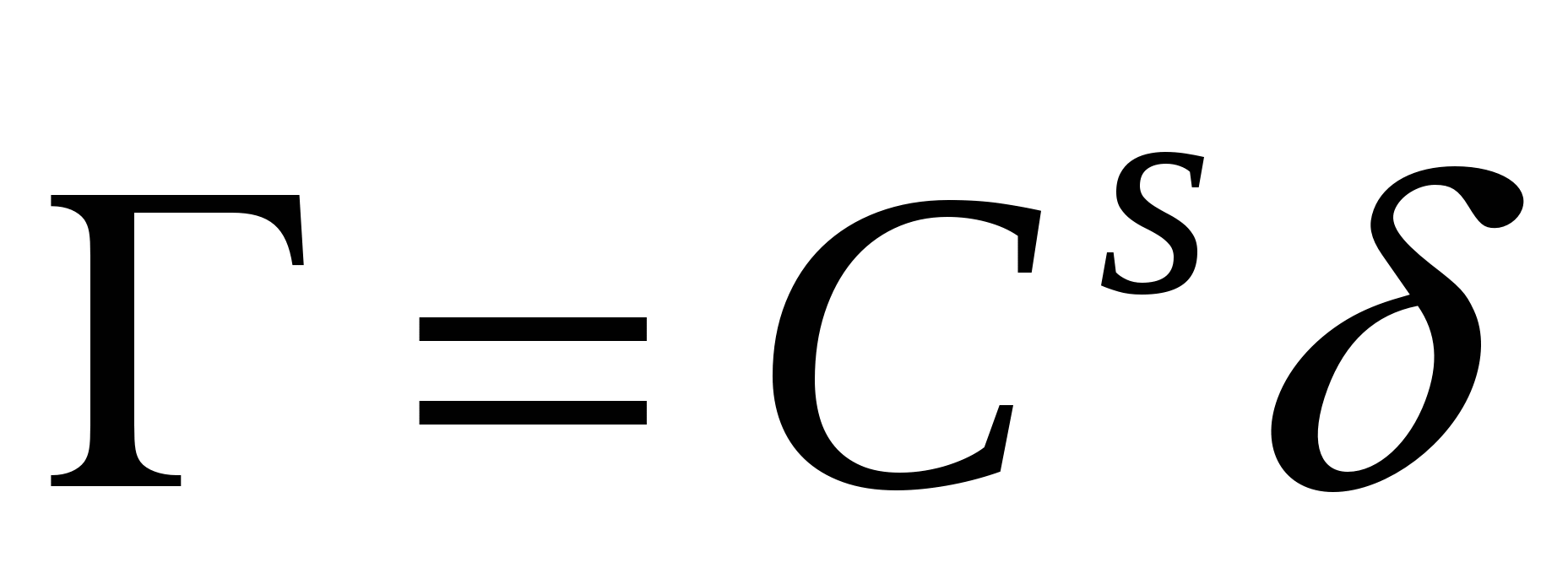
В уравнении 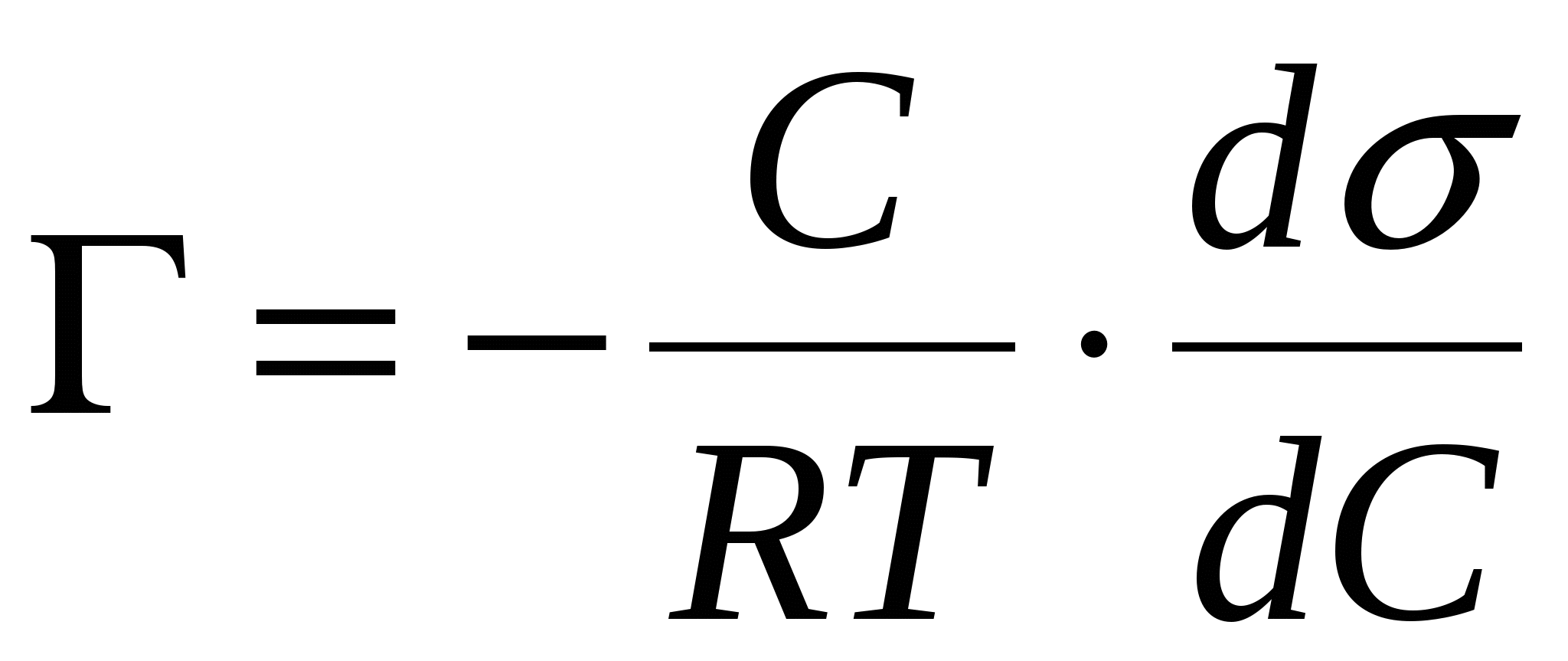 природа вещества описывается производной природа вещества описывается производной 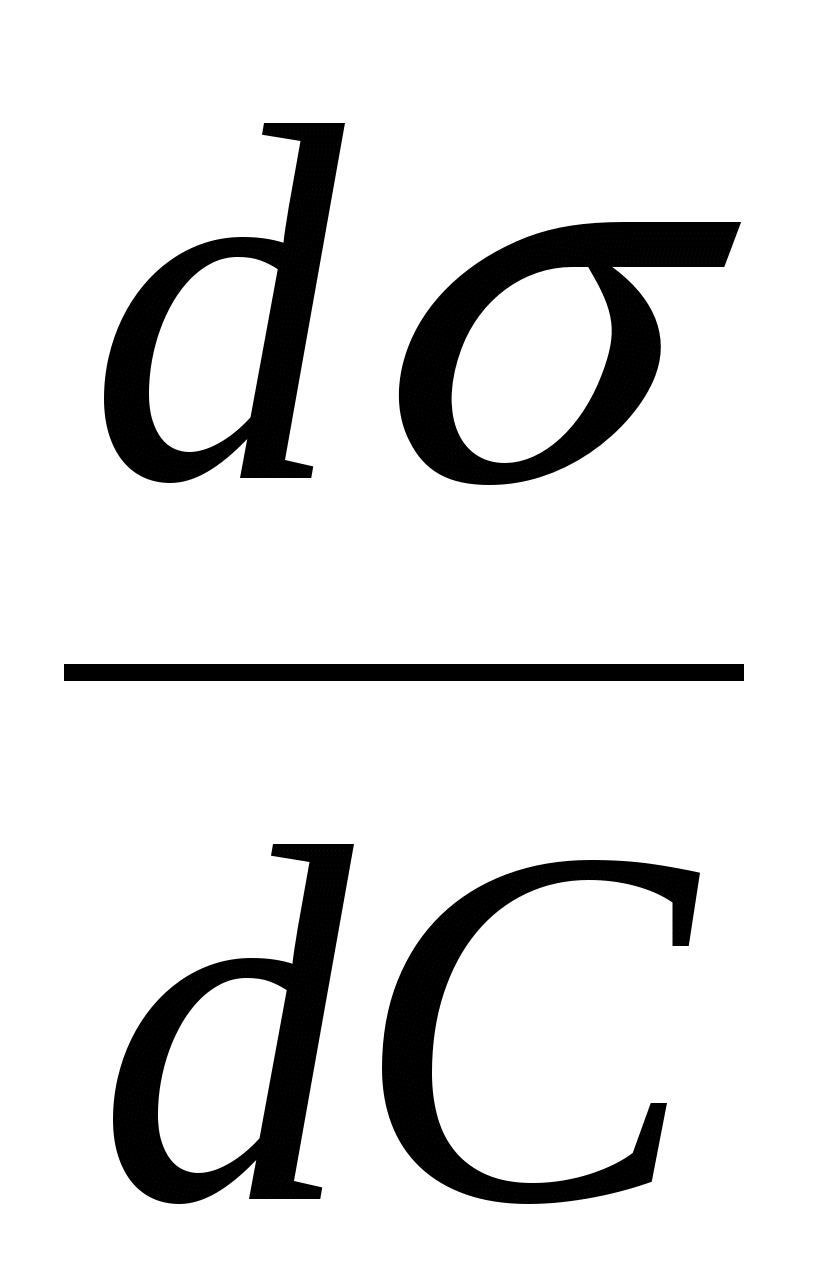 . .
Изотерма поверхностного натяжения может иметь вид 1 или 2:
1 – поверхностноинактивные вещества
2 – поверхностноактивные вещества
Поверхностной активностью g называется способность веществ снижать поверхностное натяжение в системе.
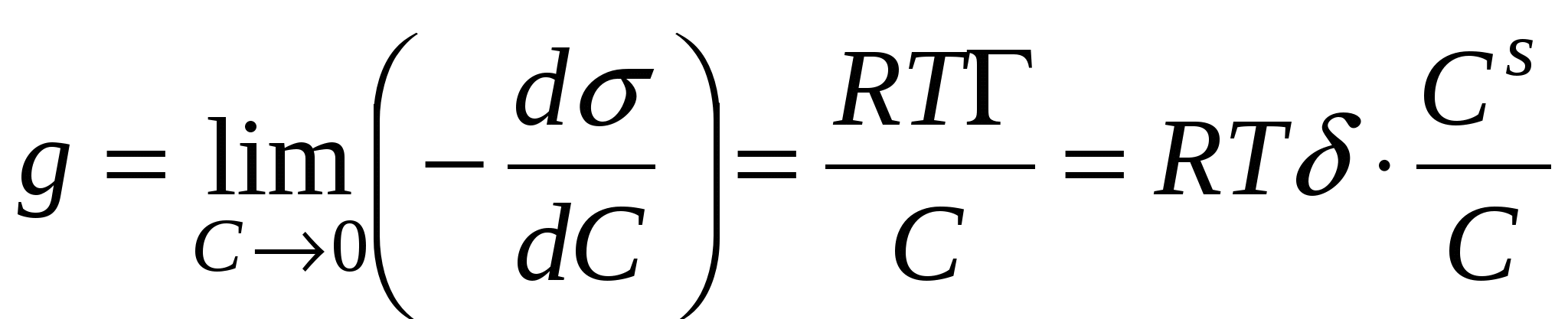
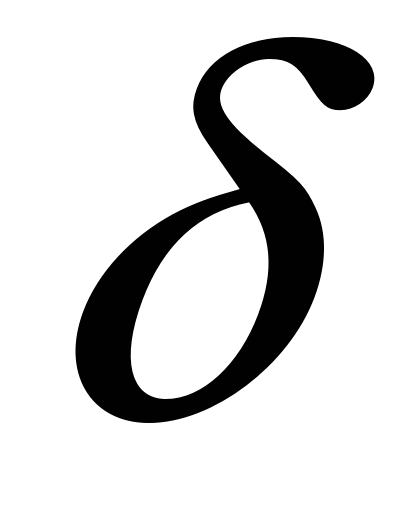 - толщина поверхностного слоя - толщина поверхностного слоя
Cs – концентрация компонента в поверхностном слое
С – объемная концентрация
Для гомологического ряда существует правило:
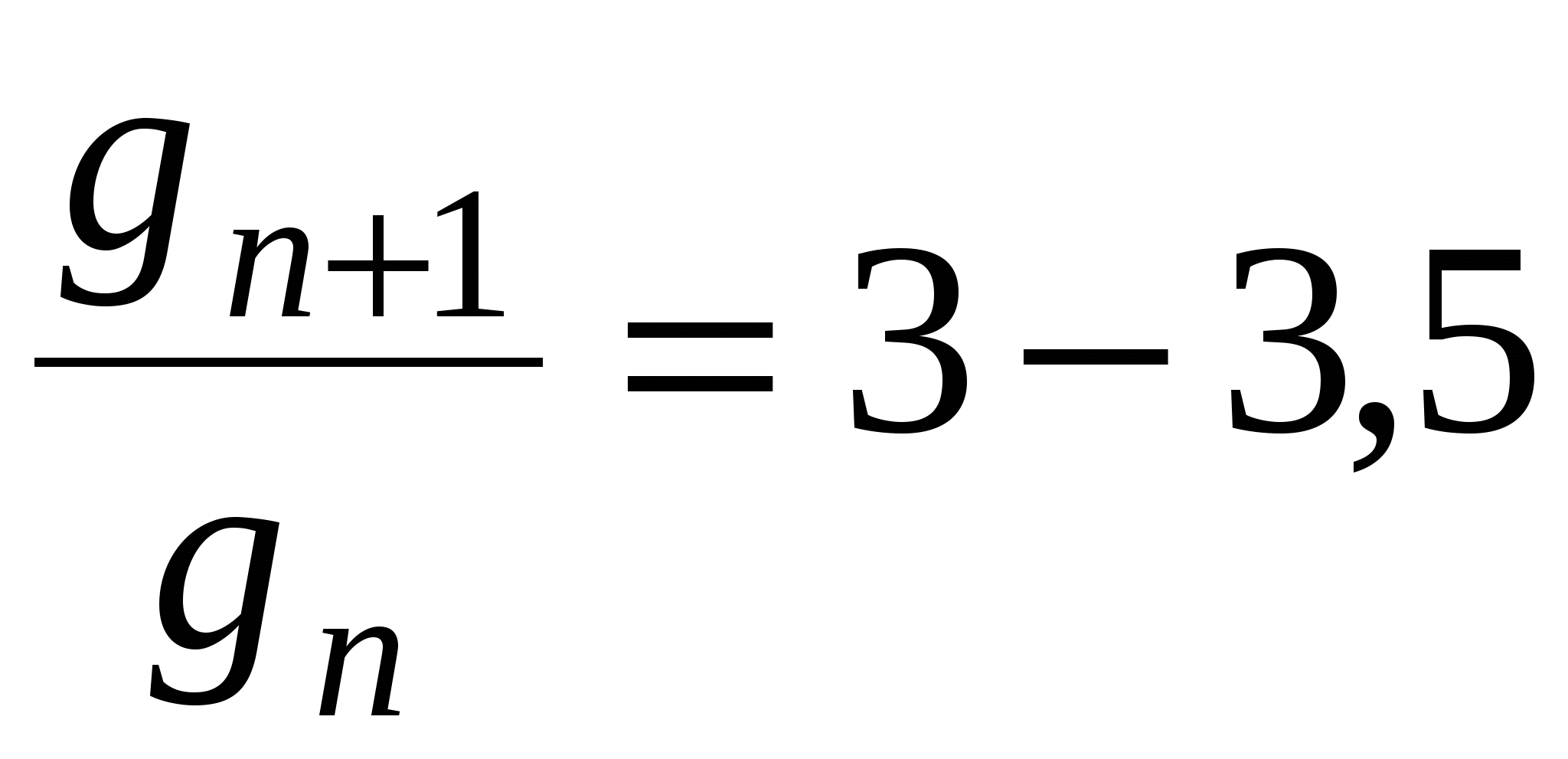 - правило Траубо Дюкло - правило Траубо Дюкло
Д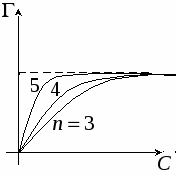 ля гомологического ряда изотерма адсорбции выглядит таким образом: ля гомологического ряда изотерма адсорбции выглядит таким образом:
Вместо A пишем Г, так как адсорбция избыточная в поверхностном слое.
Изотерма поверхностного натяжения:
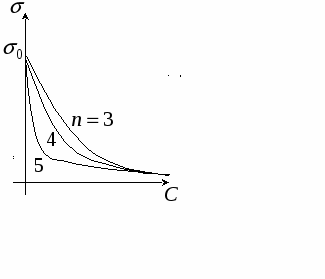
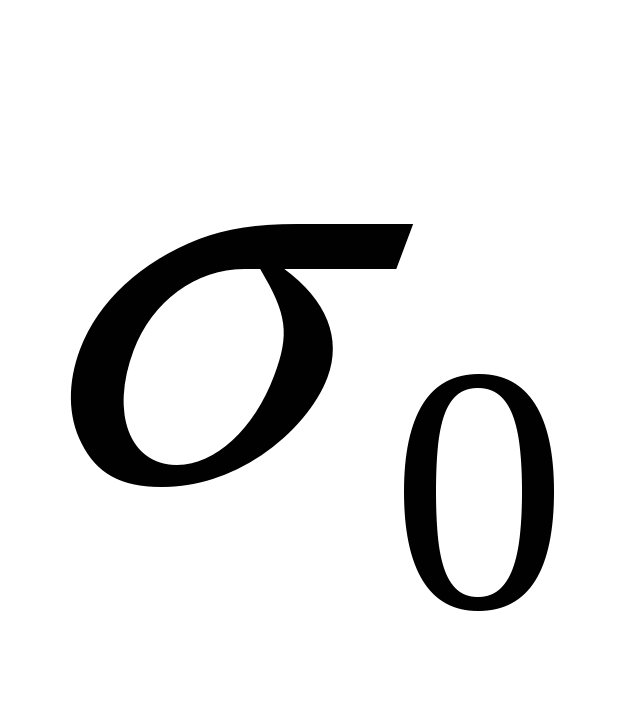 - поверхностное натяжение чистого растворителя. - поверхностное натяжение чистого растворителя.
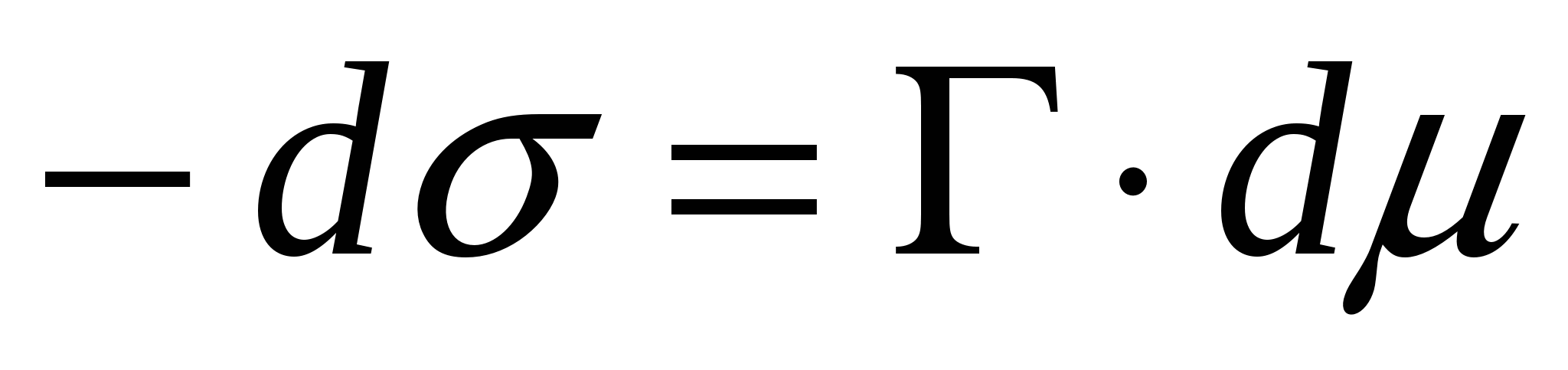 - фундаментальное адсорбционное уравнение; - фундаментальное адсорбционное уравнение;
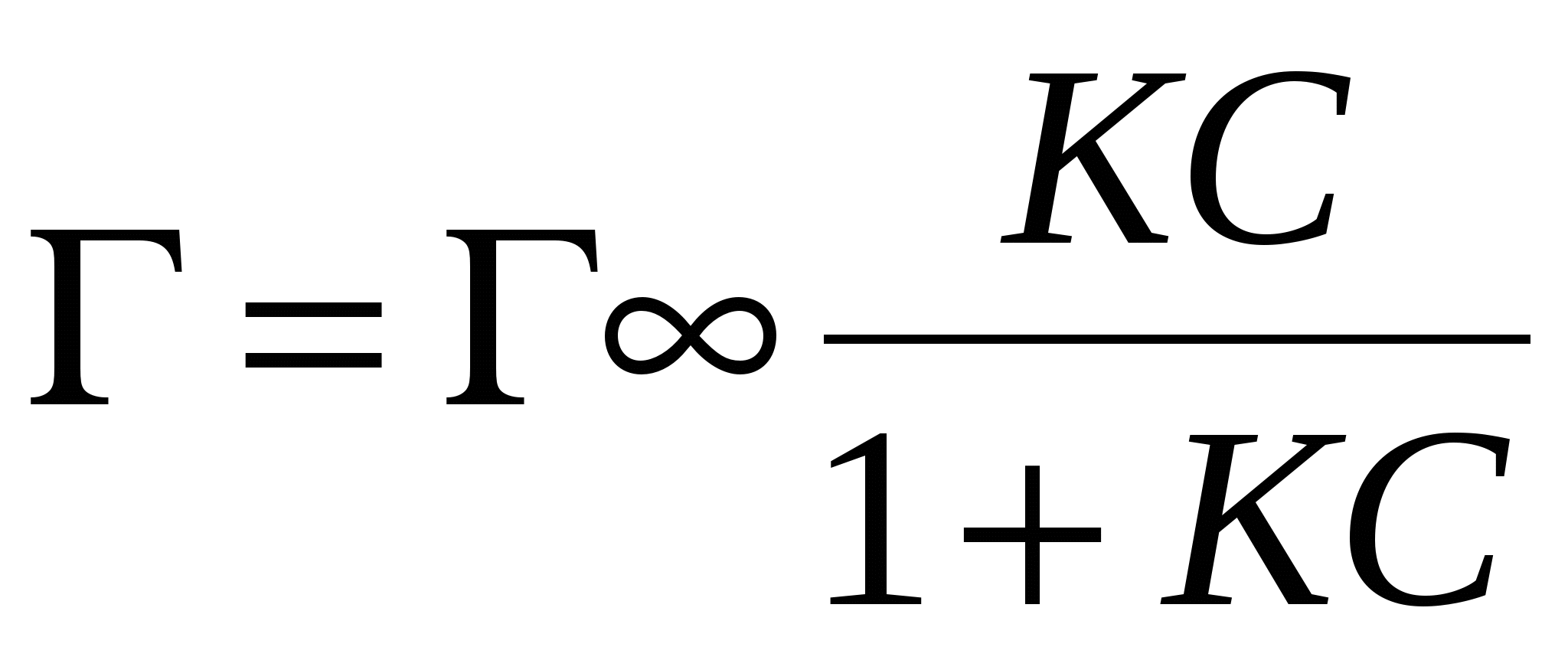 - уравнение Лангмюра. - уравнение Лангмюра.
Решим их совместно:
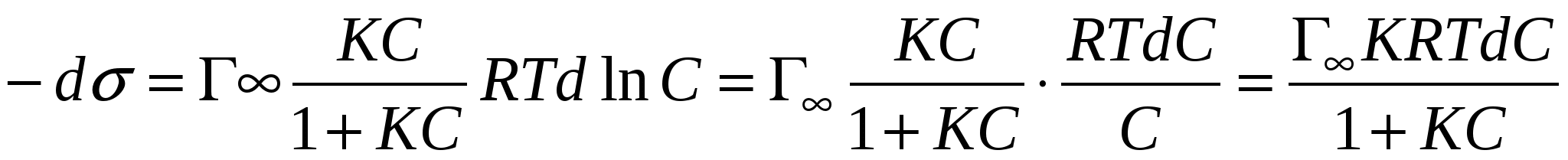
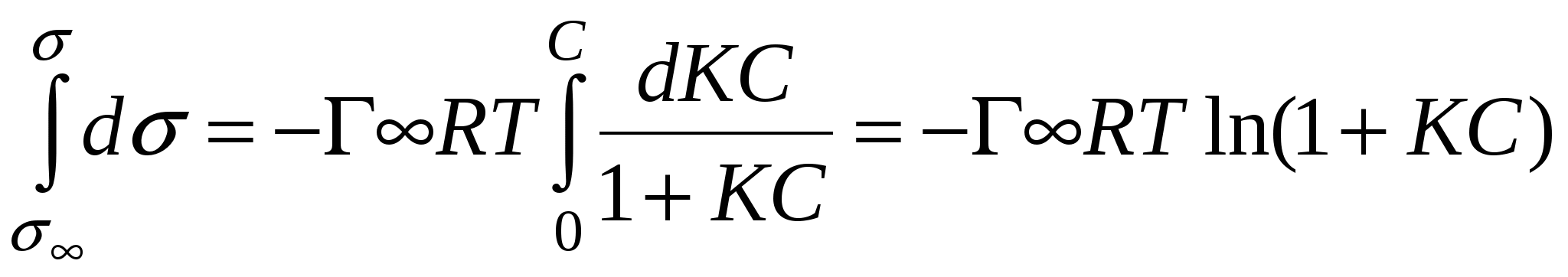
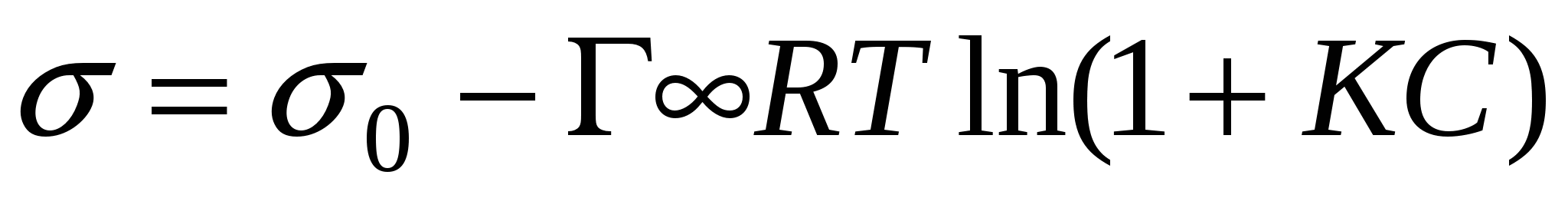 - уравнение Шишковского. - уравнение Шишковского.
или 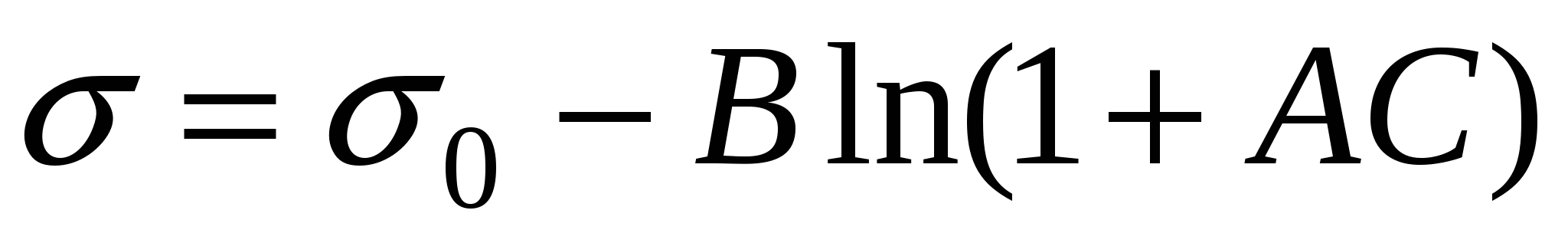
B – константа для гомологического ряда.
A - при переходе от одного гомолога к другому увеличивается в 3-3,5 раза 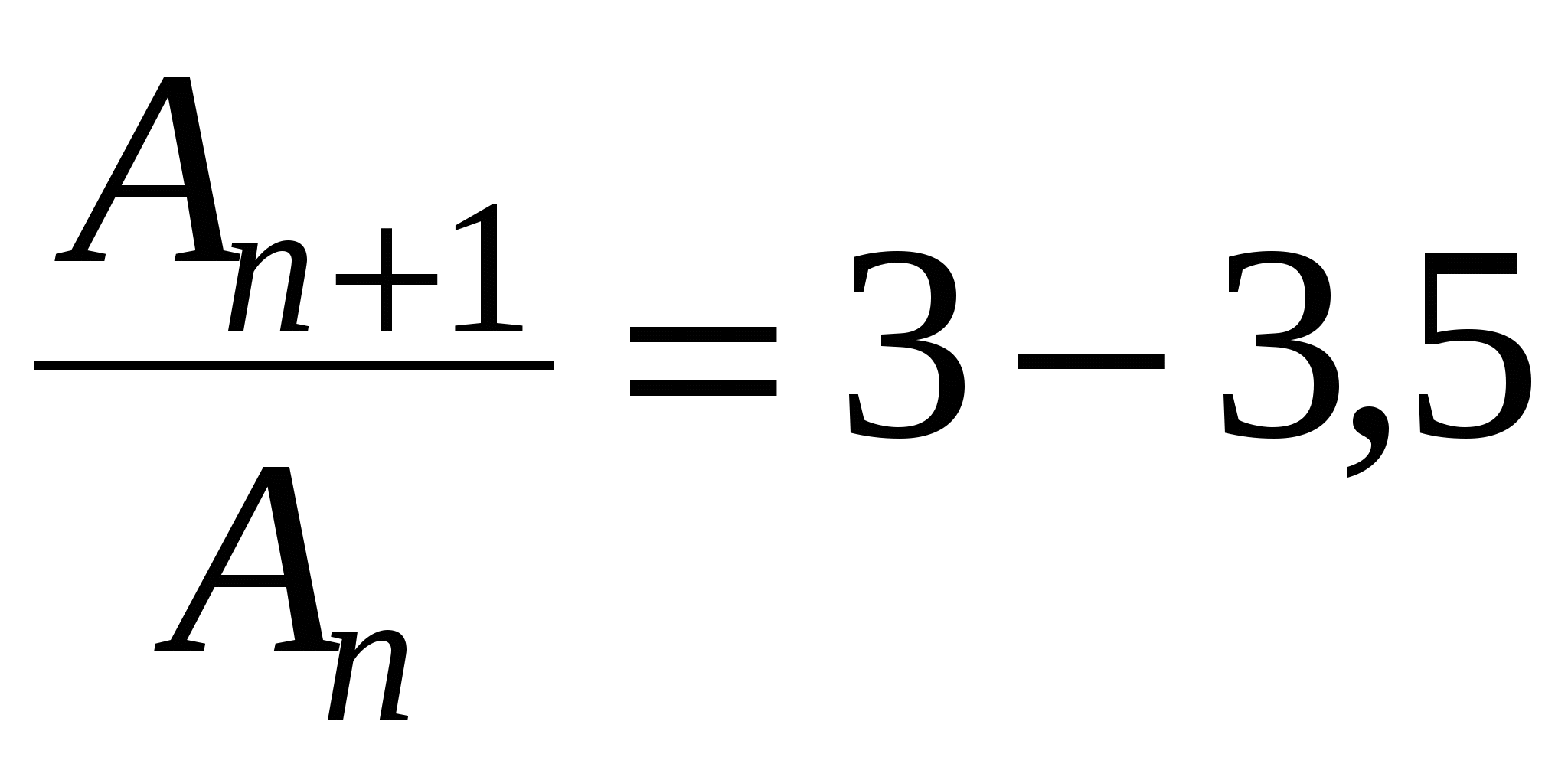
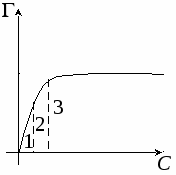 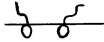
1 – область малых концентраций
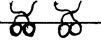
2 – средняя концентрация
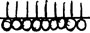
3 – мономолекулярный слой
Поверхностноактивные вещества представляют собой дифильные молекулы, т.е. включают полярную группу и неполярный углеводородный радикал.
o - полярная часть молекулы.
| - неполярная часть молекулы.
В полярном растворителе молекулы ПАВ ориентируются таким образом, что полярная часть молекулы обращена к растворителю, а неполярная выталкивается в газовую фазу.
В уравнении Шишковского 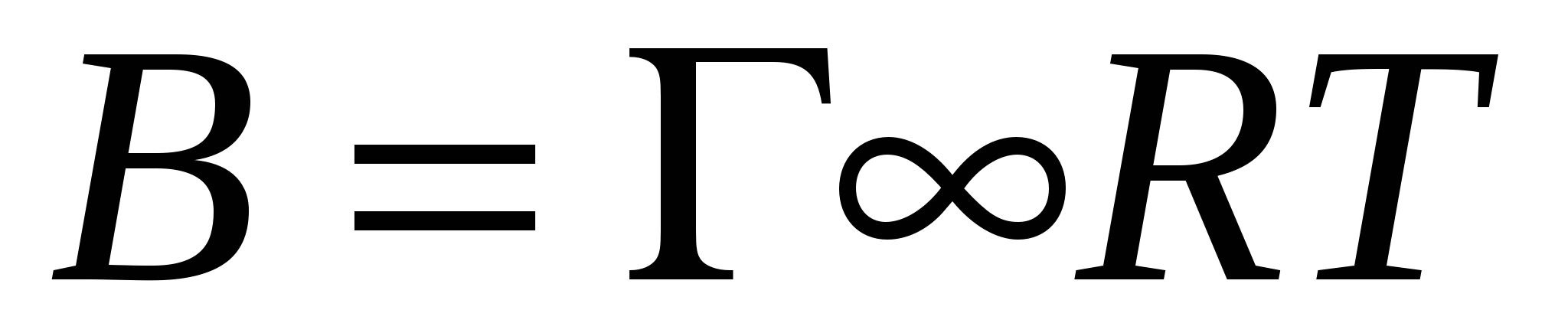 , она постоянна для гомологического ряда. , она постоянна для гомологического ряда.
Поверхностноактивное действие начинает проявляться с n>5. При концентрациях больших, чем концентрация мономолекулярного слоя, в растворах ПАВ происходит мицеллообразоваие.
Мицелла – называется агрегат молекул дифильных ПАВ, углеводородные радикалы которых образуют ядро, а полярные группы обращены в водную фазу.
Масса мицеллы – мицелляльная масса.
Ч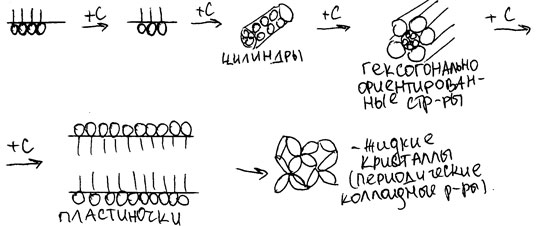 исло молекул – число агрегации. исло молекул – число агрегации.
- Сферические мицеллы
В случае мицеллообразования в растворе устанавливается равновесие
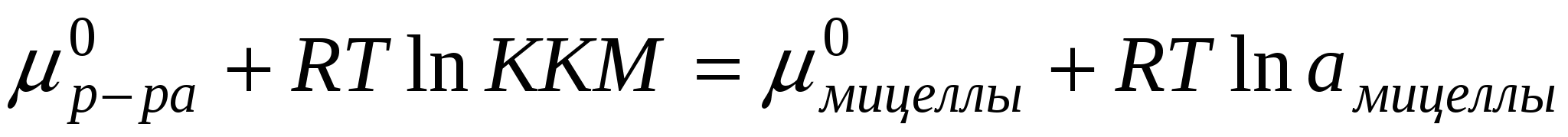
ККМ – критическая концентрация мицеллообразования.
Поскольку мы считаем мицеллу отдельной фазой:
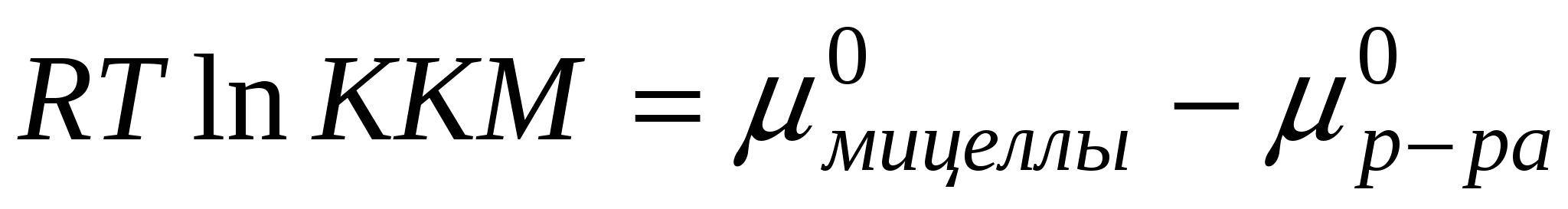
Для гомологического ряда существует эмпирическое уравнение:
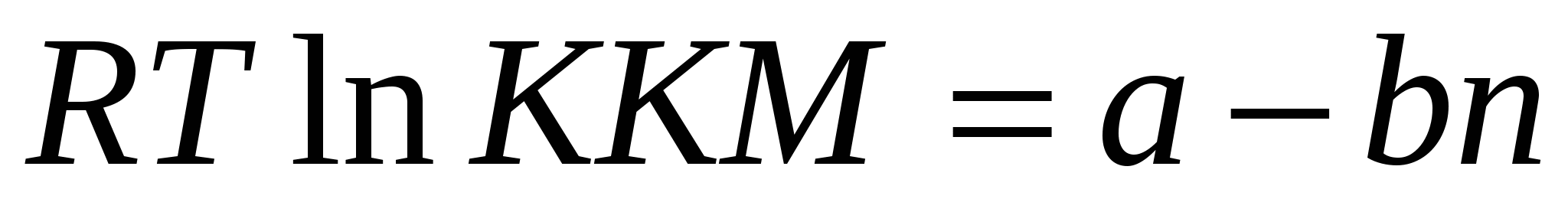
a – энергия растворения функциональной группы.
b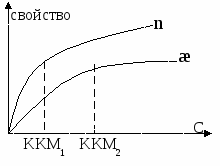 – инкремент адсорбционного потенциала, работа адсорбции на одно метиленовое звено. – инкремент адсорбционного потенциала, работа адсорбции на одно метиленовое звено.
Наличие в мицеллах углеводородного ядра создает возможность для растворения в водных растворах ПАВ соединений, которые не растворимы в воде, это явление называется солюбилизацией (то, что растворяется – солюбилизат, ПАВ – солюбилизатор).
Грязь может быть совсем не полярна, может содержать как полярную, так и не полярную часть и будет ориентироваться как молекула ПАВ.
В любом случае при солюбилизации происходит увеличение мицеллярной массы и числа агрегации не только за счет включения солюбилизата, но и за счет увеличения числа молекул ПАВ, необходимых для поддержания равновесного состояния.
Солюбилизация тем эффективнее, чем меньше молекулярная масса солюбилизата.
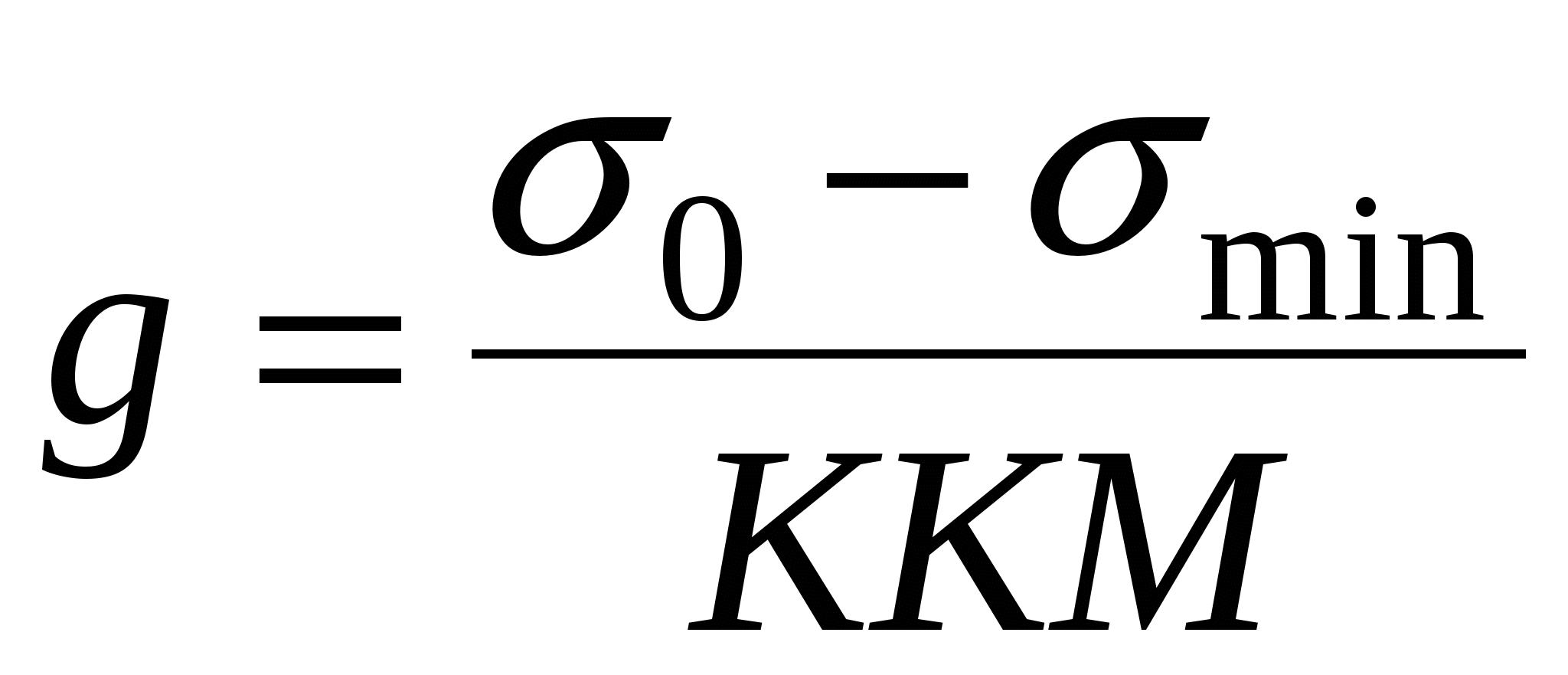
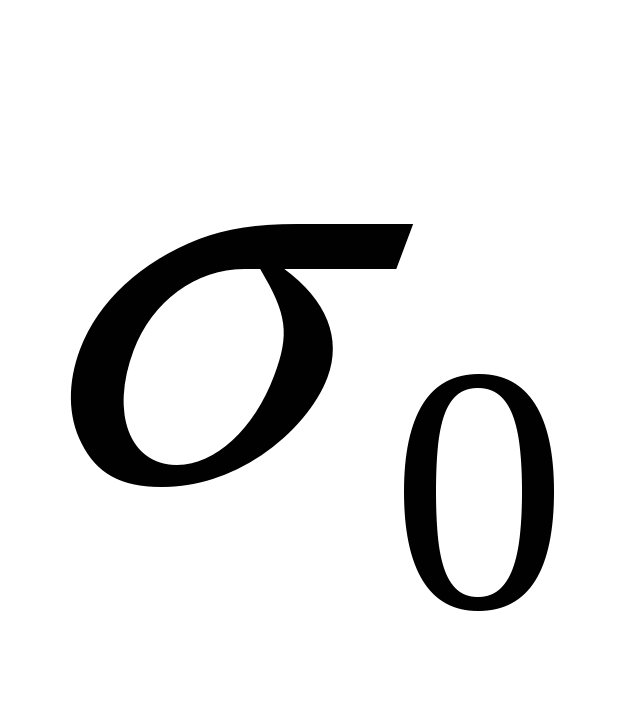
72 мН\м.
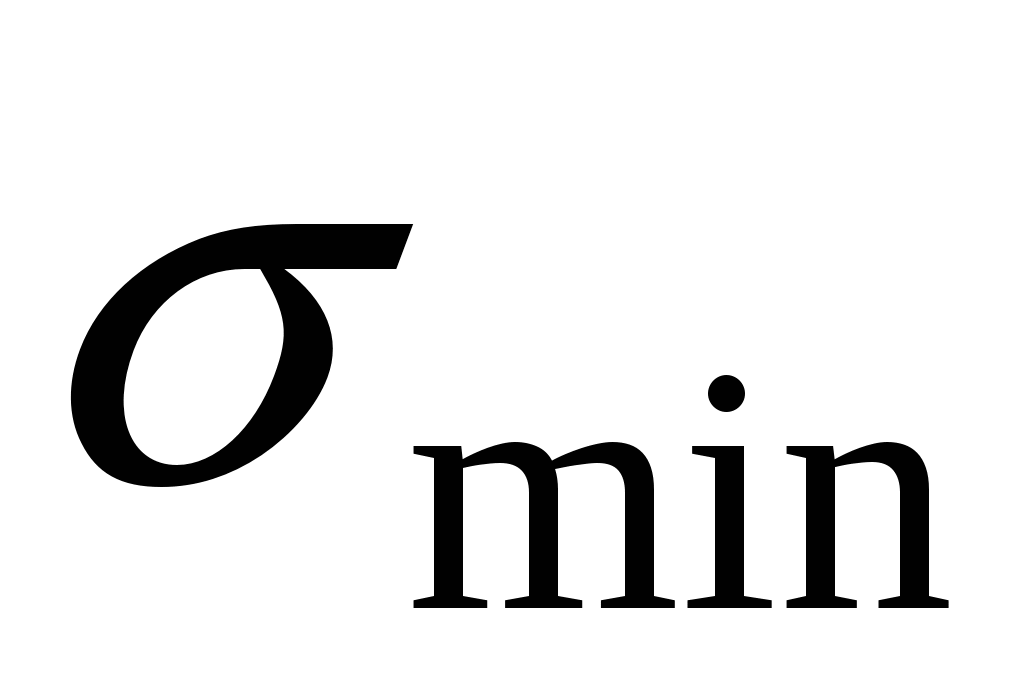
33 мН\м.
Эффективность ПАВ зависит от величины ККМ.
Двухмерное давление поверхностного слоя
→ - силы поверхностного натяжения.
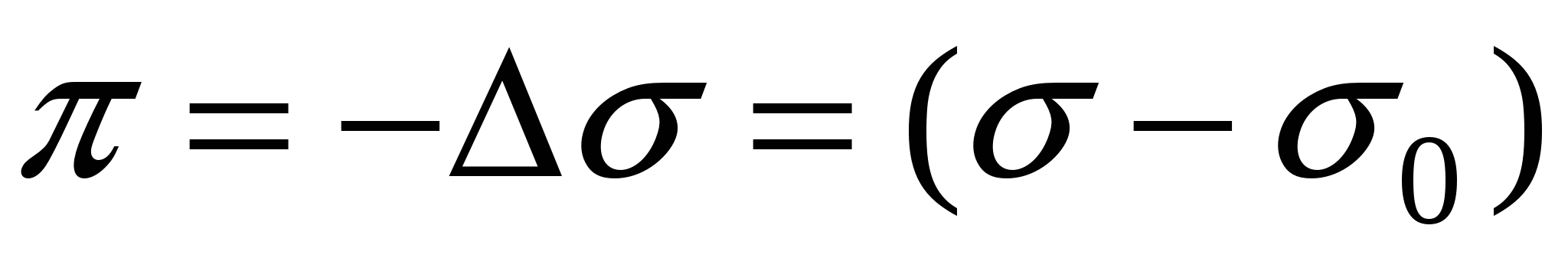 - двухмерное давление. - двухмерное давление.
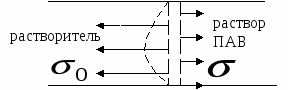
Поверхностный слой – это сила равная разности поверхностных натяжений раствора ПАВ и чистого растворителя, направленная в сторону чистой поверхности.
Между раствором и поверхностным слоем устанавливается равновесие
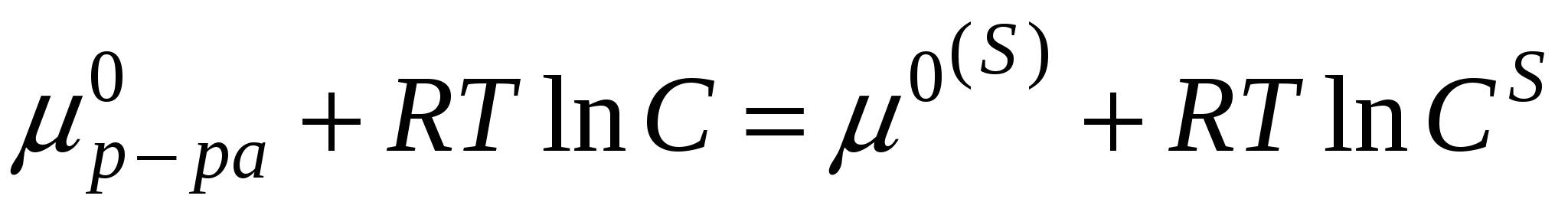
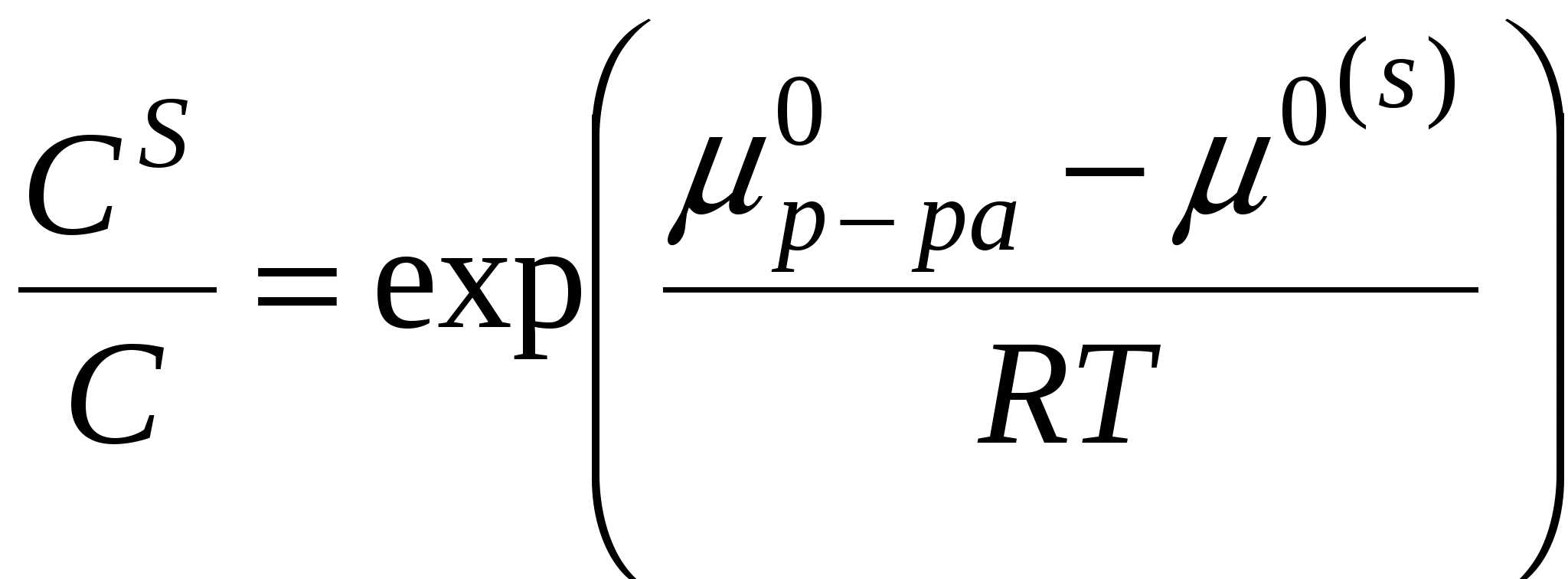
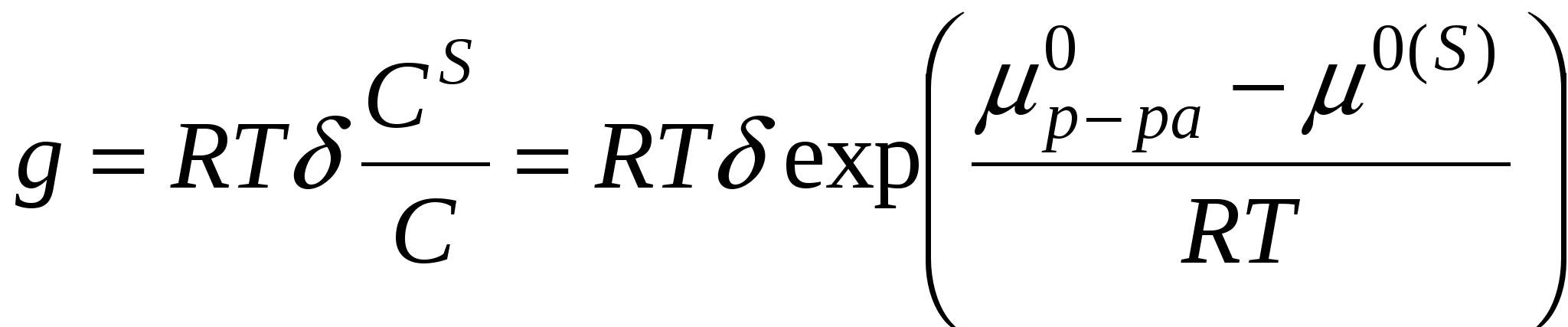
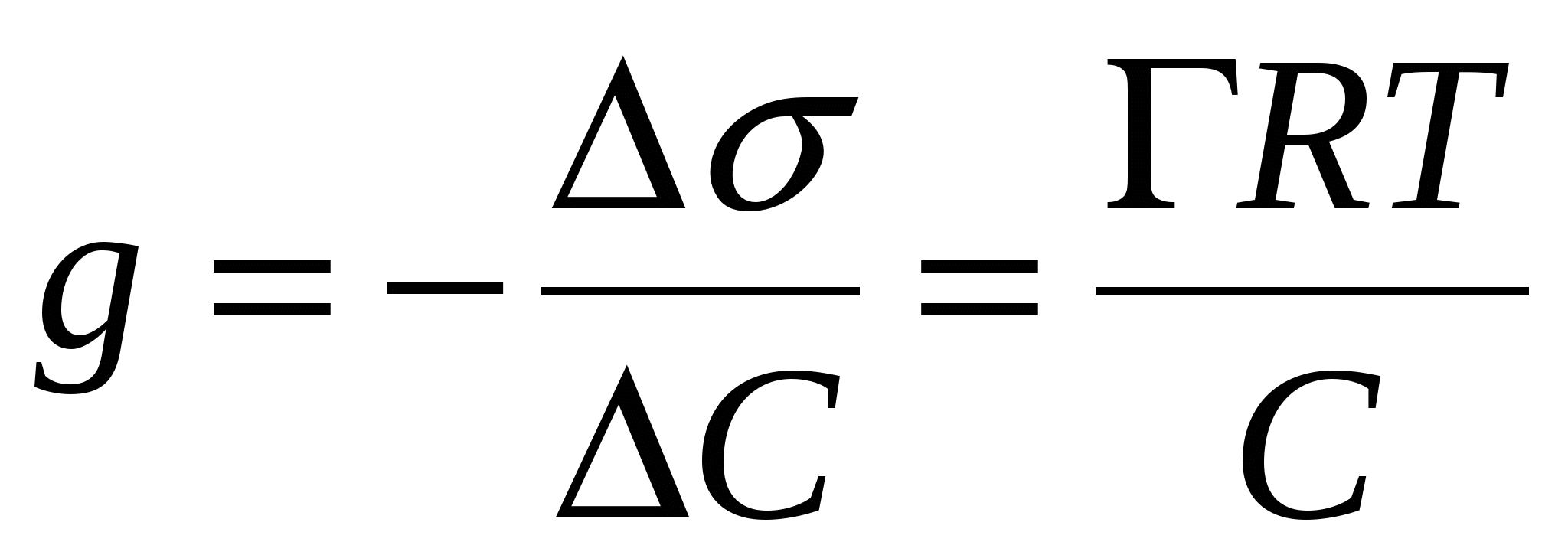
При 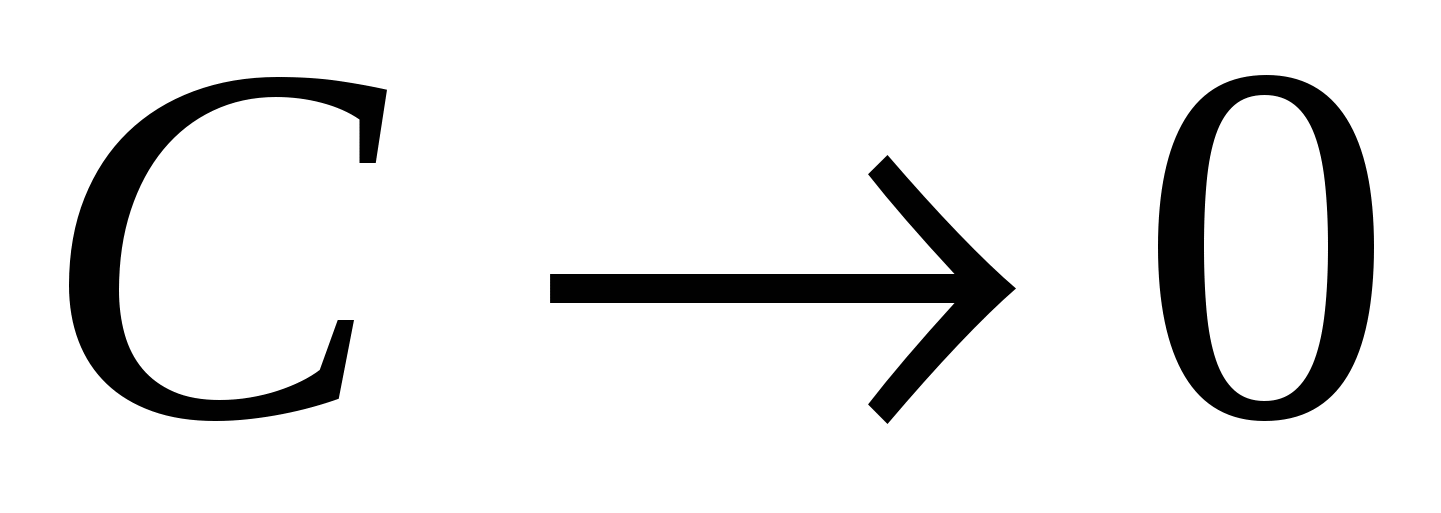 существует область, где существует область, где 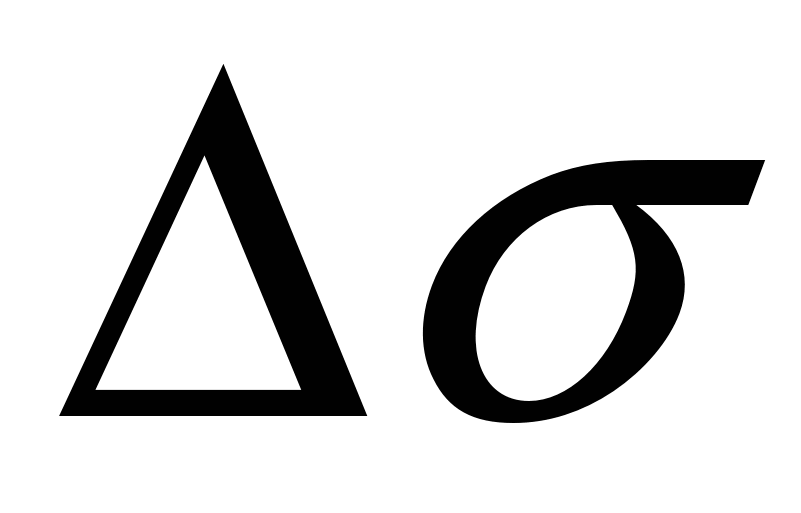 линейно зависит от концентрации. линейно зависит от концентрации.
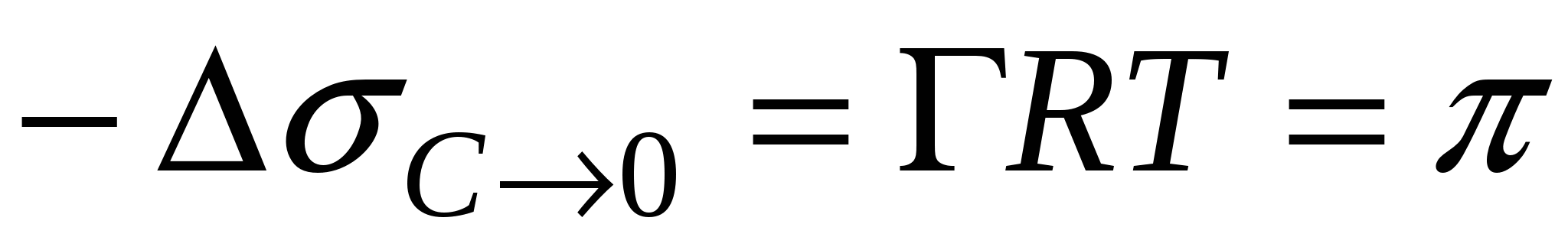 , Г [моль/м2]. , Г [моль/м2].
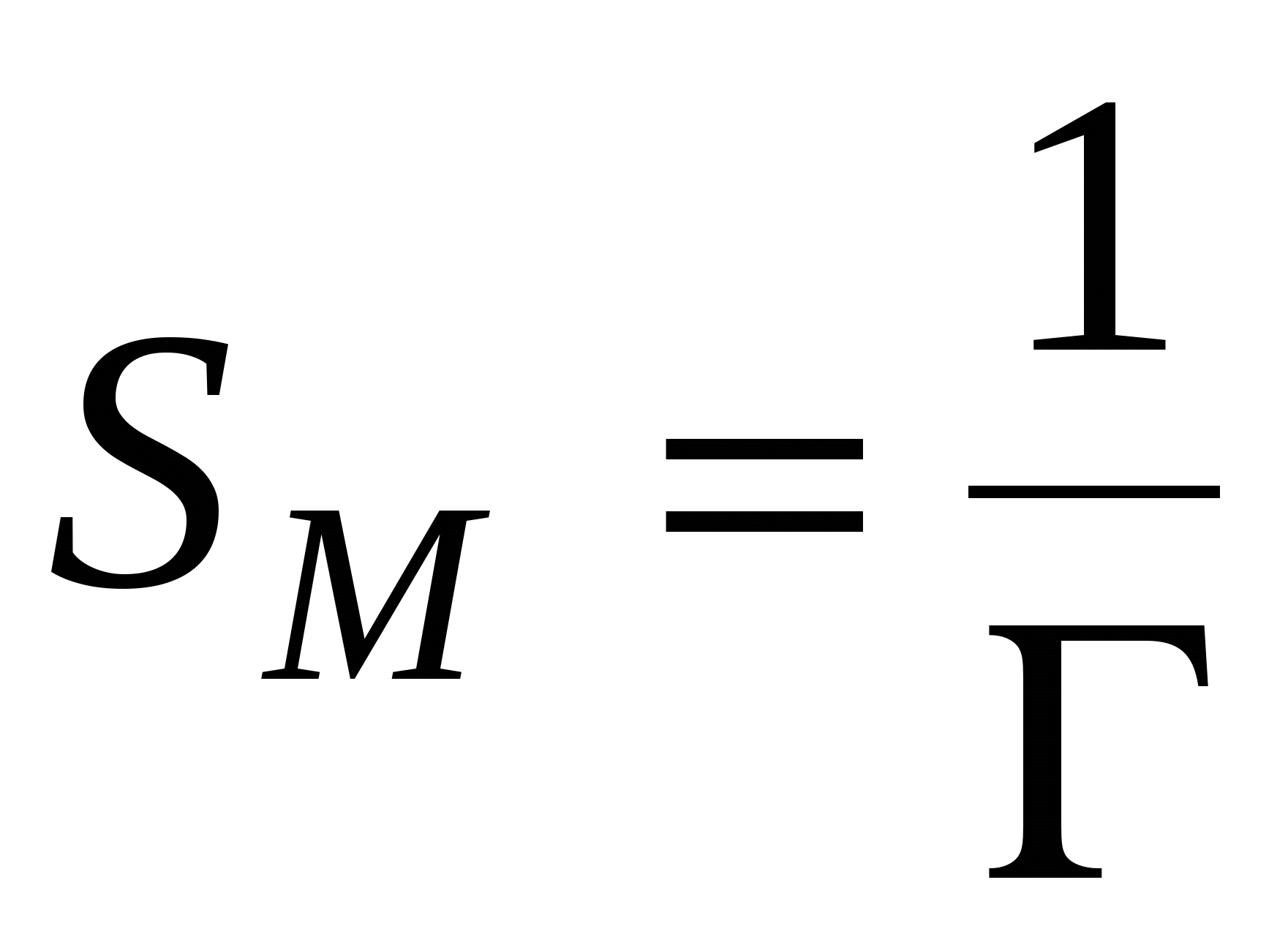 - площадь, занимаемая одним молем вещества - площадь, занимаемая одним молем вещества
Тогда изотерма двухмерного давления будет иметь вид 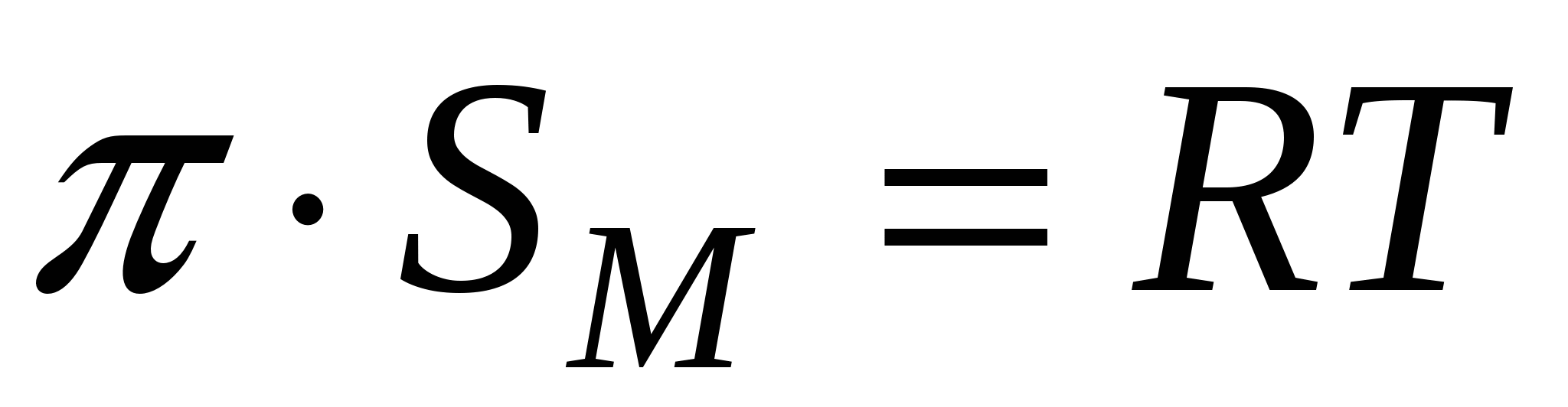
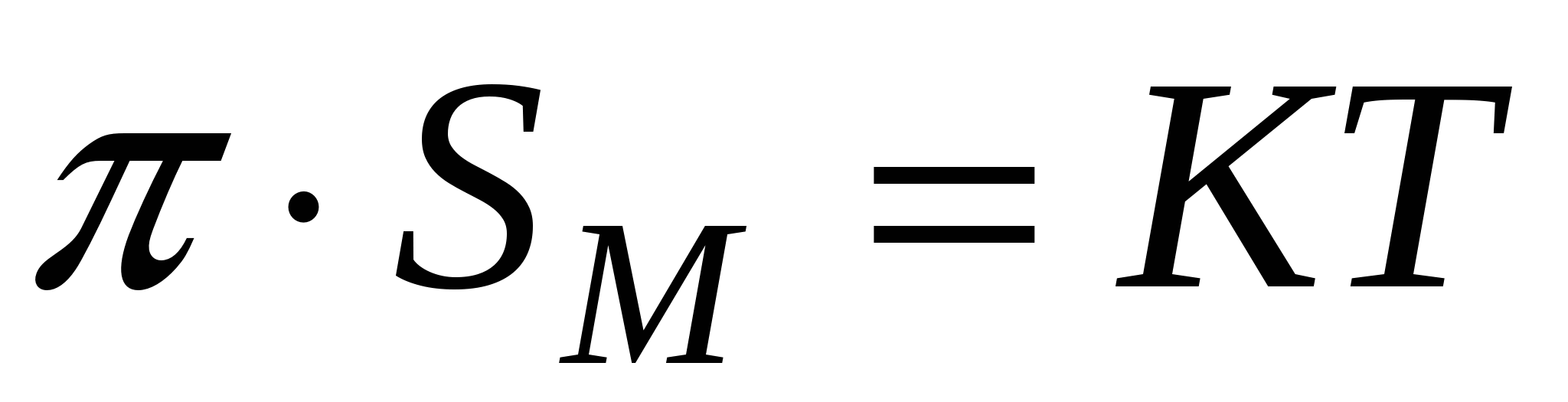 - изотерма двухмерного давления. - изотерма двухмерного давления.
Зависимость  от SМ: от SМ:
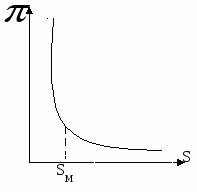
При 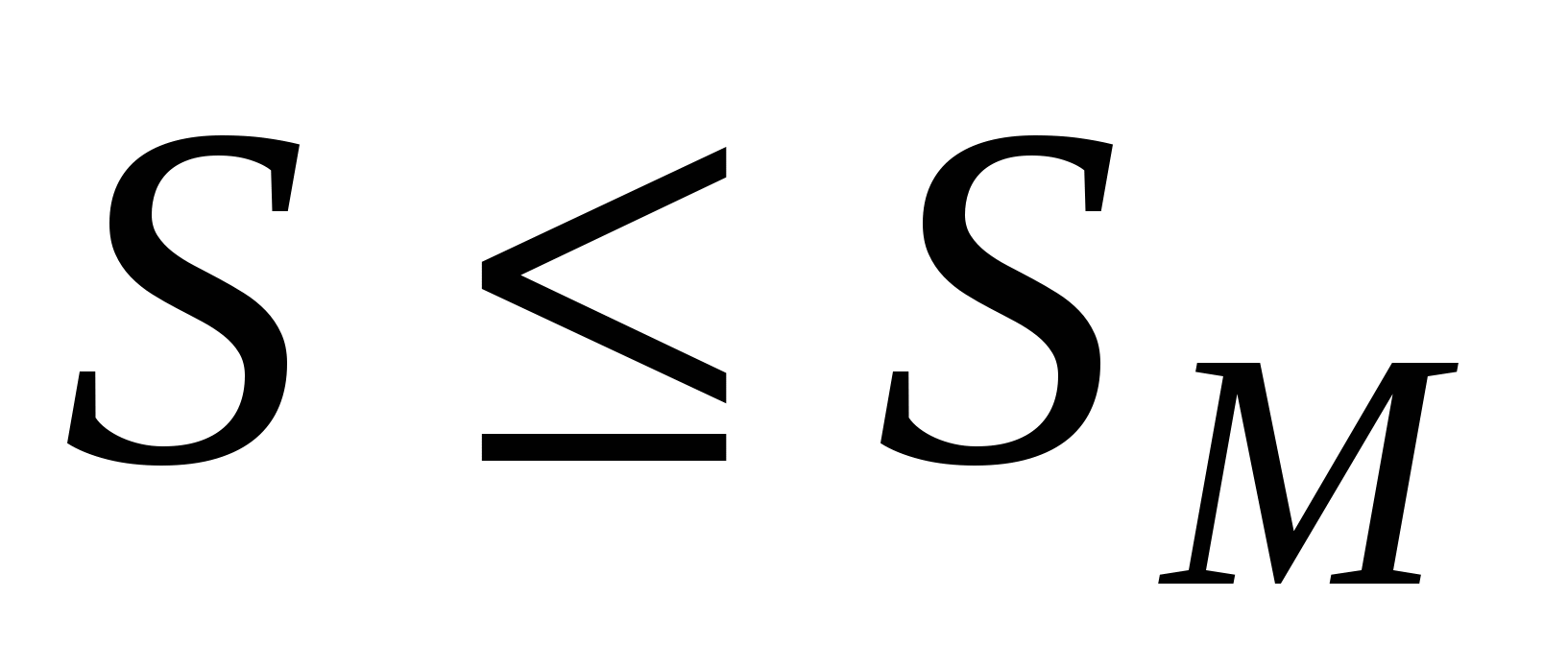 - двухмерное давление резко возрастает. При - двухмерное давление резко возрастает. При 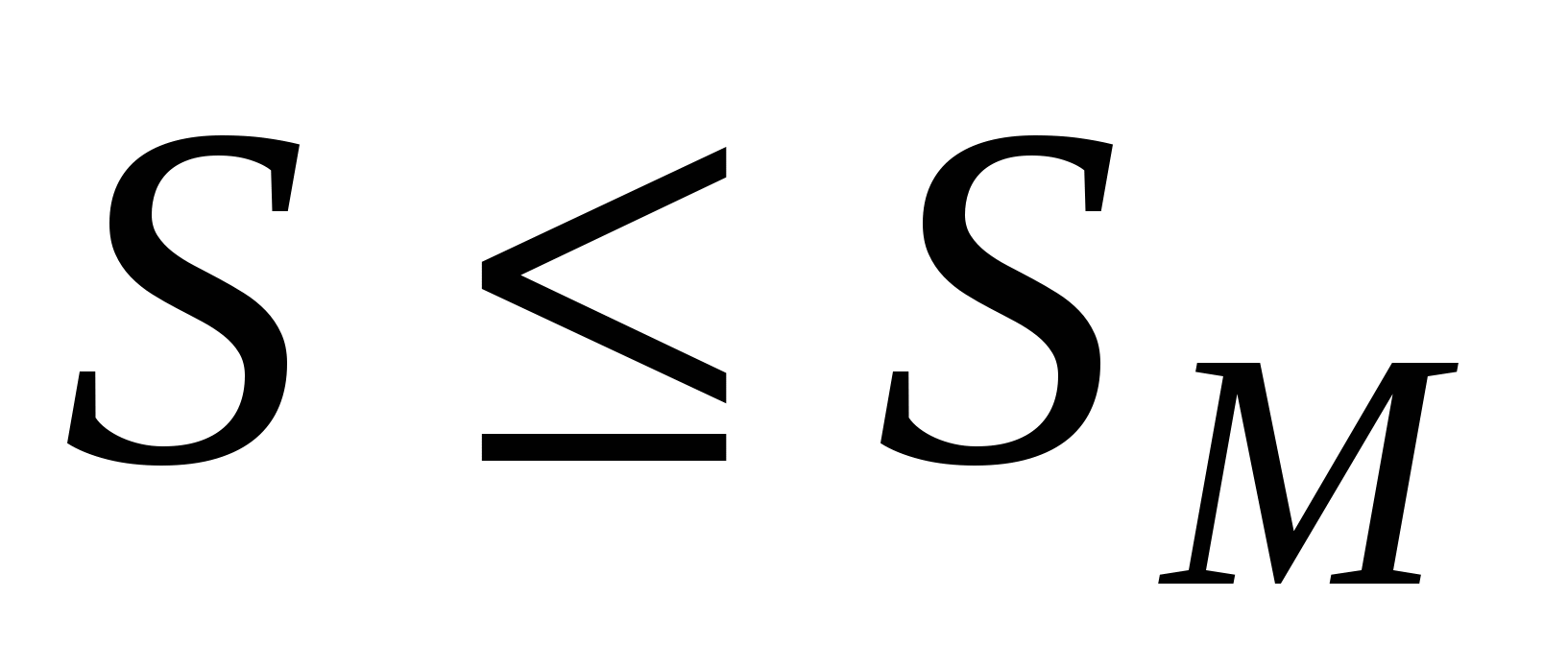 двухмерный деформируется, что вызывает резкий рост двухмерный деформируется, что вызывает резкий рост  . .
Пленка с обеих сторон ограниченная одинаковыми фазами называется двусторонней. В таких пленках наблюдается постоянное движение маточного раствора.
Пленки толщиной меньше 5 нм называются черными пленками.

А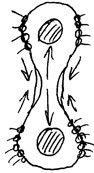 дсорбционные слои должны обладать двумя характеристиками: вязкость и легкоподвижность, текучесть и упругость. дсорбционные слои должны обладать двумя характеристиками: вязкость и легкоподвижность, текучесть и упругость.
Эффект Марангони – это самозалечивание.
 - треугольник Гиббса, - треугольник Гиббса, 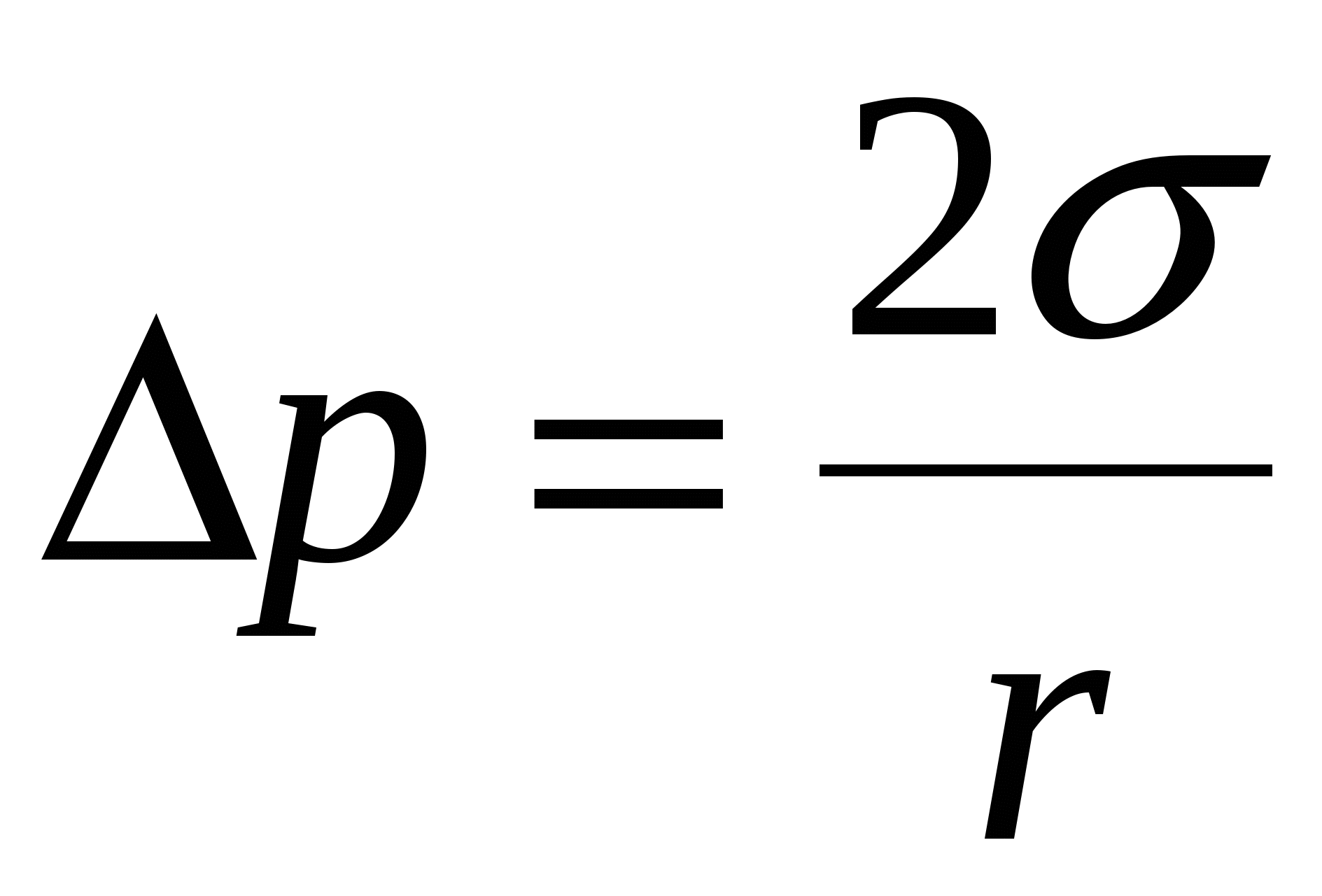 - избыточное давление. - избыточное давление.
Пленка растянулась и за счет того, что часть жидкости ушла, ПАВ усремляются в свободное место. Треугольник Гиббса.
Э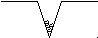 ффект адсорбционной прочности тел. ффект адсорбционной прочности тел.
На поверхности пленки всегда существует адсорбционный слой, для которого 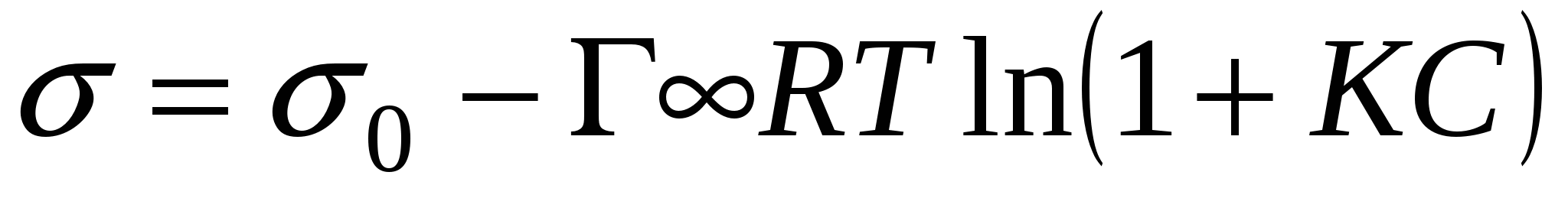 , тогда , тогда 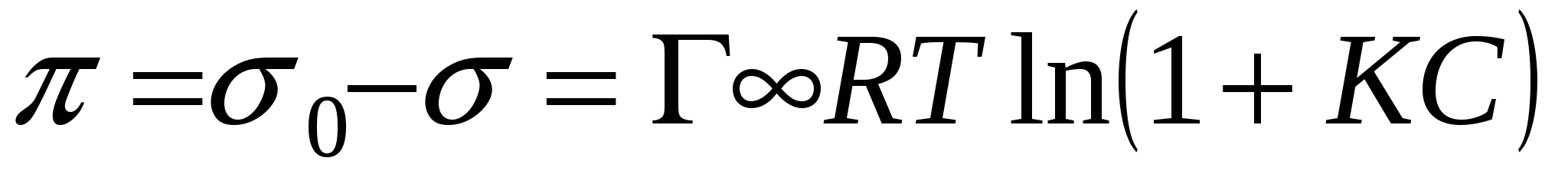
Уравнение Лангмюра:
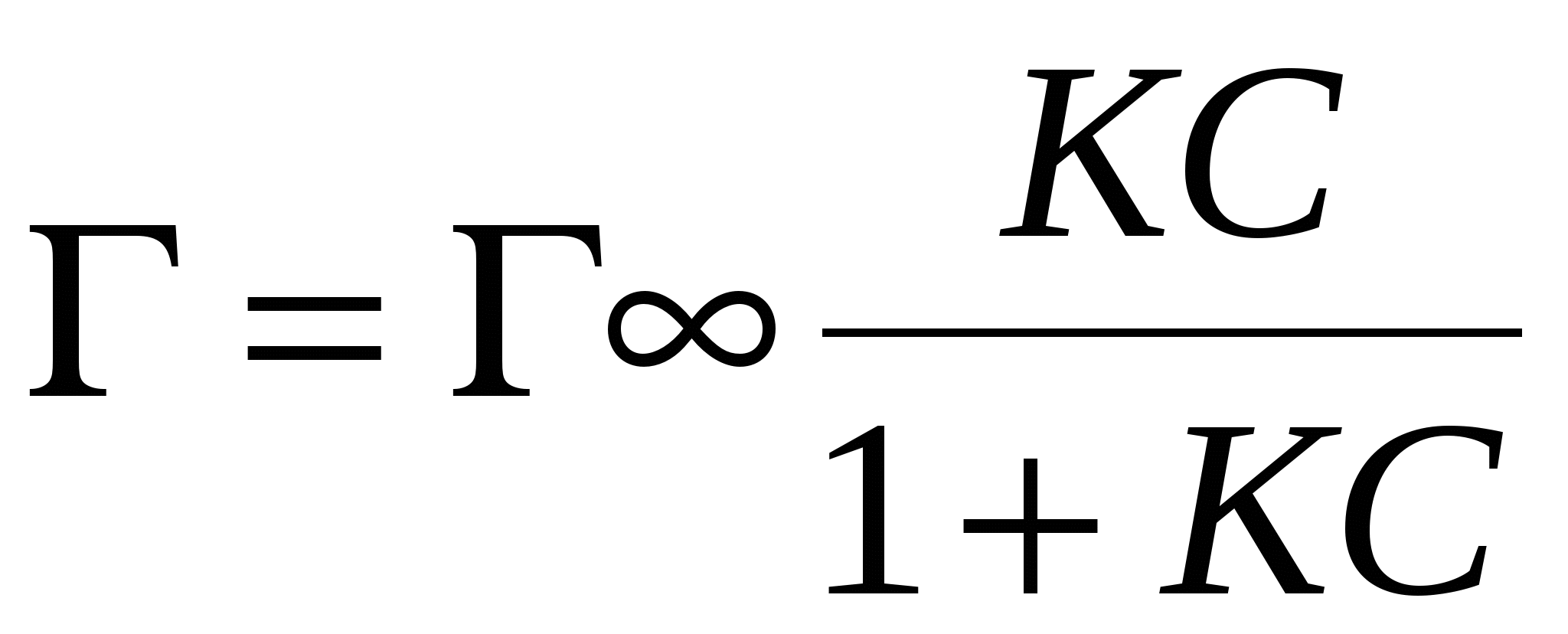  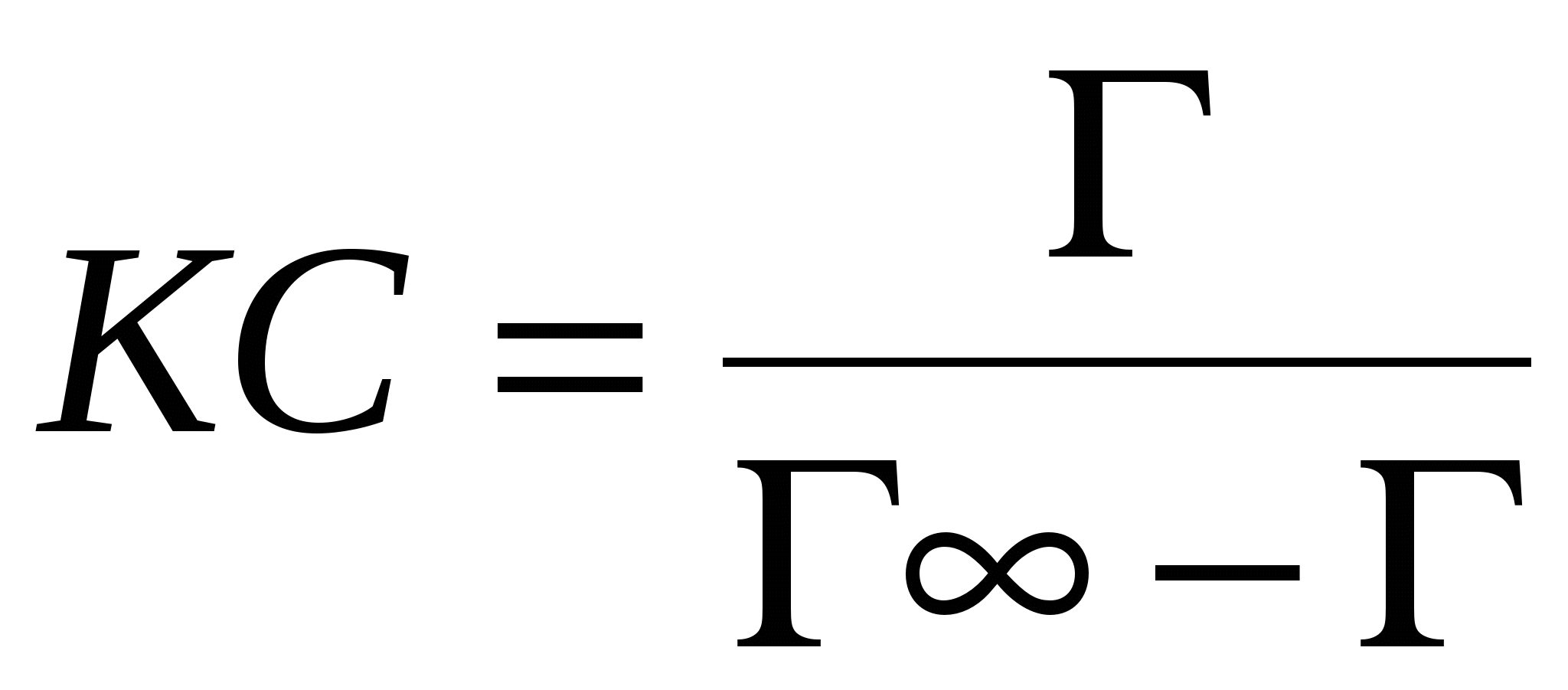 в двухмерное давление в двухмерное давление
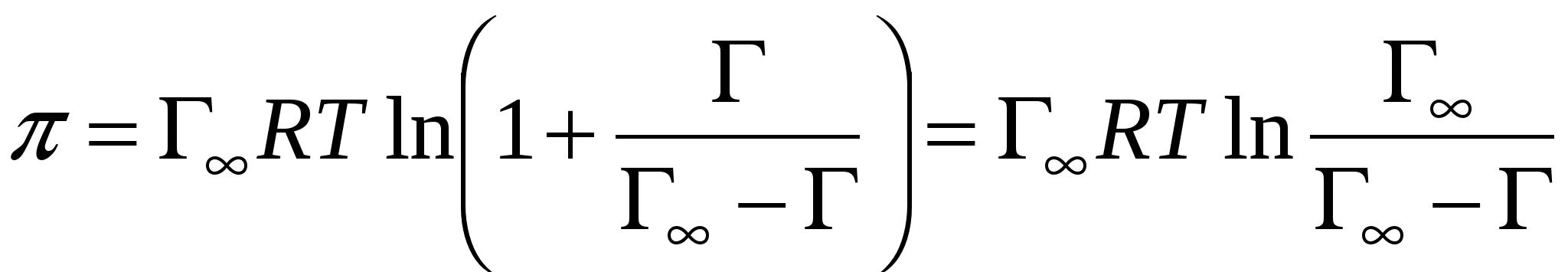 - аналог уравнения Шишковского - аналог уравнения Шишковского
Электрокинетические явления. Двойной электрический слой (ДЭС).
Модель Гелемгольца. Теория Гуи-Чапмена.
1808 г. Рейс
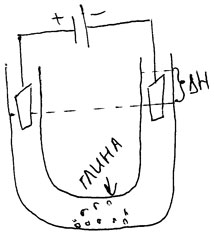
U – образная трубка, погружают в неё 2 электрода. Закон сообщающихся сосудов нарушается и происходит изменение уровня жидкости в трубке – электрокинетические явления.
Кинетические явления:
Электрофорез
Электроосмос
Потенциал течения (протекания)
Потенциал седиментации
1 и 2 возникают при наложении разности потенциалов, 3 и 4 продавливание и седиментация коллоидных частиц вызывают появление разности потенциалов.
Электроосмосом называется движение дисперсионной среды относительно неподвижной дисперсной фазы под действием электрического тока.
Электрофорез – это движение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием электрического тока.
П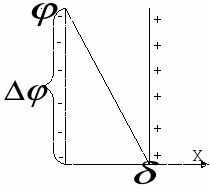 ричина возникновения электрокинетических явлений – это пространственного разделение зарядов и возникновение двойного электрического слоя. ричина возникновения электрокинетических явлений – это пространственного разделение зарядов и возникновение двойного электрического слоя.
Двойной электрический слой представляет собой плоский конденсатор, одна обкладка образована потенциалоределяющими ионами, другая – противоиноами. Ионы заражены также как потенциалопределяющие ко-ионы оттеснены в объем раствора. Расстояние между обкладками 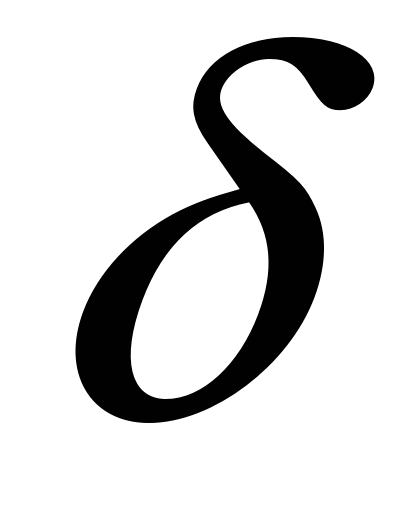 . Потенциал падает линейно, разность потенциалов . Потенциал падает линейно, разность потенциалов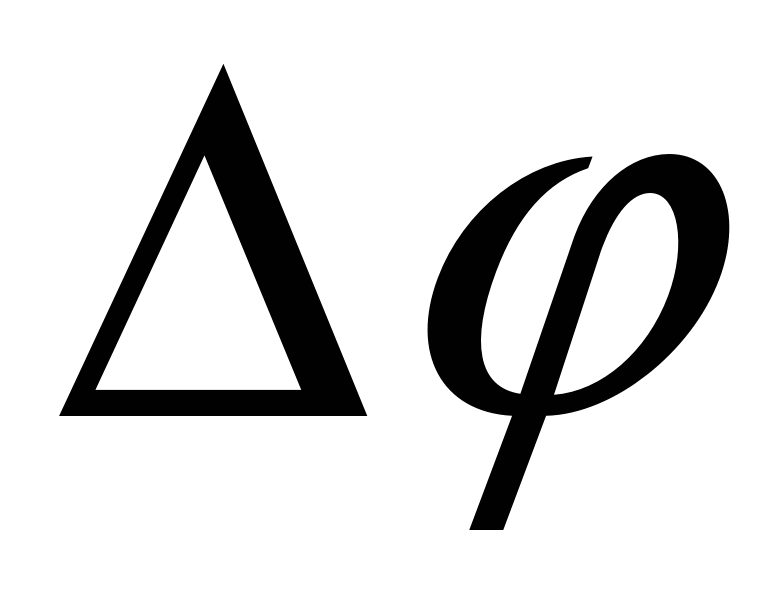 . .
Внешняя разность потенциалов вызывает появление модуля сдвига 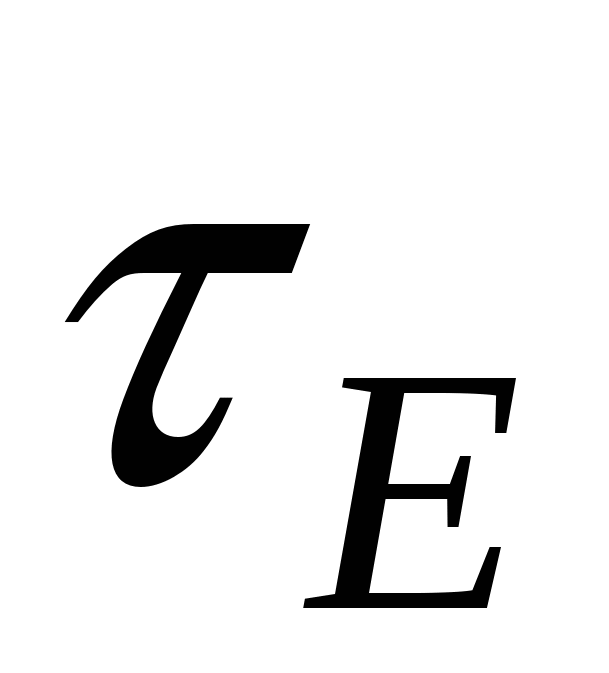 - это пара сил отнесенных к единице площади, девствующих вдоль поверхности твердого тела. - это пара сил отнесенных к единице площади, девствующих вдоль поверхности твердого тела.
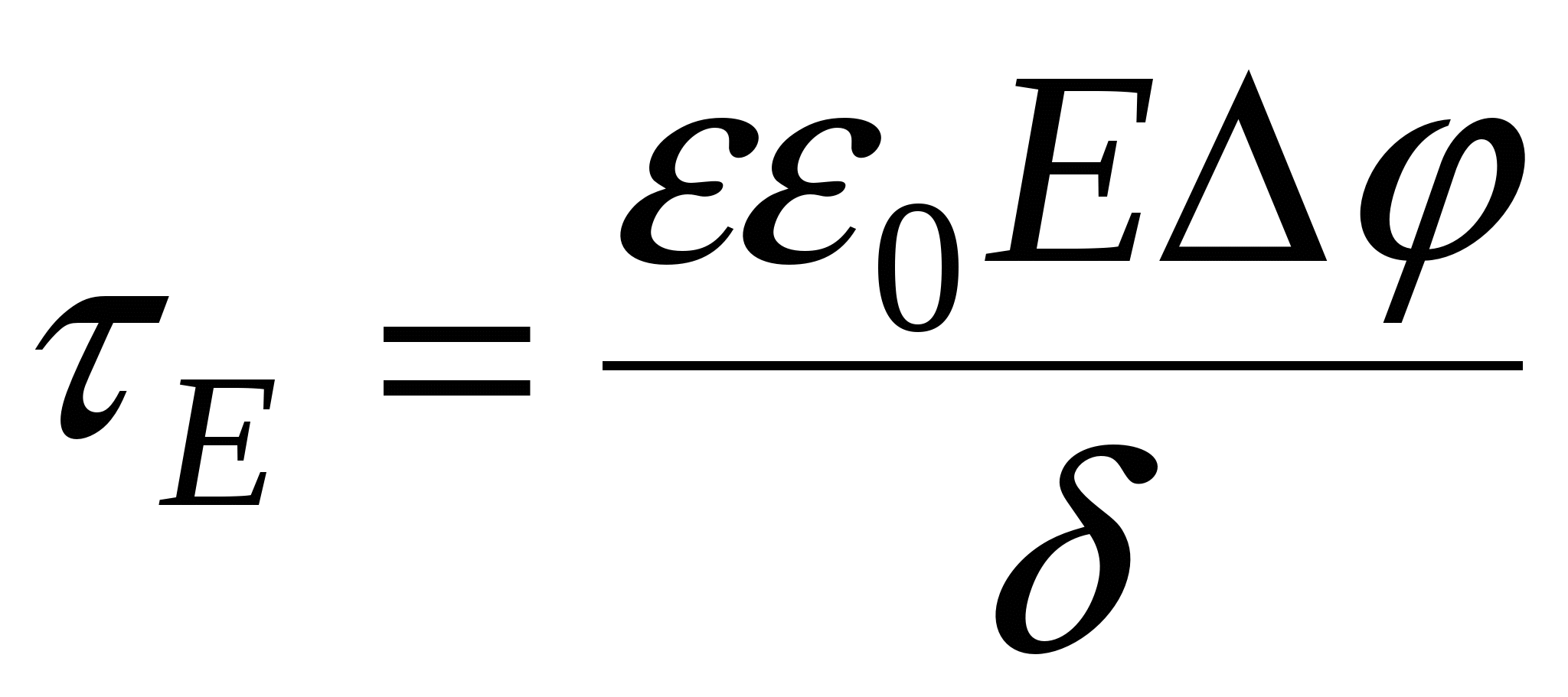
В состоянии равновесия модуль сдвига равен модулю вязкого трения (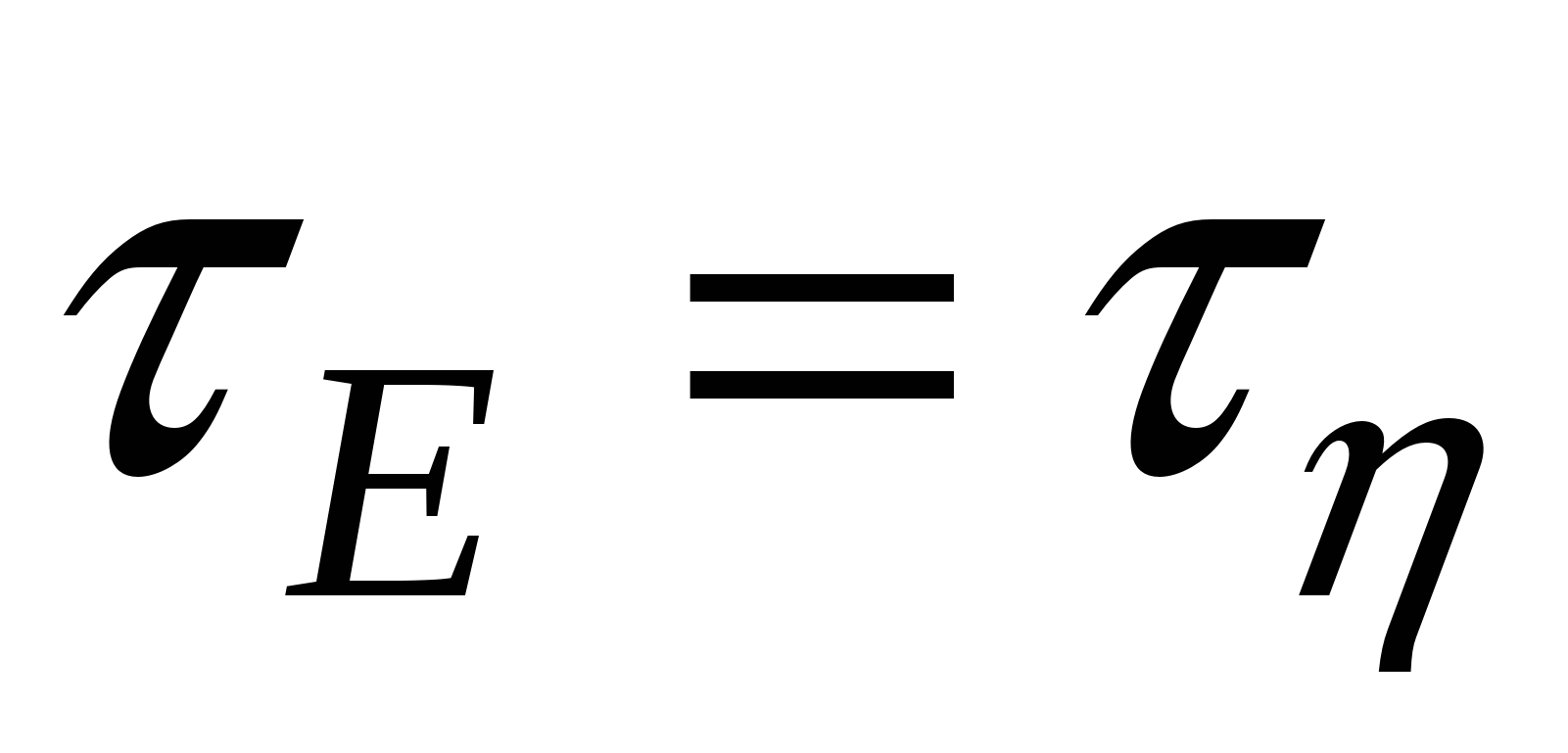 ). ).
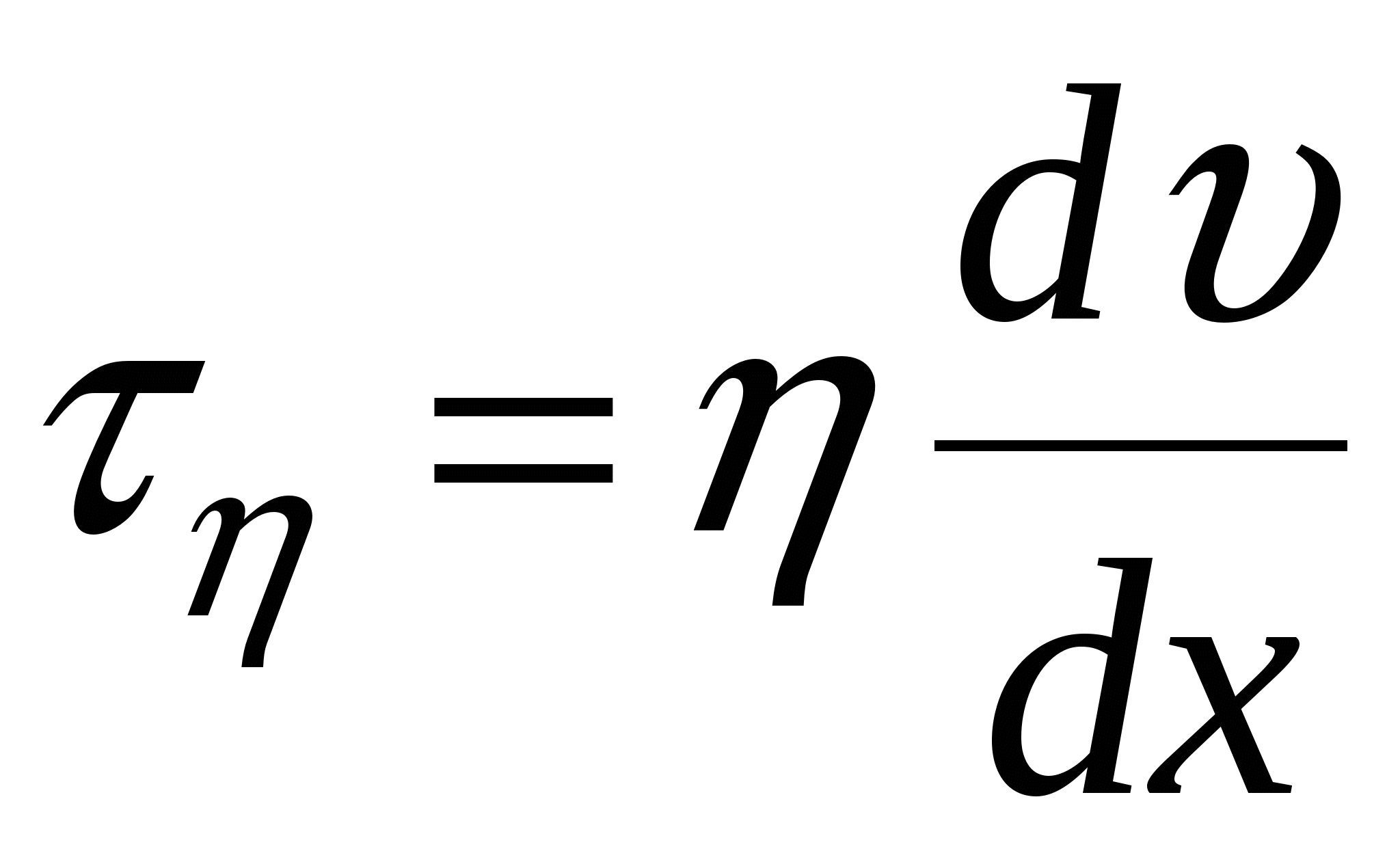
В наших условиях 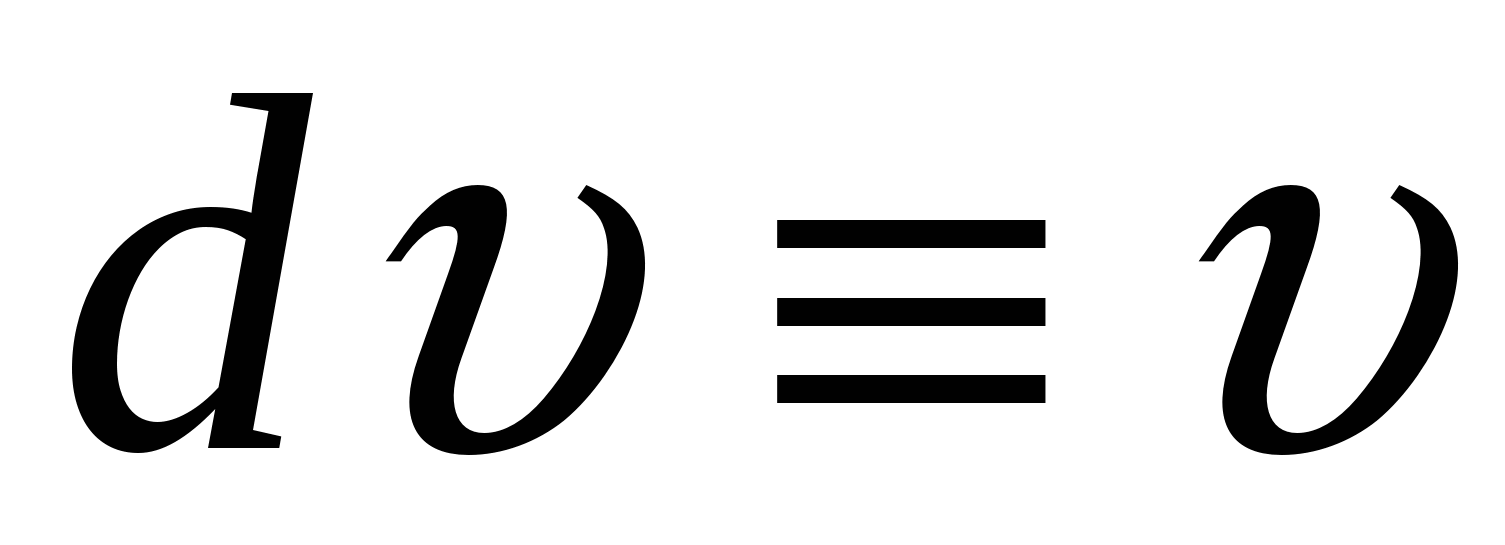 , , 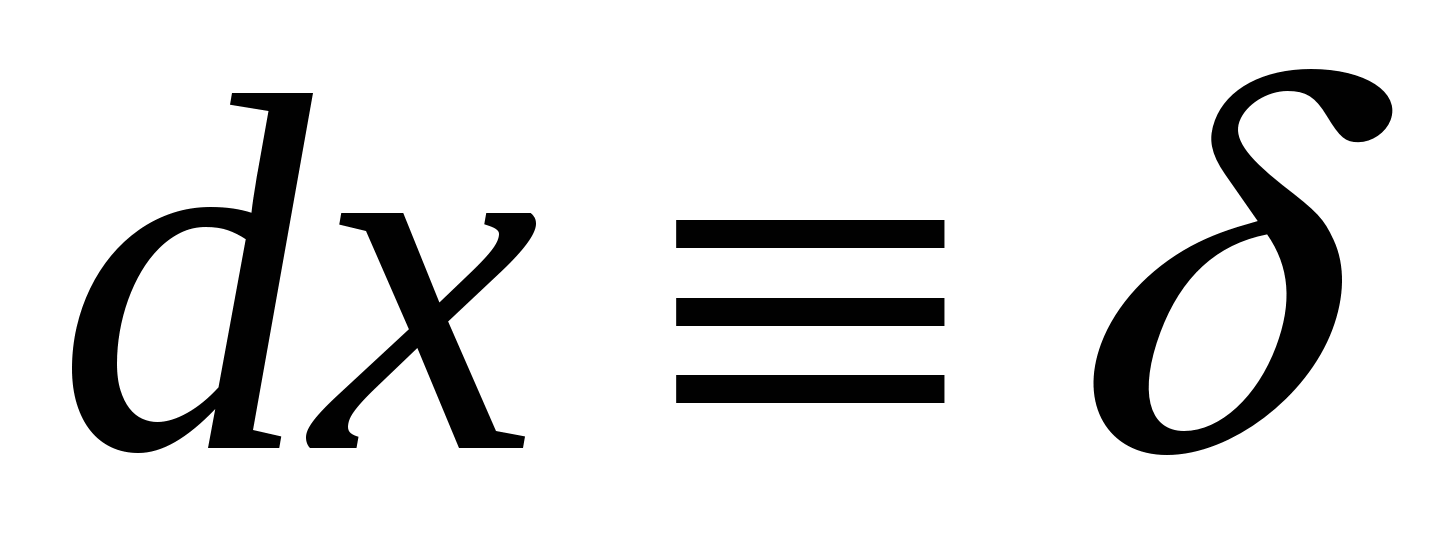
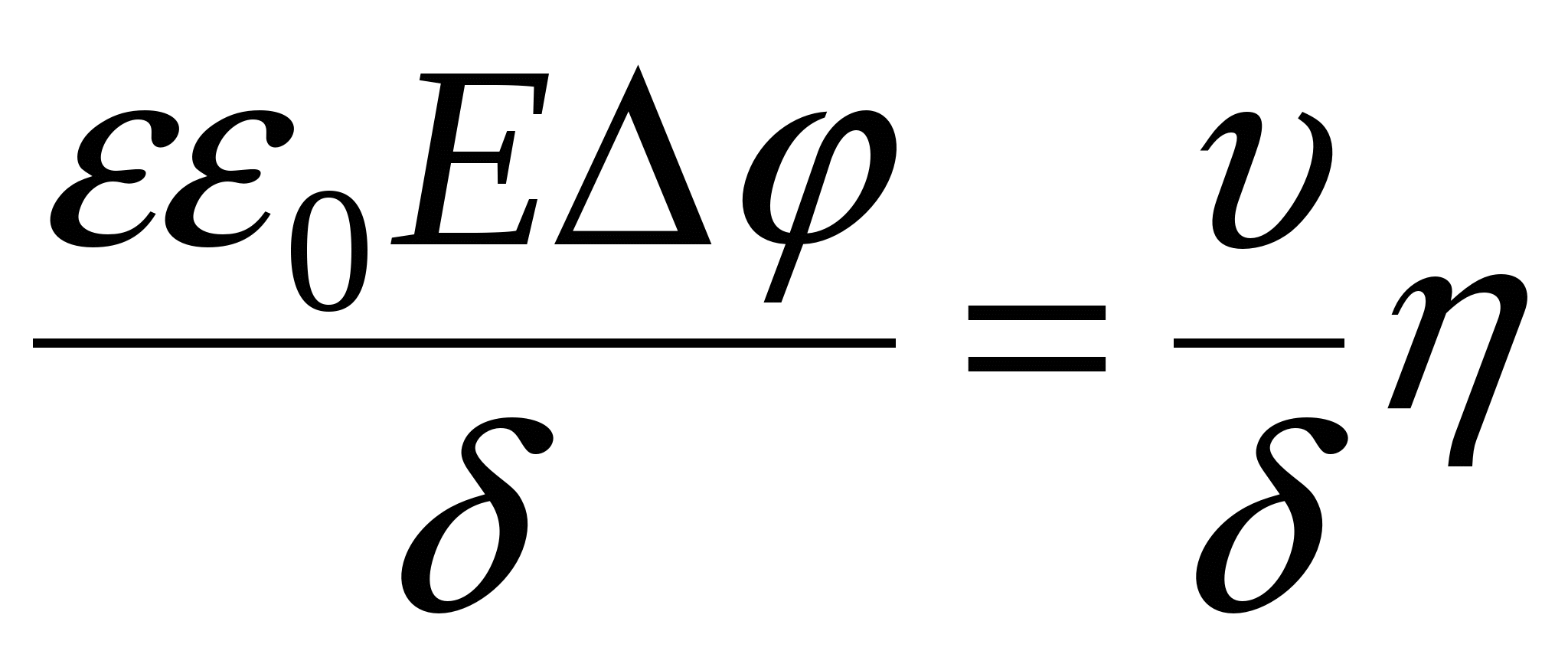
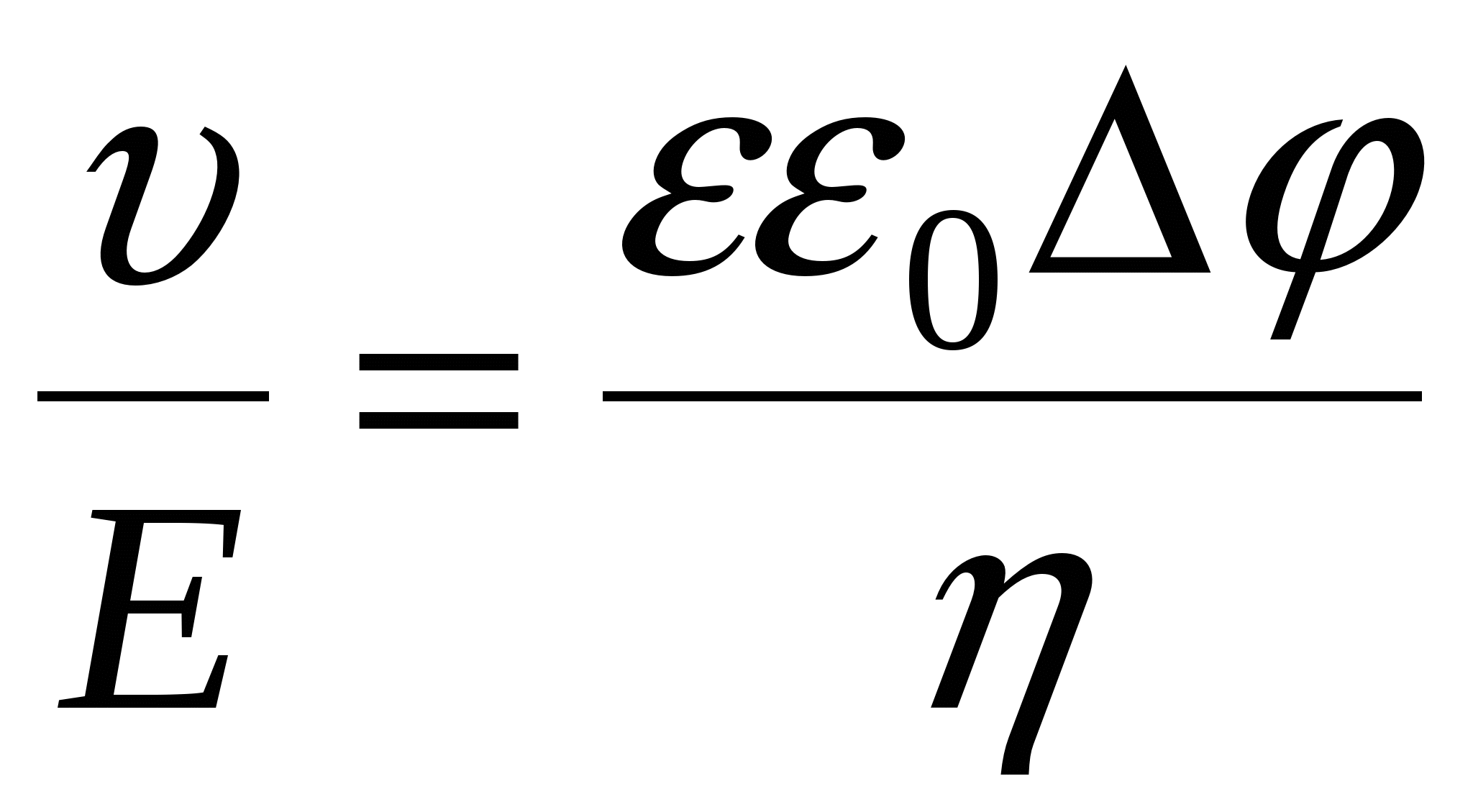 - уравнение Гелемгольца-Смалуковского - уравнение Гелемгольца-Смалуковского
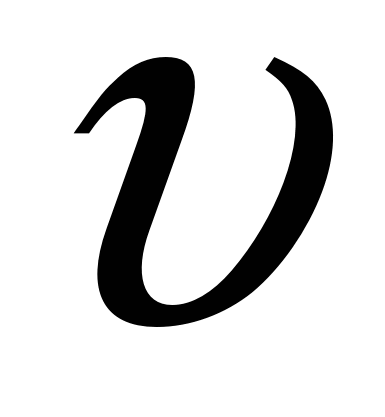 - линейная скорость смещении я фаз. - линейная скорость смещении я фаз.
E – напряженность электрического поля.
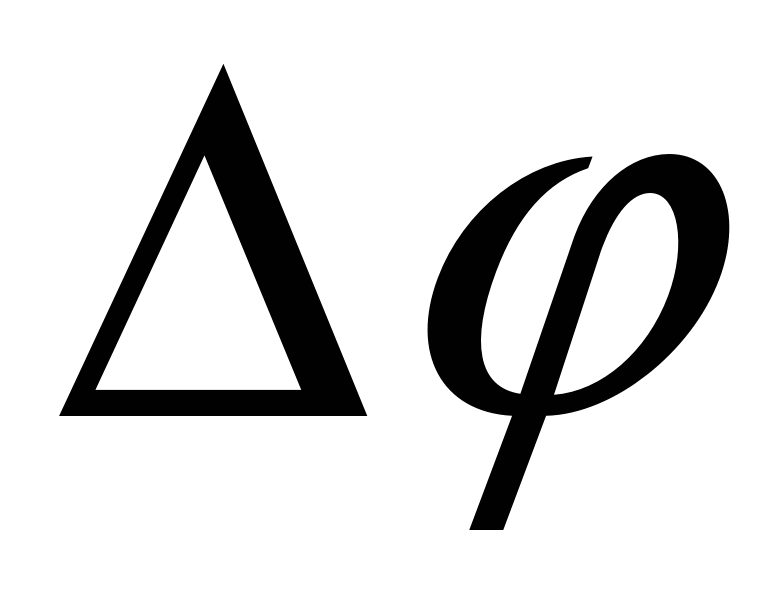 - разность потенциалов между обкладками - разность потенциалов между обкладками
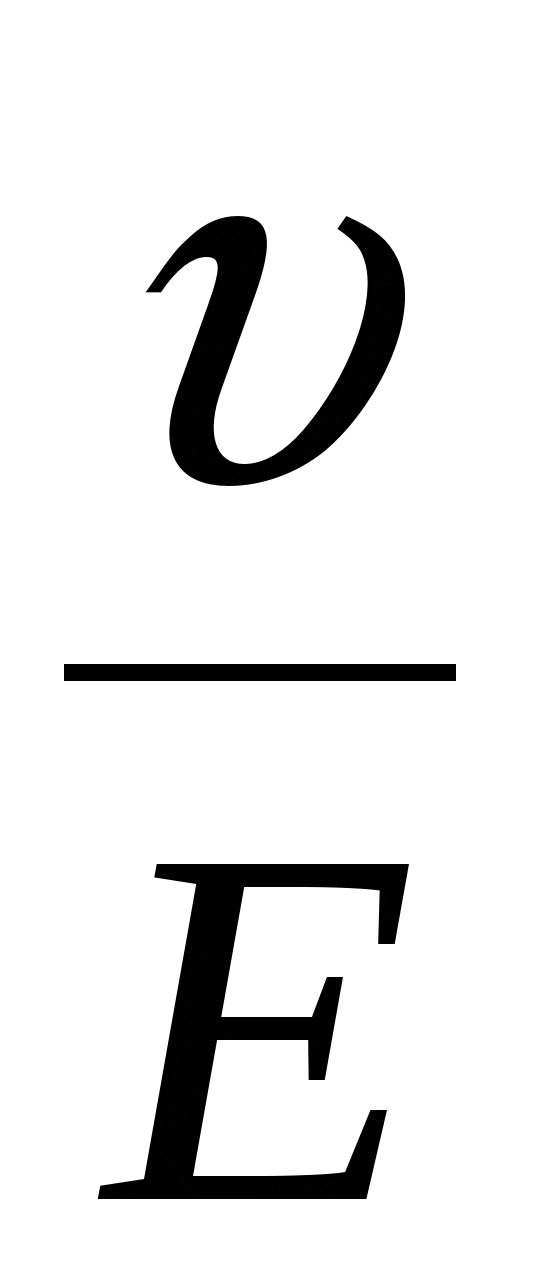 - электрофоретическая подвижность [м2/(В*с)]. - электрофоретическая подвижность [м2/(В*с)].
В модели Гелемгольца не учитывается тепловое движение молекул. Реально распределение ионов в двойном слое носит более сложный характер.
Гуи и Чапман выделили следующие причины возникновения ДЭС:
Переход иона из одной фазы в другую при установлении равновесия.
Ионизация вещества твердой фазы.
Достройка поверхности ионами, присутствующими в дисперсионной среде.
Поляризация от внешнего источника тока.
Двойной электрической слой имеет размытое или диффузное строение. Ионы стремятся равномерно распределиться во всем диффузном слое.
Диффузный слой состоит из противоинонв, протяженность слоя определяется их кинетической энергией. При температуре стремящейся к абсолютному нулю противоиноы максимально приближены к потенциалопределяющим ионам.
Даня теория базируется на двух уравнениях:
уравнение Больцмана
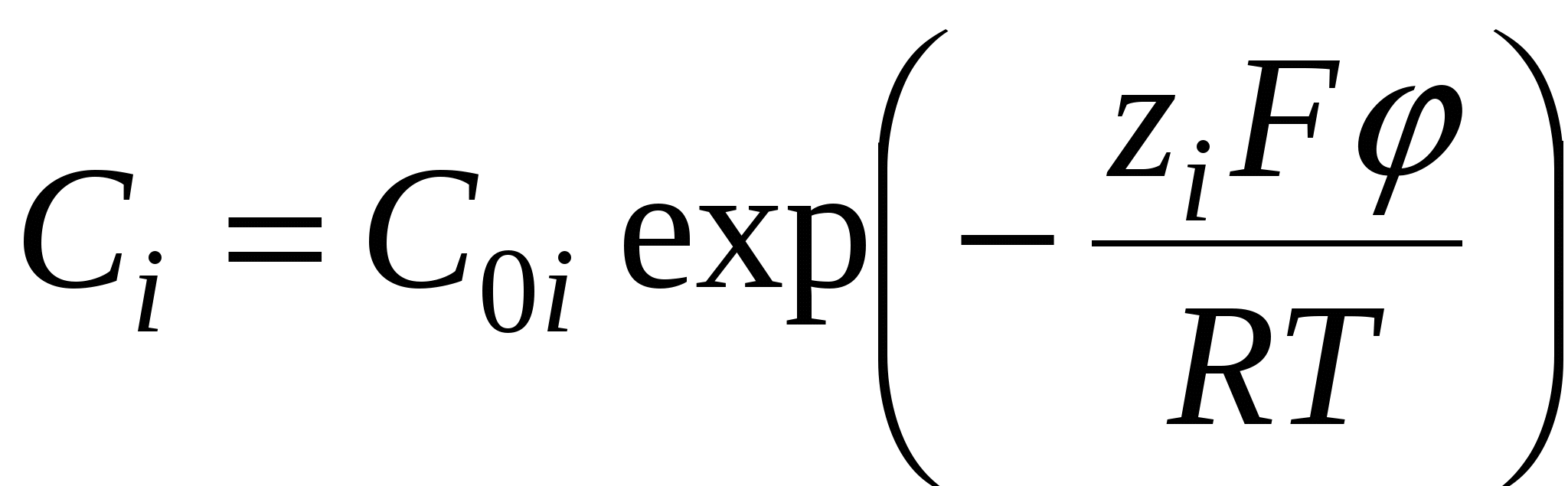
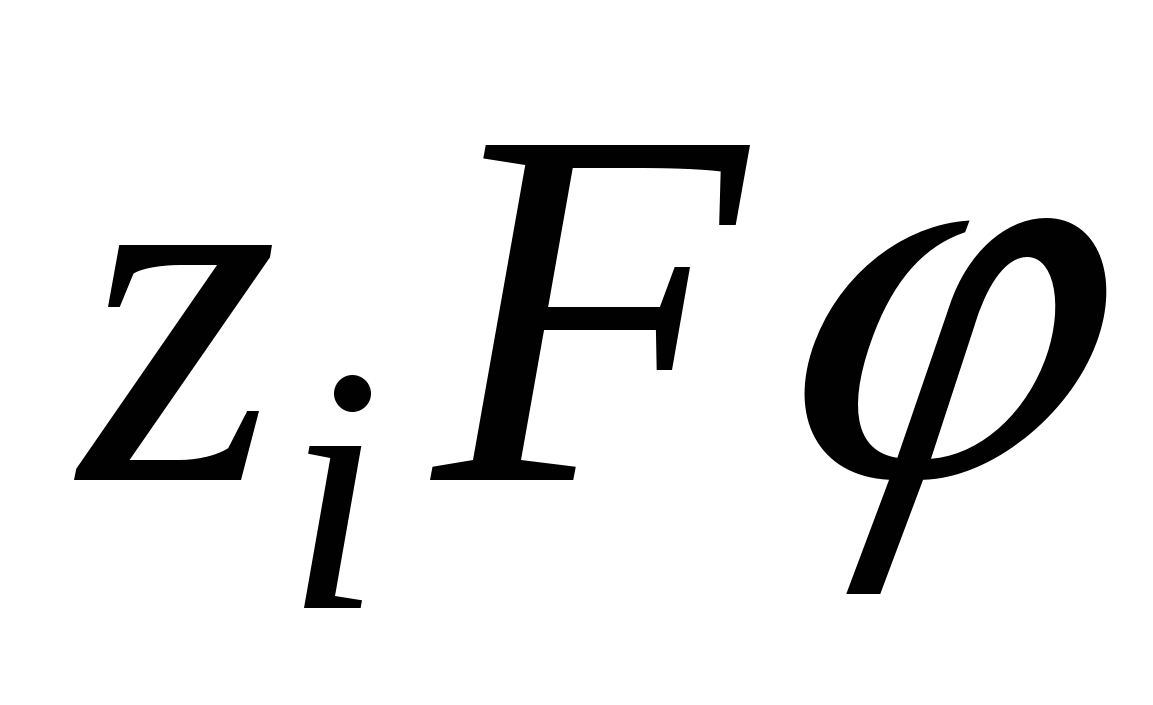 - работа против сил электростатического взаимодействия. - работа против сил электростатического взаимодействия.
 - объёмная плотность заряда. - объёмная плотность заряда.
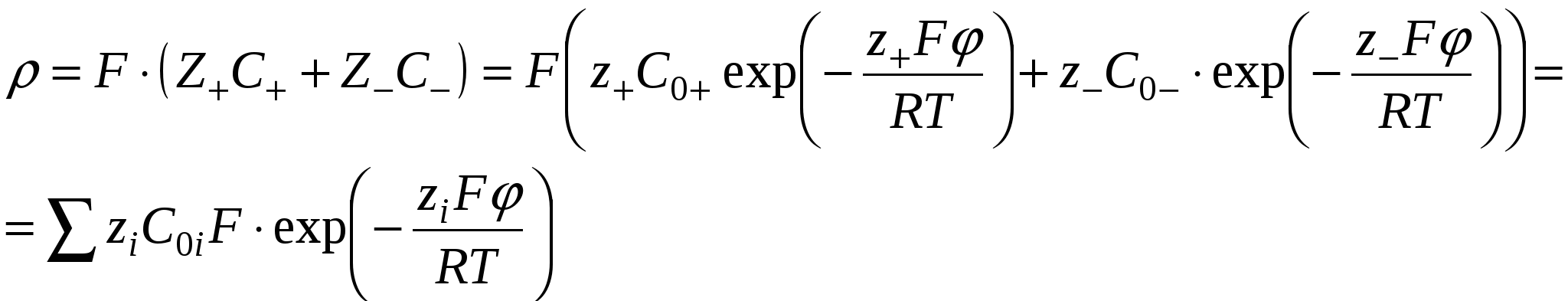
Уравнение Пуассона 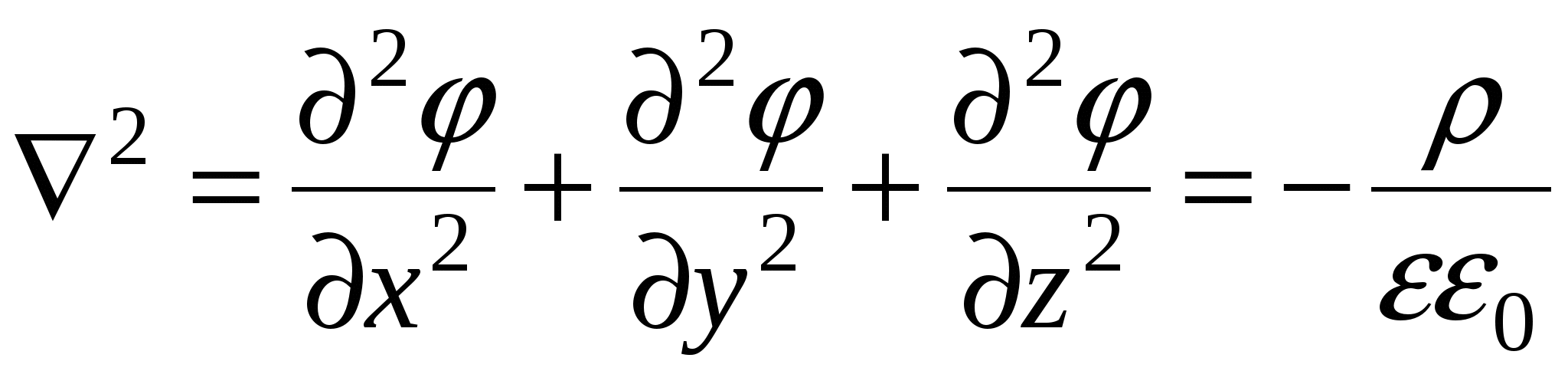
Поскольку толщина ДЭС много меньше размеров частицы и для плоского ДЭС производная по координатам 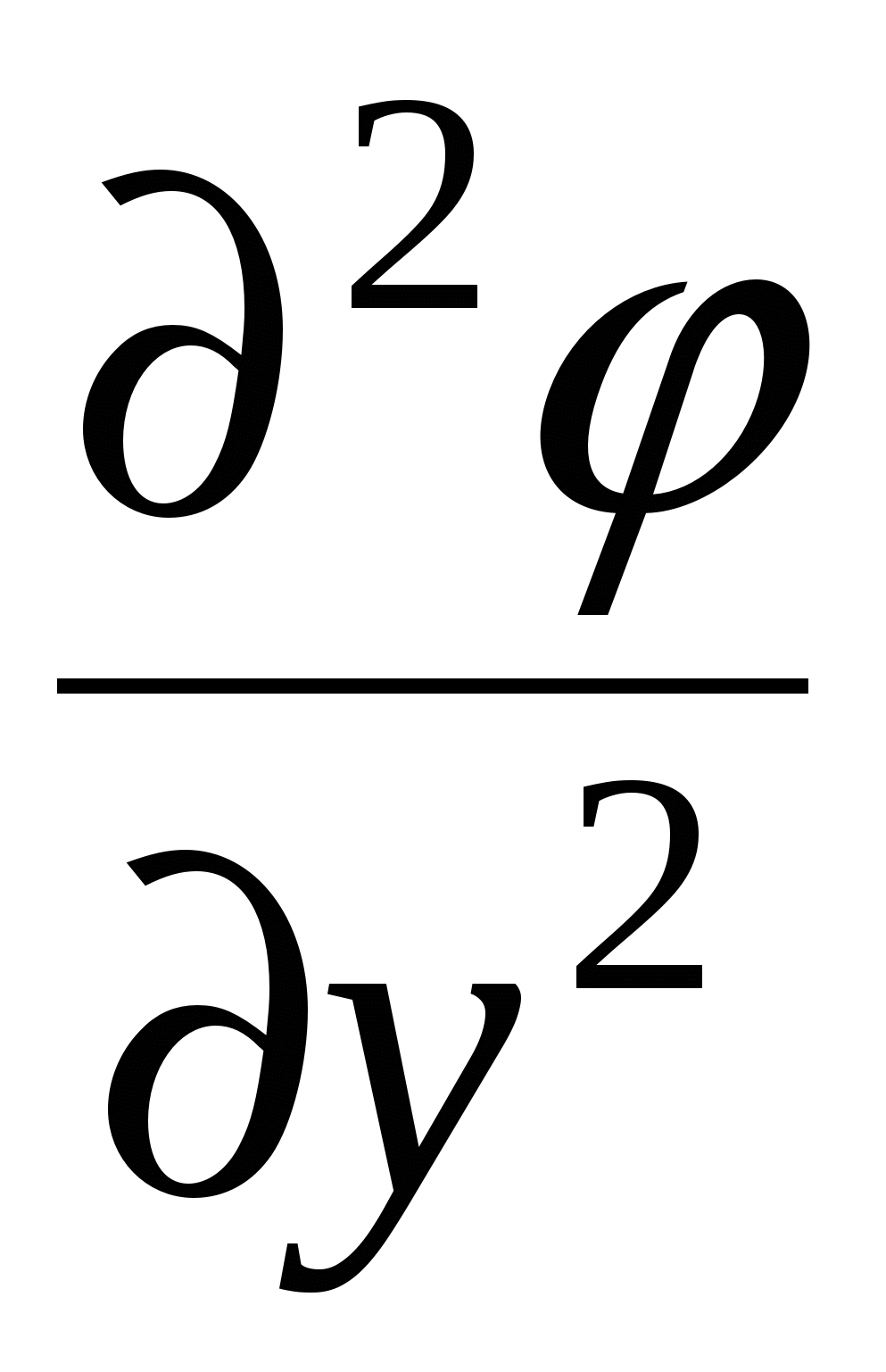 и и 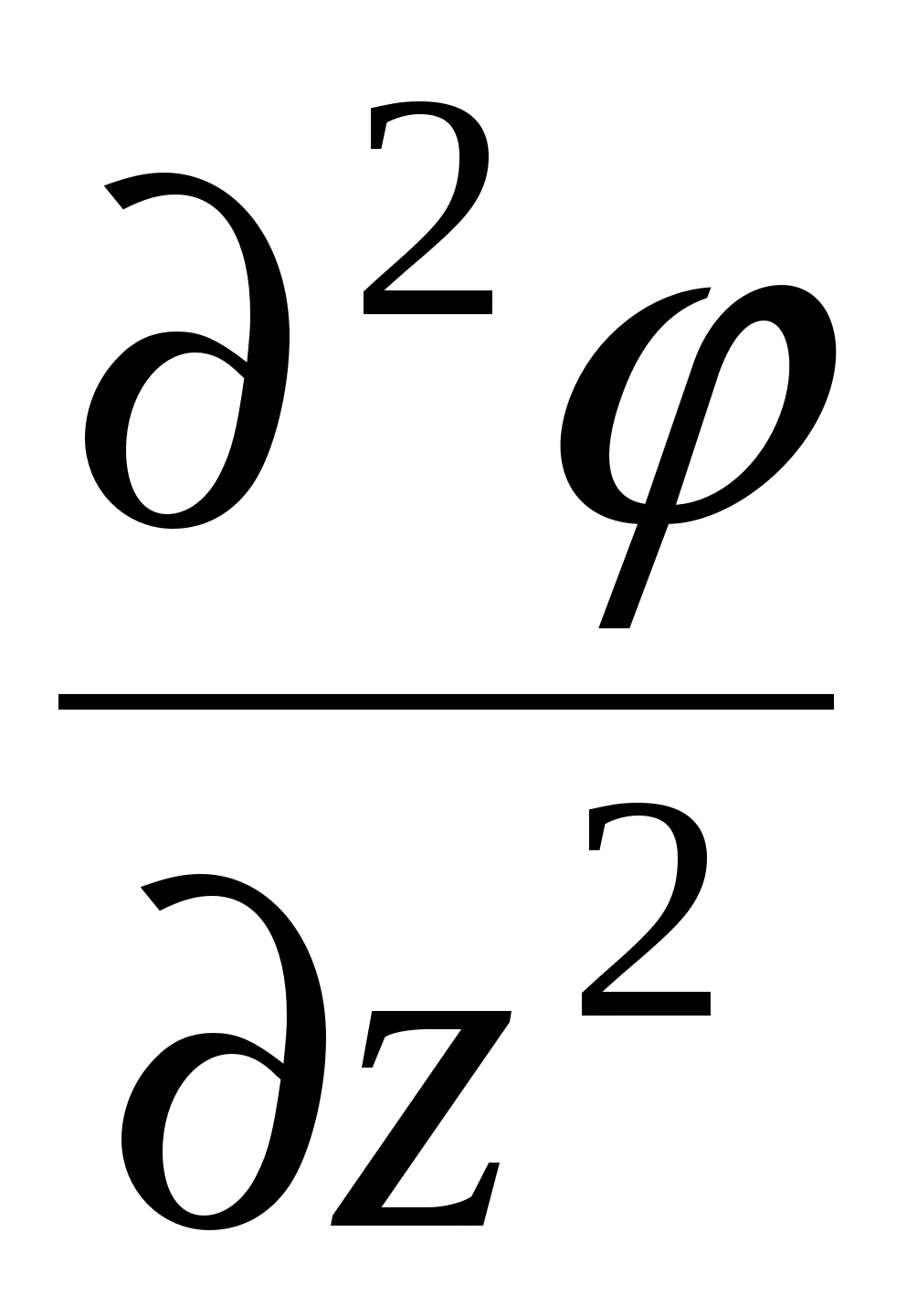 упраздняется. упраздняется. 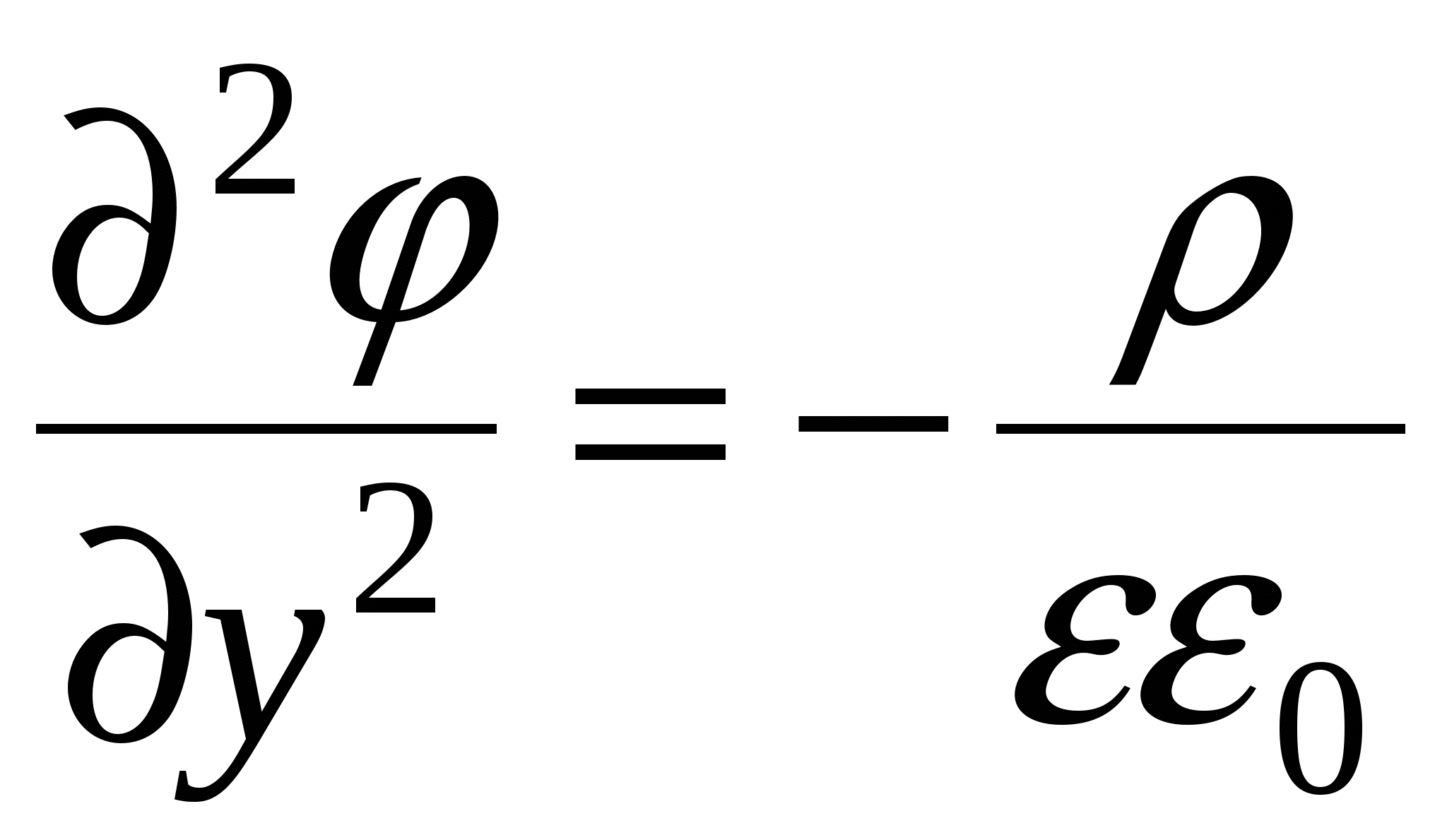
Для еу при у<<1 функцию можно разложить в ряд Маклорена:
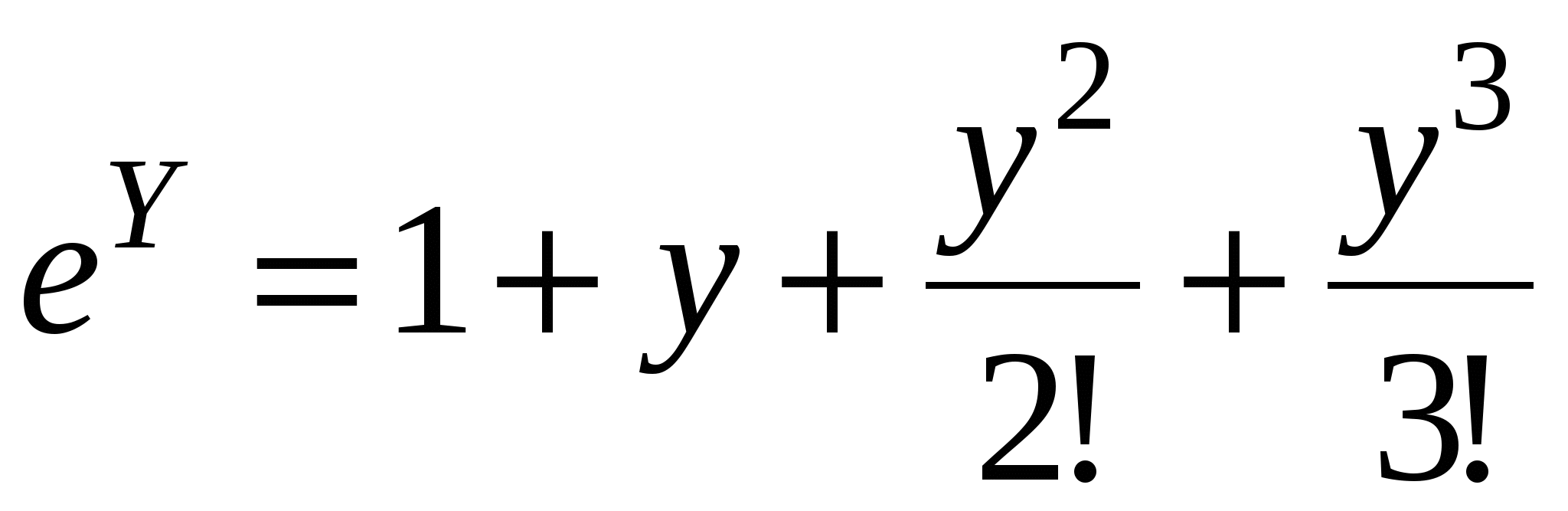
Ограничимся двумя членами ряда, тогда:
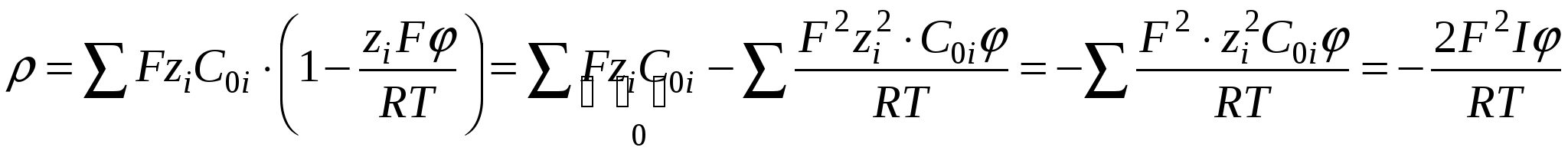
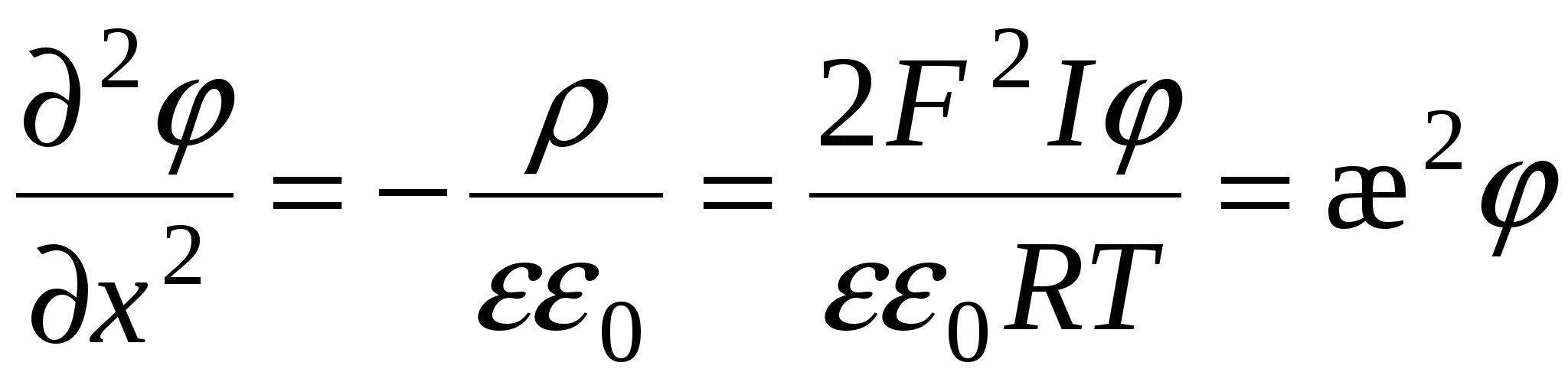
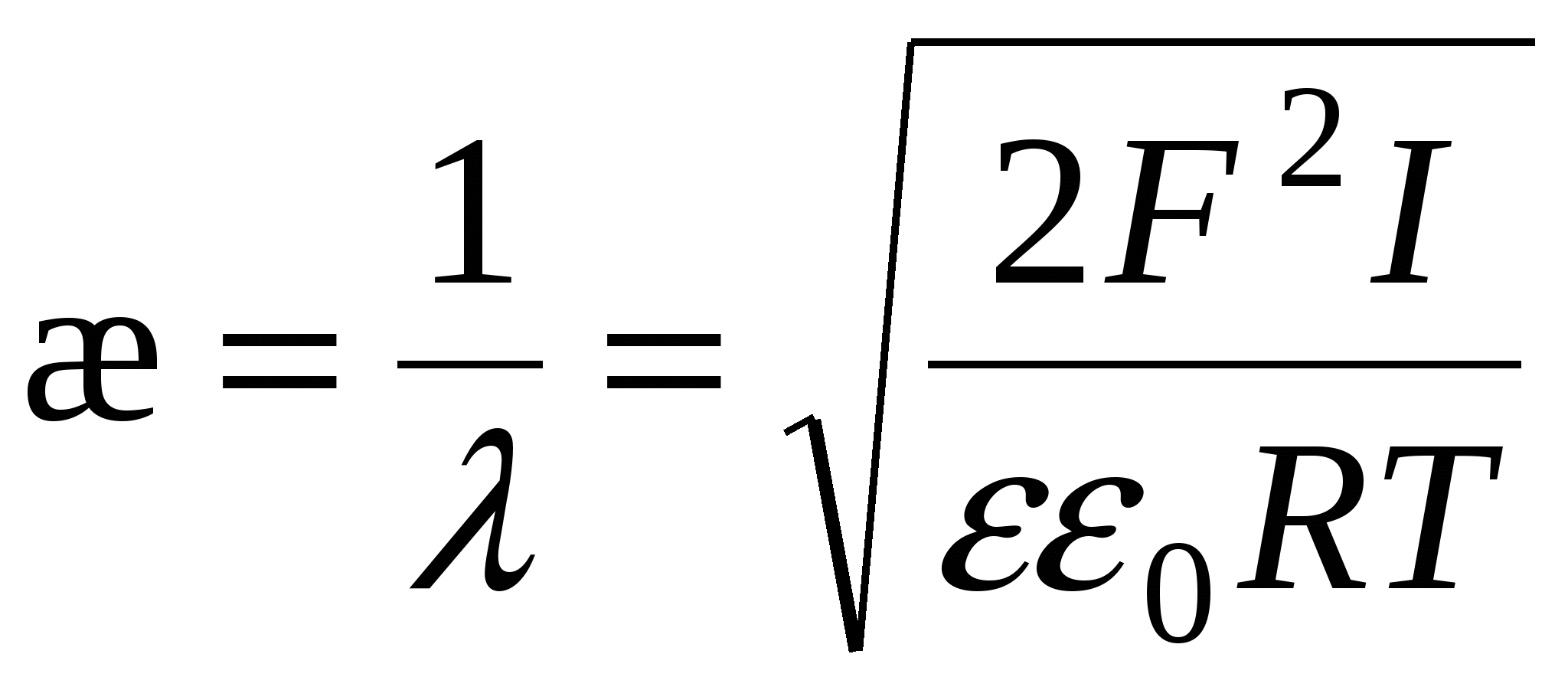
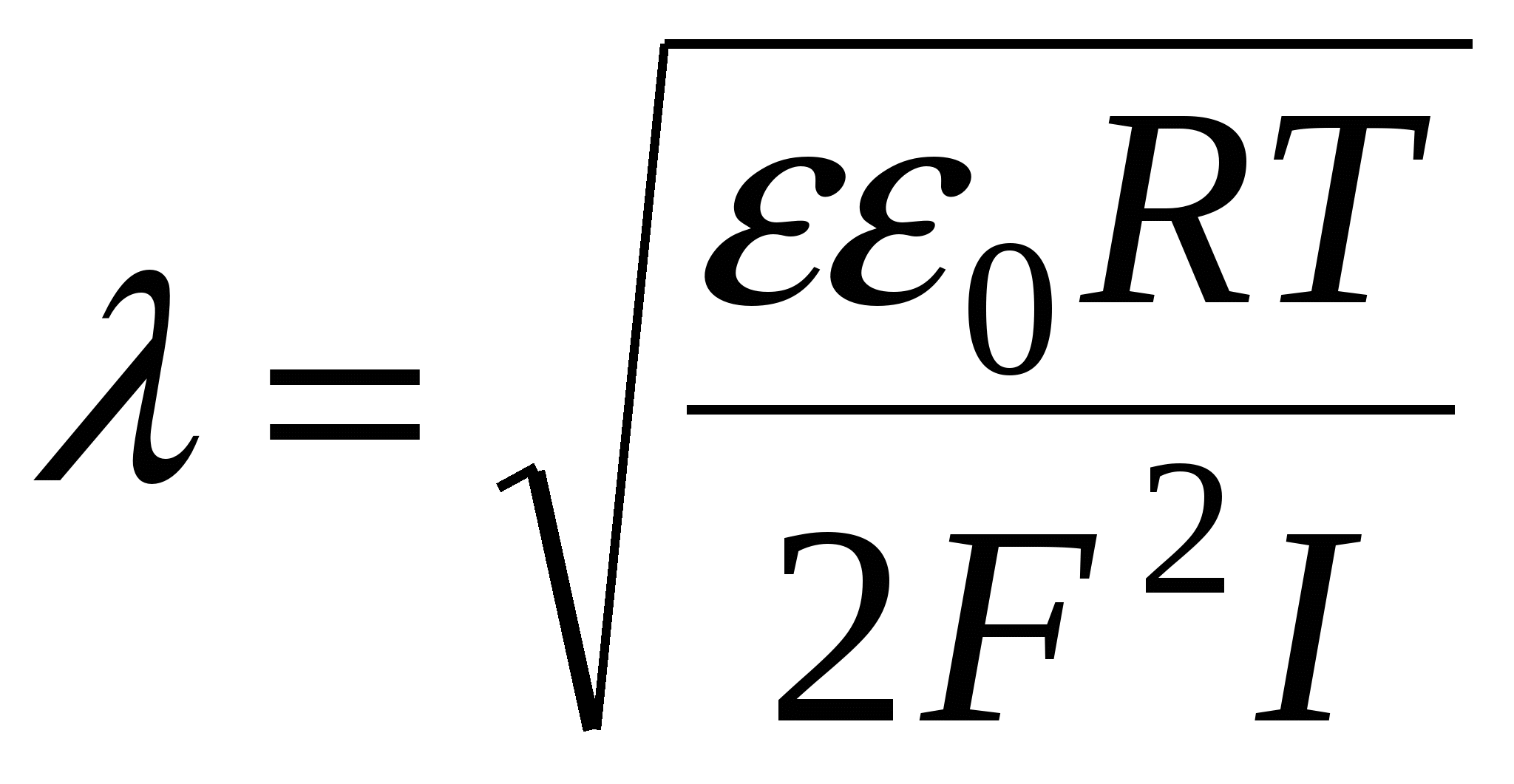 - толщина ДЭС – это расстояние, на котором потенциал ДЭС уменьшается в e раз. - толщина ДЭС – это расстояние, на котором потенциал ДЭС уменьшается в e раз.
Чем меньше температура, тем меньше 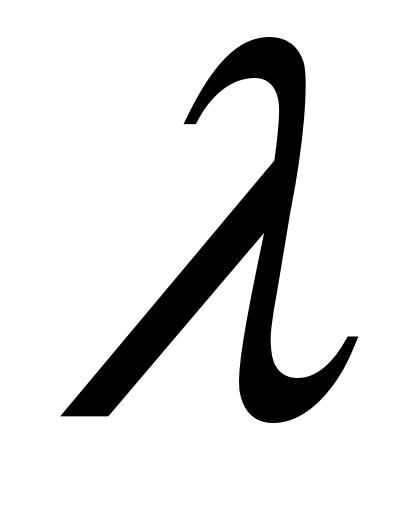 . При Т→0 – плоский ДЭС. Чем больше концентрация, тем больше I, тем меньше . При Т→0 – плоский ДЭС. Чем больше концентрация, тем больше I, тем меньше 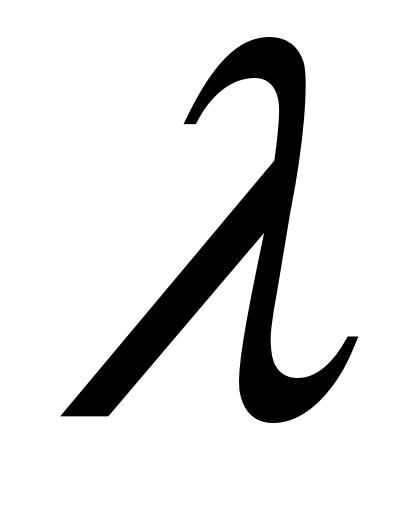 . .
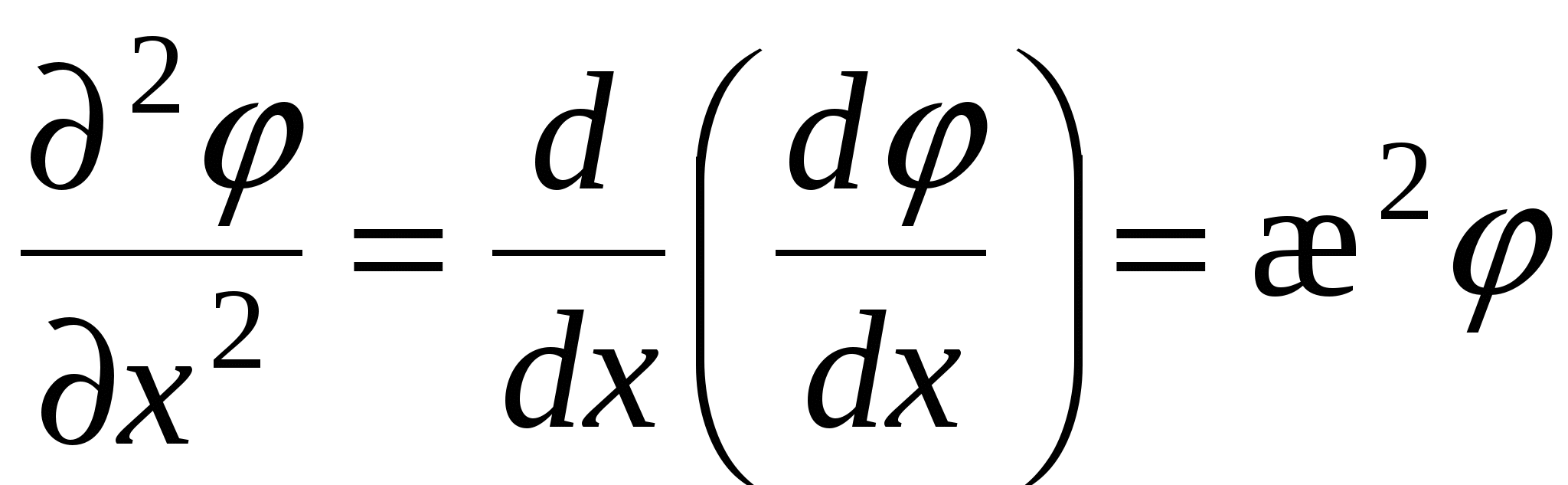
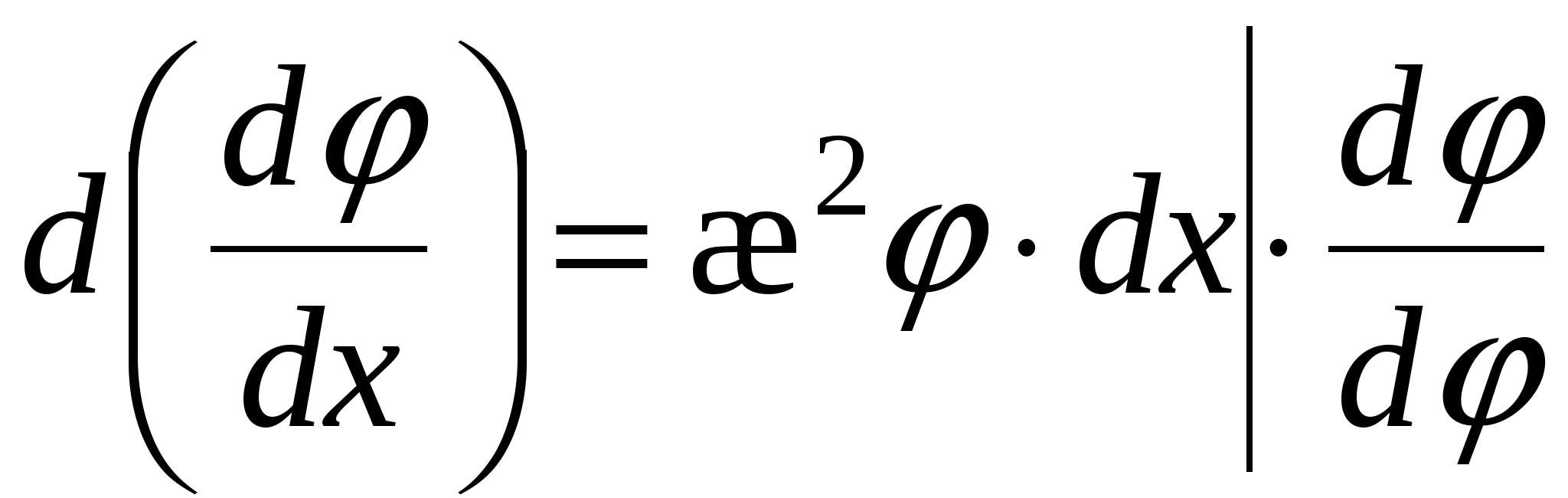
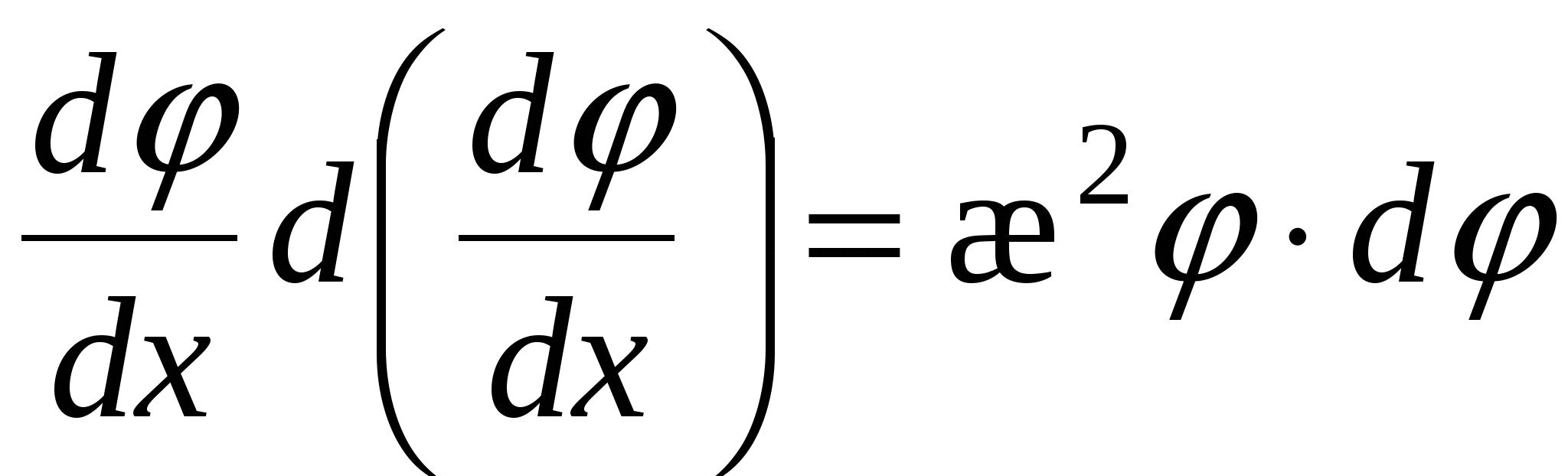
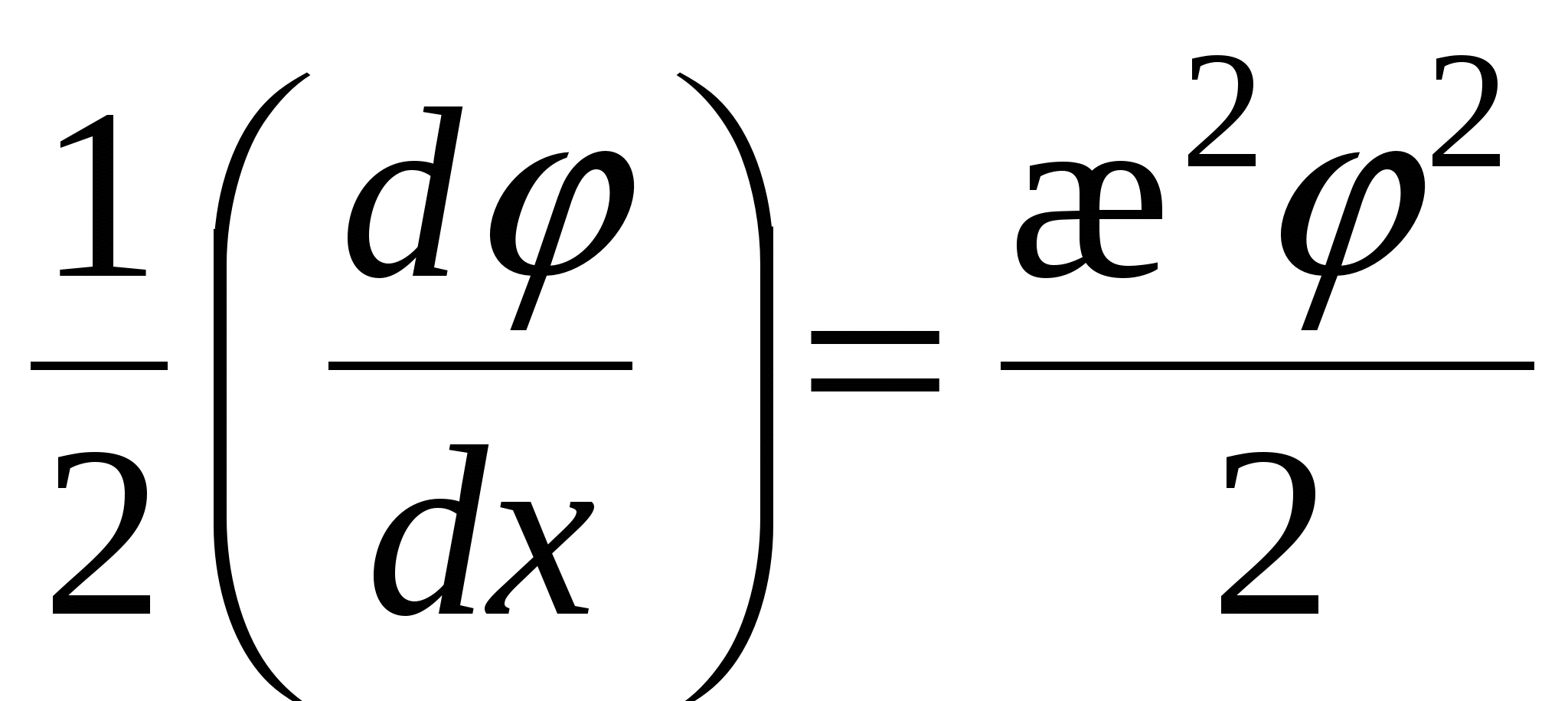
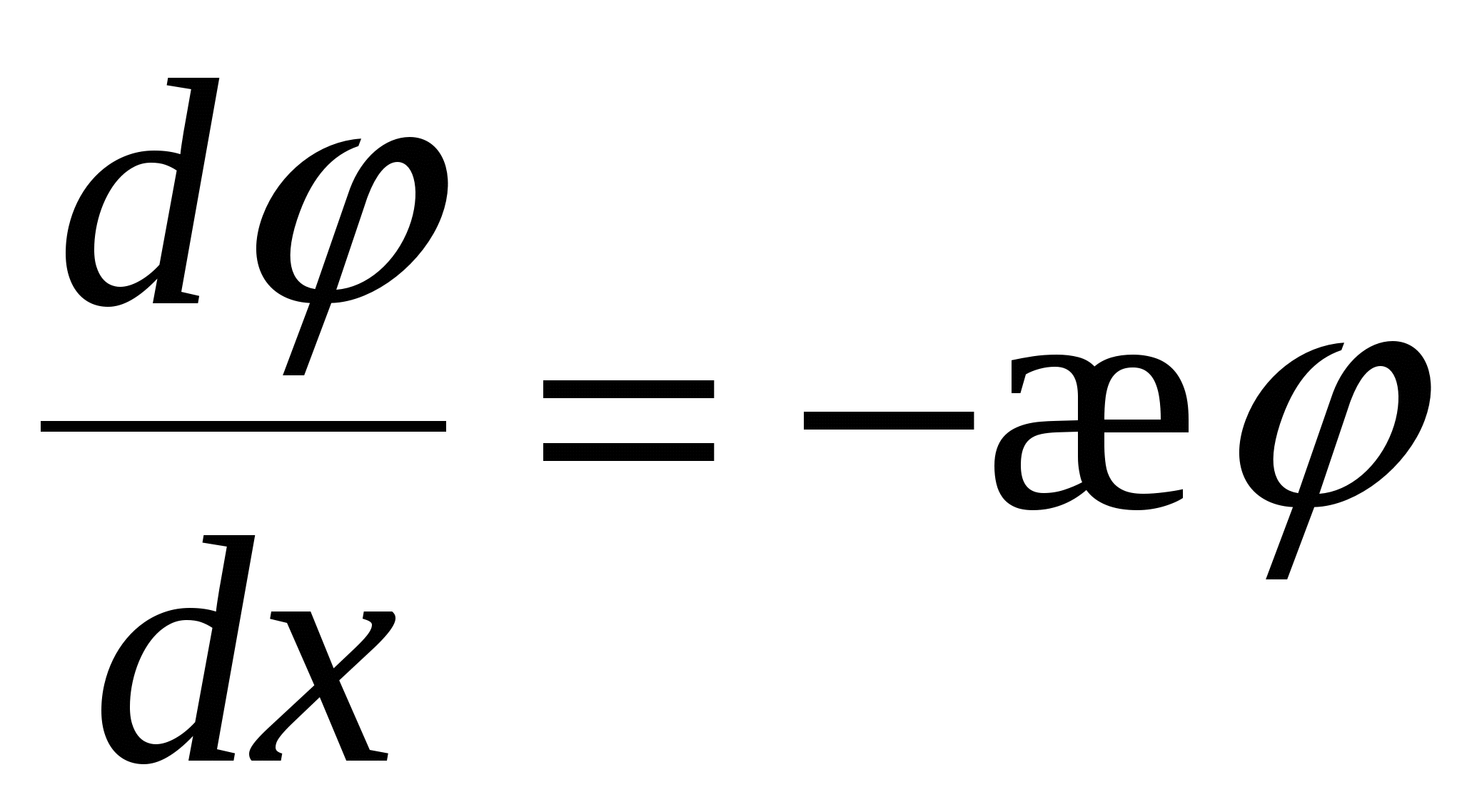  «–» означает, что потенциал с расстоянием уменьшается. => «–» означает, что потенциал с расстоянием уменьшается. =>
=> 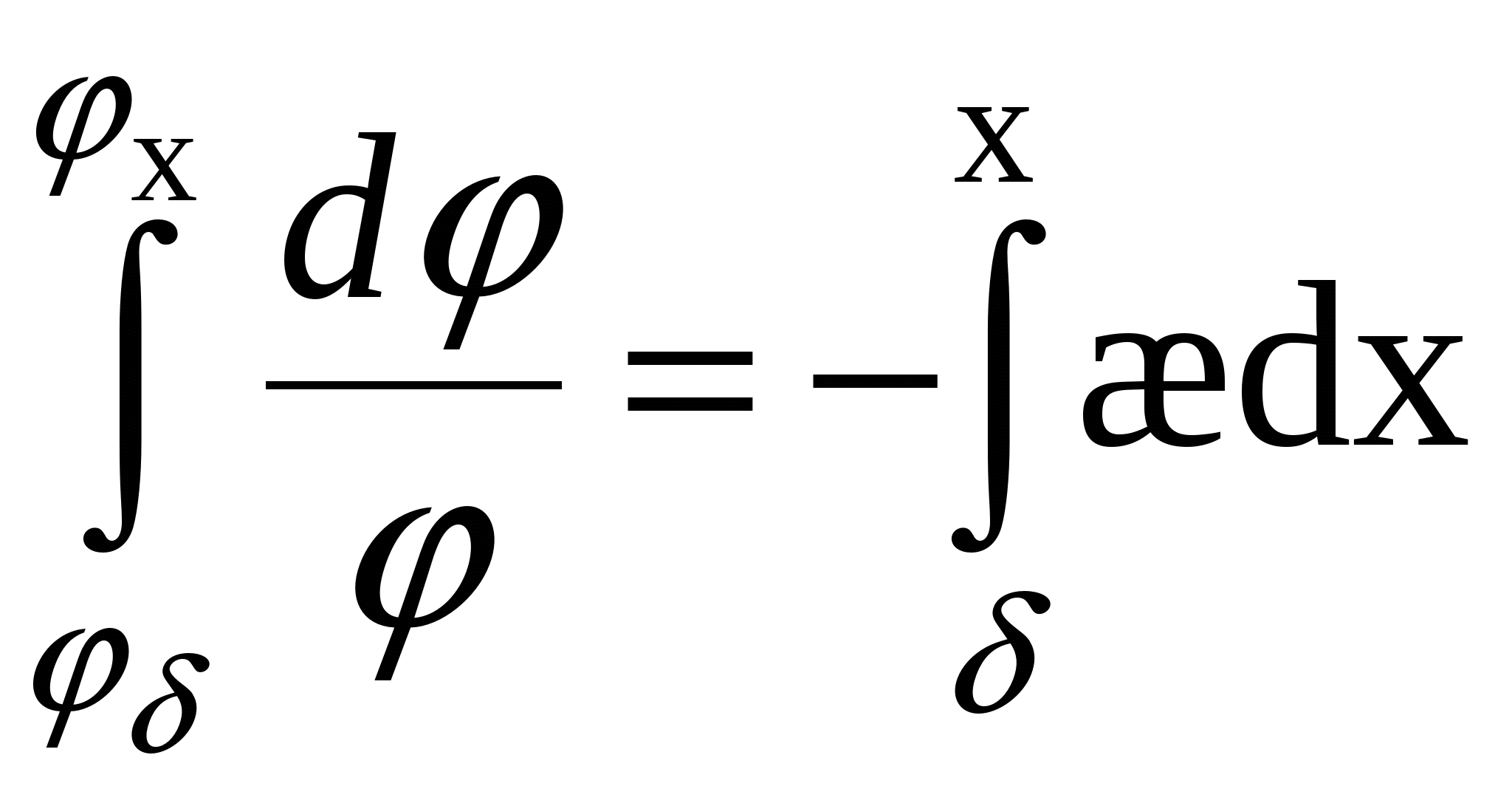
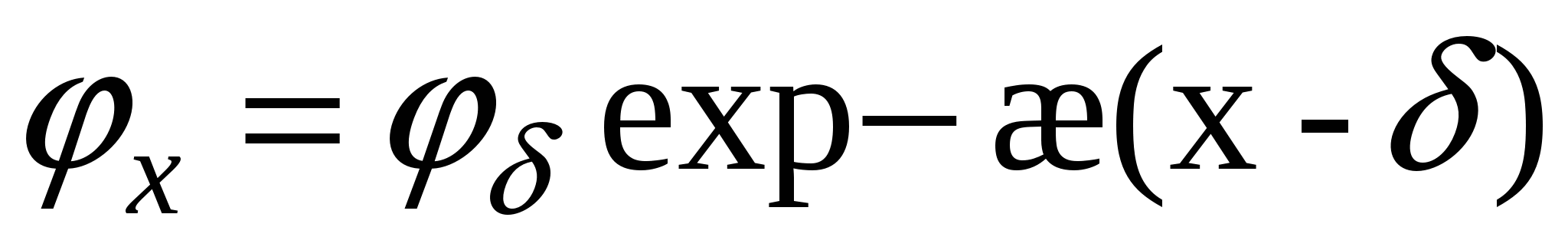
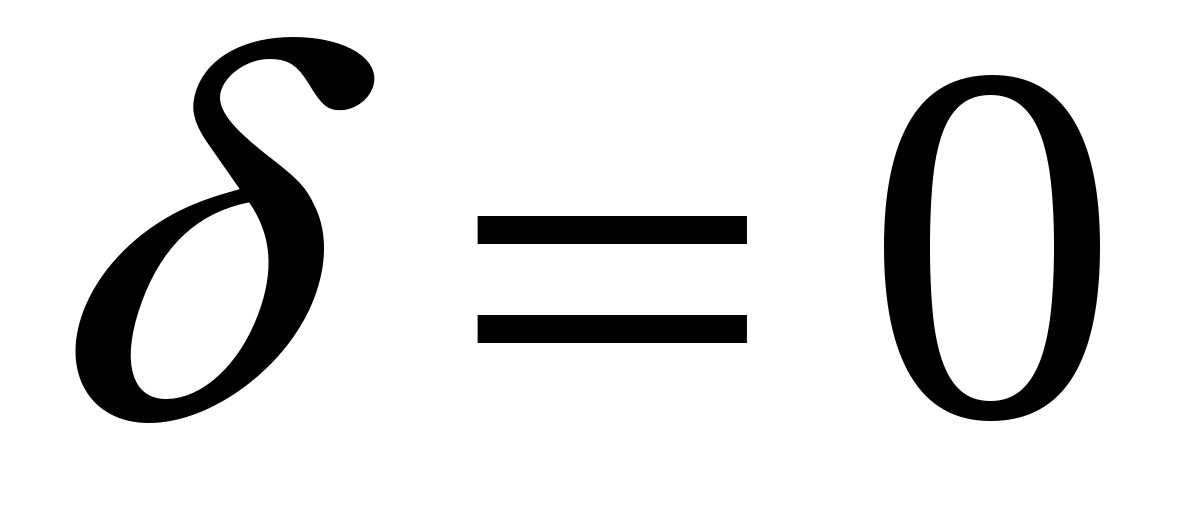 , , 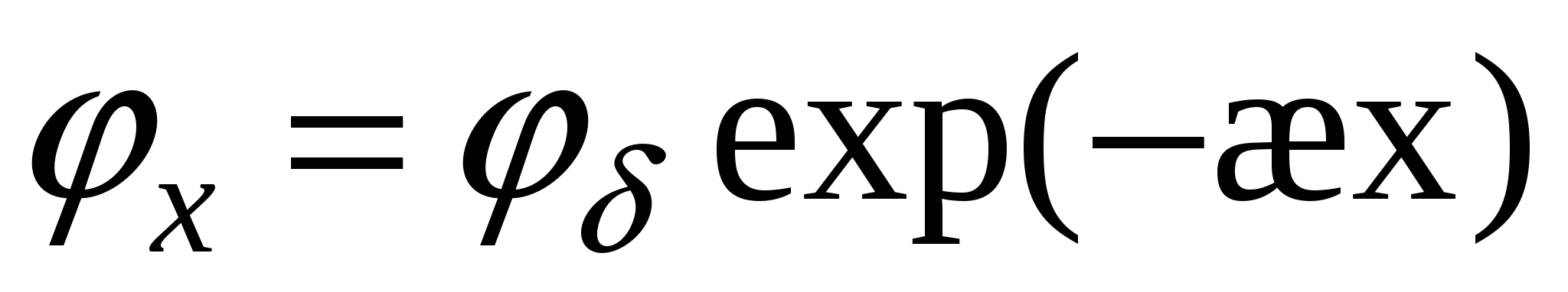 - потенциал экспоненциально уменьшается. - потенциал экспоненциально уменьшается.
Потенциал для поверхностной плотности заряда: 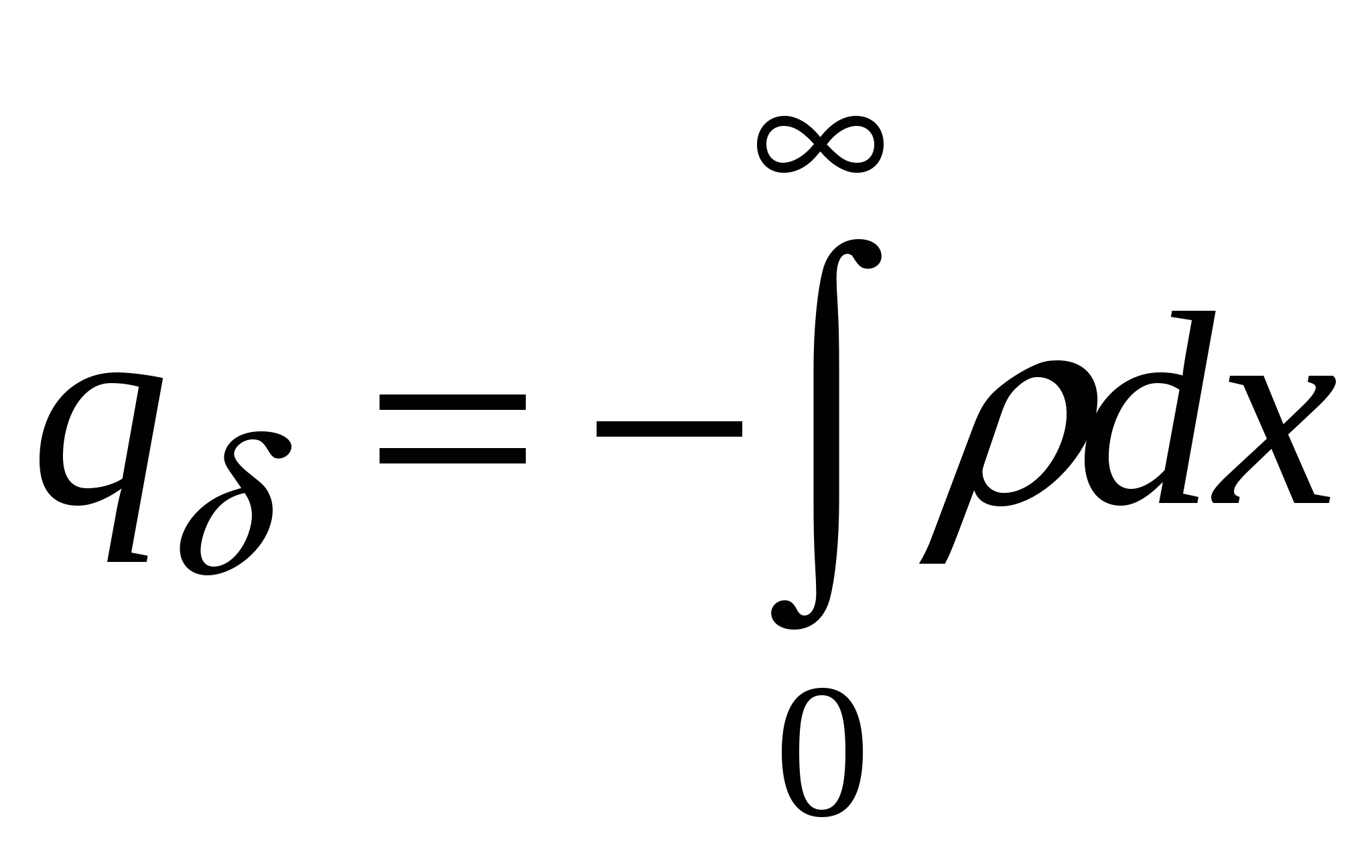
Поверхностный заряд – объемный заряд с противоположным знаком, проинтегрированный по расстоянию.
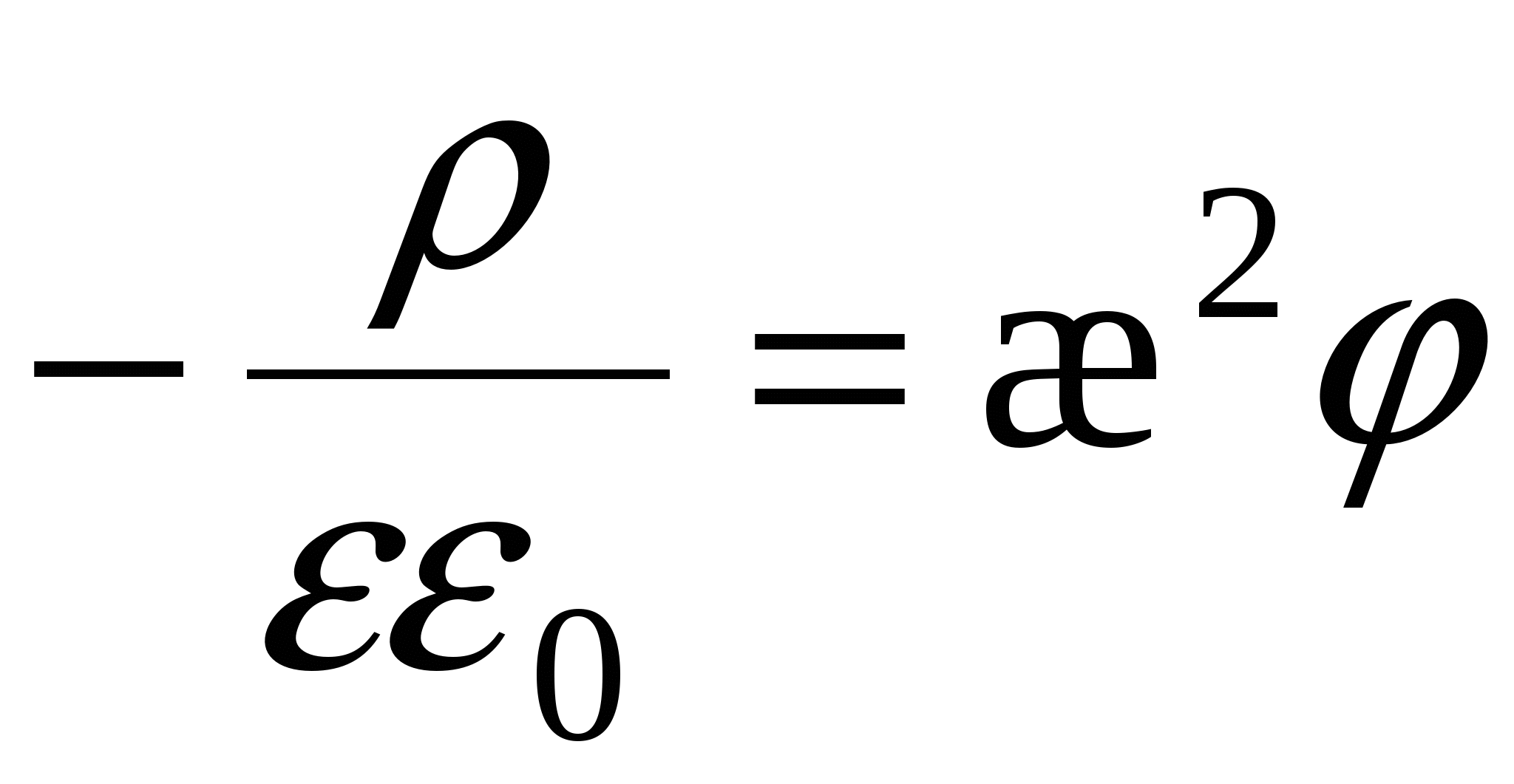  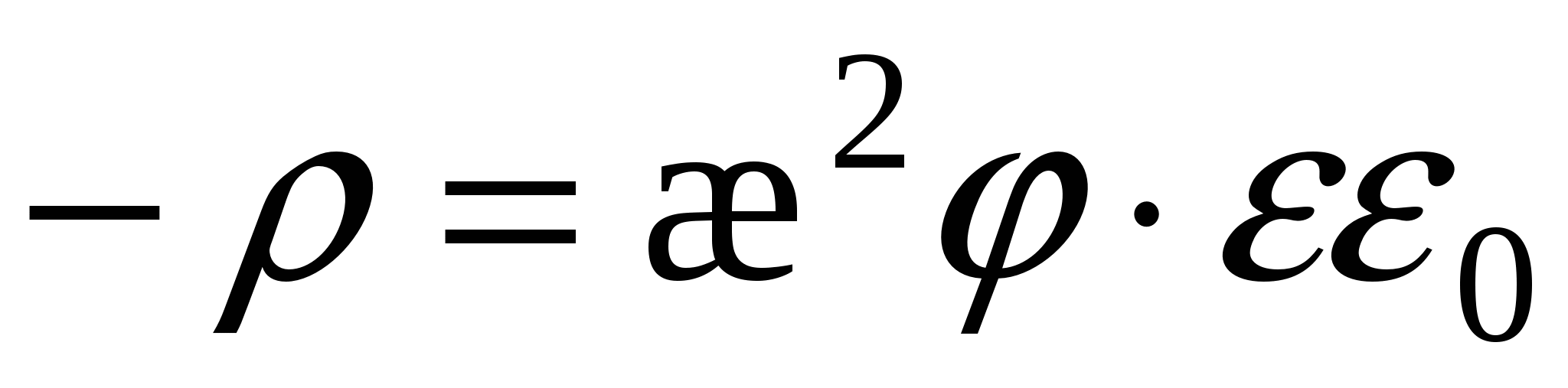
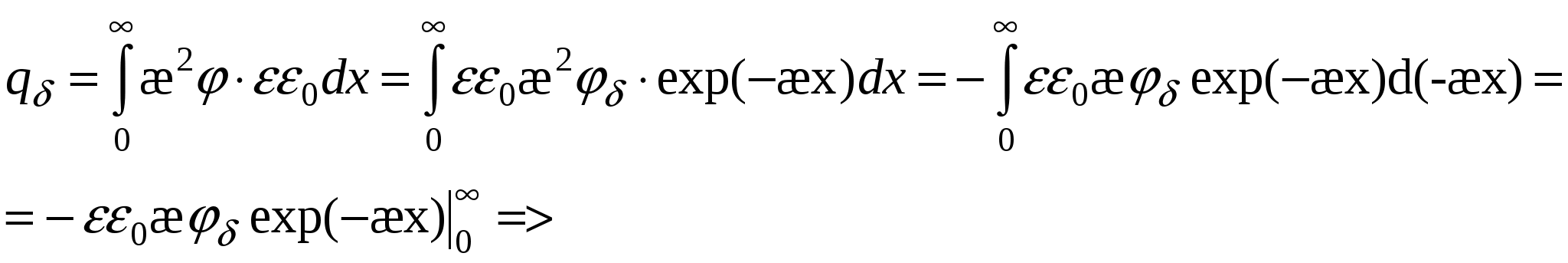
=> 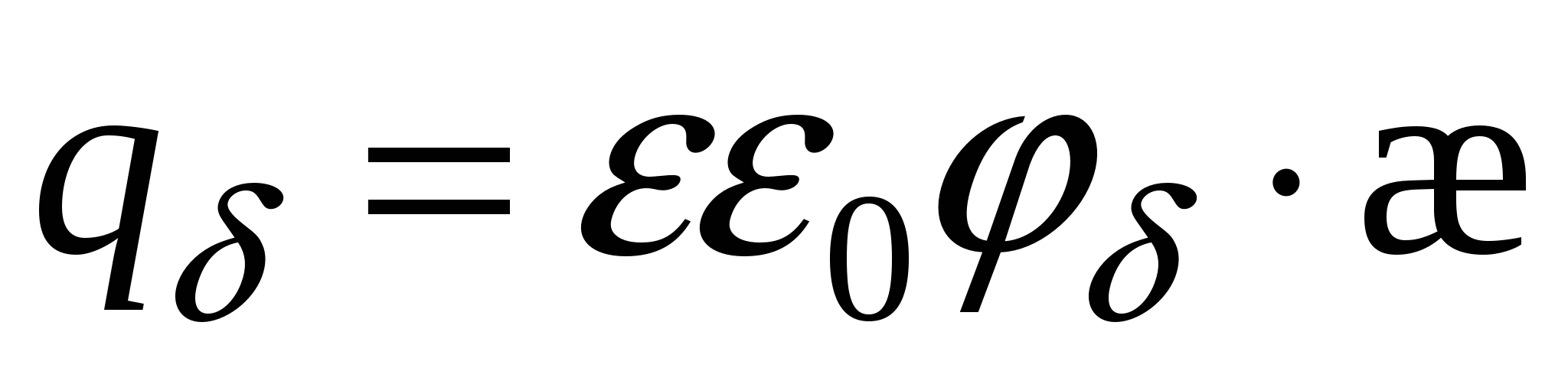
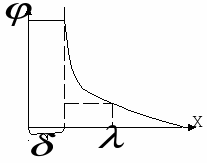
Там, где потенциал уменьшается в 2,7 раза - 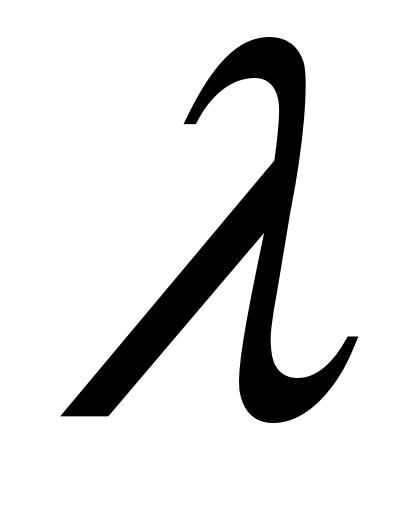
Ёмкость двойного слоя 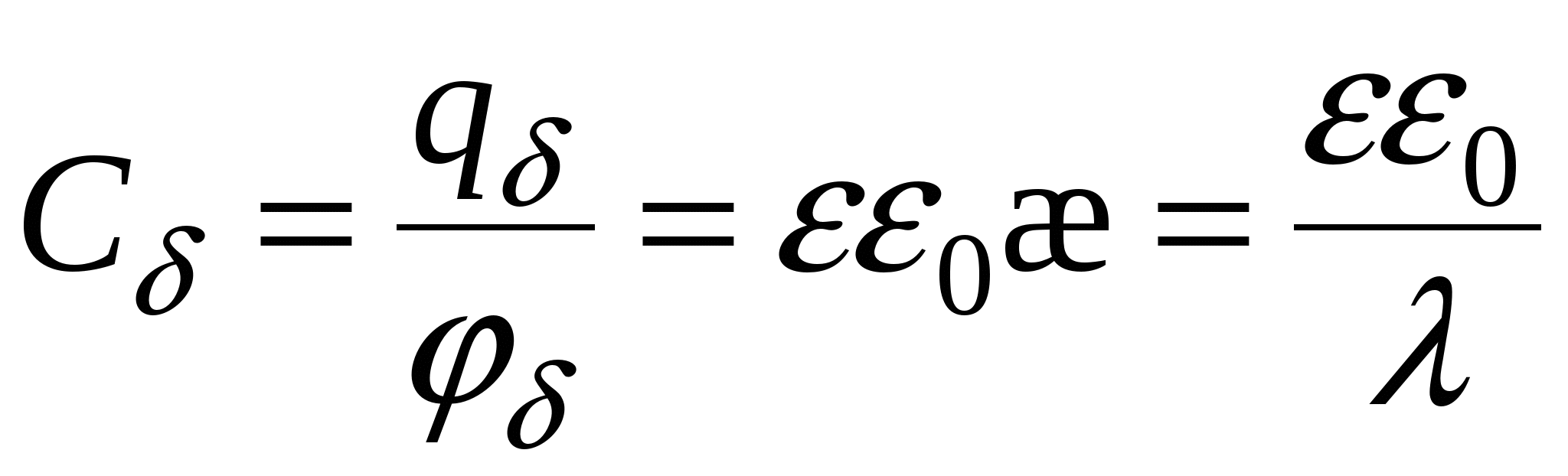
Недостаток теории – не учитывается наличие слоя Гелемгольца, т.е. не учитывает 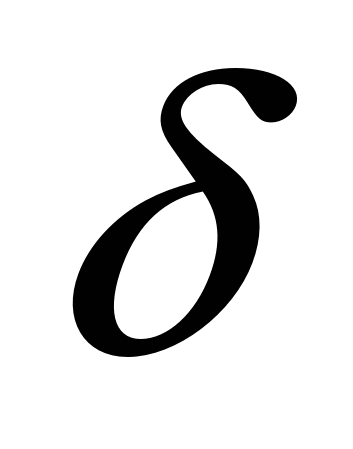 , отсюда ошибки в определении основных параметров. Также не объясняет влияние ионов различной природы на толщину двойного электрического слоя. , отсюда ошибки в определении основных параметров. Также не объясняет влияние ионов различной природы на толщину двойного электрического слоя.
|
|
|
 Скачать 1.77 Mb.
Скачать 1.77 Mb.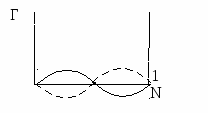 сли
сли  >1, k < 1
>1, k < 1 ассмотрим изменение концентрационного профиля по мере пересечения границы раздела жидкость-газ. Пусть компонент 2 летуч.
ассмотрим изменение концентрационного профиля по мере пересечения границы раздела жидкость-газ. Пусть компонент 2 летуч.  ри
ри 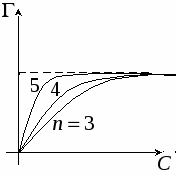 ля гомологического ряда изотерма адсорбции выглядит таким образом:
ля гомологического ряда изотерма адсорбции выглядит таким образом: 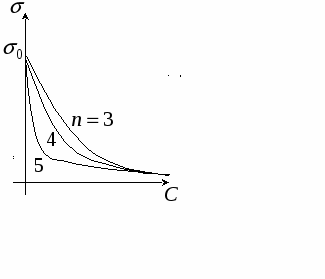

 исло молекул – число агрегации.
исло молекул – число агрегации.
 – инкремент адсорбционного потенциала, работа адсорбции на одно метиленовое звено.
– инкремент адсорбционного потенциала, работа адсорбции на одно метиленовое звено. 

 сли значения
сли значения 
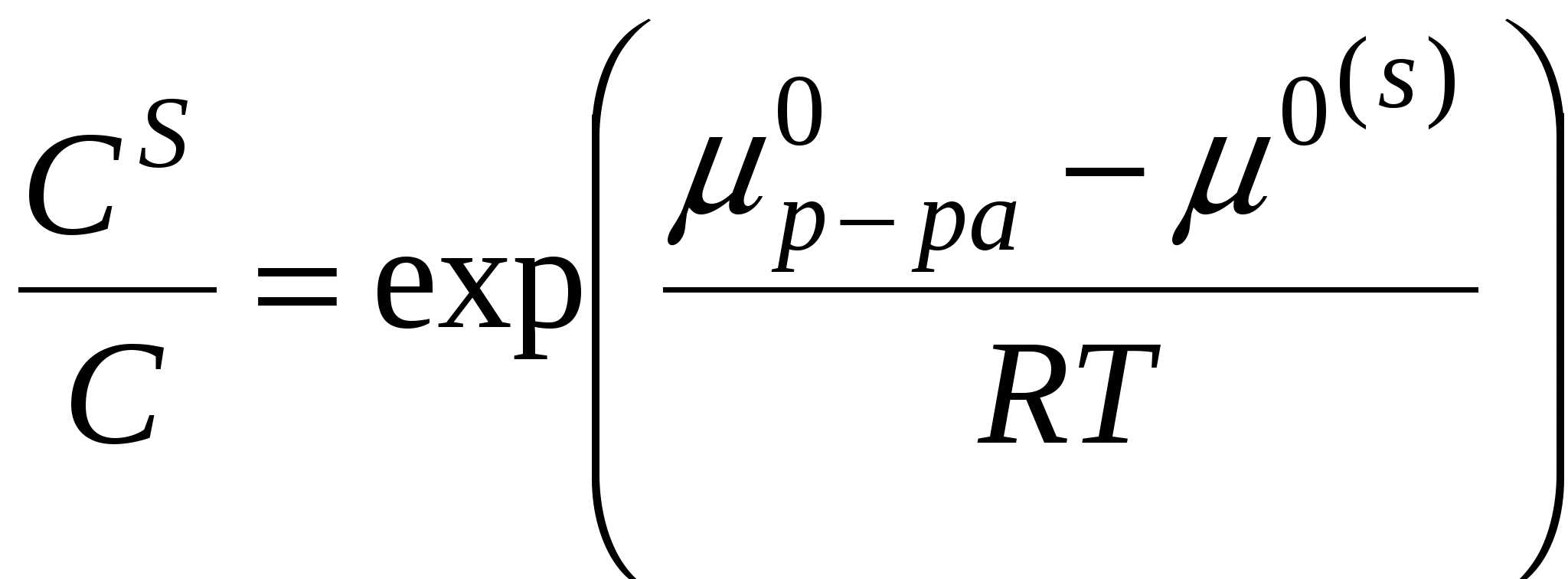


 дсорбционные слои должны обладать двумя характеристиками: вязкость и легкоподвижность, текучесть и упругость.
дсорбционные слои должны обладать двумя характеристиками: вязкость и легкоподвижность, текучесть и упругость.  - треугольник Гиббса,
- треугольник Гиббса, 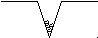 ффект адсорбционной прочности тел.
ффект адсорбционной прочности тел. 
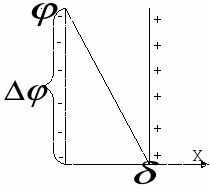 ричина возникновения электрокинетических явлений – это пространственного разделение зарядов и возникновение двойного электрического слоя.
ричина возникновения электрокинетических явлений – это пространственного разделение зарядов и возникновение двойного электрического слоя.