Коллоидная химия. Коллоидная химия Коллоидная химия наука о поверхностных явлениях и дисперсных системах. Поверхностное явление
 Скачать 1.77 Mb. Скачать 1.77 Mb.
|
400-500 нм, окраска будет дополнительная (красная). Если риливать быстро, частицы будут образовывать огрегаты ( |
| Флуоресценция | | Ополисценция |
| | возникновение | |
| Внутримолекулярный процесс | | В результате светорассеяния |
| | вызывается | |
| Узким диапазоном длин волн | | Светом с любой длиной волны |
| | Визуальное различие | |
| Исчезает при использовании светофильтров | | Присутствие светофильтра в проходящем свете |
Эффект Тиндаля – это появление светящегося конуса в проходящем свете.
Особенности:
Светорассеяние уменьшается по мере роста длины волны падающего света;
переход рассеяния в полихромное при увеличении размеров частиц до 25 нм;
Равномерное рассеяние света во всем видимом.
Поверхностные явления.
С
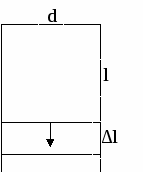 остояние молекул жидкости на поверхности и внутри объема различно. В отличие от твердых тел, молекулы жидкости не закреплены в узлах кристаллической решетки. Молекула в объеме фазы испытывает большее число межмолекулярных взаимодействий по сравнению с молекулой, которая находится на границе раздела фаз. Молекулы, находящиеся у поверхности, обладают избыточной поверхностной энергией. Для того, чтобы образовать единицу поверхности, необходимо совершить работу и разорвать межмолекулярные связи.
остояние молекул жидкости на поверхности и внутри объема различно. В отличие от твердых тел, молекулы жидкости не закреплены в узлах кристаллической решетки. Молекула в объеме фазы испытывает большее число межмолекулярных взаимодействий по сравнению с молекулой, которая находится на границе раздела фаз. Молекулы, находящиеся у поверхности, обладают избыточной поверхностной энергией. Для того, чтобы образовать единицу поверхности, необходимо совершить работу и разорвать межмолекулярные связи.Поверхностное натяжение – это работа образования единицы поверхности в обратимых изотермических условиях.
F2 – сила, действующая на ленку со стороны перемычки.
Опыт Дюпре:
Поверхностное натяжение – это сила, действующая к тангенциальной поверхности и отнесенная к единице длины периметра, ограничивающего эту поверхность.
Обобщенное уравнение I и II законов термодинамики:
Уравнение Гиббса-Гельмгольца.
Для конденсированных систем в условиях V,T=const справедливо: ΔU = ΔG + TΔS.
GS – энергия Гиббса.
Поверхностная энергия не зависит от температуры!
P = const:
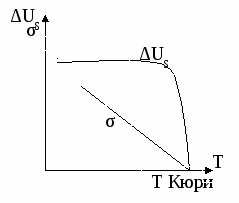
В точке Кюри исчезает поверхность и полная поверхностная энергия обращается в нуль.
Капиллярные явления.
С
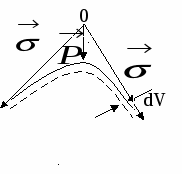 тремление жидкости уменьшить свою поверхностную энергию выражается в появлении кривизны и дополнительного давления.
тремление жидкости уменьшить свою поверхностную энергию выражается в появлении кривизны и дополнительного давления. Для сферы:
К
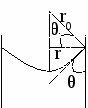 ривизна поверхности может быть положительной и отрицательной.
ривизна поверхности может быть положительной и отрицательной.положительная – центр в жидкой фазе,
отрицательная – центр в газовой фазе.
r0 – радиус кривизны;
r – радиус капилляра
θ – краевой угол смачивания.
Поскольку система стремится сократить свою поверхностную энергию, она всегда будет стараться иметь минимальную поверхность.
Переход из конденсированного состояния в газообразное, n=1 моль, V = Vm = M/ρ
а) T = const
В случае постоянства температуры можно записать, что
P – давление над искривленной поверхностью, РS – давление над плоской пов-тью
Следствия:
положительная кривизна: чем < капля, тем больше давление насыщенных паров
отрицательная кривизна: чем < размер пор, тем < давление или тем легче протекает процесс конденсации в порах.
б) Р = const
 , (
, (Следствие: по мере уменьшения размеров частиц происходит снижение температуры фазового перехода.
Методы определения поверхностной энергии.
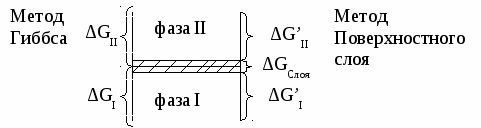
Метод Гиббса:
Метод поверхностного слоя:
За толщину слоя принимают расстояние по обе стороны от границы раздела фаз, за пределами которого поверхностные свойства перестают отличаться от объемных.
Метод поверхностного слоя используется редко, т.к. громоздок.
Смачивание. Растекание.
Кагезия. Адгезия.
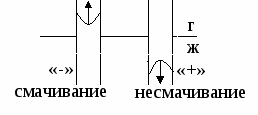
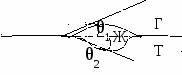
Смачивание – это явление взаимодействия жидкости с твердым или жидким телом при наличии границы раздела трех фаз.
У
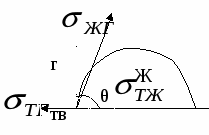 гол между поверхностями ж/г и тв/ж называется краевым углом смачивания (θ).
гол между поверхностями ж/г и тв/ж называется краевым углом смачивания (θ).Для капли, находящейся в состоянии равновесия справедливо:
В зависимости от значения краевого угла, может быть 3 ситуации:
1) θ < 900 – смачивание
2) θ > 900 – несмачивание
3) θ – не устанавливается
Работа растекания – это энергия, которая выделяется при покрытии поверхности тонким слоем жидкости или это сила, действующая к поверхности вдоль всей поверхности контакта.
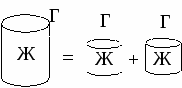
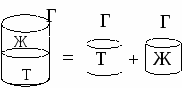
Кагезия – это взаимодействие между частицами одной фазы. Это работа, которую необходимо затратить на разрыв фазы, отнесенная к единице поверхности разрыва.
Работа адгезии затрачивается на образование двух новых поверхностей
А
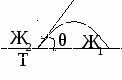 дгезионные силы возникают на расстояниях, сопоставимых с молекулярными. Сила взаимодействия определяется наличием реакционноспособных групп и энергетическим состоянием поверхности.
дгезионные силы возникают на расстояниях, сопоставимых с молекулярными. Сила взаимодействия определяется наличием реакционноспособных групп и энергетическим состоянием поверхности.Угол θ характеризует «фильность» поверхности и откладывается в боле полярную фазу.
Для этой картины условия равновесия:
Теплота смачивания (НСМ) – это количество энергии, которое выделяется при смачивании единицы поверхности.
Для характеристики поверхности используют соотношение:
НВ – теплота смачивания водой, НМ – теплота смачивания поверхности маслом.
Если
Кварц 2, крахмал 20, активированный уголь 0,4
Коэффициент шероховатости – отношение поверхности истинной к поверхности геометрической.
Шероховатость поверхности увеличивает как явление смачиваемости, так и явление несмачиваемости.
Е
 сли поверхность не ровная (шероховатая), возможно установление нескольких краевых углов.
сли поверхность не ровная (шероховатая), возможно установление нескольких краевых углов.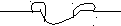
Твердое тело растворяется в жидкости:
Методы измерения поверхностного натяжения.
| Статическое Методы, основанные на изучении статического равновесия
| Полустатические
n 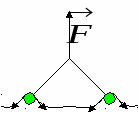 0 – число капель для стандартной жидкости 0 – число капель для стандартной жидкостиnX – для измеряемой 2. Метод Дю-Нуи 3. Метод избыточных давлений. |
Динамические методы: метод колеблющихся струй.
АДСОРБЦИЯ.
Возникает в результате стремления системы уменьшить свою поверхностную энергию
Адсорбцией называется процесс перераспределения компонента между объемной фазой и поверхностным слоем.
В случае химической адсорбции иногда поверхностная энергия может возрастать на фоне общего уменьшения энергии системы.
Адсорбент – более плотная фаза, адсорбат – перераспределяющийся компонент.
Выделяют адсорбцию на границах: Т-Г, Т-Ж, Ж-Г.
Для характеристики адсорбции применяют две величины:
А – полная адсорбция – это количество адсорбата в поверхностном слое, отнесенное к единице массы или площади адсорбента. Может измеряться в моль/м2, моль/кг, г/кг и т.д.
Г – «гамма» - избыточная адсорбция (гипсовская) – это избыток адсорбата в поверхностном слое по сравнению с таким же объемом фазы, отнесенной к единице поверхности или массы адсорбента.
Г<А
Десорбция – это процесс, обратный адсорбции.
Помимо химической адсорбции существует адсорбция физическая, которая отличается меньшей прочностью связей.
Физическая адсорбция осуществляется за счет действия сил Ван-дер-Ваальса:
| Дисперсионное взаимодействие (Силы Лондона) Всеобщие. Флуктуация электронной плотности в одном атоме порождает флуктуация электронной плотности в другом. (неполярное-неполярное) | Электростатическое взаимодействие (силы Кеезона) 2 диполя ориентируются по отношению друг к другу определенным образом. (полярное-полярное) | Индукционное взаимодействие (силы Дебая) Дипольный момент в полярном веществе индуцирует дипольный момент в неполярном. (полярное- неполярное) |
Взаимодействия при физической адсорбции.
В случае взаимодействия двух атомов:
U
 – энергия взаимодействия;
– энергия взаимодействия;U = UПРИТЯЖ. + UОТТАЛК.
В случаях взаимодействия атомов с твердой поверхностью, необходимо провести суммирование всех взаимодействий.
х
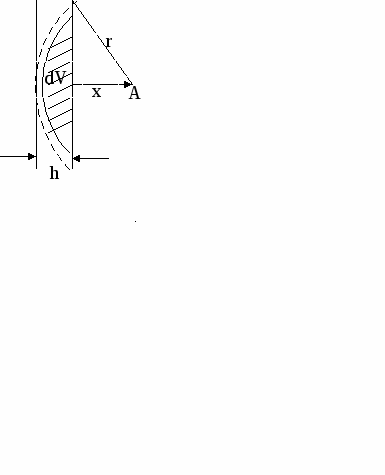 – расстояние до поверхности
– расстояние до поверхностиr – радиус действия сил притяжения
h = r – x
dV – объем
n – число молекул поверхности
UАДС. – энергия адсорбционного взаимодействия
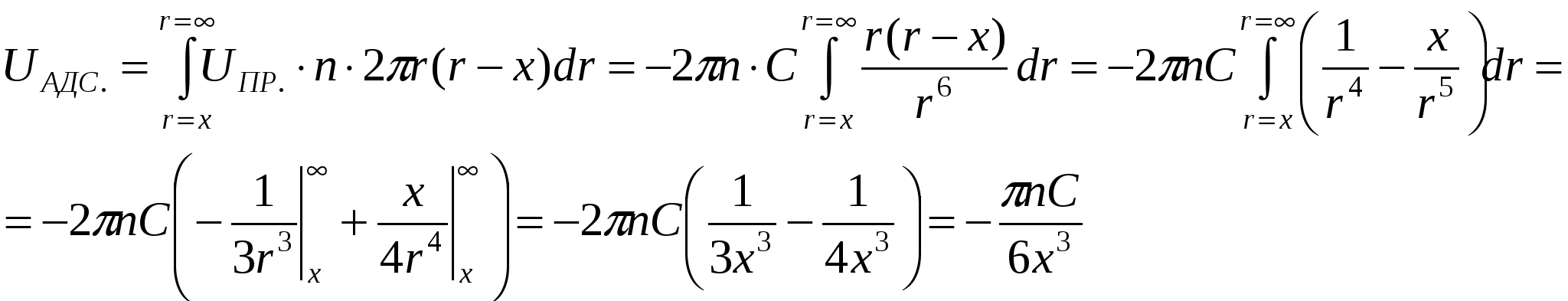
В случае адсорбции притяжение усиливается. И в случае при взаимодействии типа неполярное-неполярное адсорбция преимущественно локализуется в углублениях.
Электростатическое взаимодействие.
Полярный адсорбент – неполярный адсорбат
Неполярный адсорбент – полярный адсорбат
Полярный адсорбент – полярный адсорбат.
М
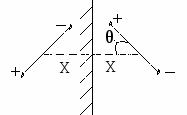 олекулу адсорбата представляют как диполь, а адсорбента – как проводник, в котором молекула адсорбата индуцирует диполь зеркально симметрично по отношению к данному.
олекулу адсорбата представляют как диполь, а адсорбента – как проводник, в котором молекула адсорбата индуцирует диполь зеркально симметрично по отношению к данному.X – расстояние до середины
При взаимодействии возникает потенциал:
Потенциал стремится принять максимальное значение, т.е. диполи стремятся сориентироваться перпендикулярно к поверхности.
Поскольку повышение температуры способствует росту Броуновского движения, оно приводит к торможению процесса адсорбции.
В случае электростатического взаимодействия адсорбат преимущественно локализуется на выступах.
Фундаментальное адсорбционное уравнение.
В случае адсорбции происходит перераспределение компонента, а значит, изменяется химический потенциал. Процесс адсорбции можно рассматривать как переход поверхностной энергии в химическую.
Объем слоя = 0, тогда обобщенное уравнение I и II закона термодинамики:
T = const; (1) = (2) =>
Для двухкомпонентной системы:
=>
Для случая адсорбции тв. тело – газ:
Изотерма, изопикна, изостера связаны друг с другом.
Т.к. адсорбция функция
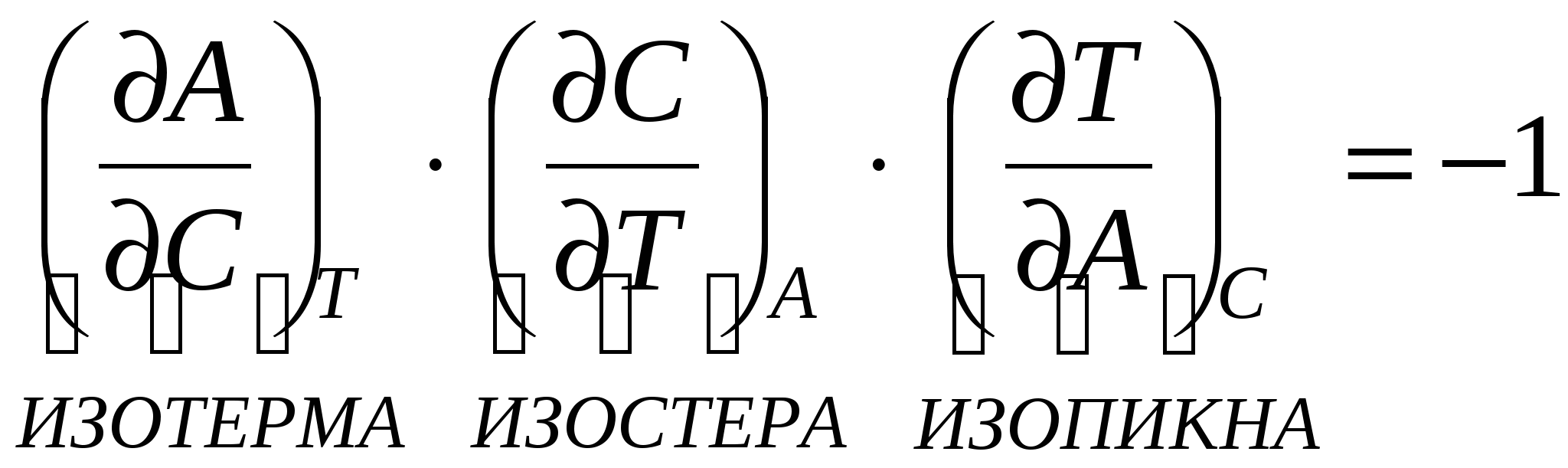
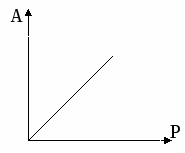
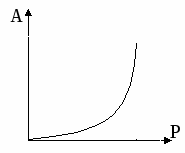
Изотерма Генри Изотерма Лангмюра
Термодинамика. Адсорбция.
Для конденсированных сред:
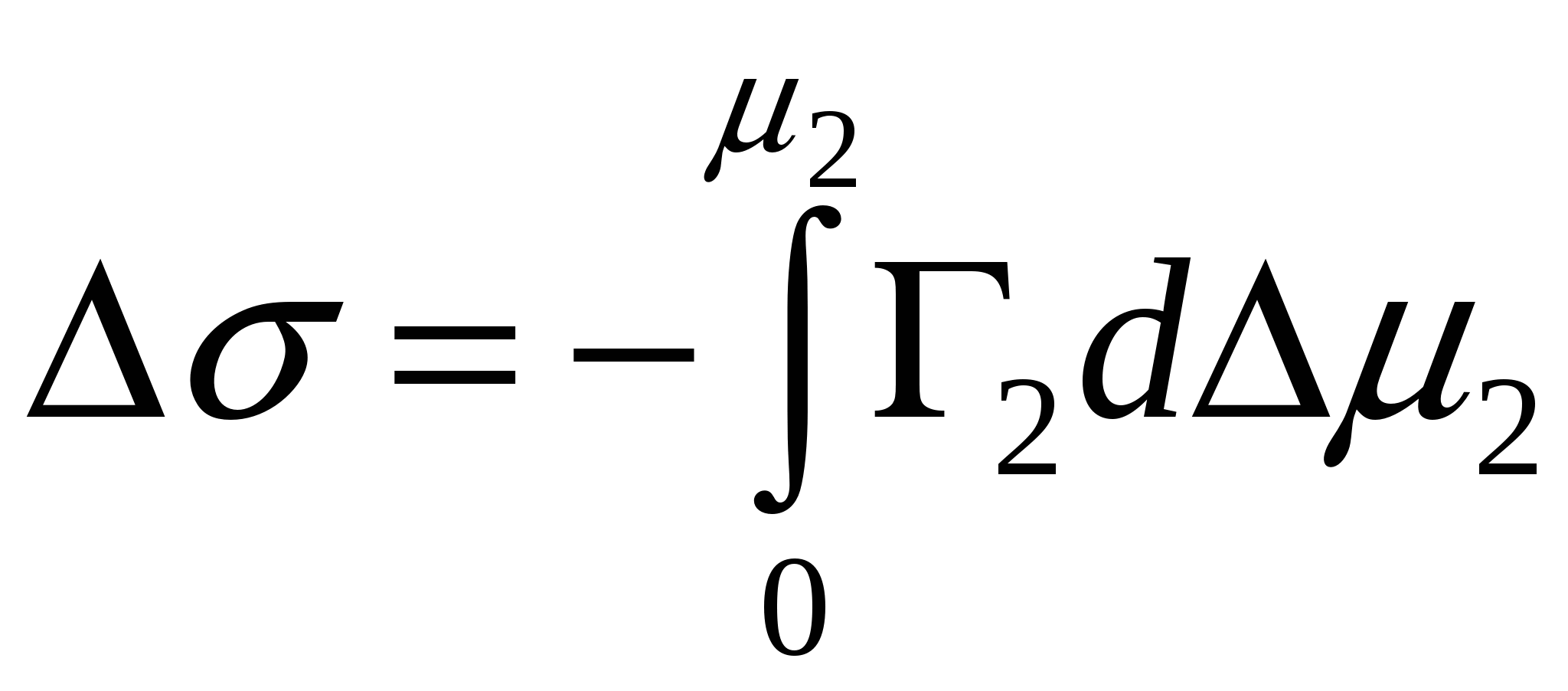
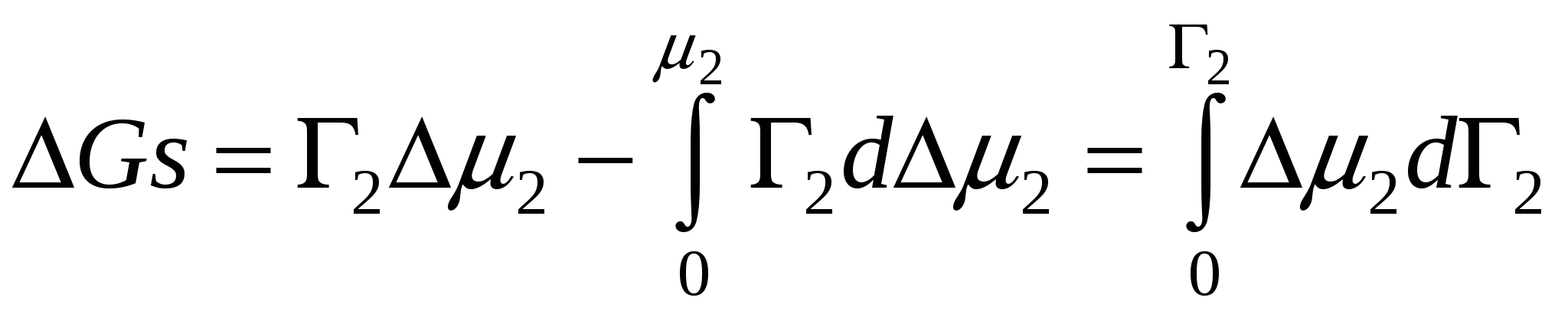 - интегральное изменение энергии Гиббса.
- интегральное изменение энергии Гиббса.P–давление над искривленной поверхностью, РS –давление над плоской поверхностью
Дифференциальное изменение энтрапии
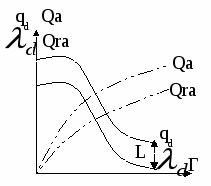 ,
, 
Qa – интегральная теплота адсорбции,
Qra – интегральная чистая теплота адсорбции,
Уравнение Генри
Исследование адсорбции затрудняется неоднородностью поверхности, поэтому простейшие закономерности получают для однородных поверхностей.
Рассмотрим взаимодействие газов с твердой поверхностью, когда осуществляется переход газа из равновесного состояния в объеме в равновесное состояние на поверхности. Этот случай аналогичен равновесию газов в поле силы тяжести.
В процессе адсорбции происходит изменение химических потенциалов.
Для объемной фазы:
Для газа на поверхности:
В состоянии равновесия
В уравнении Генри константа не зависит от концентрации
У
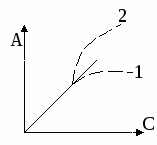 равнение Генри выполняется в области низких давлений и концентраций. По мере роста концентрации возможны 2 типа отклонений от закона Генри:
равнение Генри выполняется в области низких давлений и концентраций. По мере роста концентрации возможны 2 типа отклонений от закона Генри: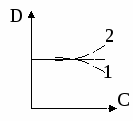
1 – положительные отклонения, D уменьшается, А уменьшается
2 – отрицательные отклонения, D – возрастает, А – возрастает.
Тип отклонения определяется преобладанием тот или иного типа взаимодействия адсорбент-адсорбат.
При сильном адгезионном взаимодействии коэффициенты активности возрастают – положительное отклонение. В случае когезионных взаимодействий наблюдаются отрицательные отклонения.

 - Двулучеприломление.
- Двулучеприломление.