|
|
Коллоидная химия. Коллоидная химия Коллоидная химия наука о поверхностных явлениях и дисперсных системах. Поверхностное явление
Теория быстрой коагуляции Смолуховского.
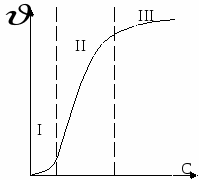
Зависимость скорости коагуляции от концентрации электролита.
I – скорость коагуляции мала,
II – скорость коагуляции практически пропорциональна концентрации электролита.
III – область быстрой коагуляции, скорость практически не зависит от концентрации.
Основные положения:
Исходный золь монодисперсный, сходные частицы имеют сферическую форму.
Все столкновения частиц результативны.
При столкновении двух первичных частиц образуется вторичная. Вторичная + первичная = третичная. Первичное, вторичное, третичное – кратность.
В терминах химической кинетики процесс коагуляции может быть описан уравнением:
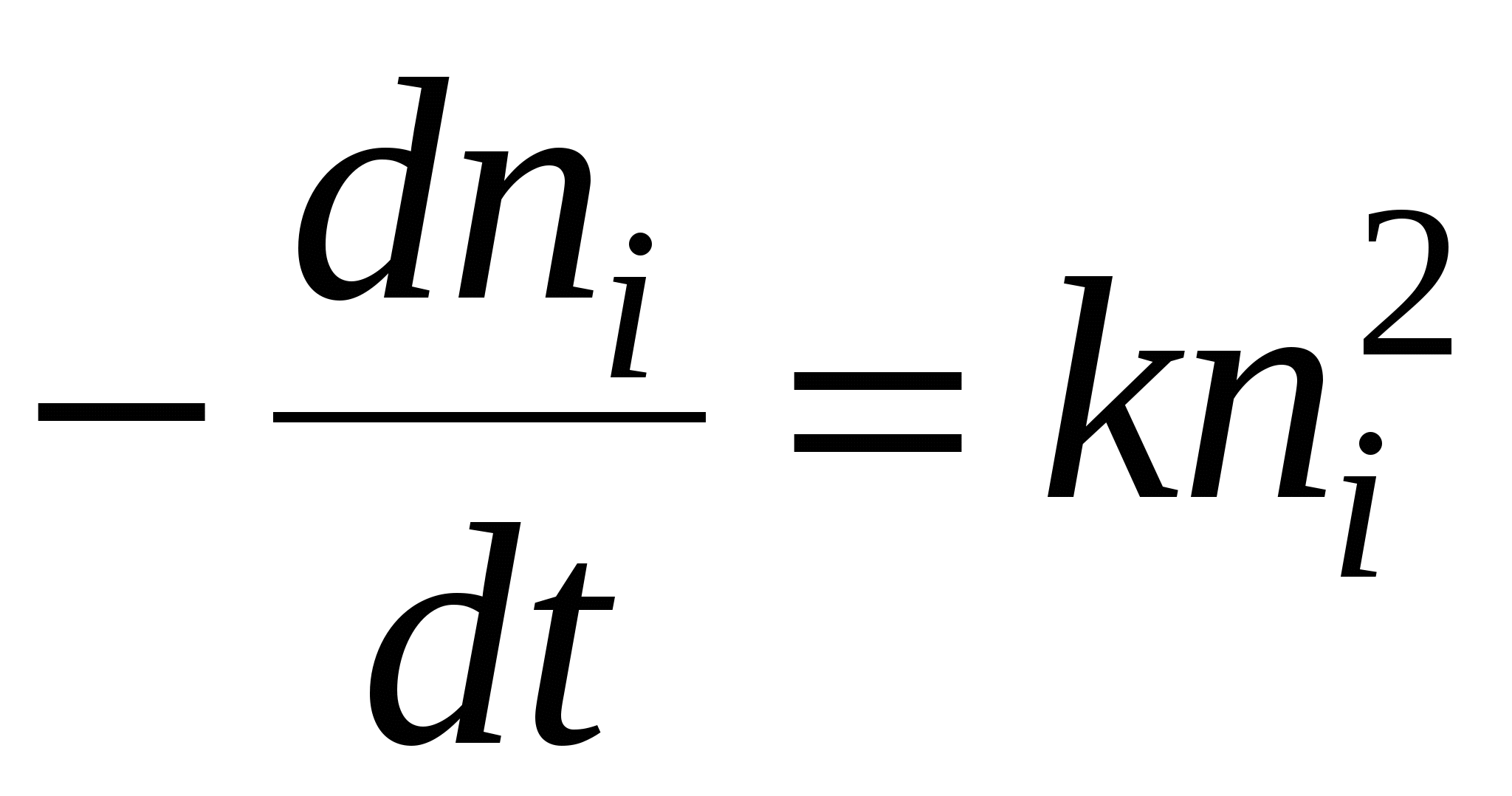
Решением будет уравнение: 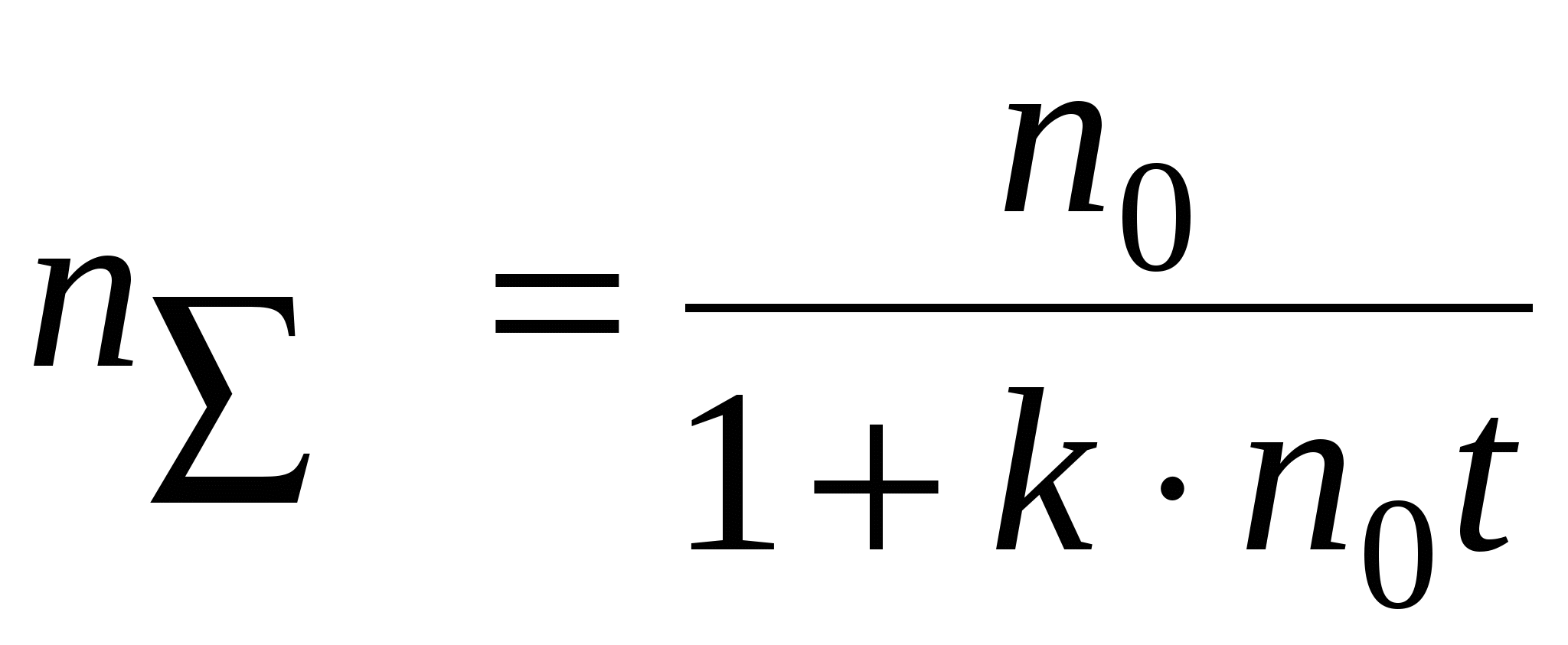
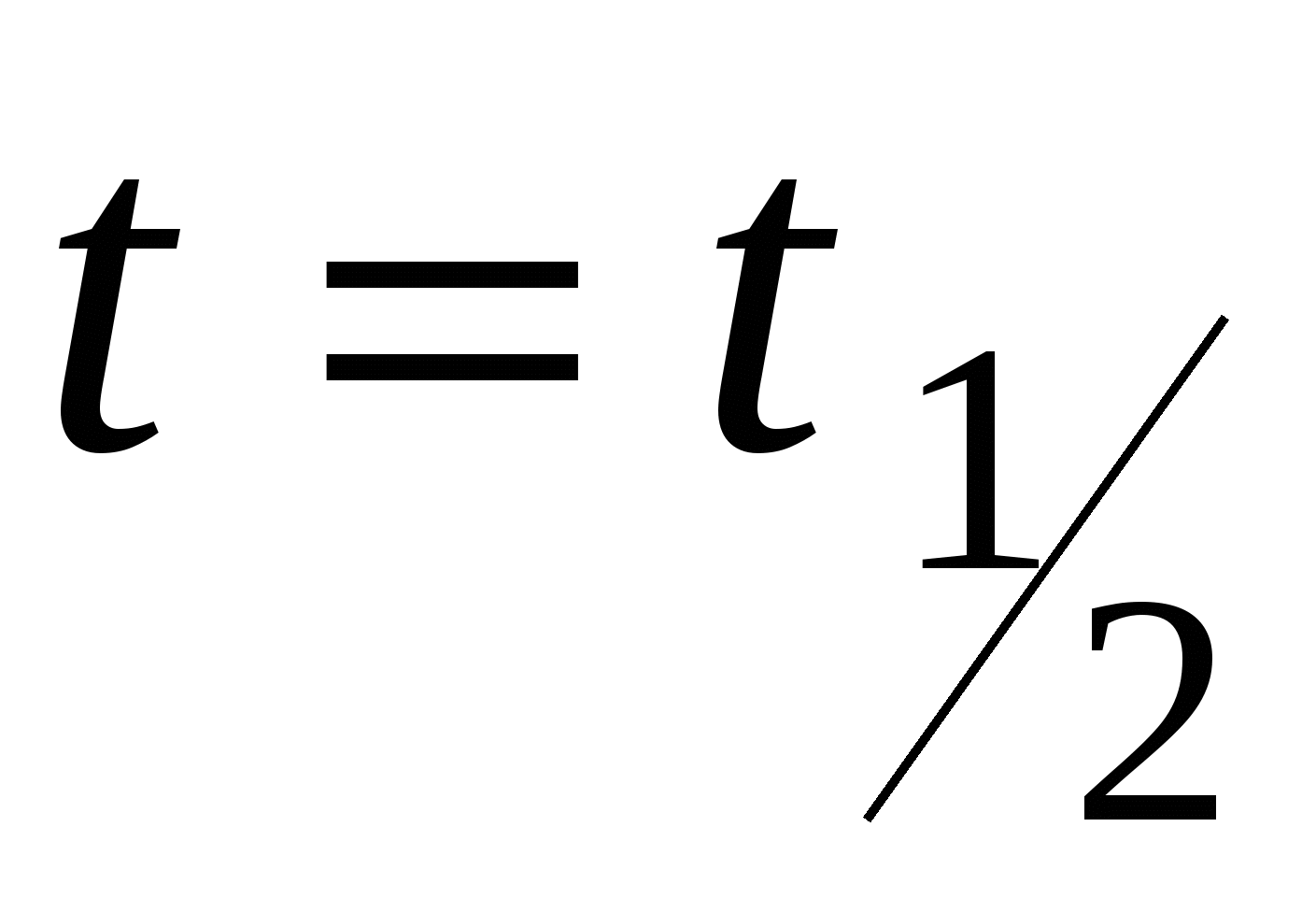 - время половинной коагуляции. Это время, в течение которого число частиц золя уменьшается в 2 раза. - время половинной коагуляции. Это время, в течение которого число частиц золя уменьшается в 2 раза.
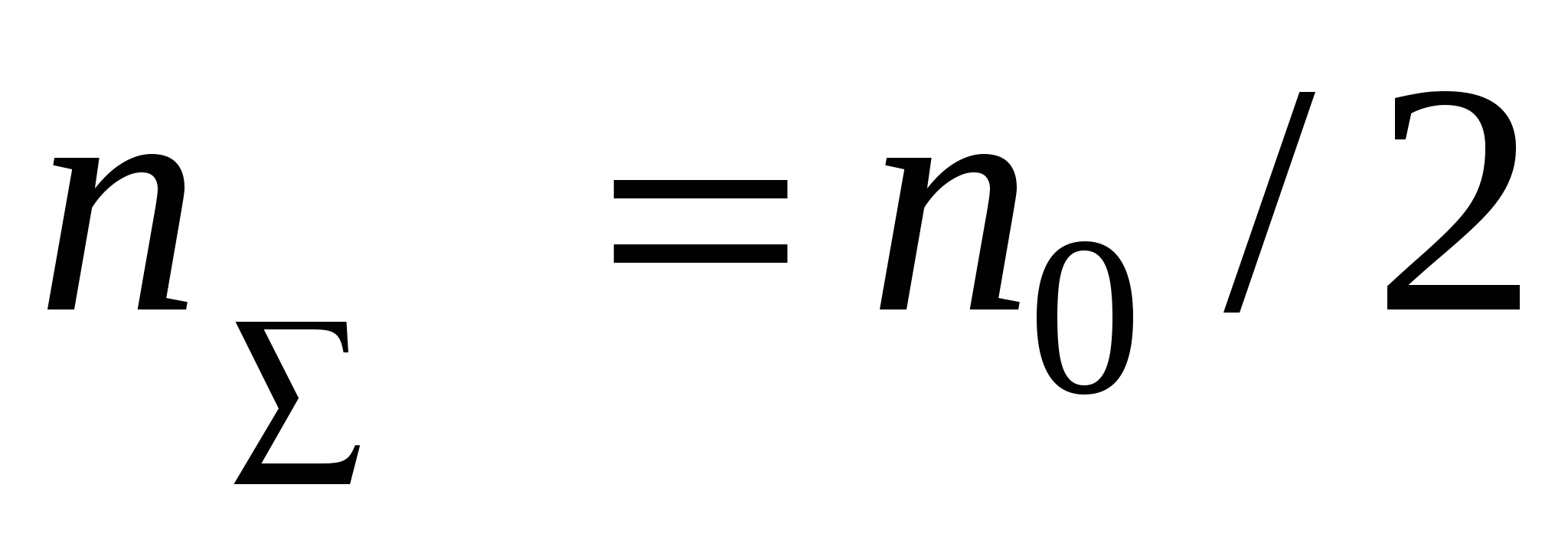
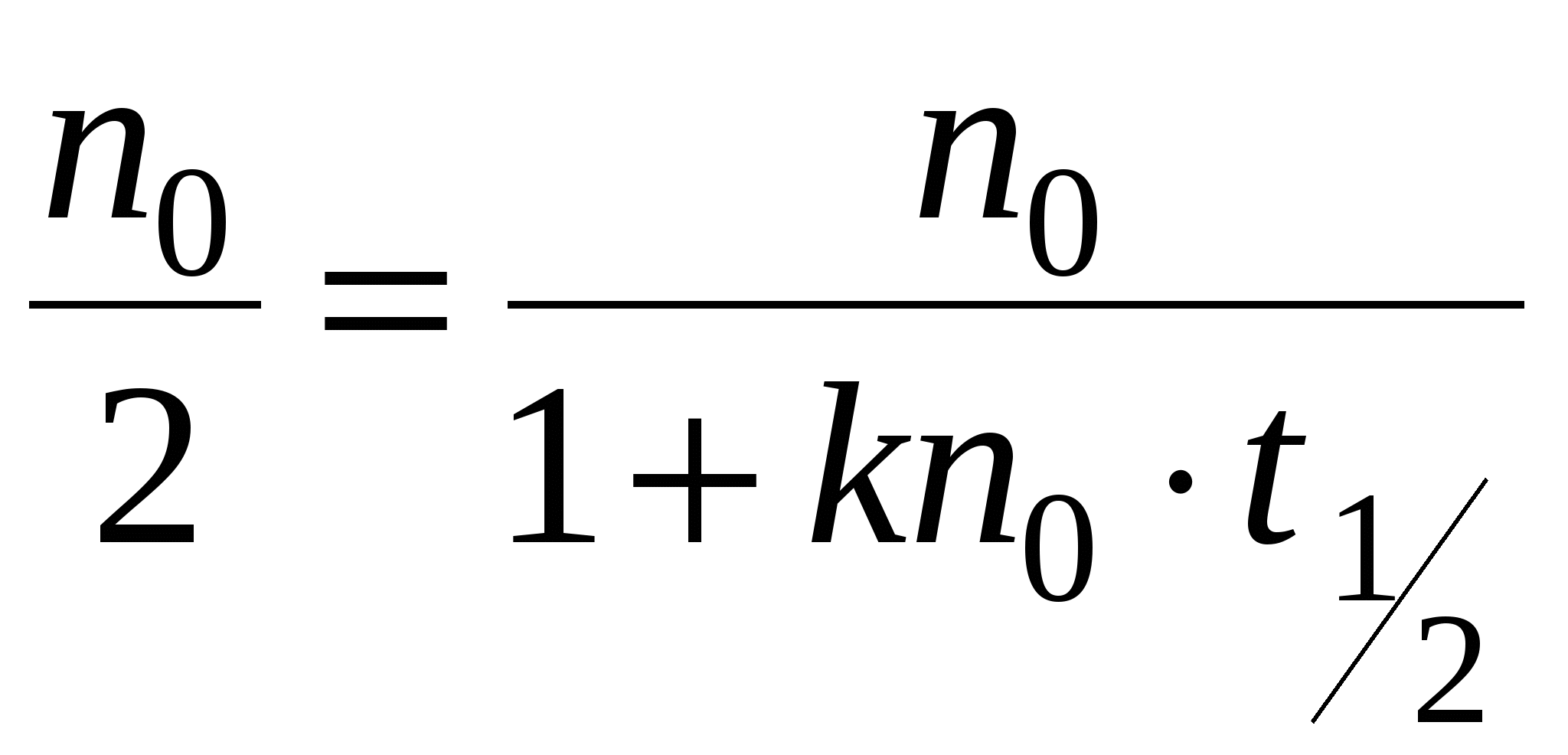 , , 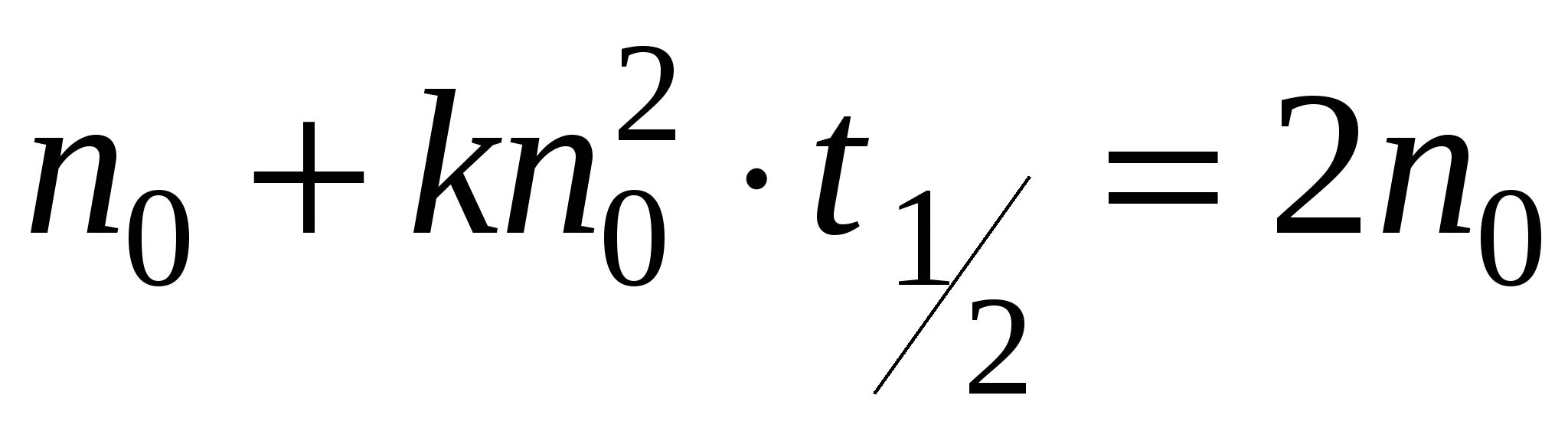 , , 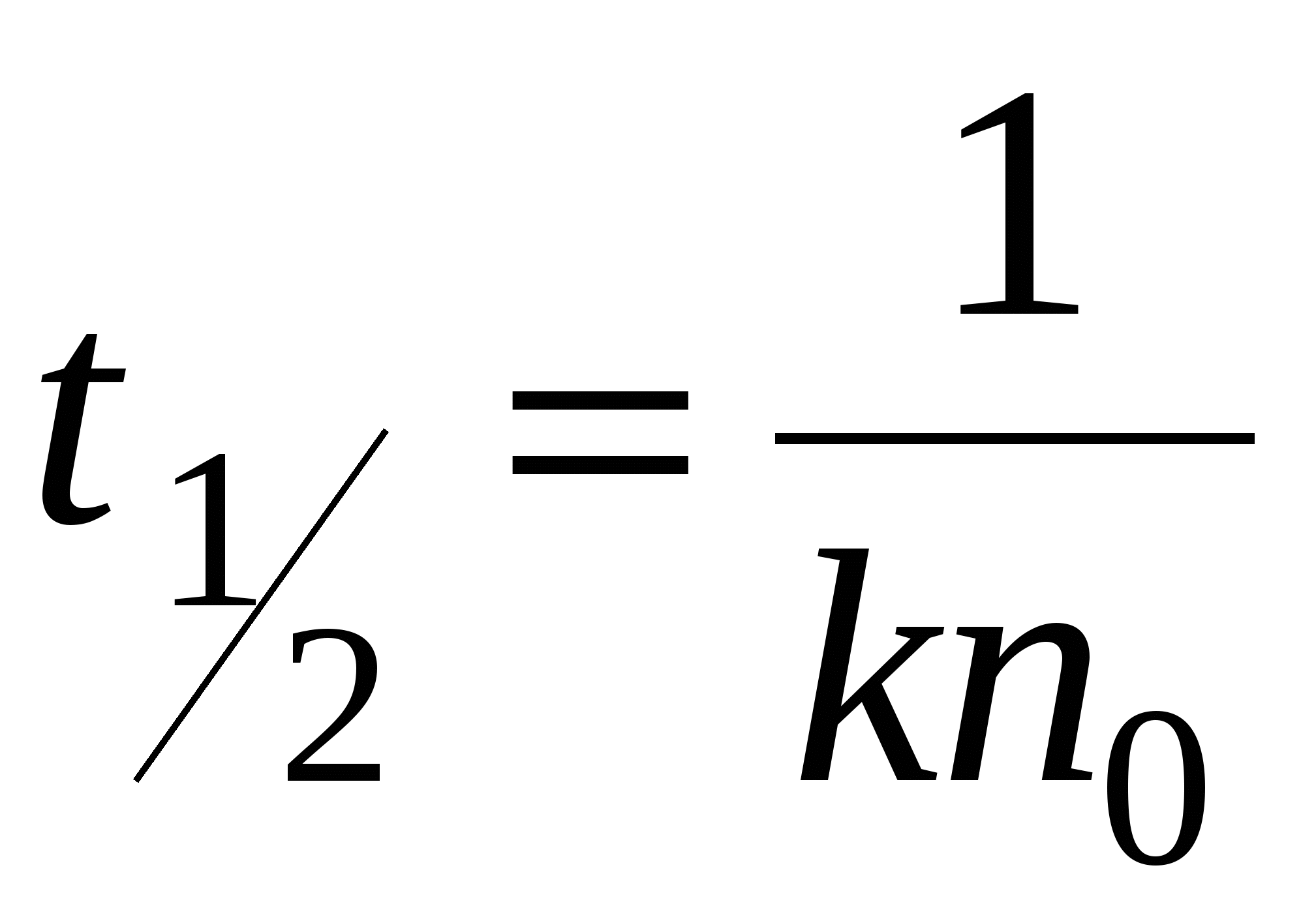
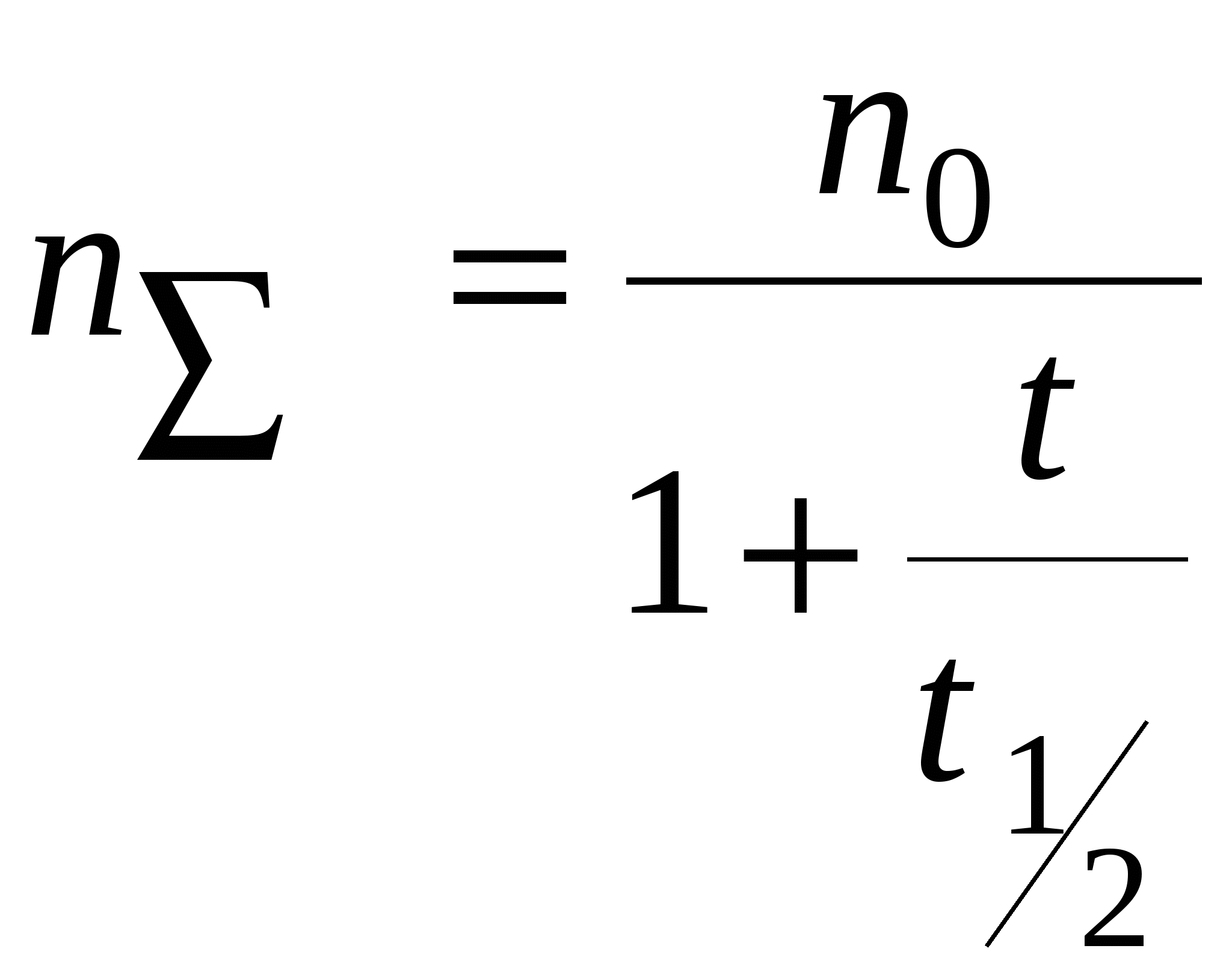 , , 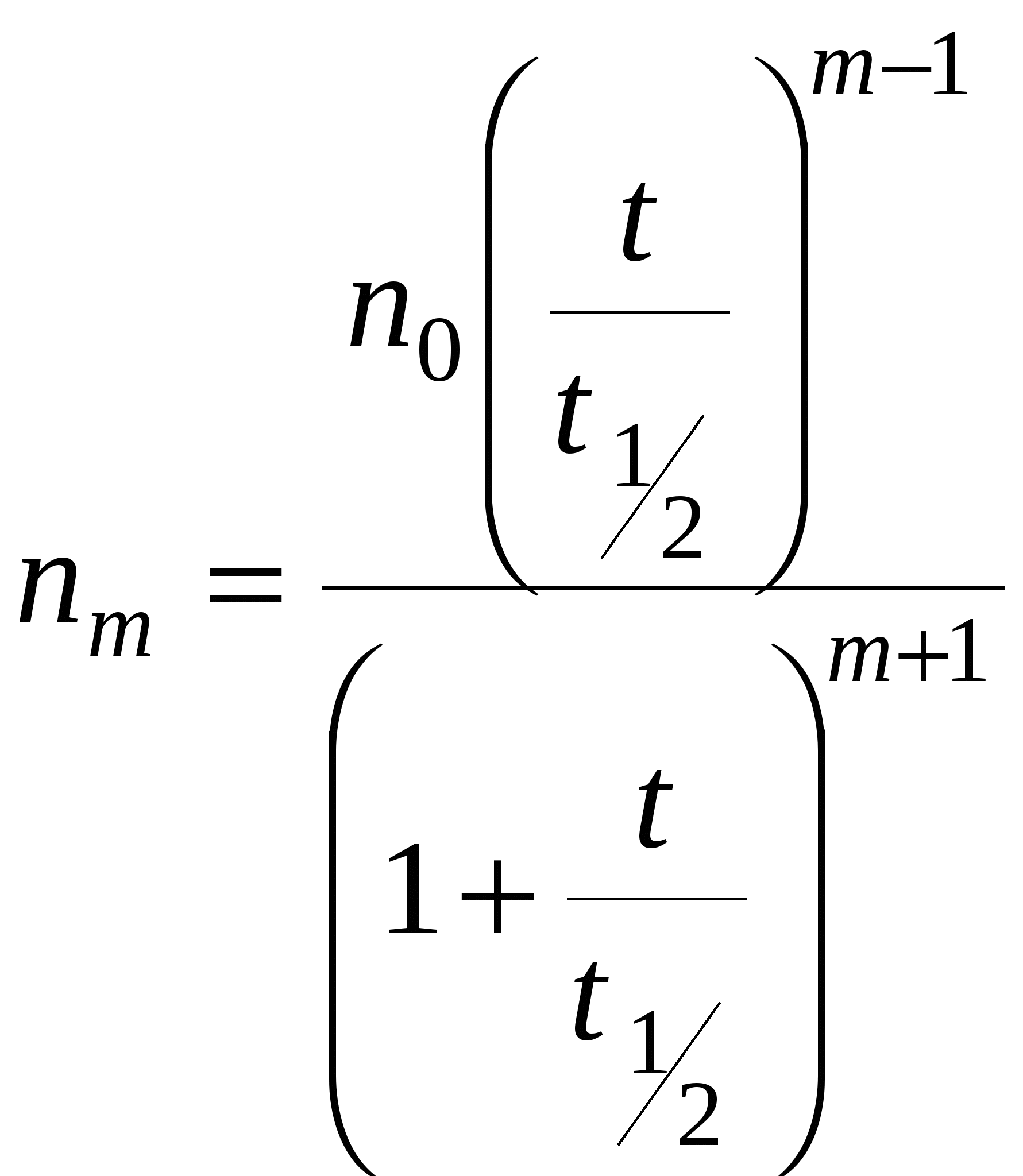
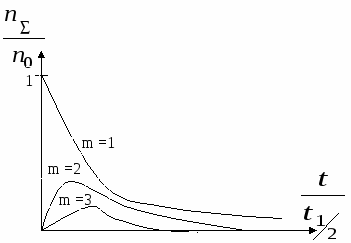
По мере увеличения кратности максимум кривых коагуляции сдвигается в сторону больших значений 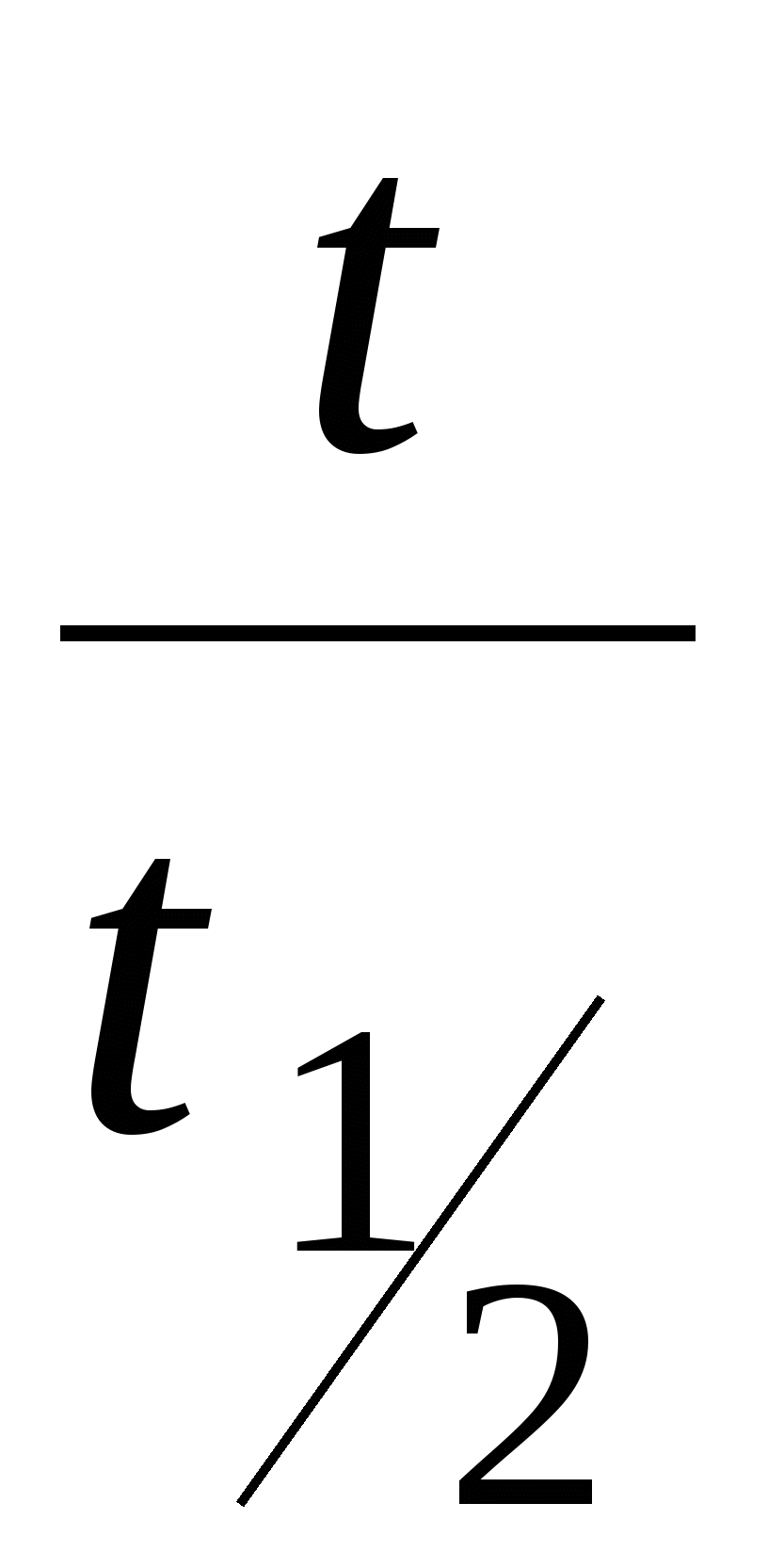 . .
Недостатки:
Предположение о монодисперсности.
Предположение о результативности всех столкновений.
Основы термодинамики дисперсных систем
Дисперсные системы могут образовываться в результате диспергирования (или измельчения) или в результате конденсации. В случае диспергирования требуется затраты работы в результате образующиеся системы нуждаются в дополнительной стабилизации.
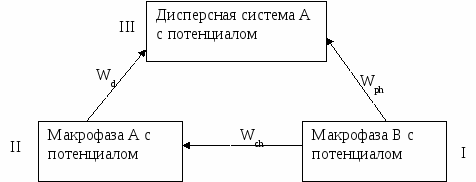
Wd – работа диспергирования
Wch – химическая работа
Wph – работа фазообразования
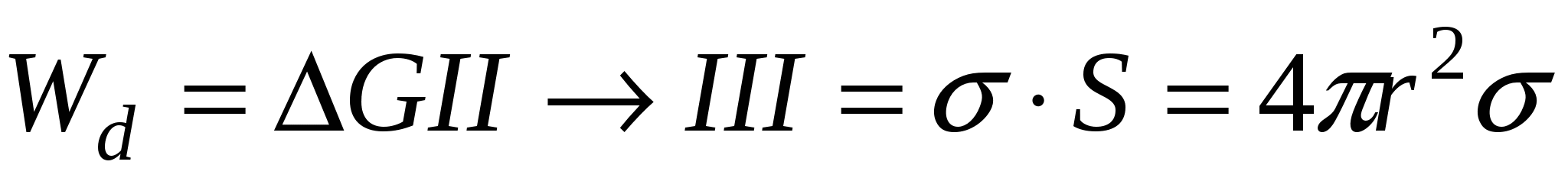
При этом 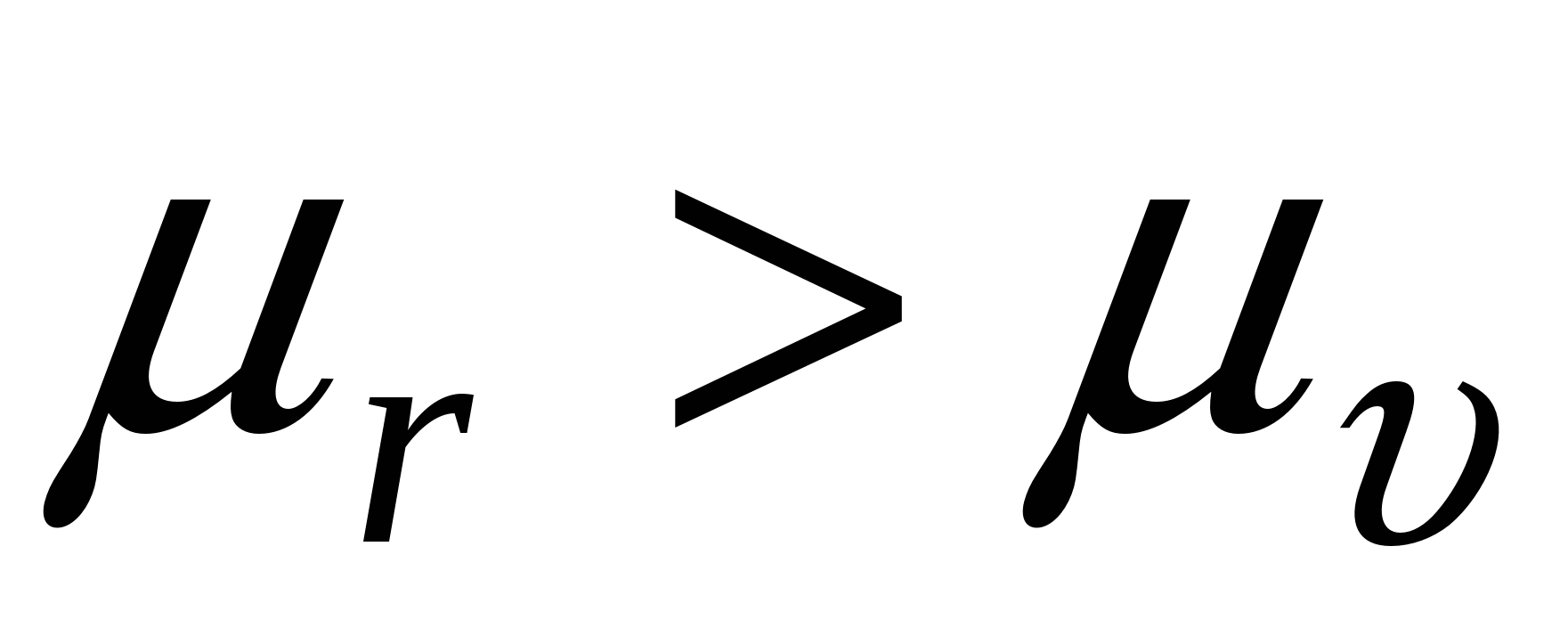 , а , а 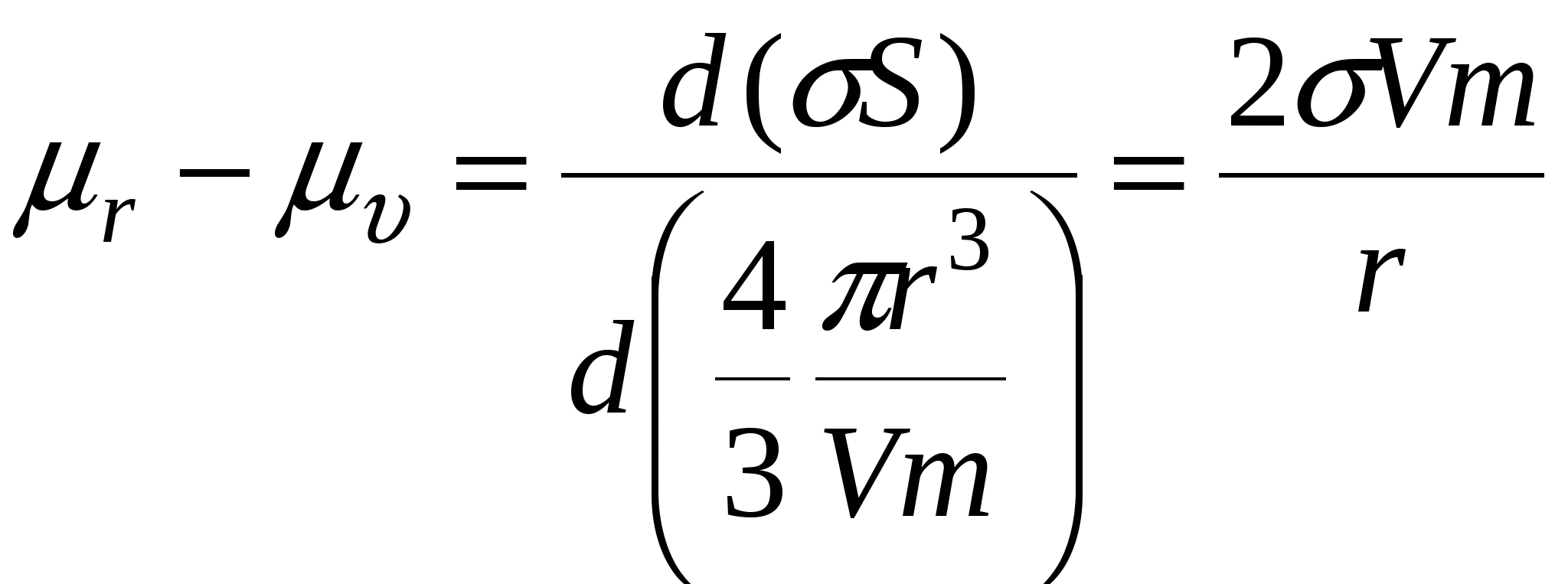
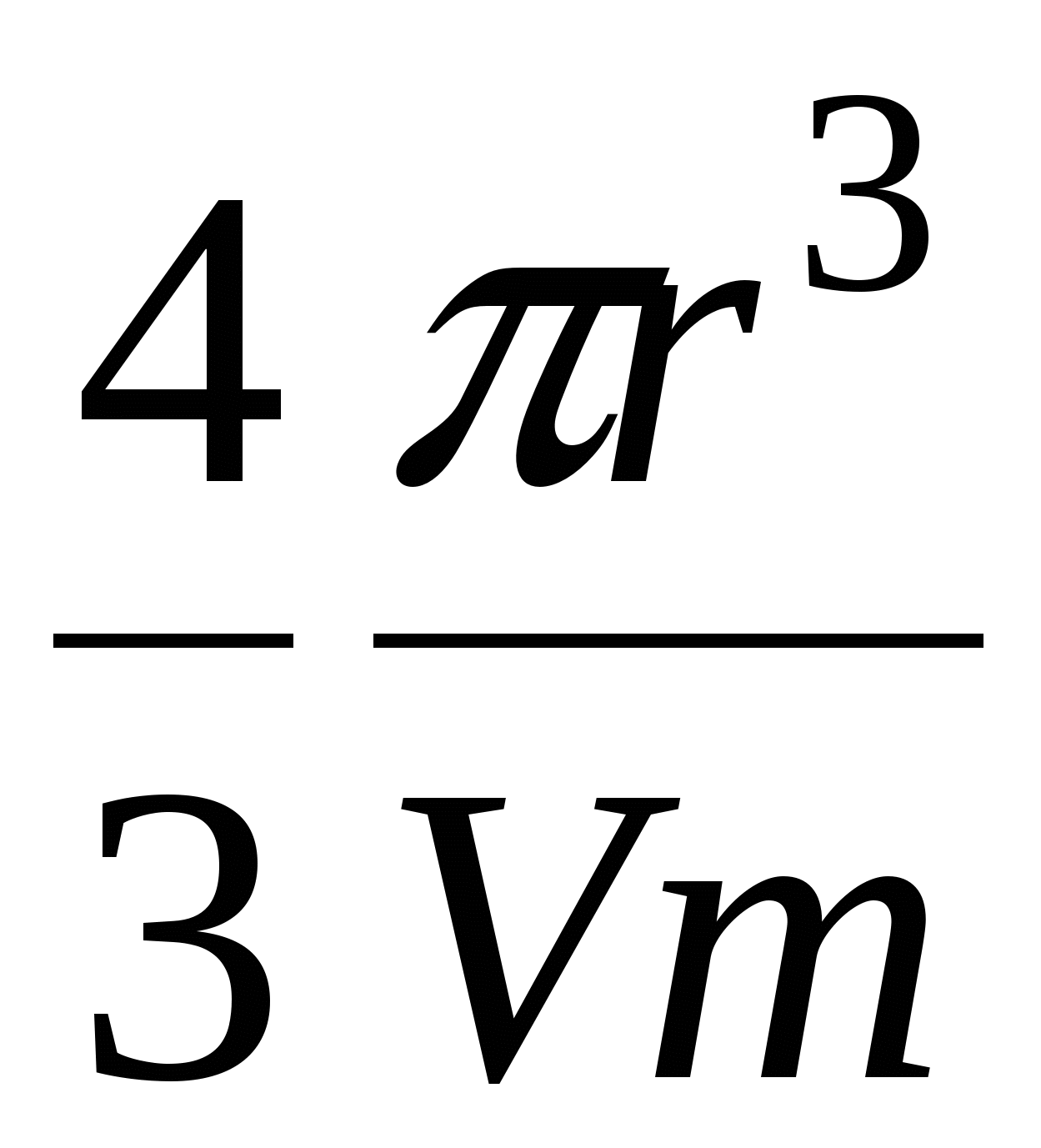 - число частиц - число частиц
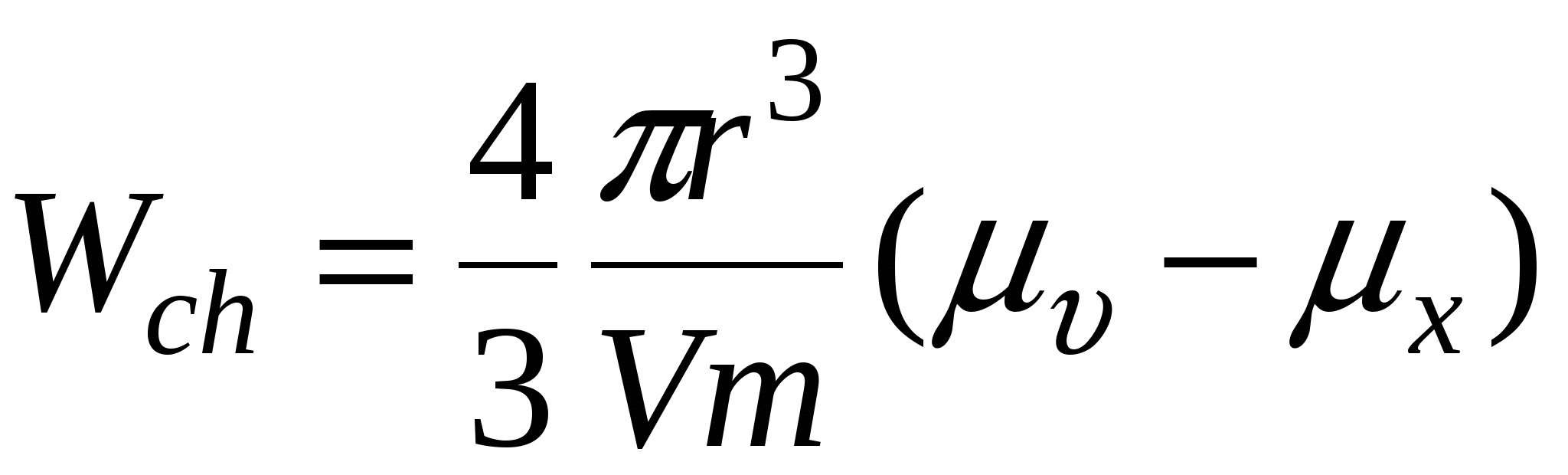
Для работы фазообразования:
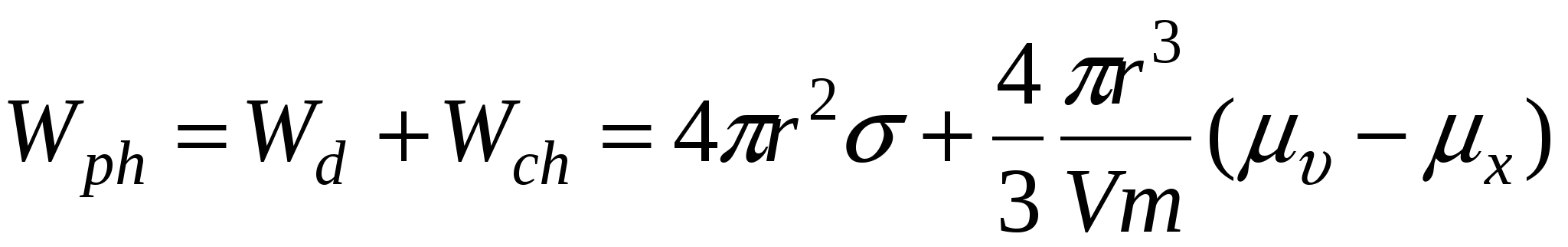
Особый случай: состоянии I и III равновесны, т.е. 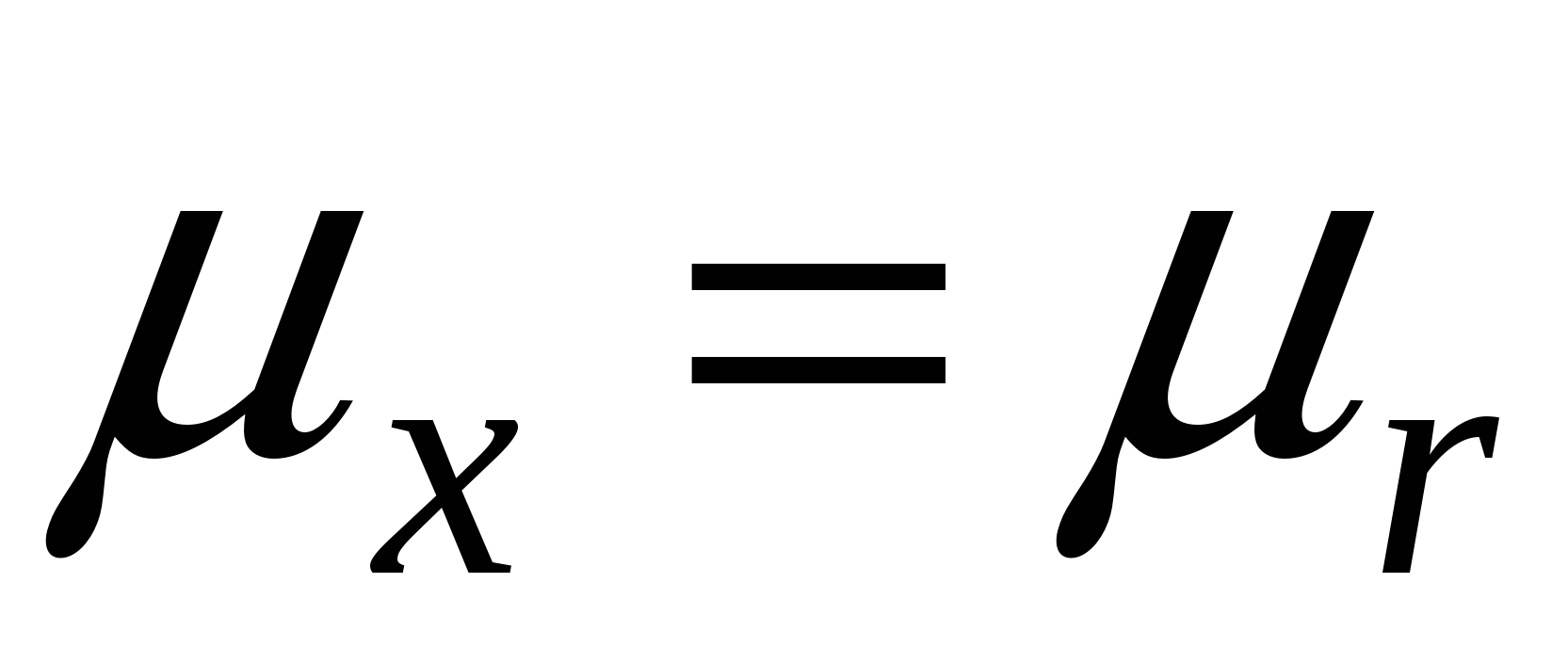
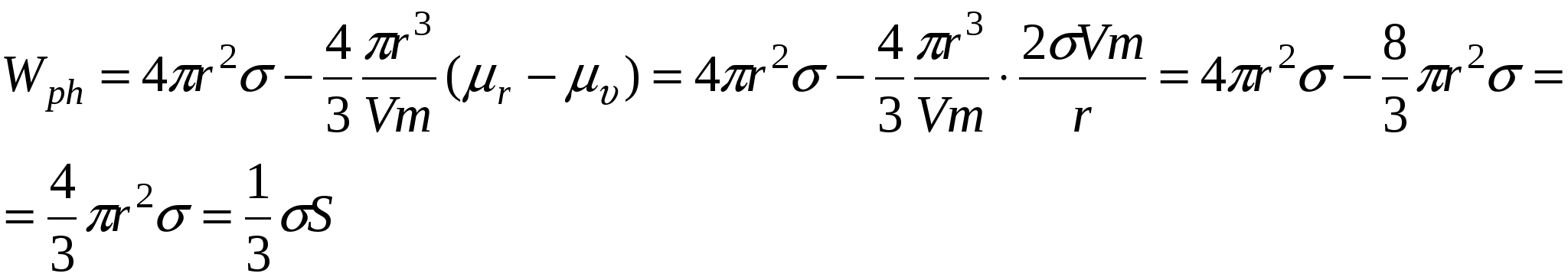
Работа фазообразования 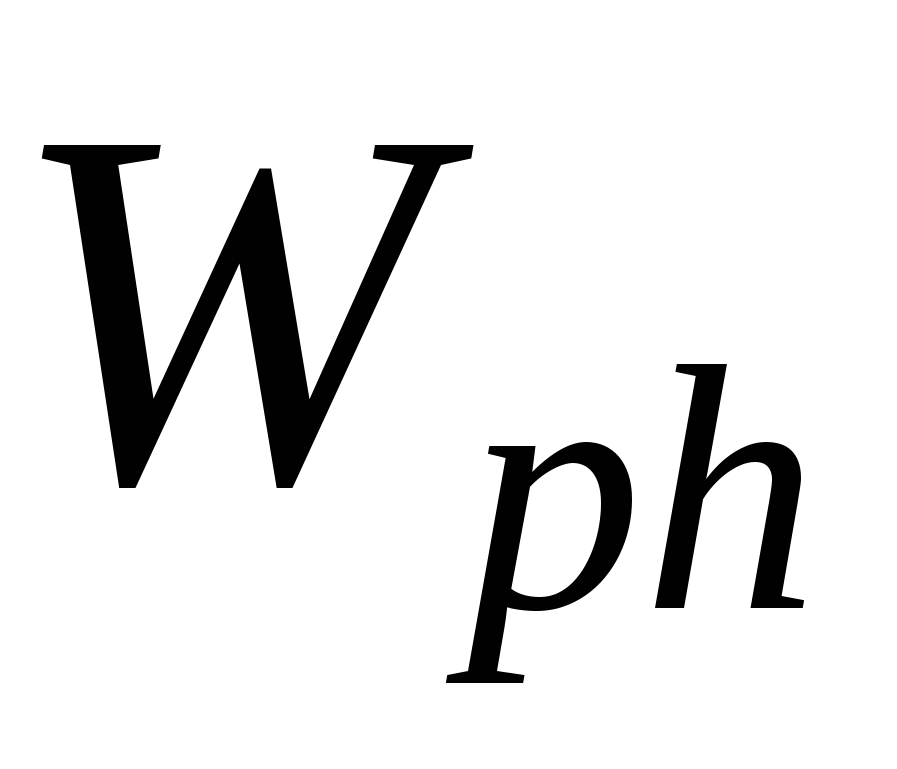 составляет 1/3 от работы диспергирования ( составляет 1/3 от работы диспергирования (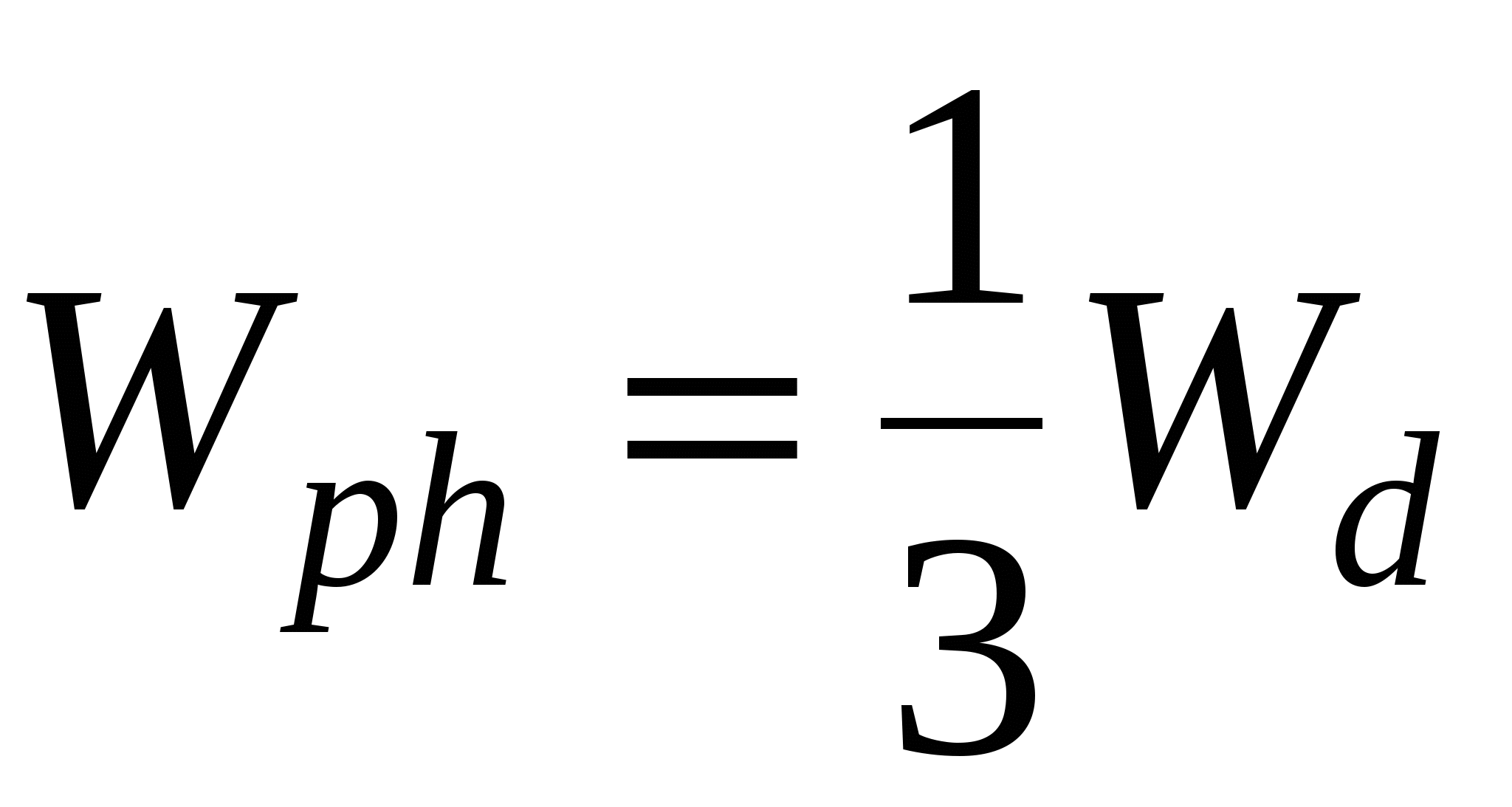 )и процесс будет является энергетически выгодным, если число образовавшихся частиц или увеличение энтропии в системе покрывает затраты на фазообразование, т.е. образовавшиеся частицы принимают участие в броуновском движении. )и процесс будет является энергетически выгодным, если число образовавшихся частиц или увеличение энтропии в системе покрывает затраты на фазообразование, т.е. образовавшиеся частицы принимают участие в броуновском движении.
Рост энтропии в системе учитывается следующим образом: 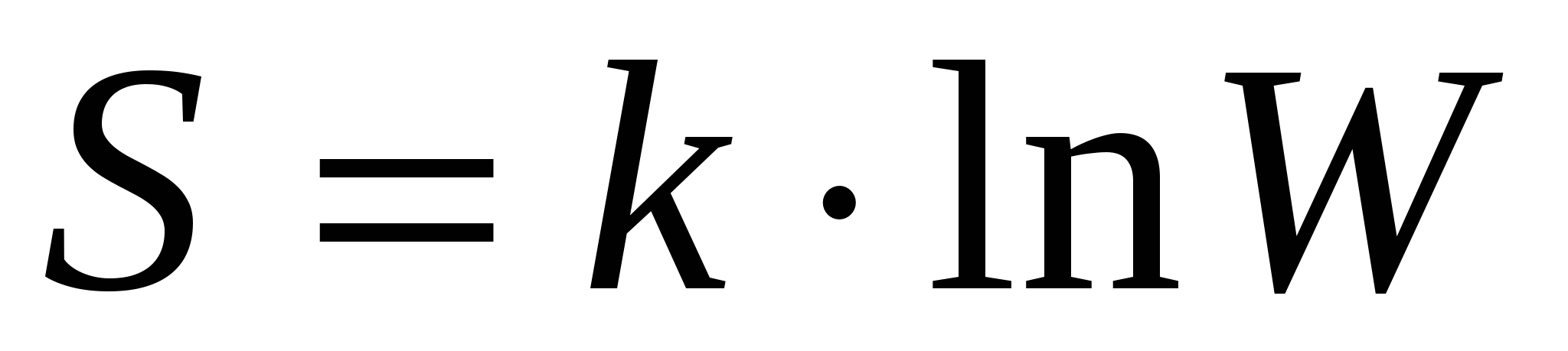 . .
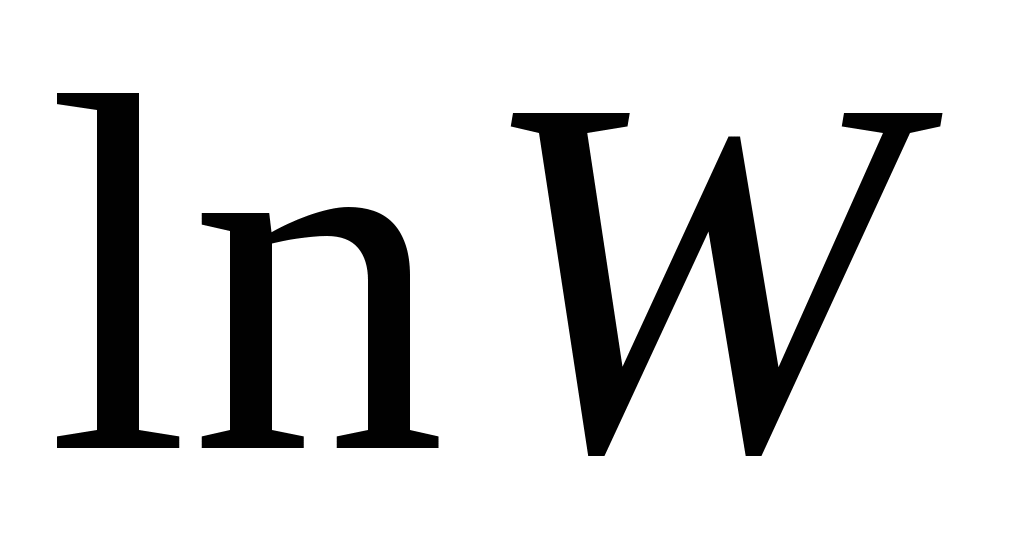 - вероятность какого-либо состояния. - вероятность какого-либо состояния.
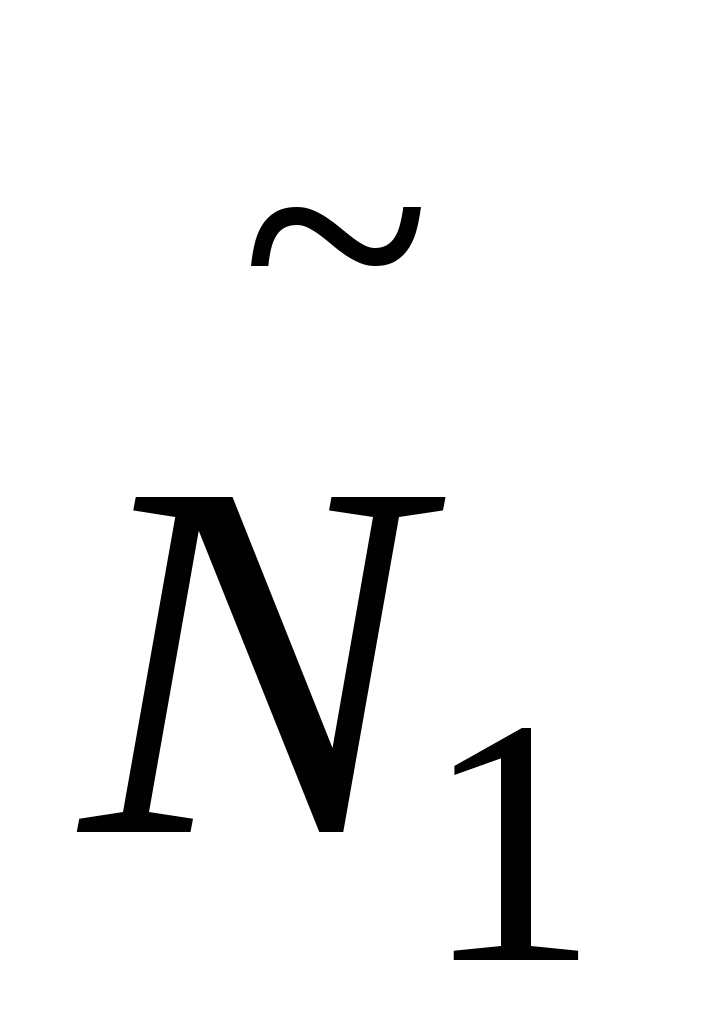 - число частиц дисперсной фазы. - число частиц дисперсной фазы.
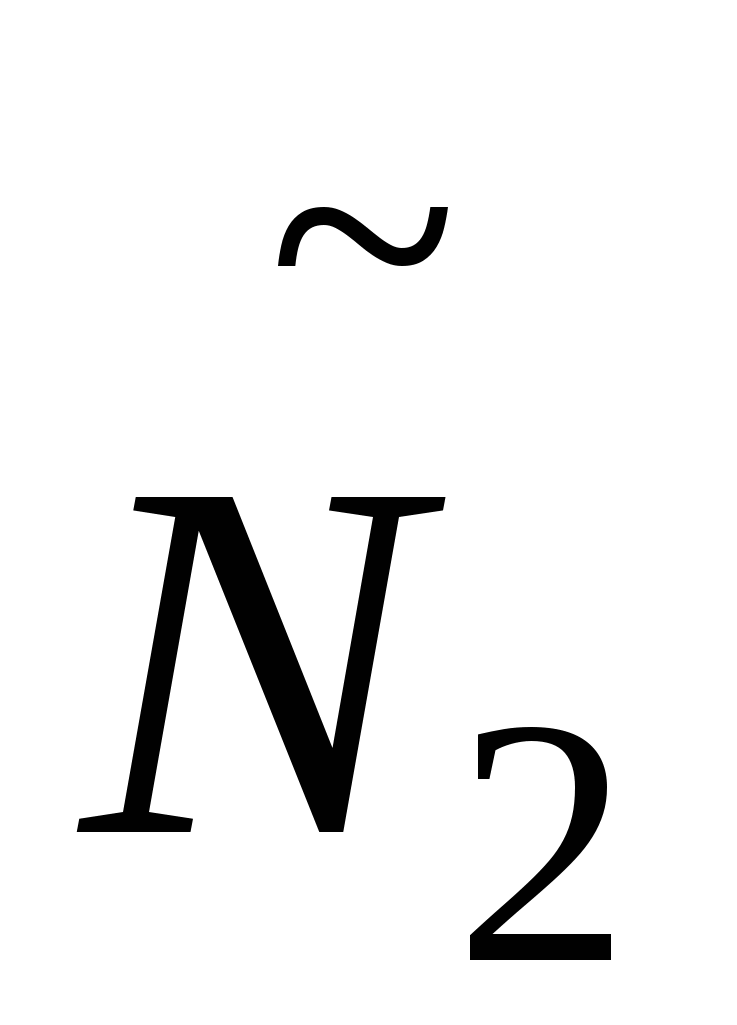 - число частиц дисперсной среды. - число частиц дисперсной среды.
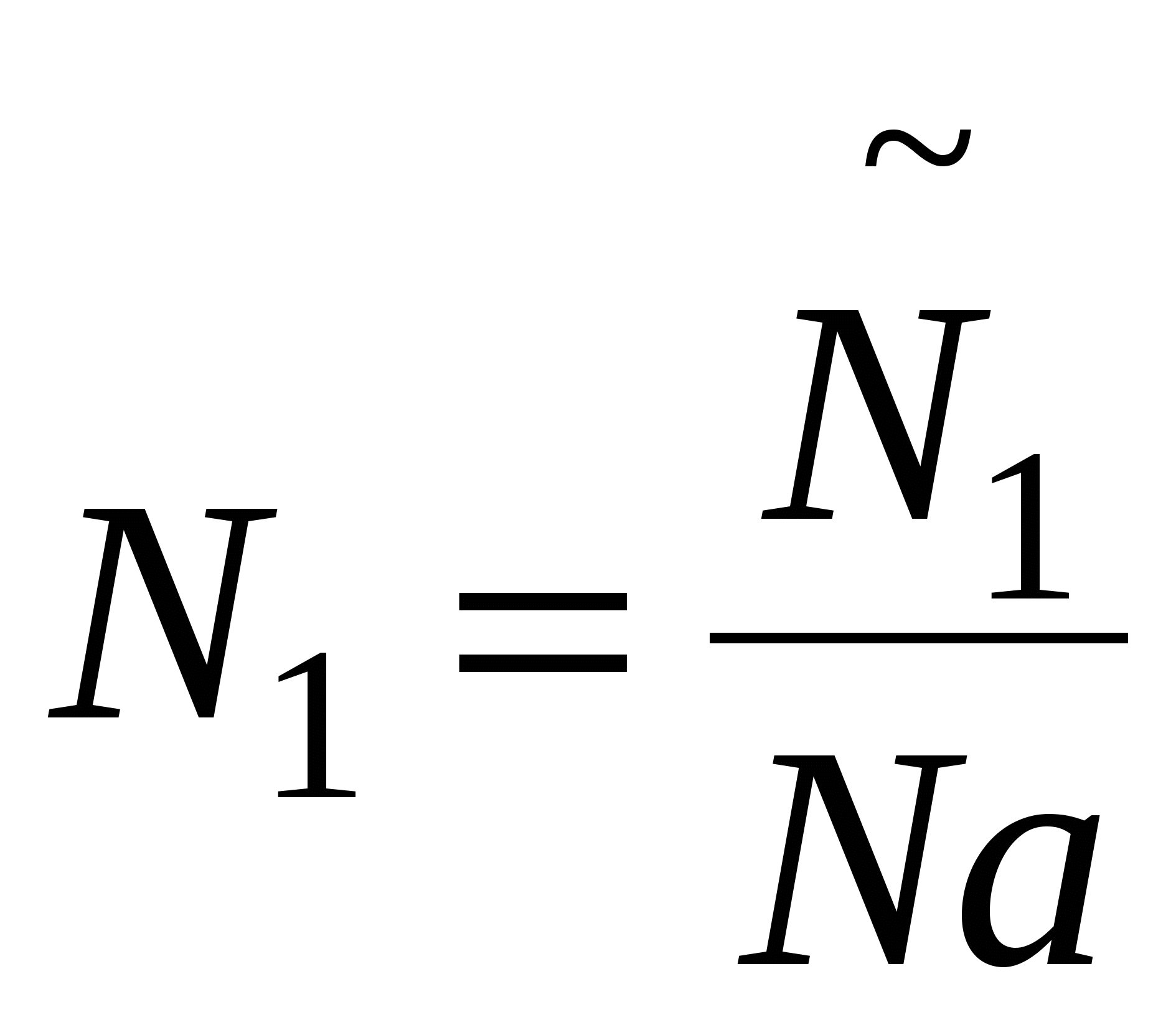 , , 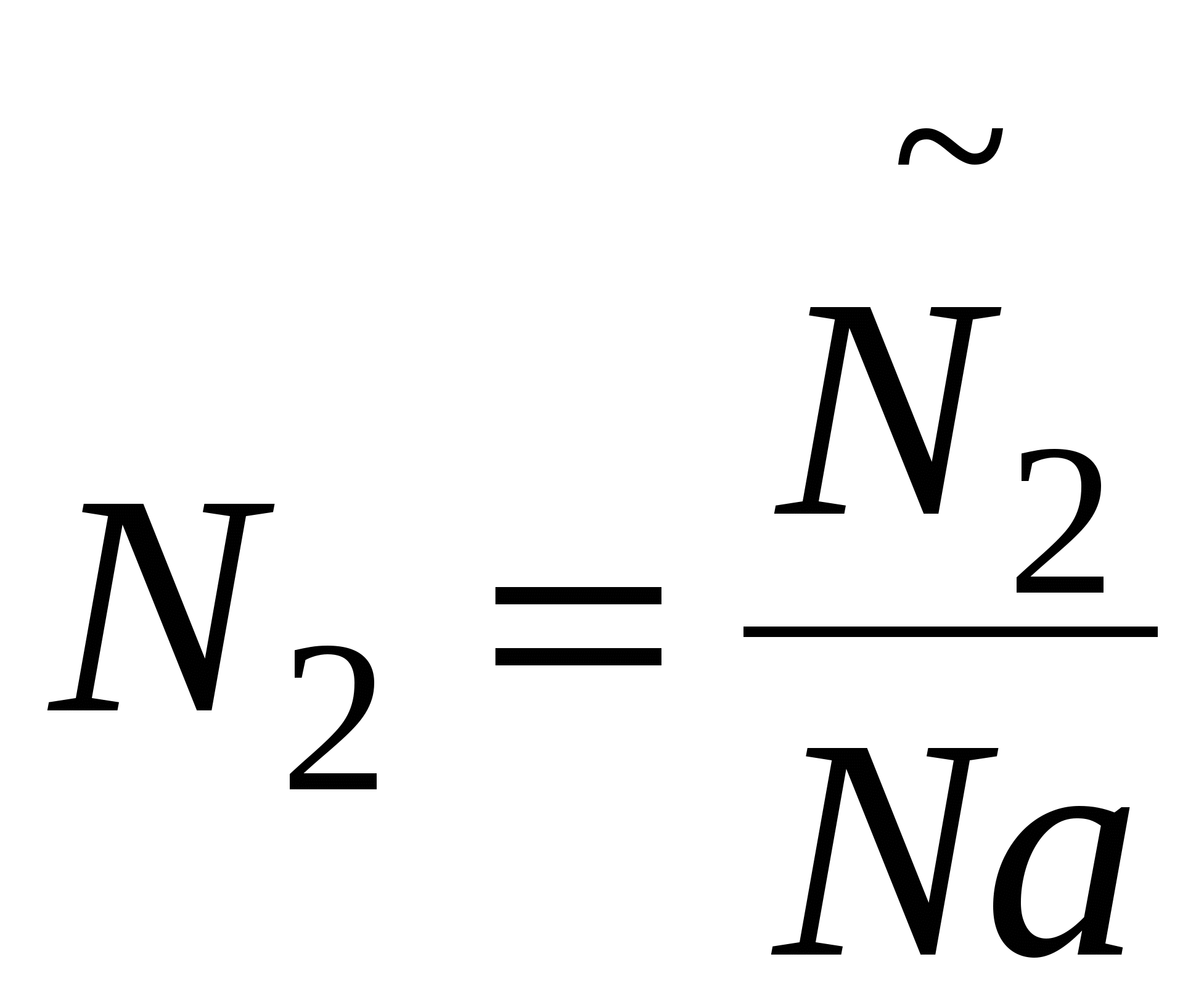 , тогда изменения энтропии в случае дисперсной системы: , тогда изменения энтропии в случае дисперсной системы:
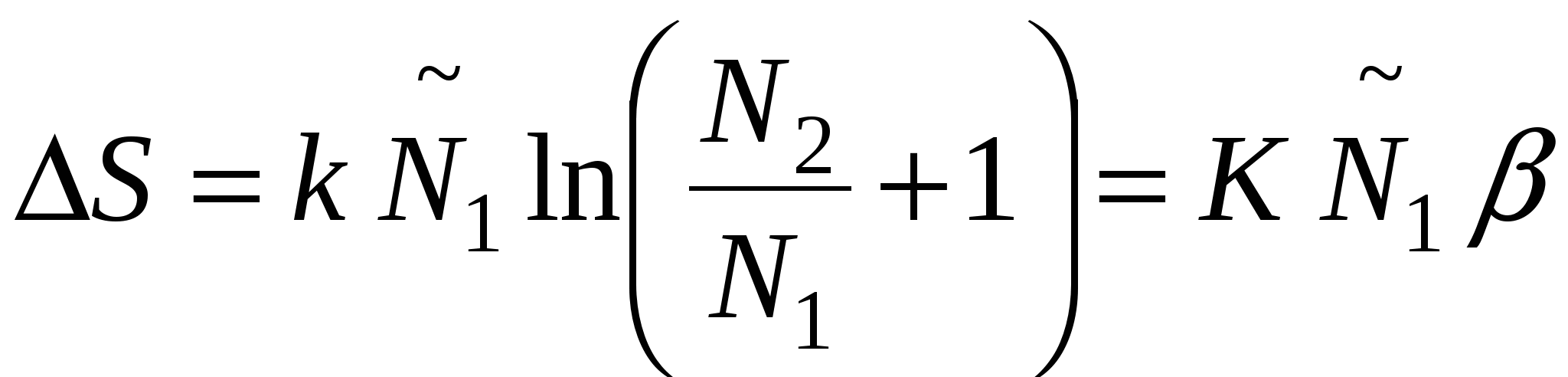
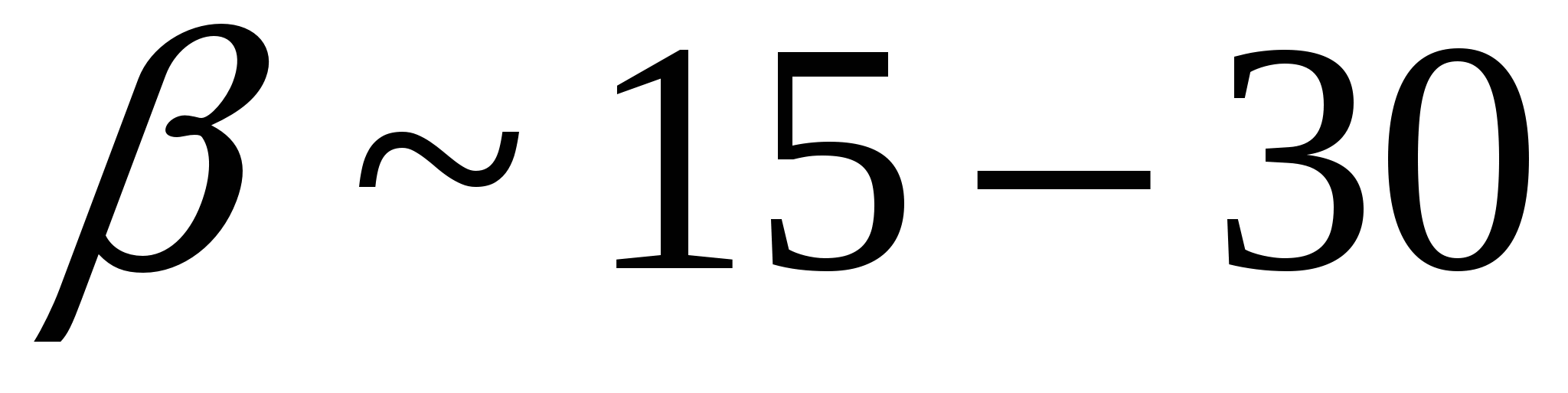
В случае образования дисперсной системы
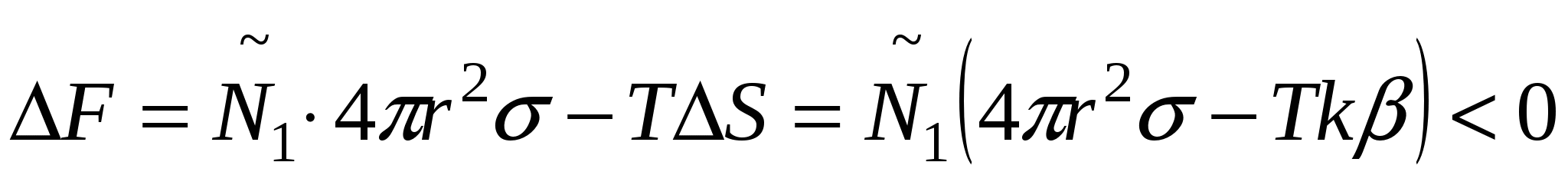
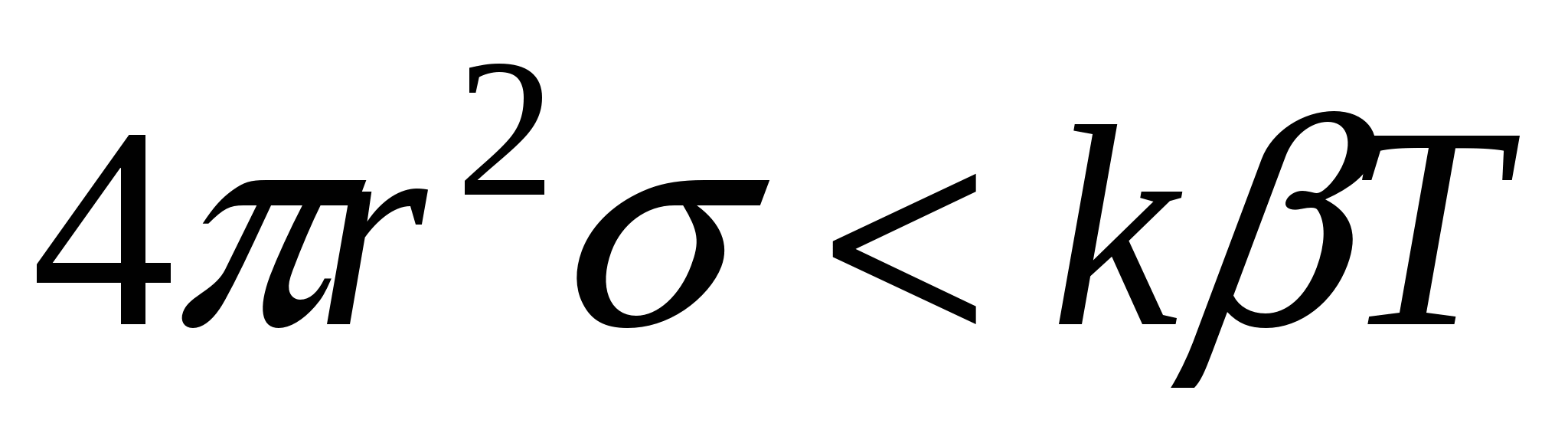
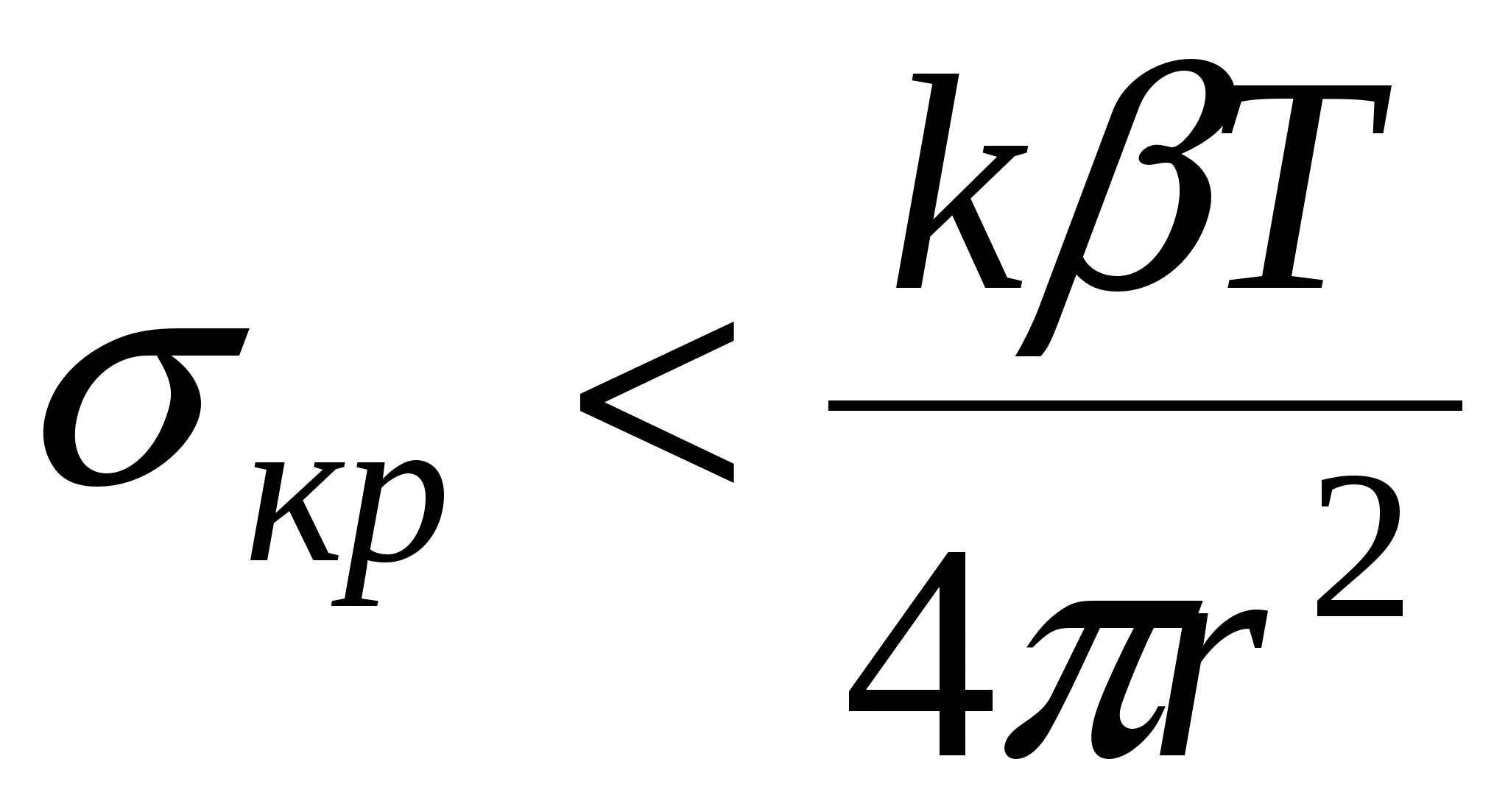
Системы, которые образуются самопроизвольно называются лиофильными, характеризуются низкими значениями 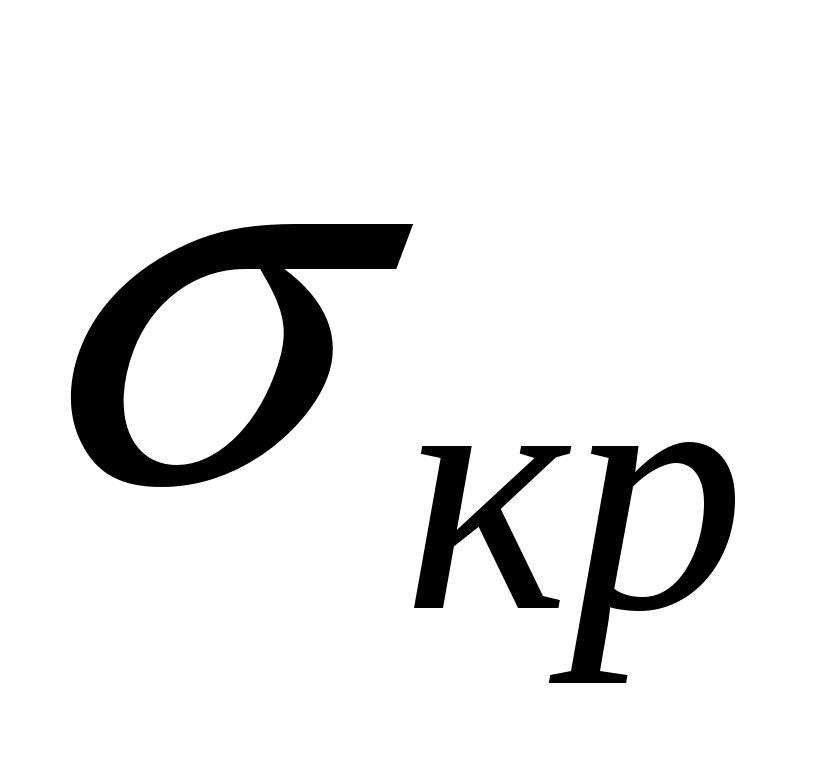 и стабильные. и стабильные.
Системы лиофобные не образуются самопроизвольно, т/д неустойчивы и требуют дополнительной стабилизации чаще всего за счет введения в систему ПАВ.
В случае конденсационного образования работа фазообразования имеет вид:
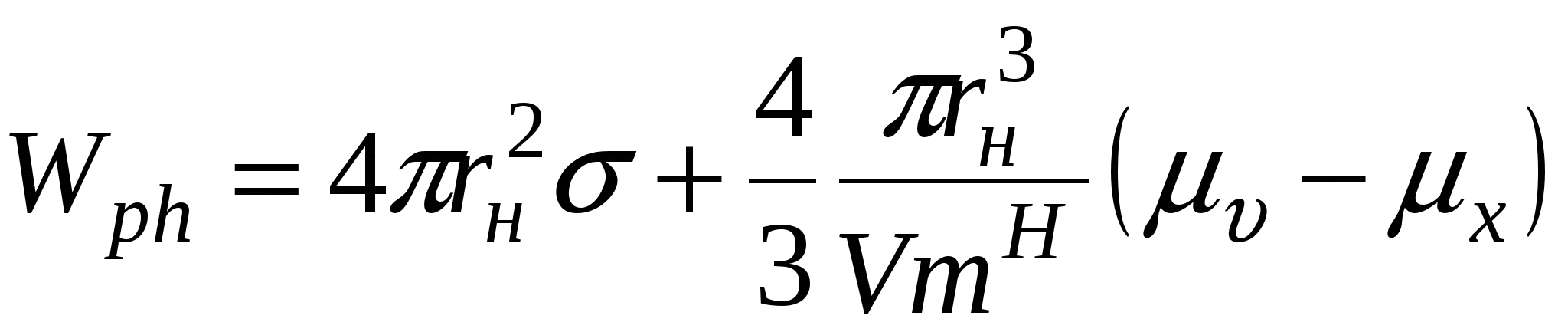 , где индекс н соответствует молярному образованию (зародышу) новой фазы. , где индекс н соответствует молярному образованию (зародышу) новой фазы.
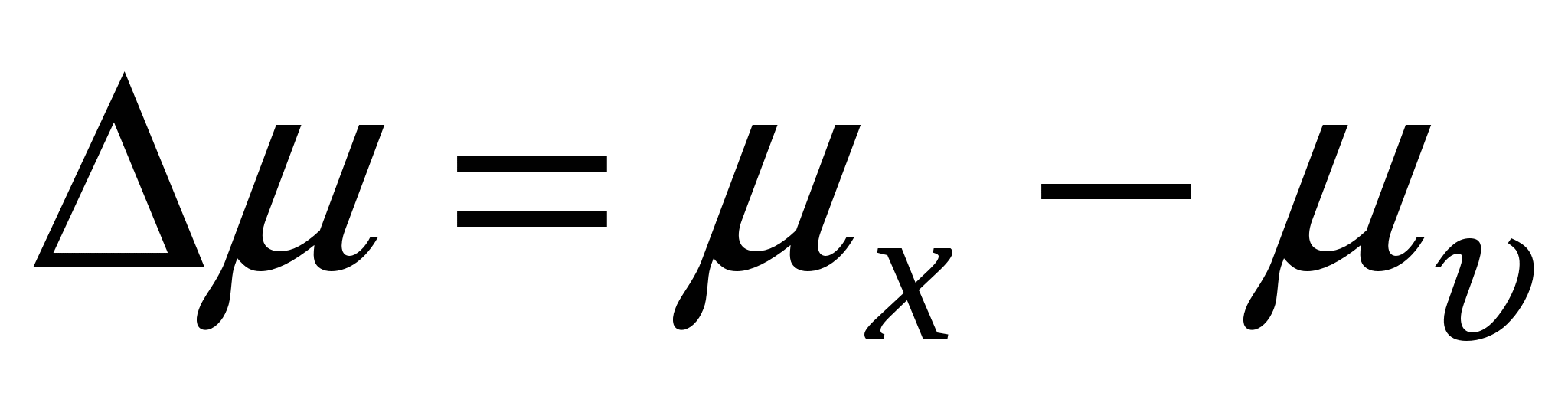 - пересыщение в системе - пересыщение в системе
В случае равновесия образующейся дисперсной системы и маточного раствора, когда 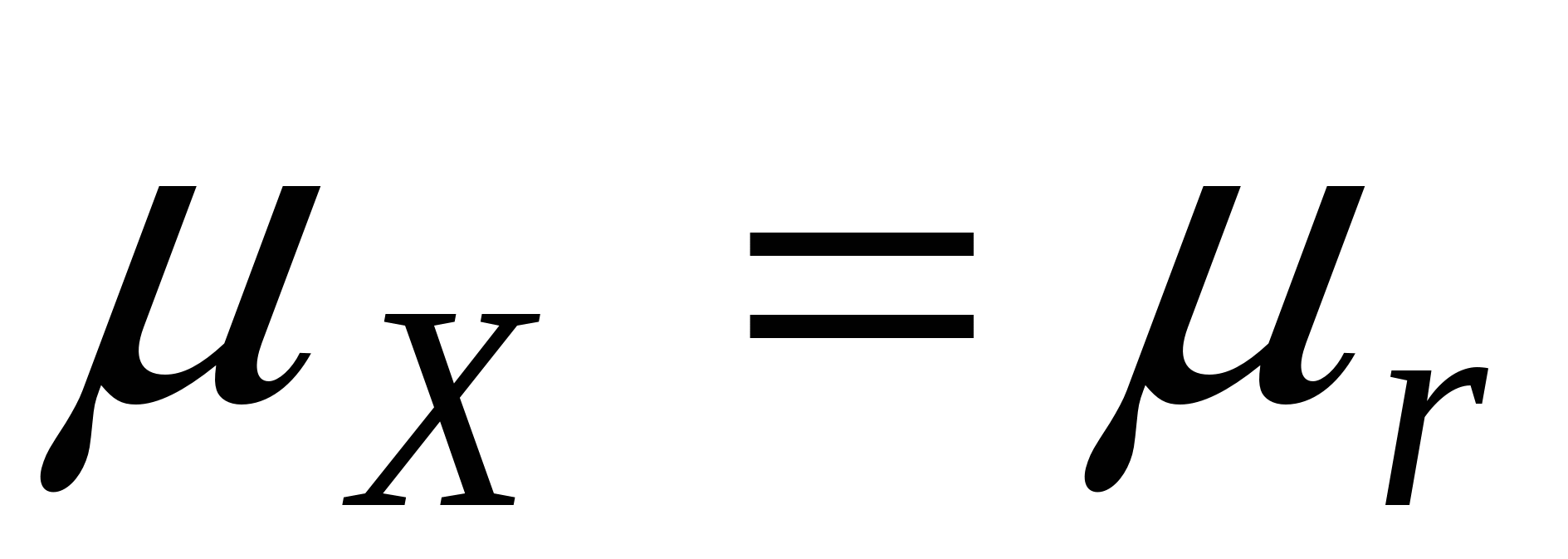 , , 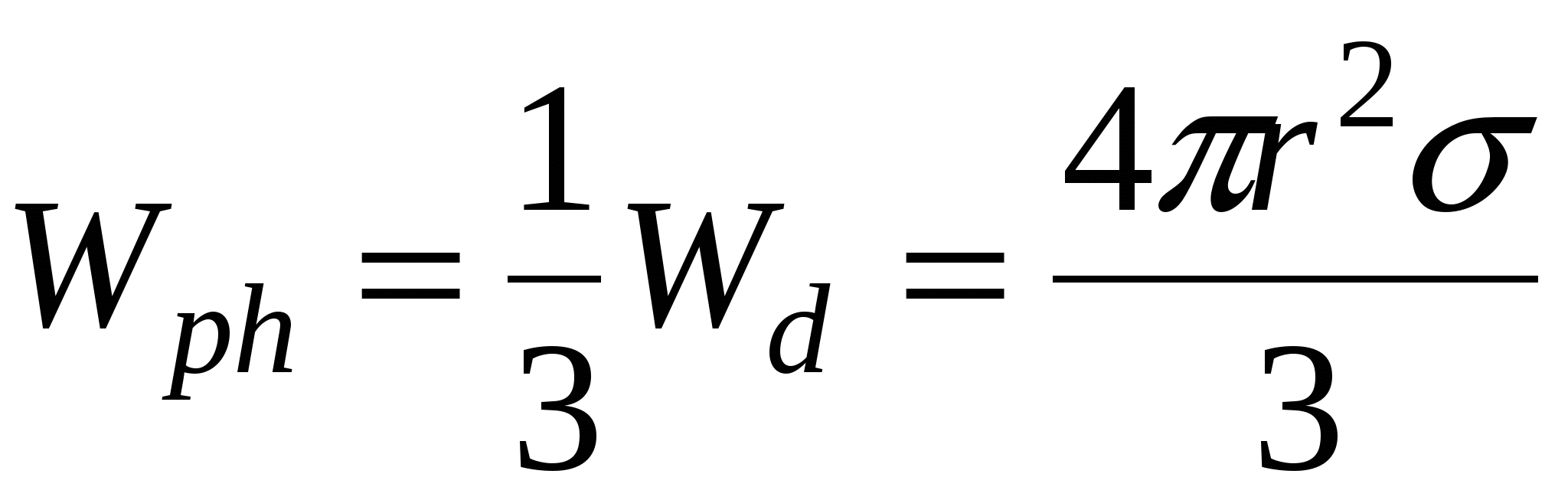
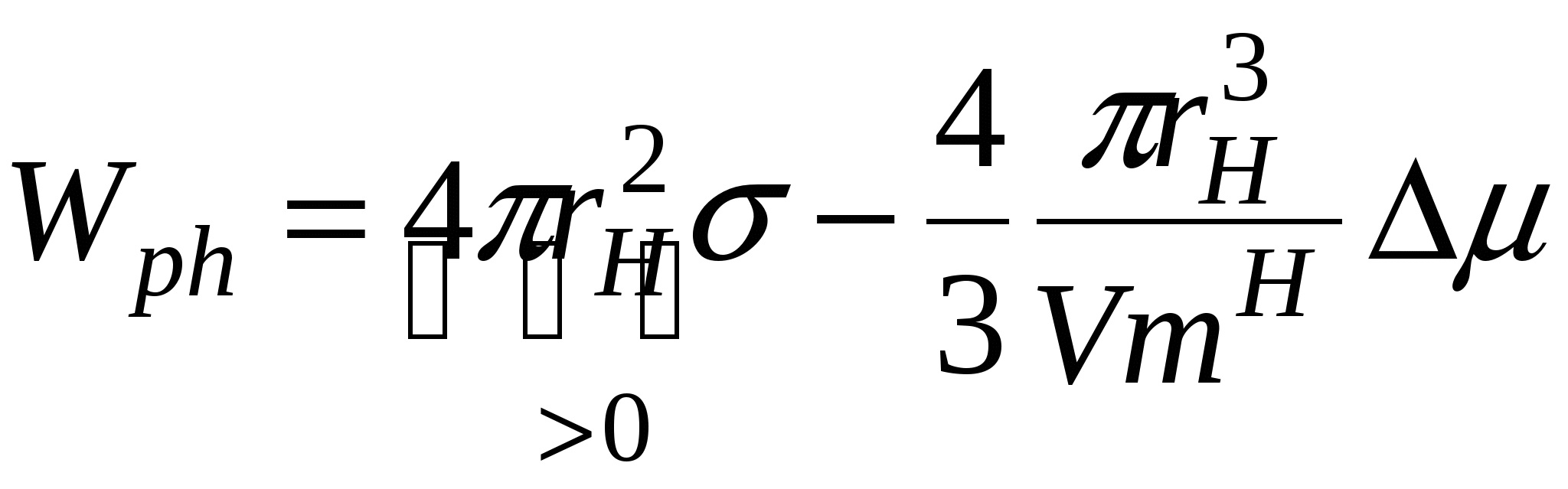
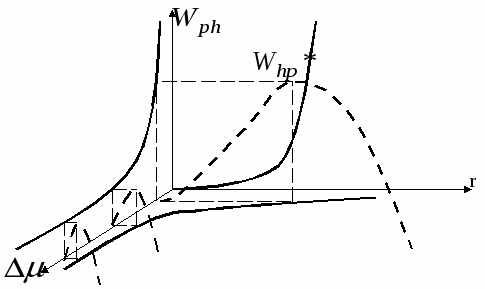
Ход зависимости работы фазообразования определяется величиной не только r, но и величиной пересыщения 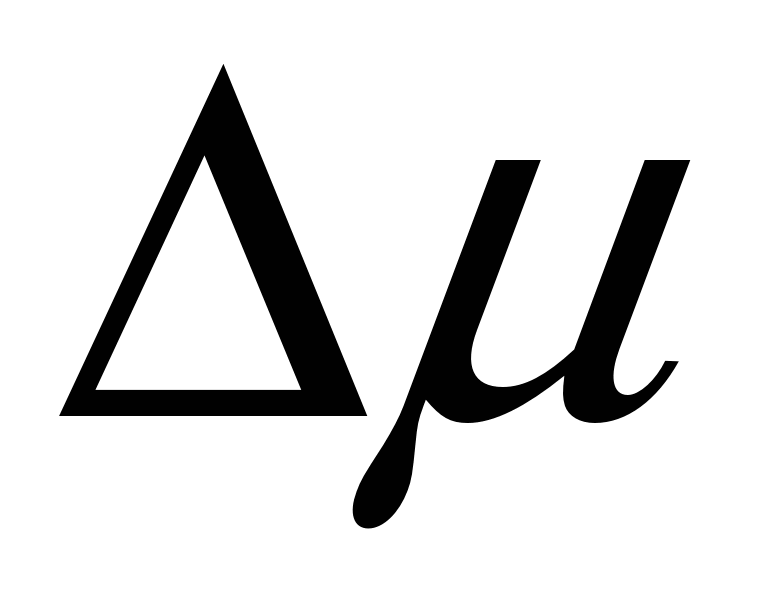 и в случае достаточно высоких пересыщений работа фазообразования будет уменьшаться как и в случае достаточно высоких пересыщений работа фазообразования будет уменьшаться как 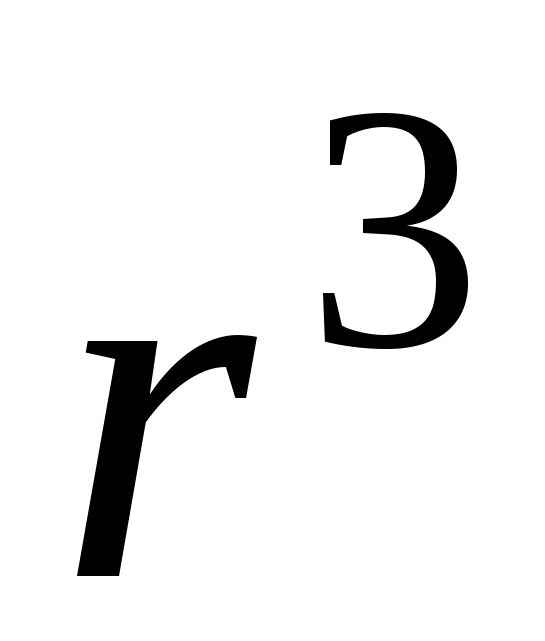 , т.е. зависимость работы фазообразования как функции от размера частиц ( , т.е. зависимость работы фазообразования как функции от размера частиц (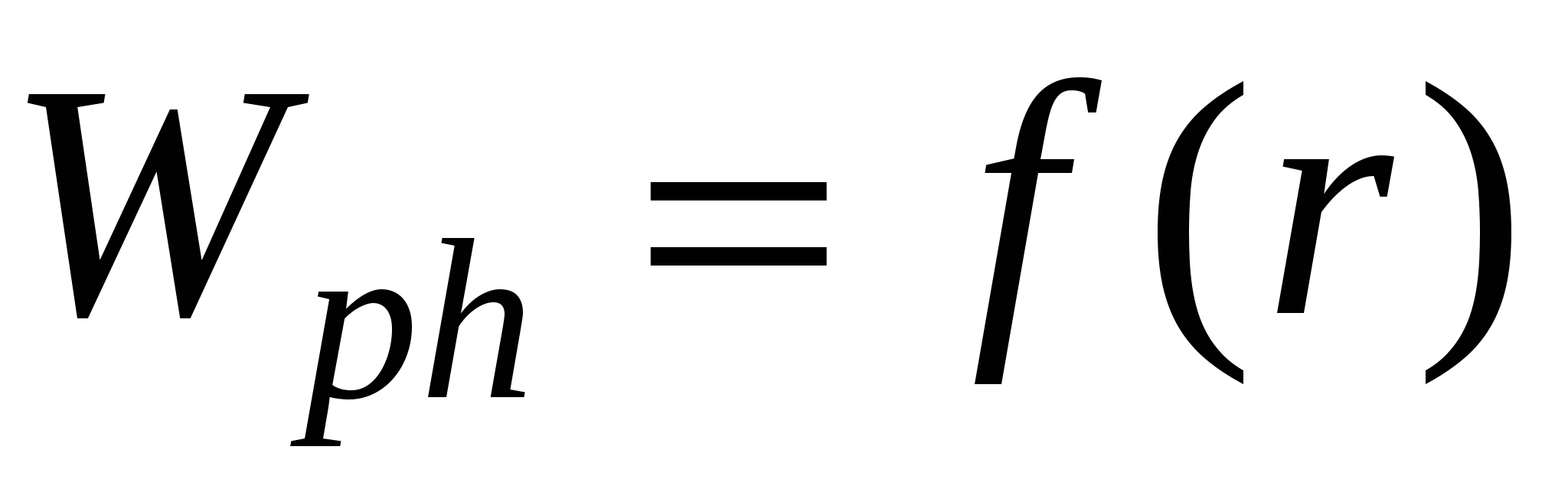 )будет проходить через максимум, условиями которого является: )будет проходить через максимум, условиями которого является: 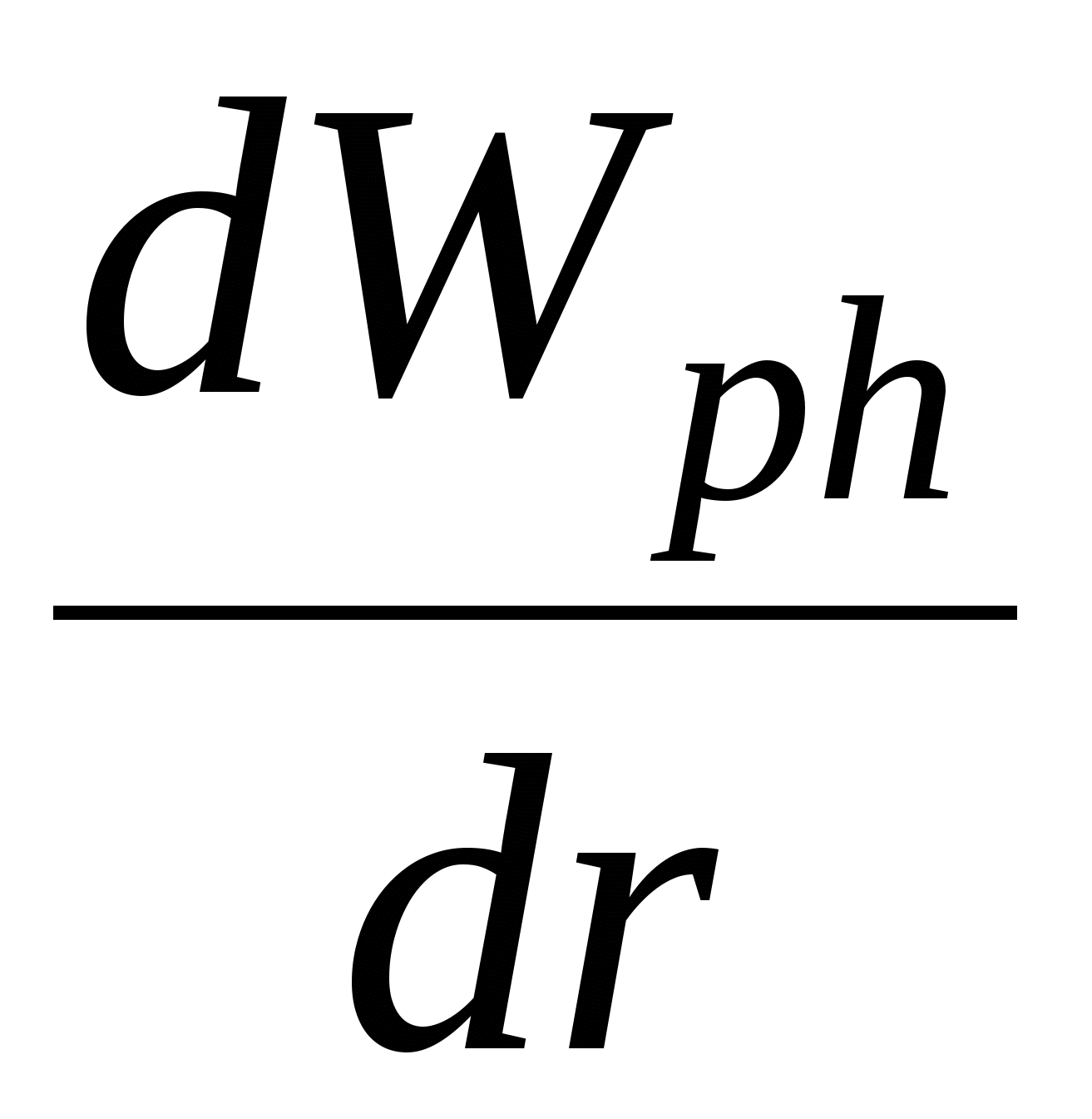
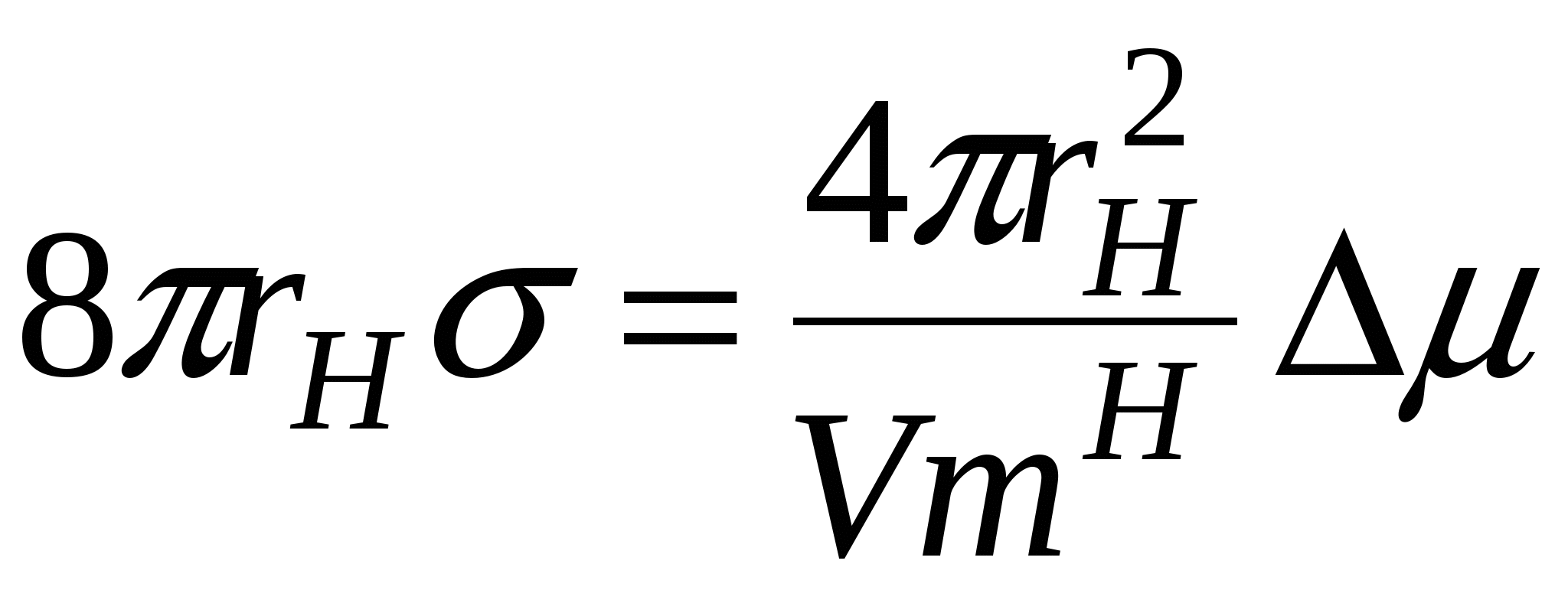 , , 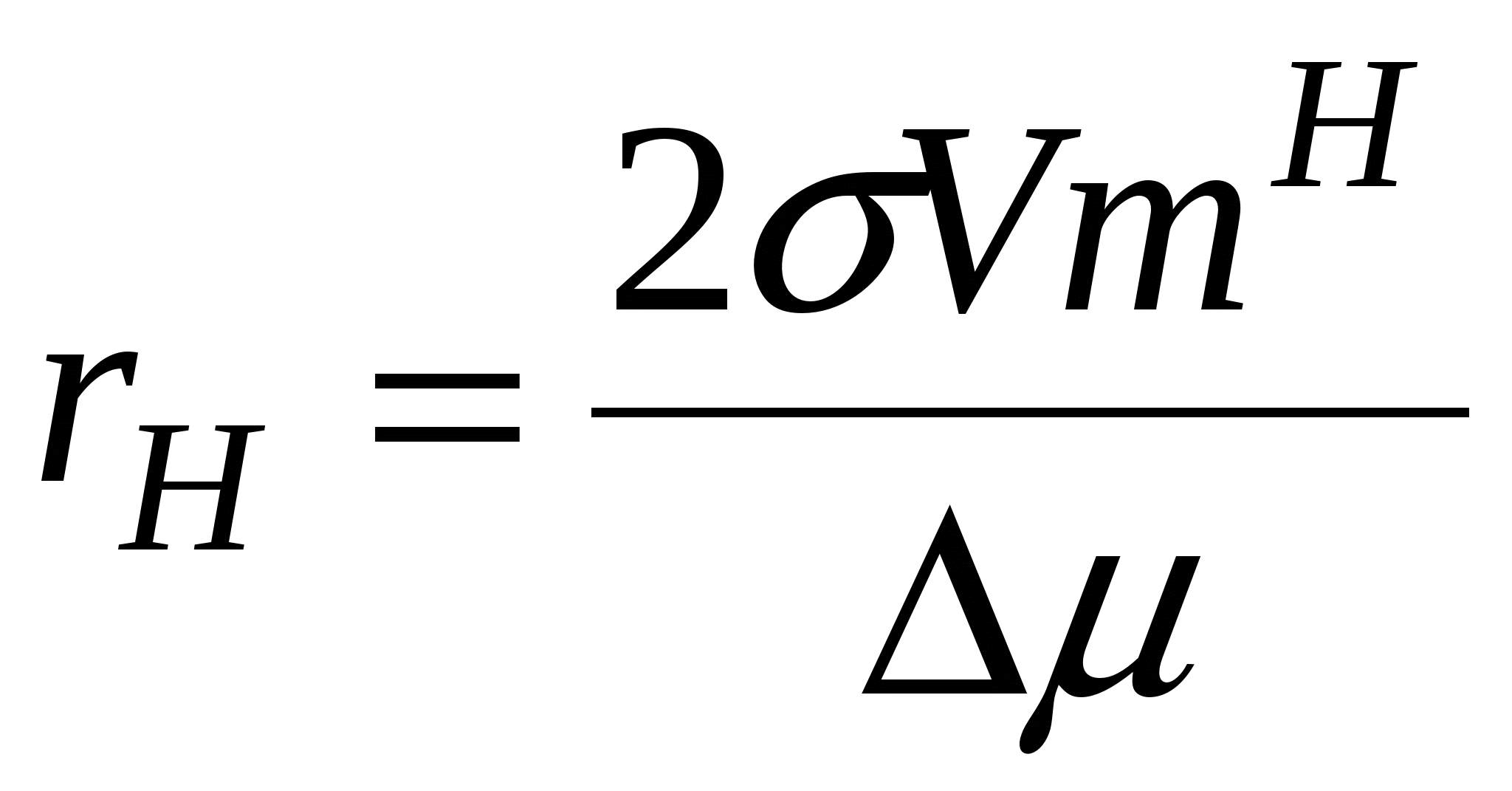
Тогда в случае равновесия, когда 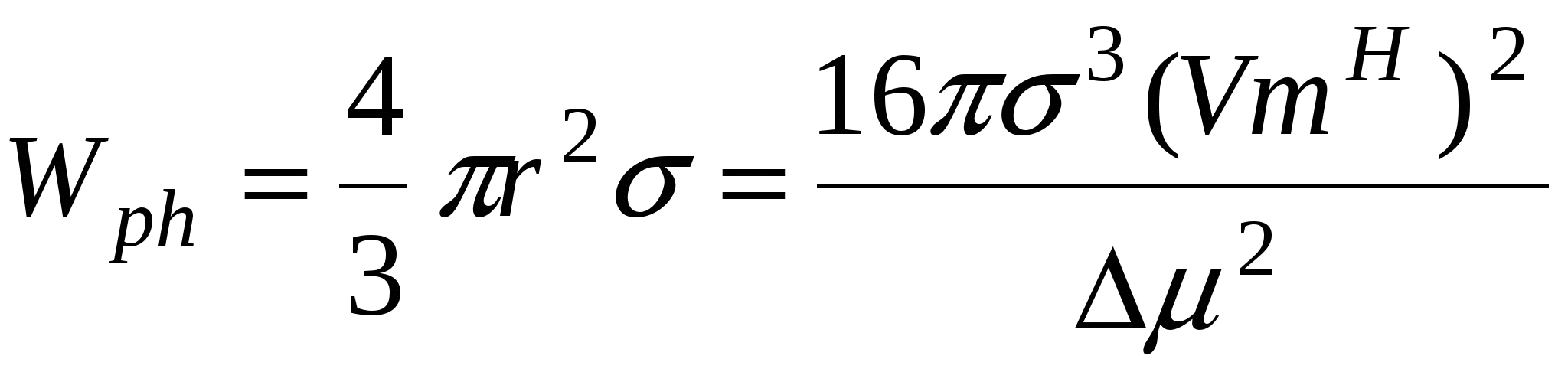
1) размер критического зародыша новой фазы 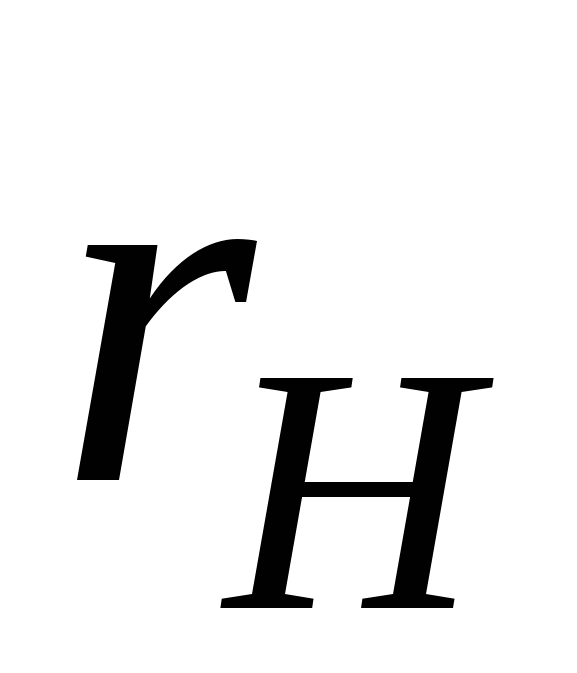
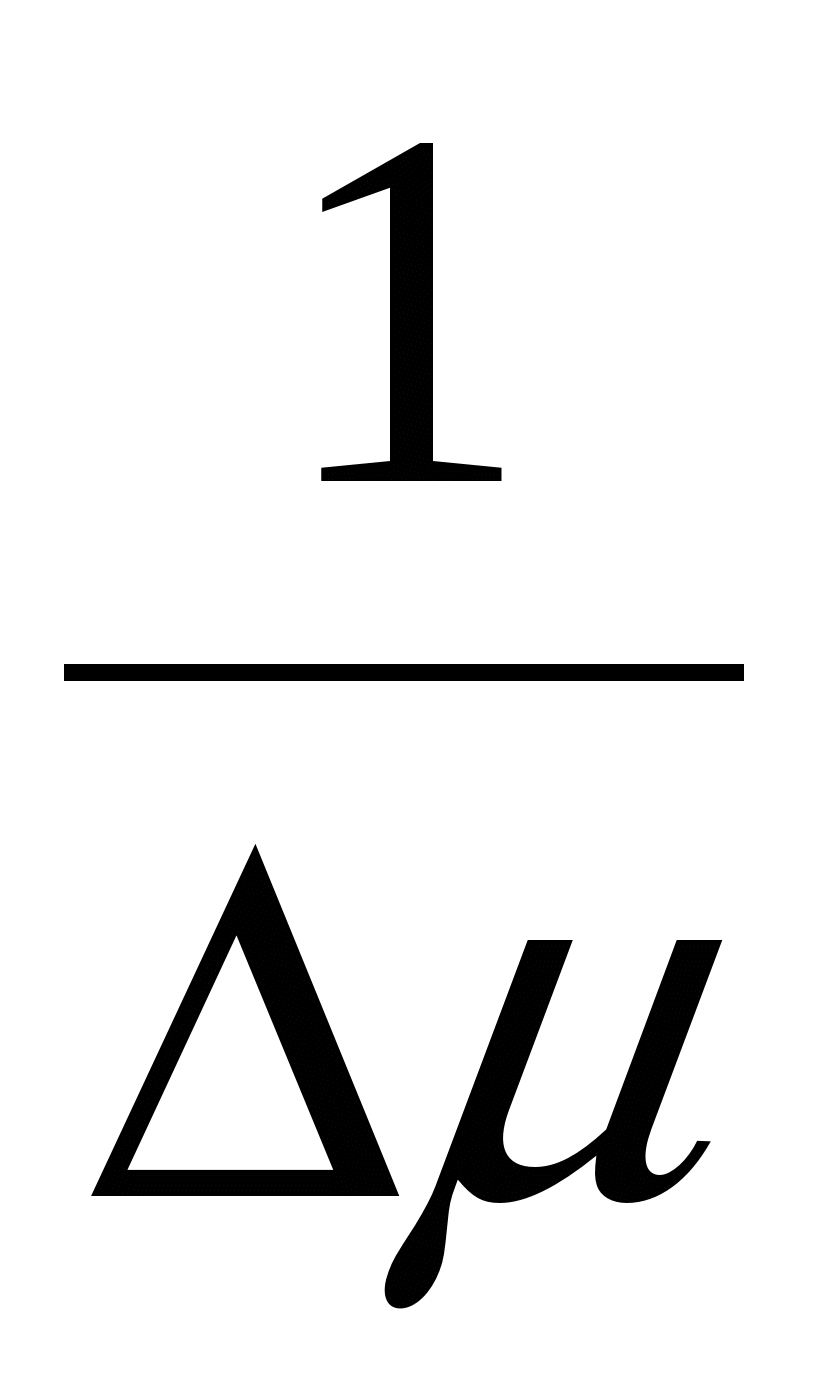
2) В отсутствии пересыщения 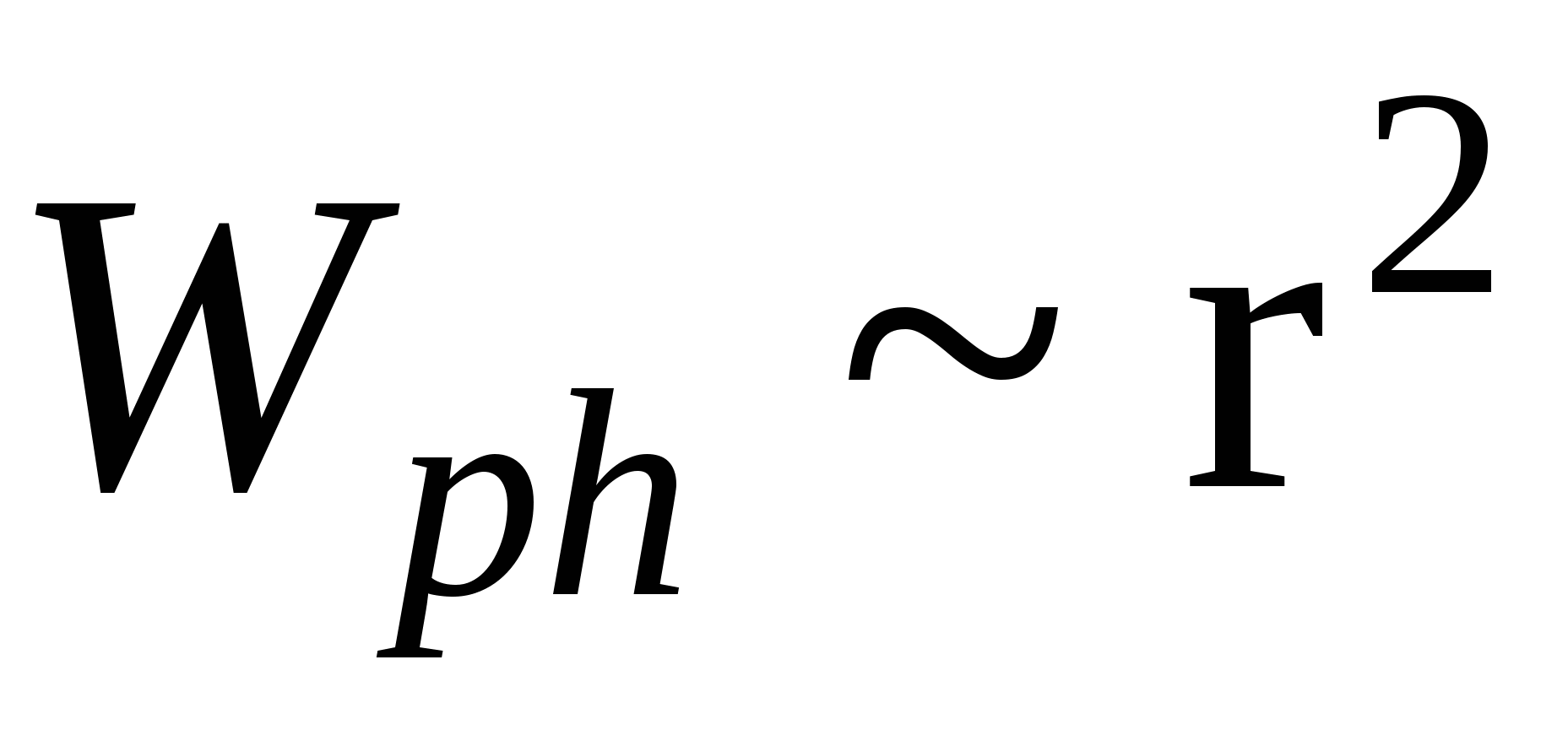
3) 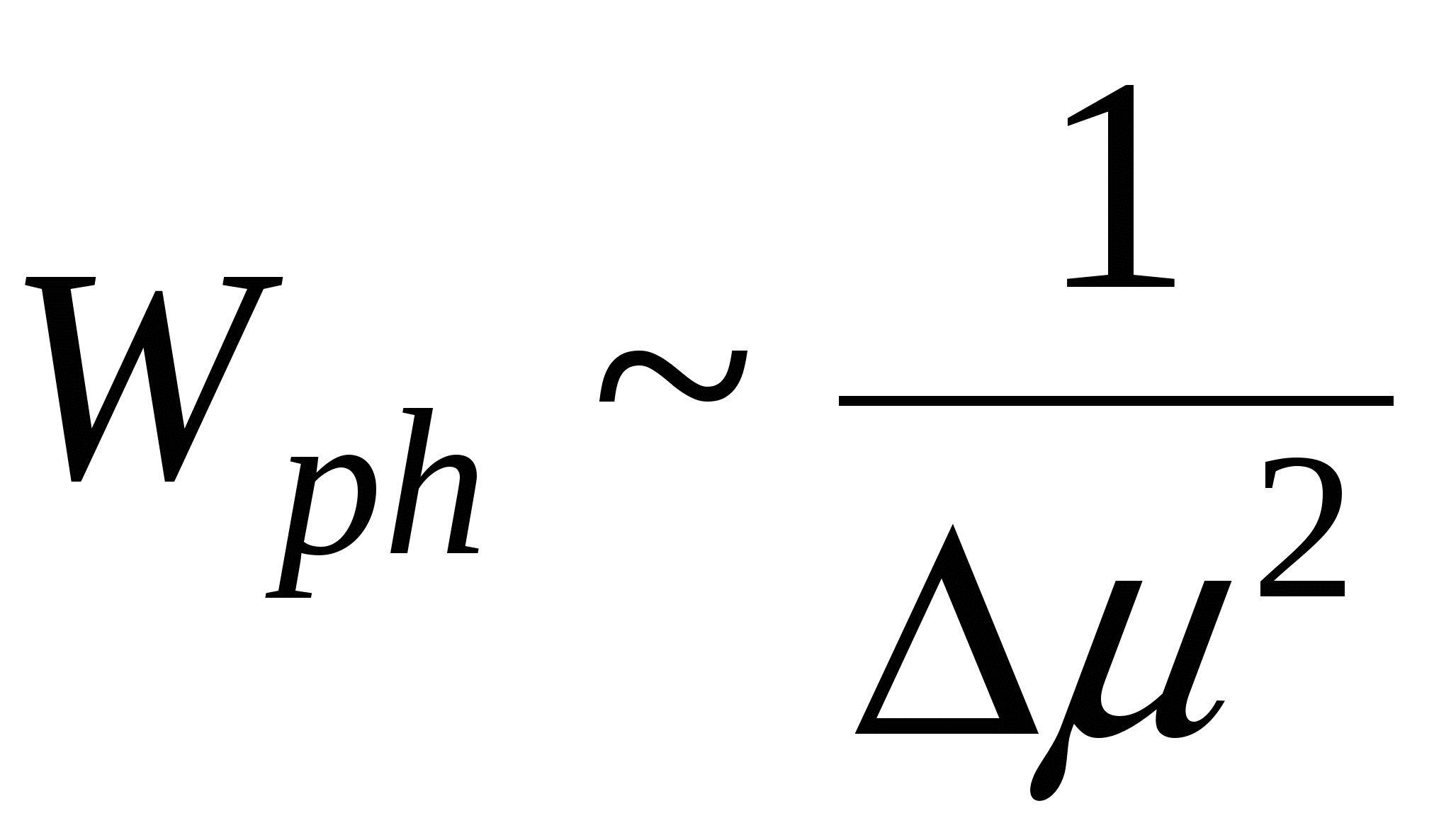
Чем больше пересыщение, тем меньше частица остатка.
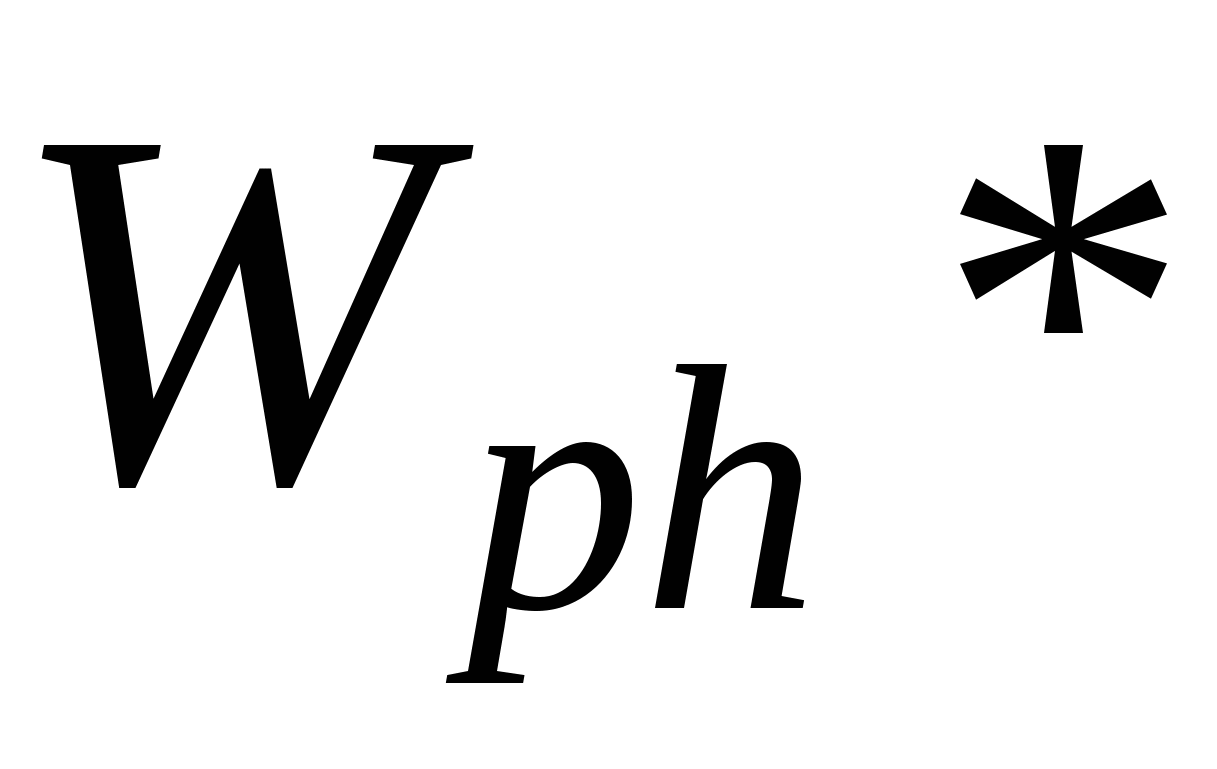 - Энергетический барьер, после преодоления которого в системе начинается самопроизвольное зародышеобразование. - Энергетический барьер, после преодоления которого в системе начинается самопроизвольное зародышеобразование.
Чем выше величина пересыщения в системе, тем меньше размеры критических зародышей.
Кинетика образования новой фазы.
Включает в себя две стадии:
1. Стадия образования зародышей (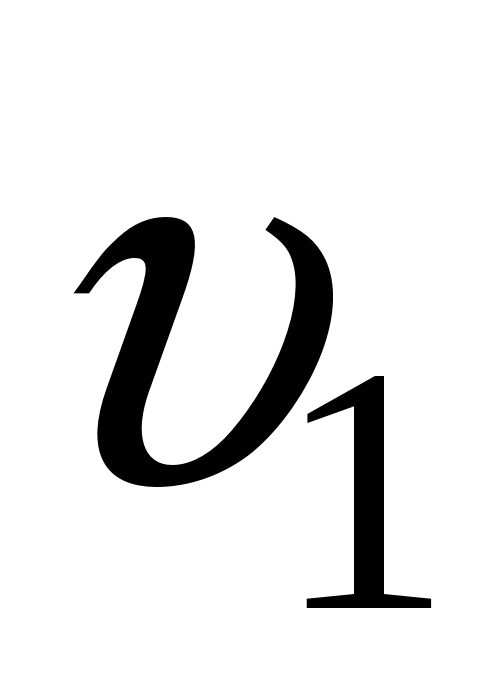 ). ).
Образование центров кристаллизации (I) .
Стадия доставки вещества к этим центрам(U).
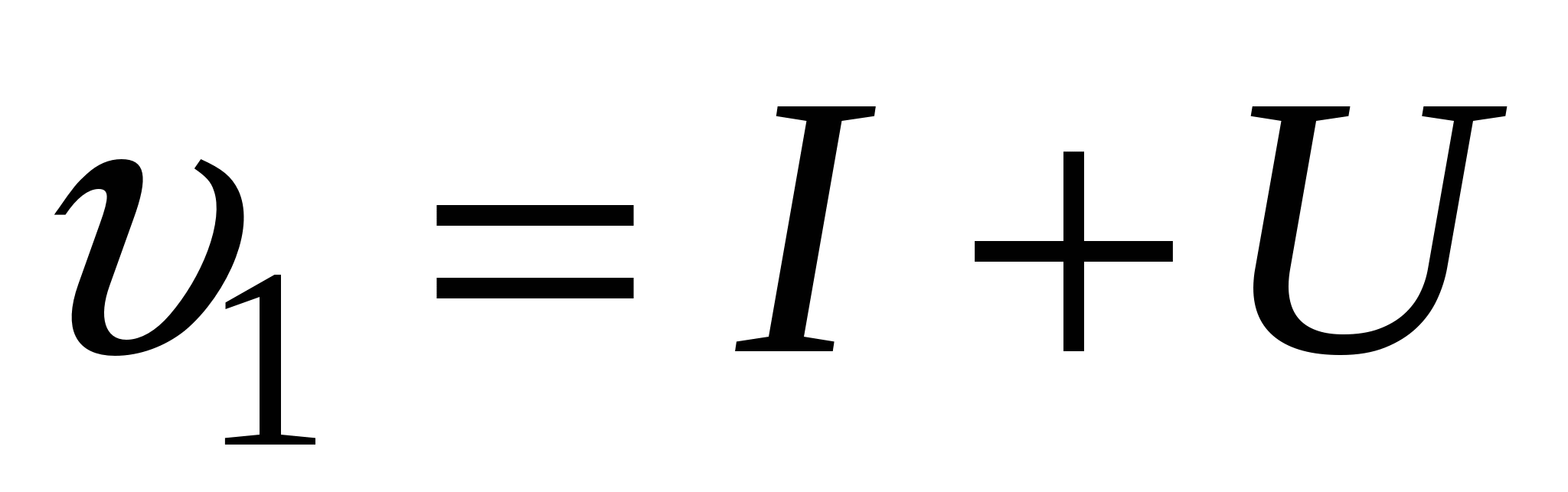
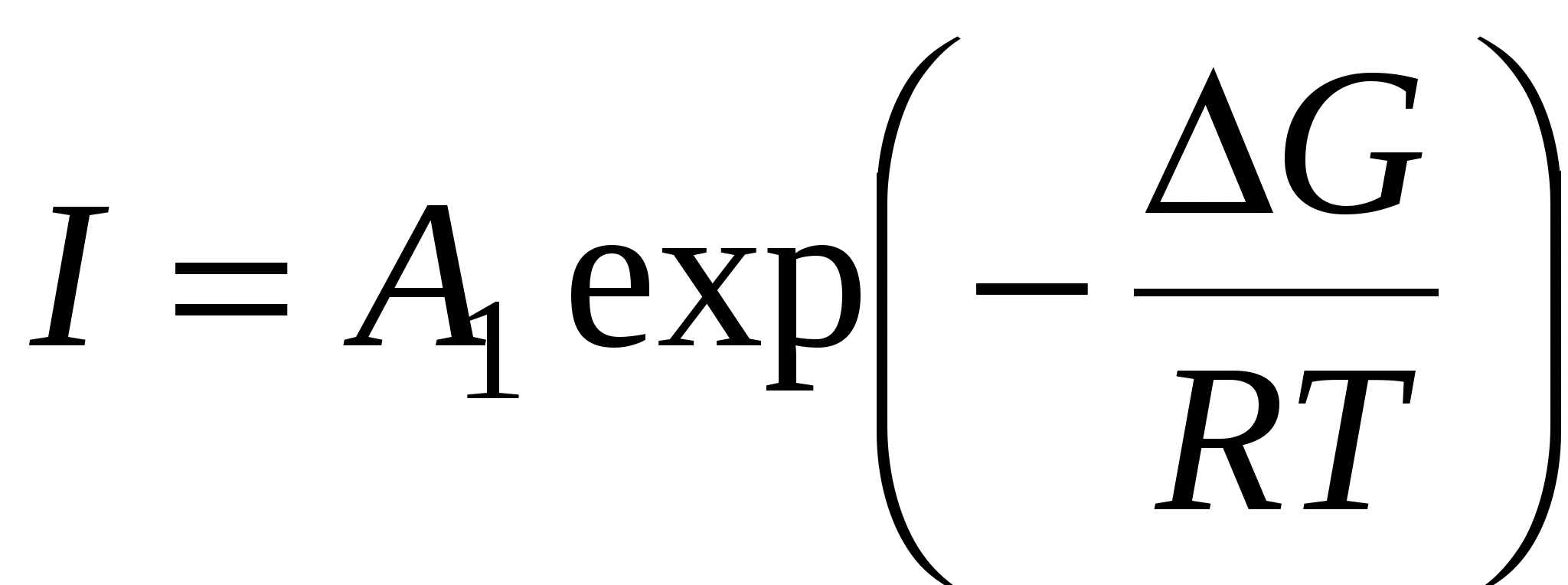 , , 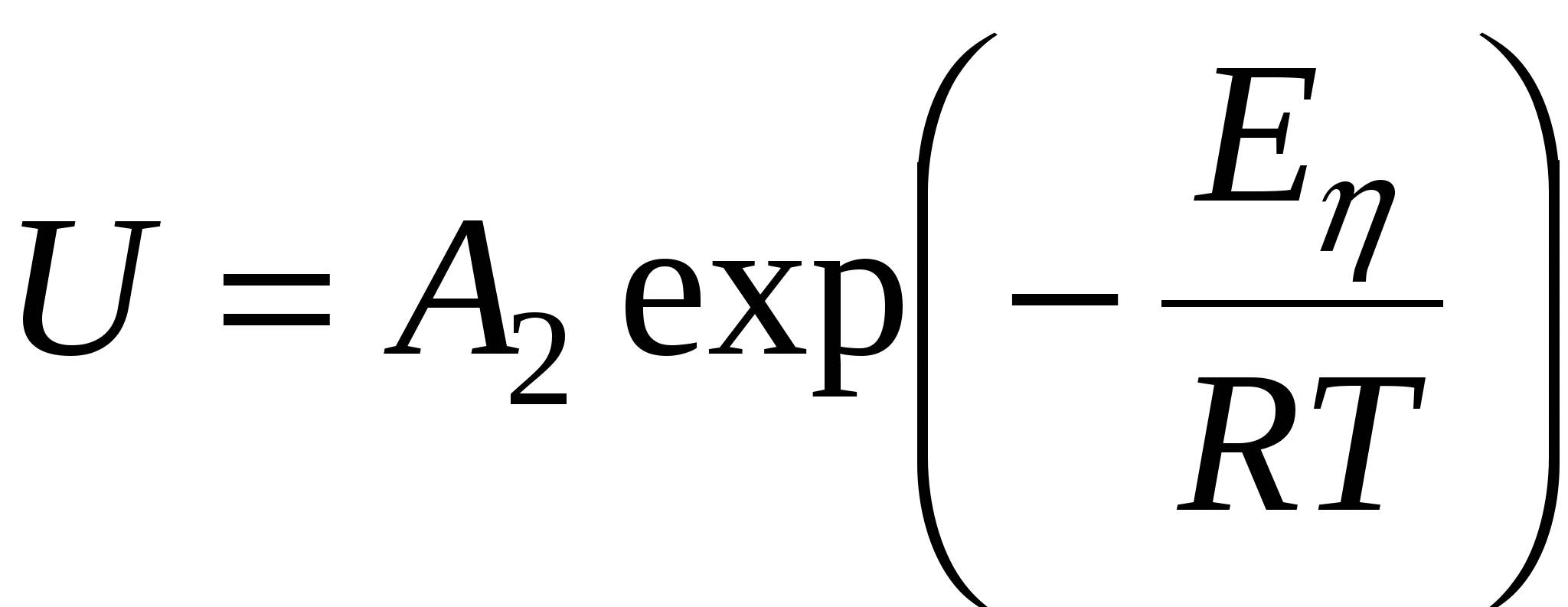
 - энергия Гиббса образования центра кристаллизации - энергия Гиббса образования центра кристаллизации
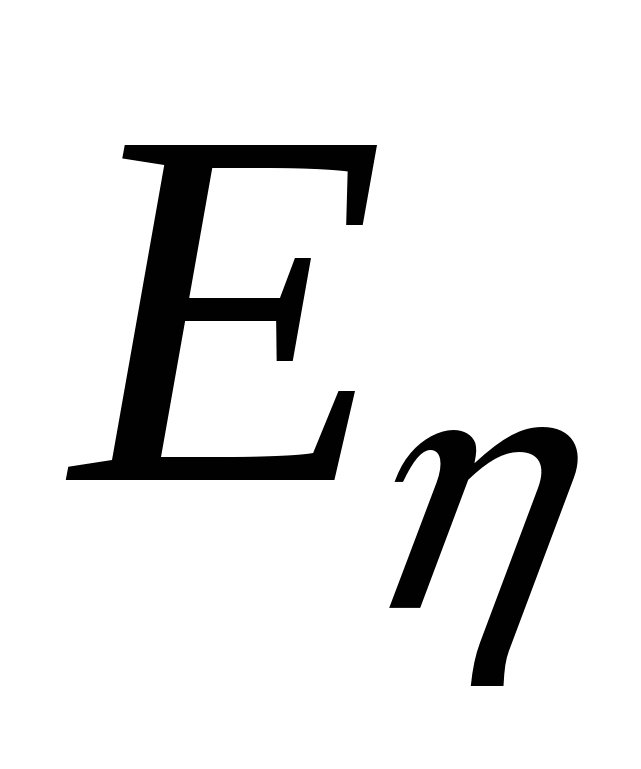 - энергия активации вязкого течения, - энергия активации вязкого течения,
т.к. вязкость 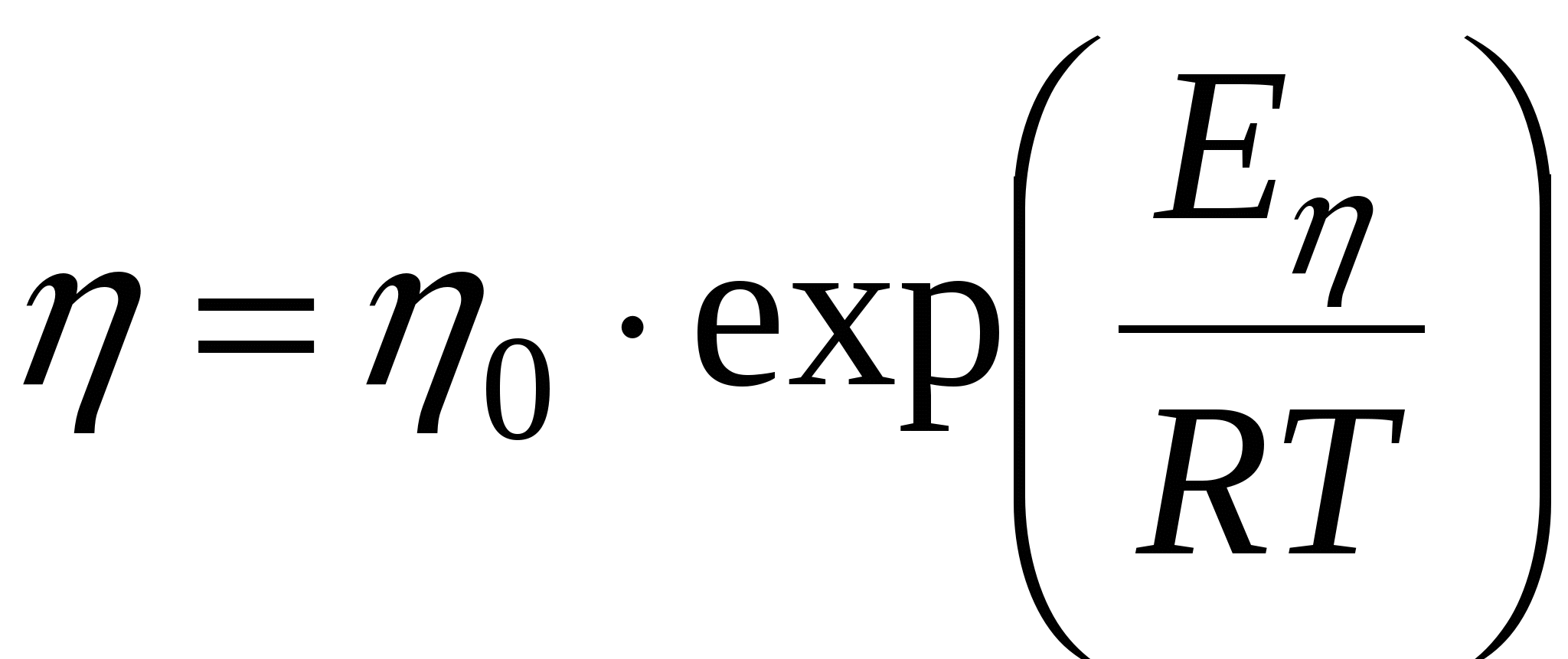
Скорость доставки обратно зависит от вязкости, поскольку в exp нет минуса. Скорость доставки обратная вязкости. Чем выше вязкость в системе, тем ниже скорость доставки.
Тогда для 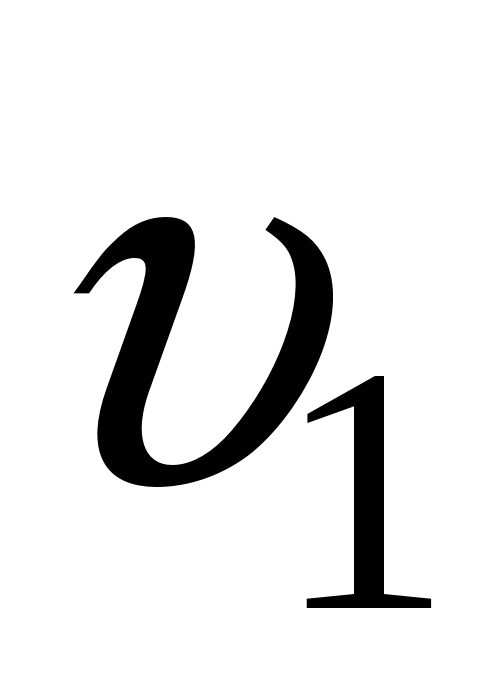 можно записать: можно записать: 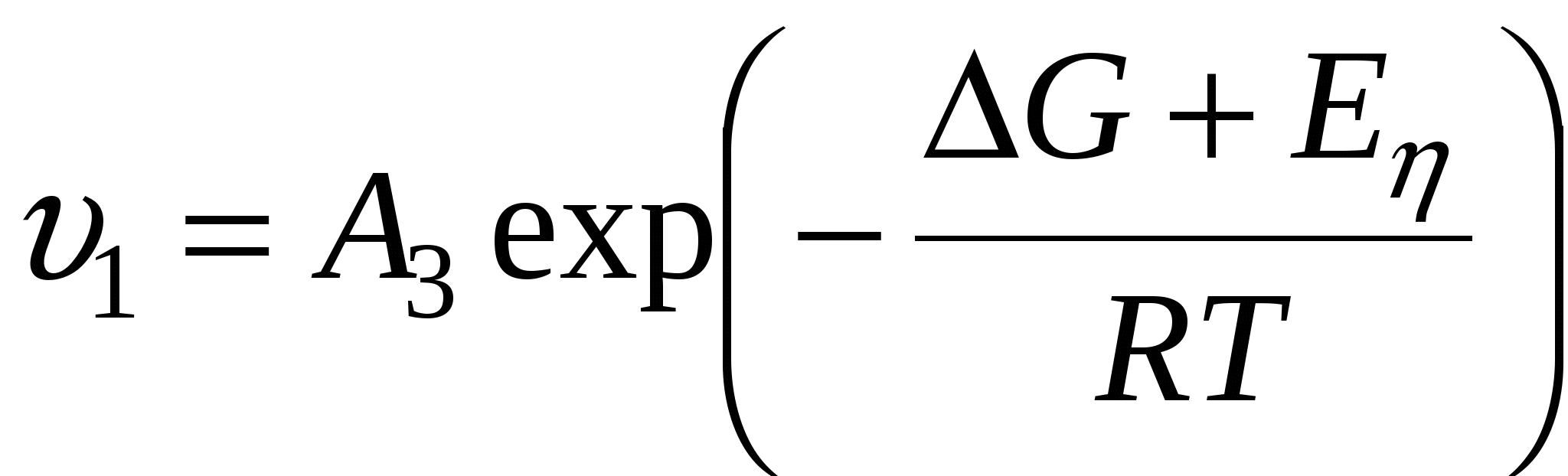
2. Стадия роста зародыша 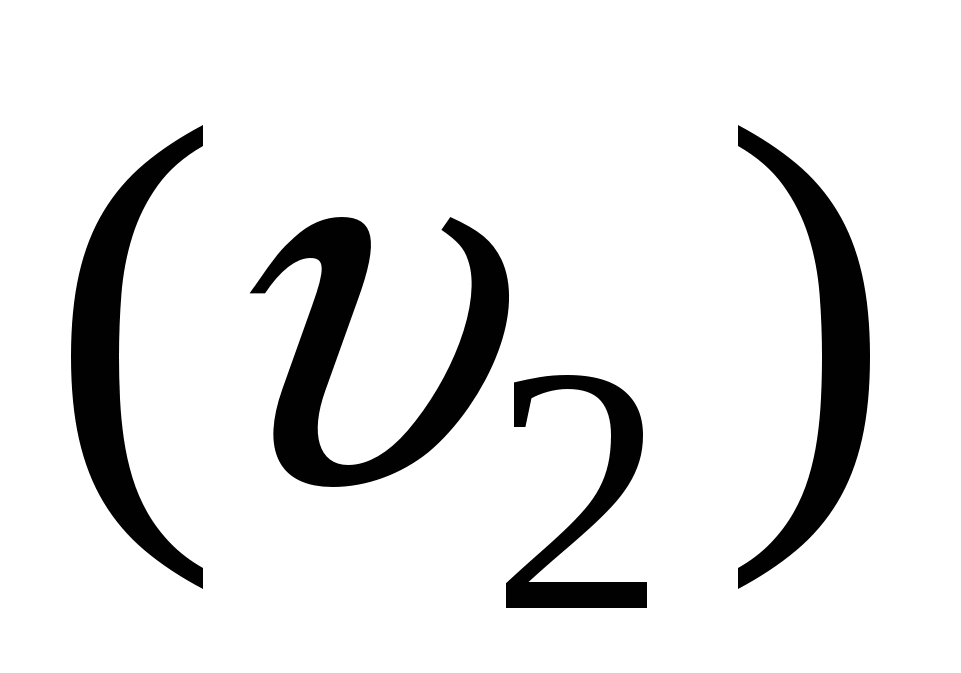 = образование центров двухмерной конденсации (I’) + доставка вещества к этим центрам (U). = образование центров двухмерной конденсации (I’) + доставка вещества к этим центрам (U). 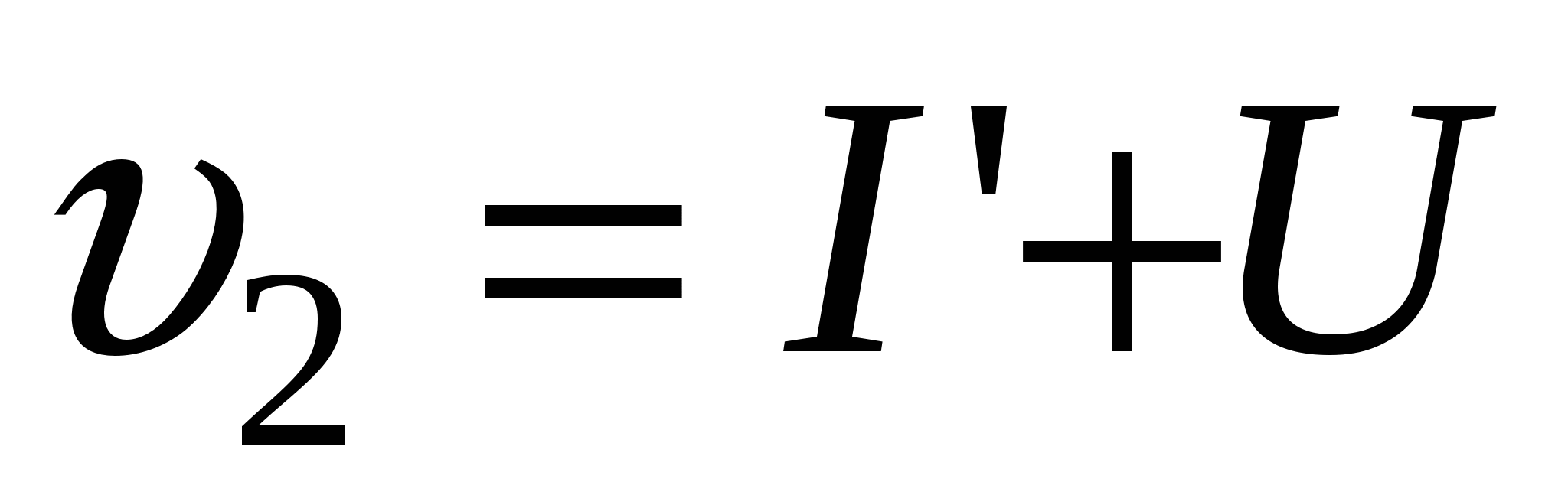
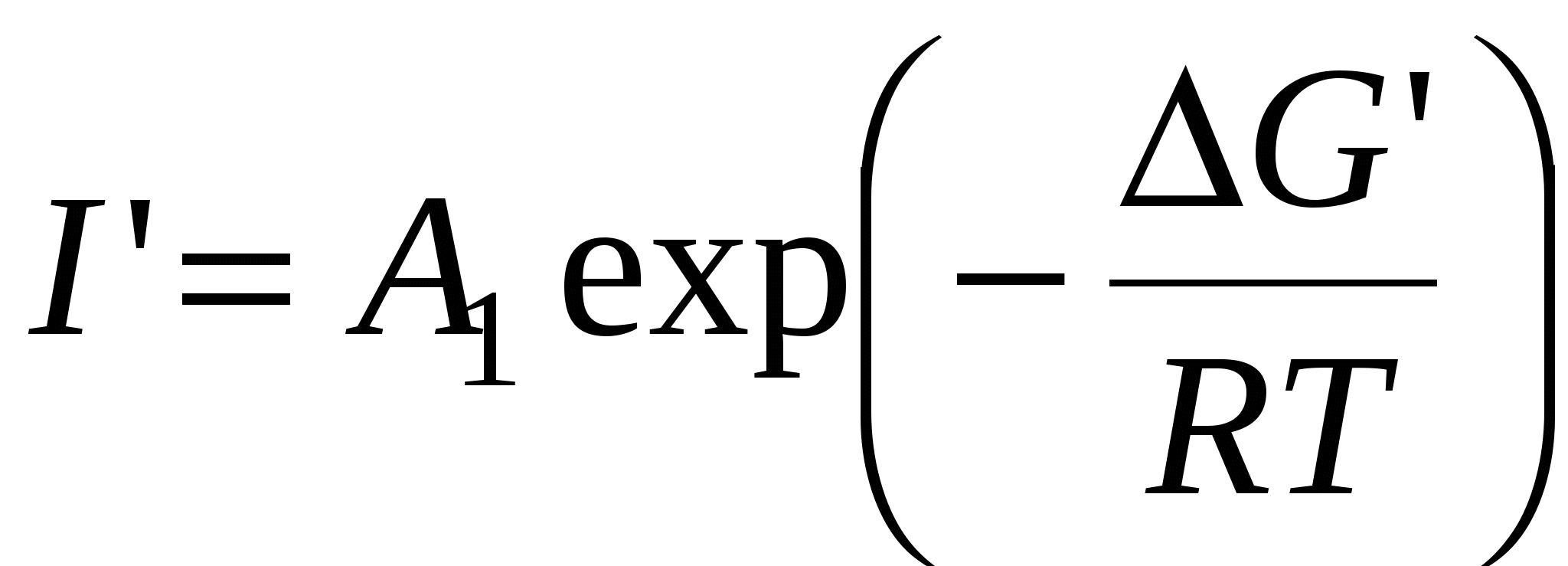
Для скорости роста: 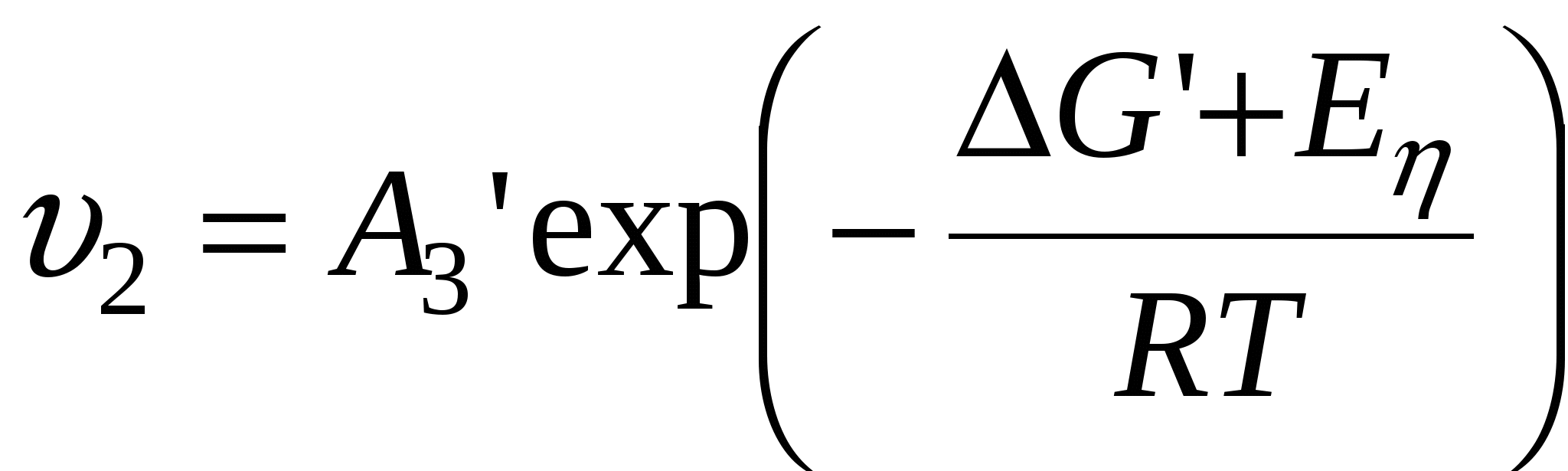
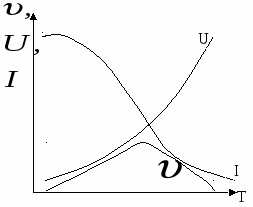
Чем больше температура, чем меньше переохлаждение в системе, тем хуже образуется зародыш (тем меньше скорость зародышеобразования и тем больше скорость доставки). Чем больше переохлаждение в системе, тем лучше зародыши растут.
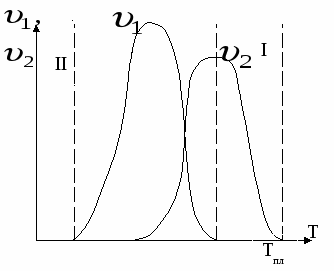
I – метастабильная зона переохлаждения, не происходит образования зародышей, вследствие недостаточного пересыщения в системе.
II – метастабильная зона высокой вязкости, в системе возможно образование зародышей, но невозможна доставка вещества, вследствие высокой вязкости.
Когда 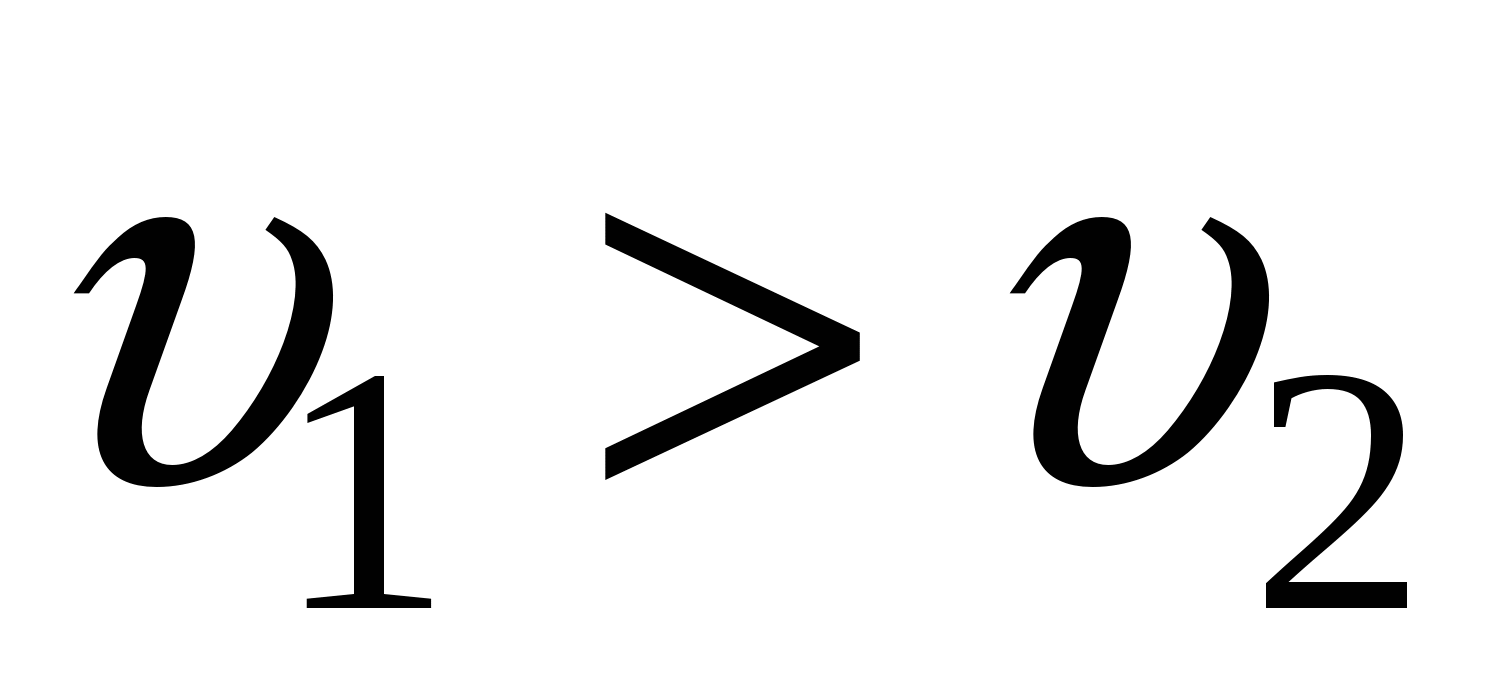 , т.н. зародыши образуются быстрее, чем вещество к ним доставляется – мелкокристаллические осадки (или высокодисперсные системы). , т.н. зародыши образуются быстрее, чем вещество к ним доставляется – мелкокристаллические осадки (или высокодисперсные системы).
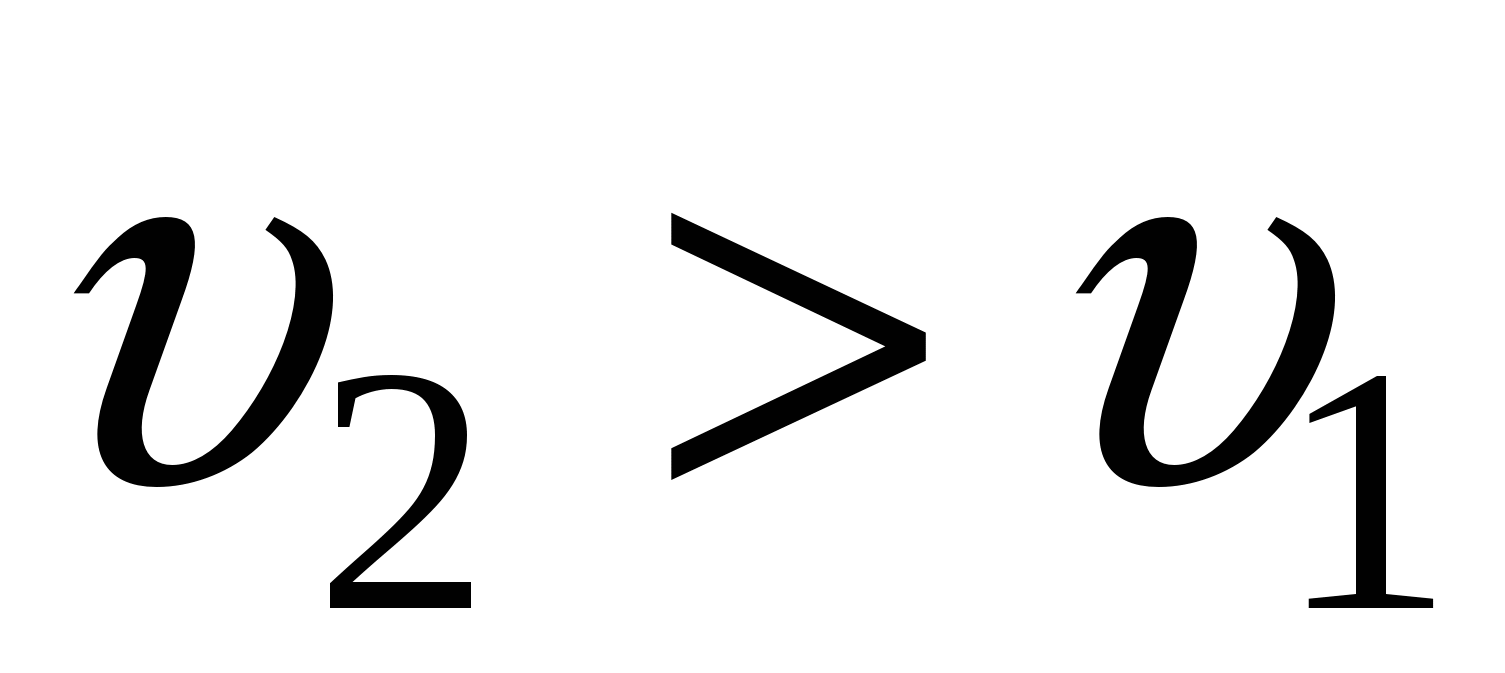 – крупнокристаллические осадки (среднедисперсные и грубодисперсные системы). – крупнокристаллические осадки (среднедисперсные и грубодисперсные системы).
|
|
|
 Скачать 1.77 Mb.
Скачать 1.77 Mb.