|
|
Коллоидная химия. Коллоидная химия Коллоидная химия наука о поверхностных явлениях и дисперсных системах. Поверхностное явление
Теория Штерна. Строение коллоидной мицеллы.
Двойной электрический слой состоит из двух частей: плотной и диффузной. Плотный слой образуется в результате взаимодействия потенциалобразующих ионов со специфически адсорбирующимися. Эти ионы, как правило, частично или полностью дегидратированы и могут иметь как одинаковый, так и противоположный к потенциалопределяющим ионам заряд. Это зависит от соотношения энергии электростатического взаимодействия 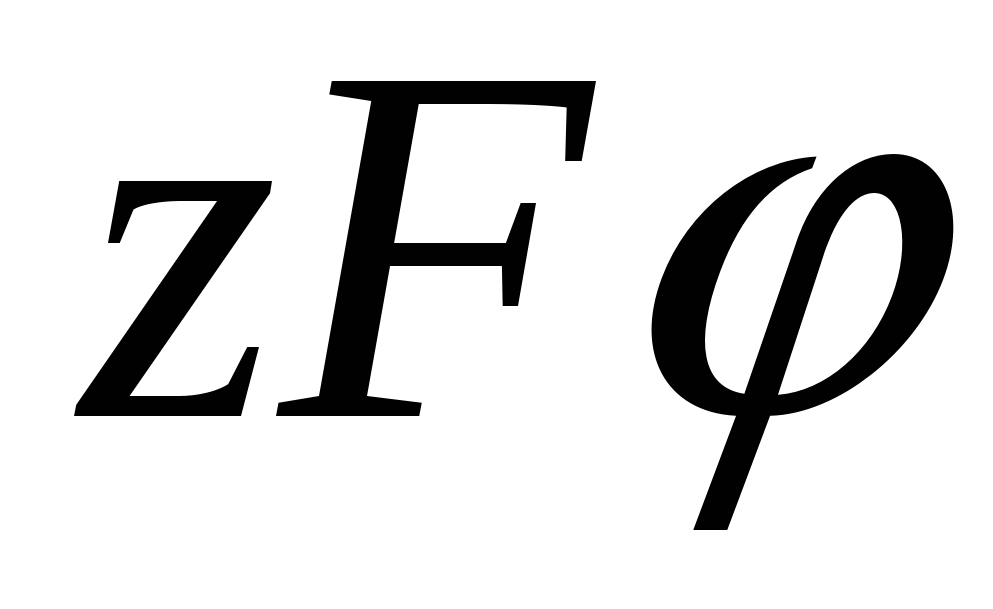 и потенциала специфической адсорбции и потенциала специфической адсорбции 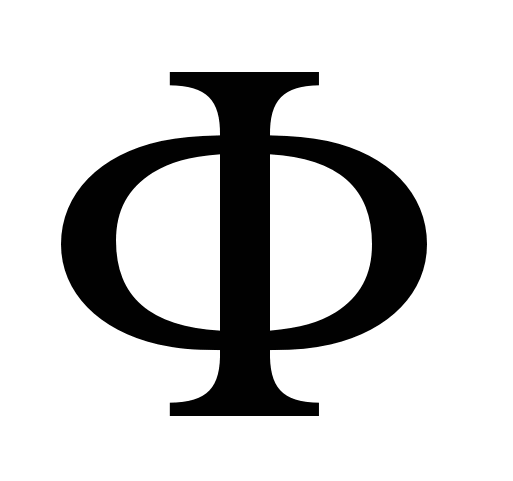 . Ионы плотного слоя закреплены. Другая часть ионов расположена в диффузном слое, эти ионы свободны и могут перемещаться вглубь раствора, т.е. из области большей концентрации в область меньшей. Общая плотность заряда складывается из двух частей. . Ионы плотного слоя закреплены. Другая часть ионов расположена в диффузном слое, эти ионы свободны и могут перемещаться вглубь раствора, т.е. из области большей концентрации в область меньшей. Общая плотность заряда складывается из двух частей.
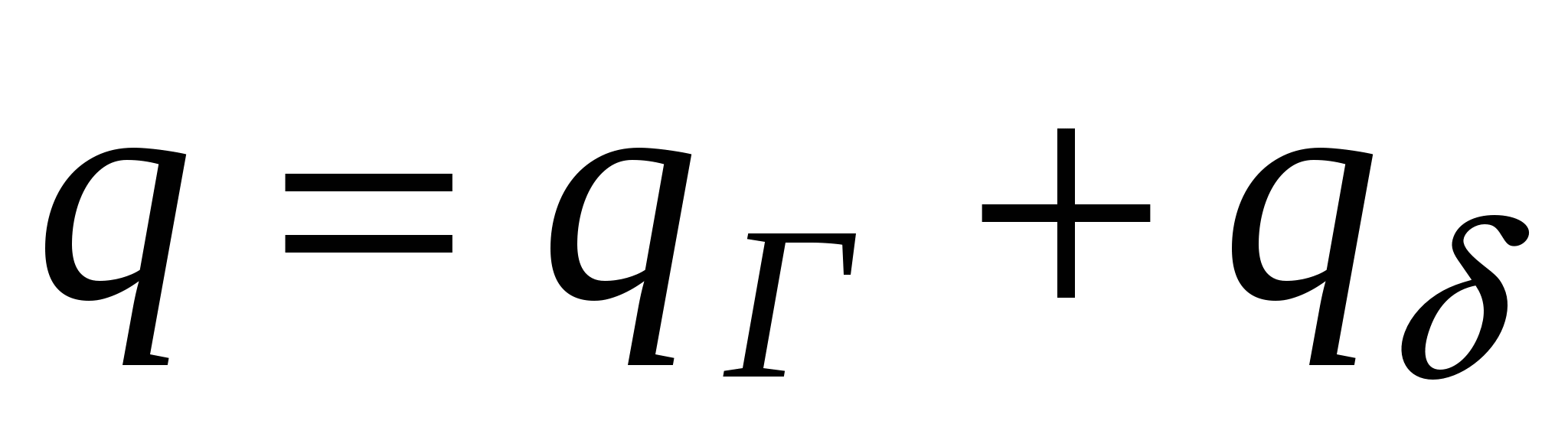
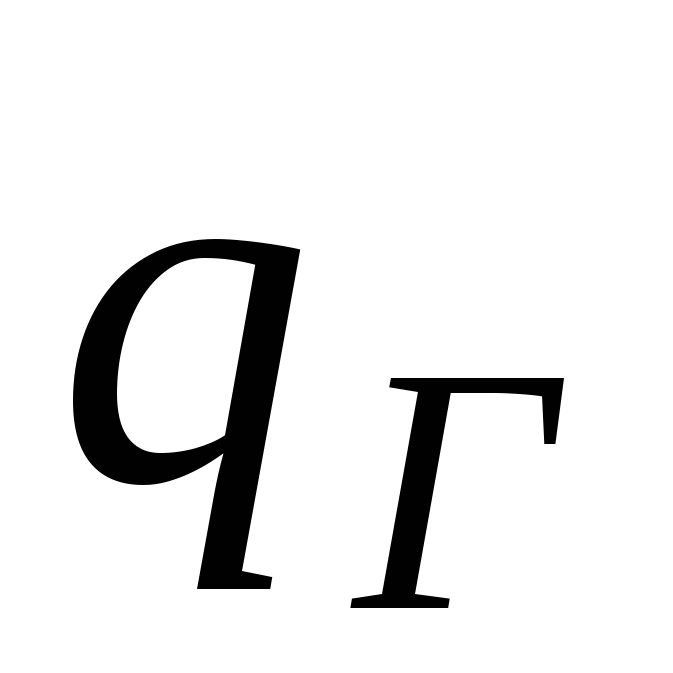 - заряд слоя Гельмгольца - заряд слоя Гельмгольца
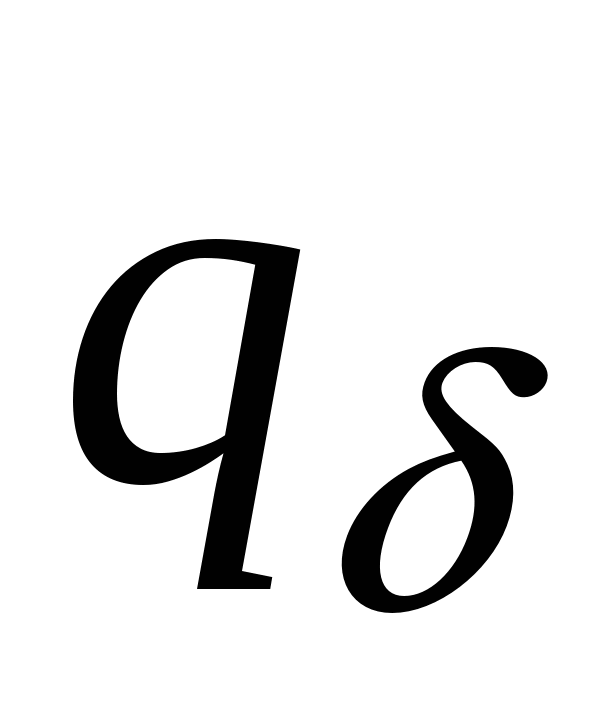 - Заряд диффузного слоя - Заряд диффузного слоя
Поверхность имеет определенное число адсорбционных центров, каждый из которых взаимодействует с одним противоионом. Константа такой квазихимической реакции равна:
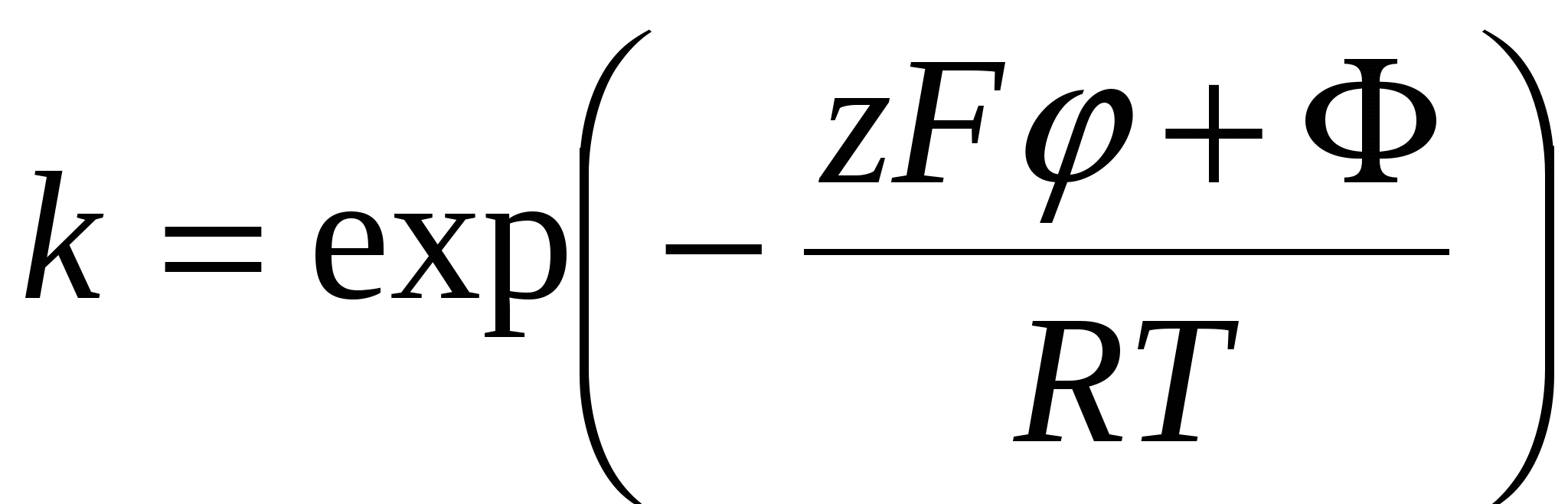
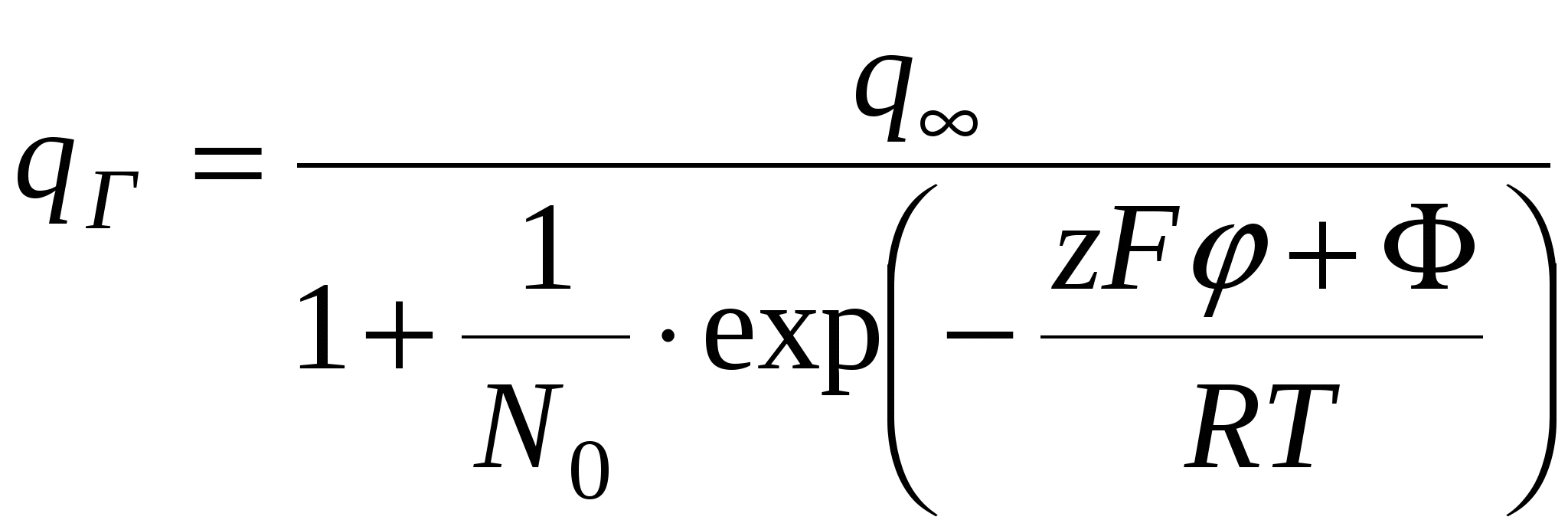 , где , где 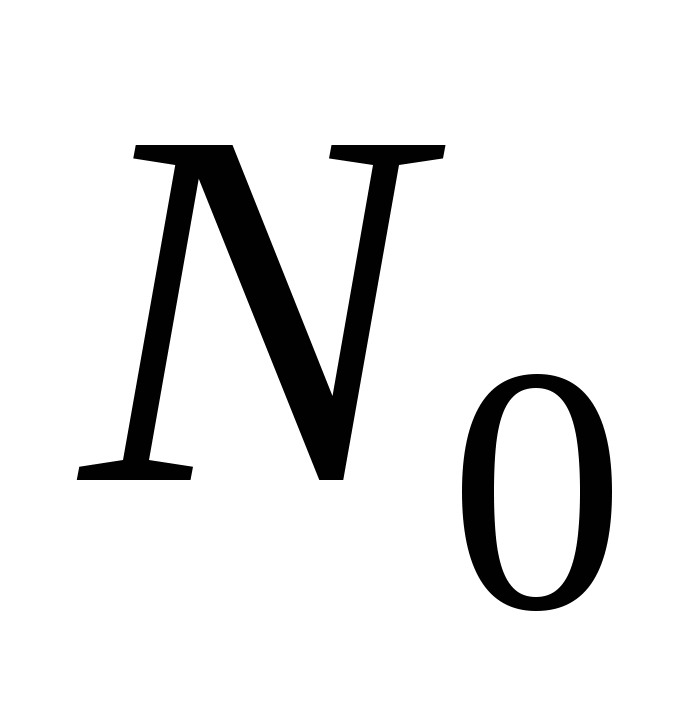 - мольная доля противоионов в растворе - мольная доля противоионов в растворе
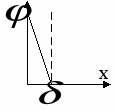
Распределение Гельмгольца
Потенциал убывает линейно
Р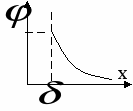 аспределение потенциала по Гуи. Плотного слоя нет, потенциал убывает экспоненциально со значения аспределение потенциала по Гуи. Плотного слоя нет, потенциал убывает экспоненциально со значения 
Р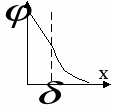 аспределение по Штерну. аспределение по Штерну.
Вначале снижение потенциала линейно, а затем экспоненциально.
При наложении электрического поля в случае электрофореза движется не непосредственно частица твердой фазы, а частица твердой фазы со слоем окружающих её ионов. ДЭС повторяет форму частицы дисперсной фазы. При наложении потенциала отрывается часть диффузного слоя. Линия разрыва называется границей скольжения.
Потенциал, возникающий на границе скольжения в результате отрыва части диффузного слоя, называется электрокинетическим потенциалом (Дзэта потенциал  ). ).
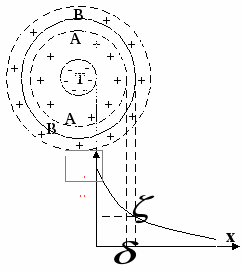
Частица дисперсной фазы, с окружающим её слоем противоионов и двойным электрическим слоем называется мицеллой.
Правила написания коллоидных мицелл:
В агрегате мицеллы всегда лежит труднорастворимое соединение.
Для того, чтобы образовалась дисперсная система, один из электролитов должен присутствовать в избытке.
ДЭС образуется из ионов электролита, который берут в избытке.
Потенциал поверхности (потенциалопределяющие ионы) – это ионы одноименные к дисперсной фазе.
Противоионы образуют плотную и диффузные части ДЭС. На образовании плотной части расходуется 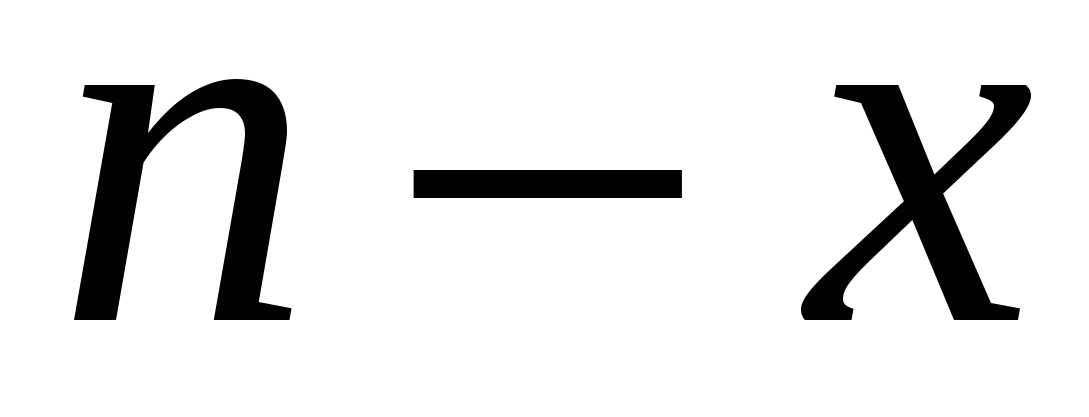 ионов, на образование диффузной части - ионов, на образование диффузной части - 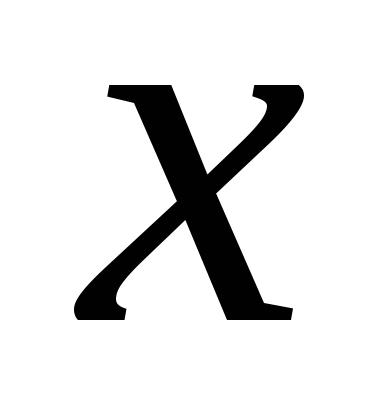 . .
Мицелла электронейтральная.
при написании формулы необходимо учитывать стехиометрические коэффициенты.
1-1 зарядный электролит
T – частица дисперсной фазы.
AA – граница плотной и диффузной части.
BB – граница скольжения.
Граница скольжения может совпадать с линией AA, а может и не совпадать.
Значения pH, при котором дзэта-потенциал равен нулю, называется изоэлектрической точкой.
CaCl2 + Na2SO4 → CaSO4↓ + 2NaCl
1. В избытке CaCl2
CaCl2 ↔ Ca2+ + 2Cl-
{CaSO4m∙nCa2+2(n - x)Cl-}2x+xCl- - запись мицеллы.
CaSO4m – агрегат.
CaSO4m∙nCa2+ – ядро.
CaSO4m∙nCa2+2(n - x)Cl- - частица.
2. В избытке Na2SO4
Na2SO4↔2Na+ + SO42-
{CaSO4m∙nSO42-2(n-x)Na+}2x-2xNa+ - мицелла
CaSO4m – агрегат.
CaSO4m∙nSO4 2+ – ядро.
CaSO4m∙nSO42-2(n-x)Na+ - частица
Уравнение Гелемгольца-Смолуховского
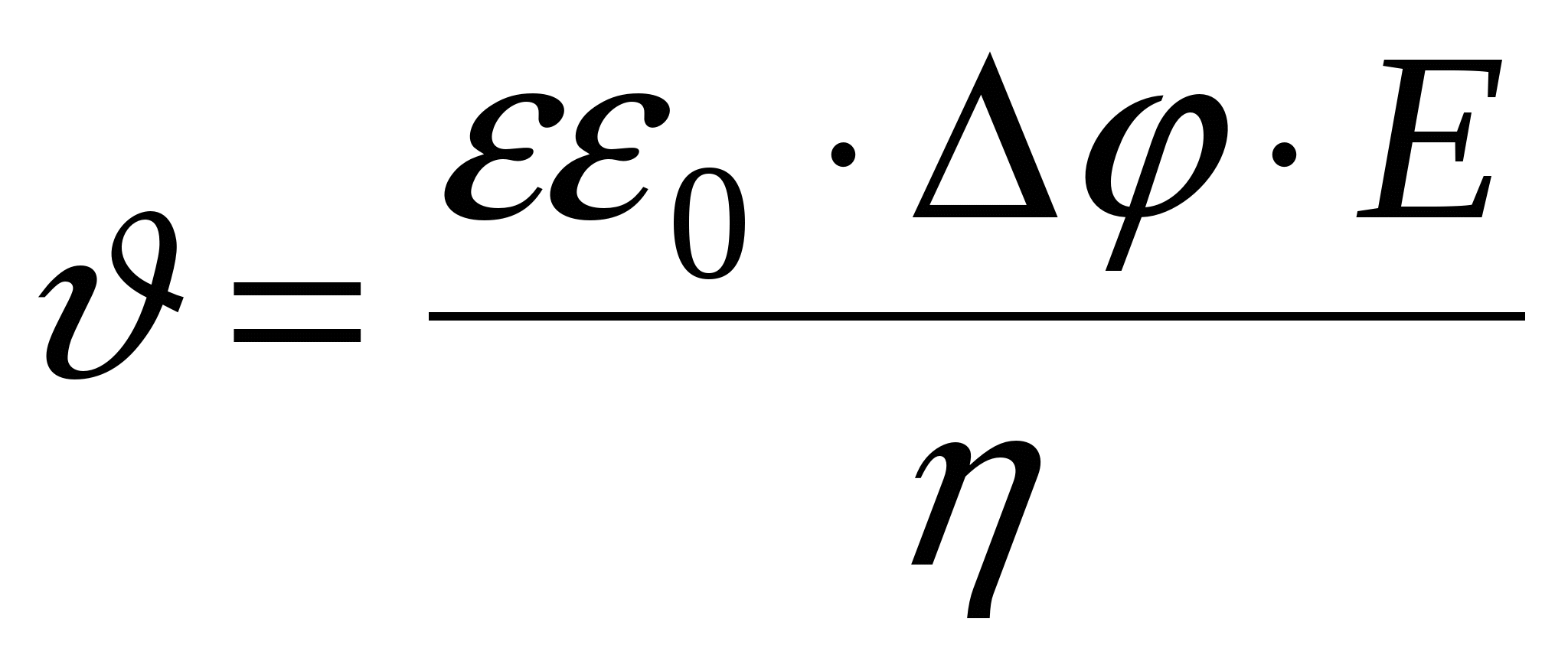
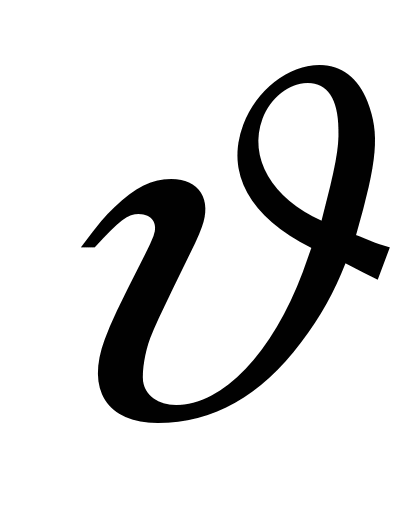 - линейная скорость смещения границ (в электроосмосе). - линейная скорость смещения границ (в электроосмосе).
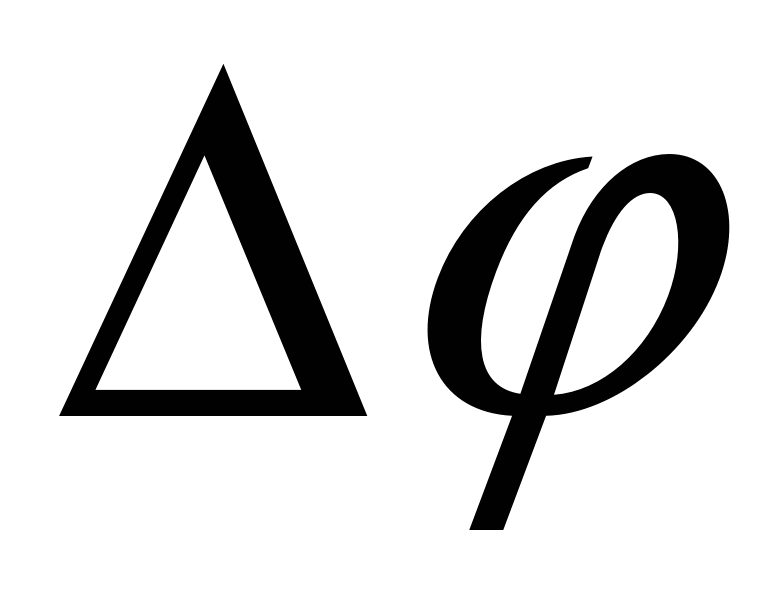 - разность потенциалов на обкладках конденсатора (в электроосмосе). - разность потенциалов на обкладках конденсатора (в электроосмосе).
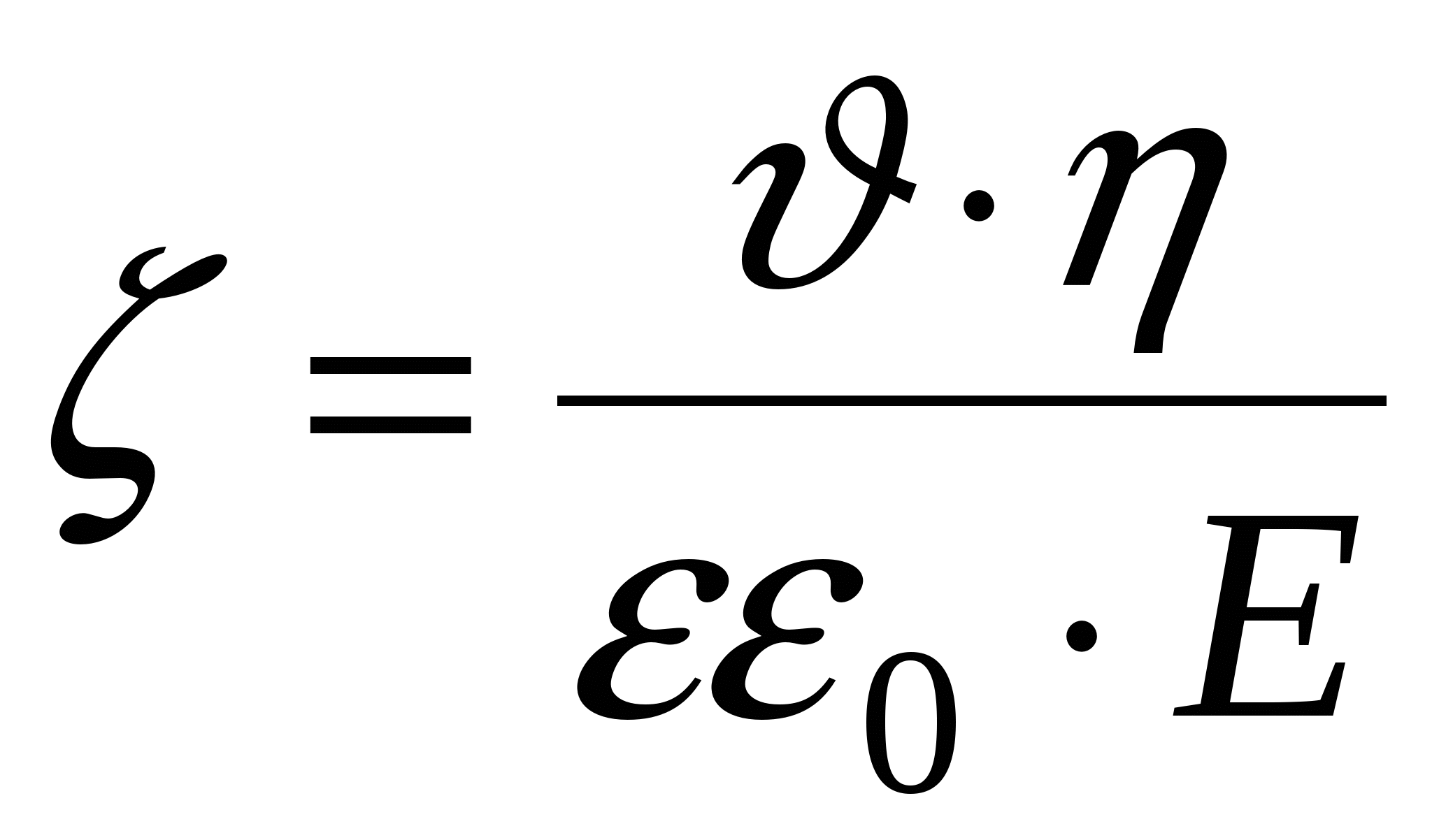
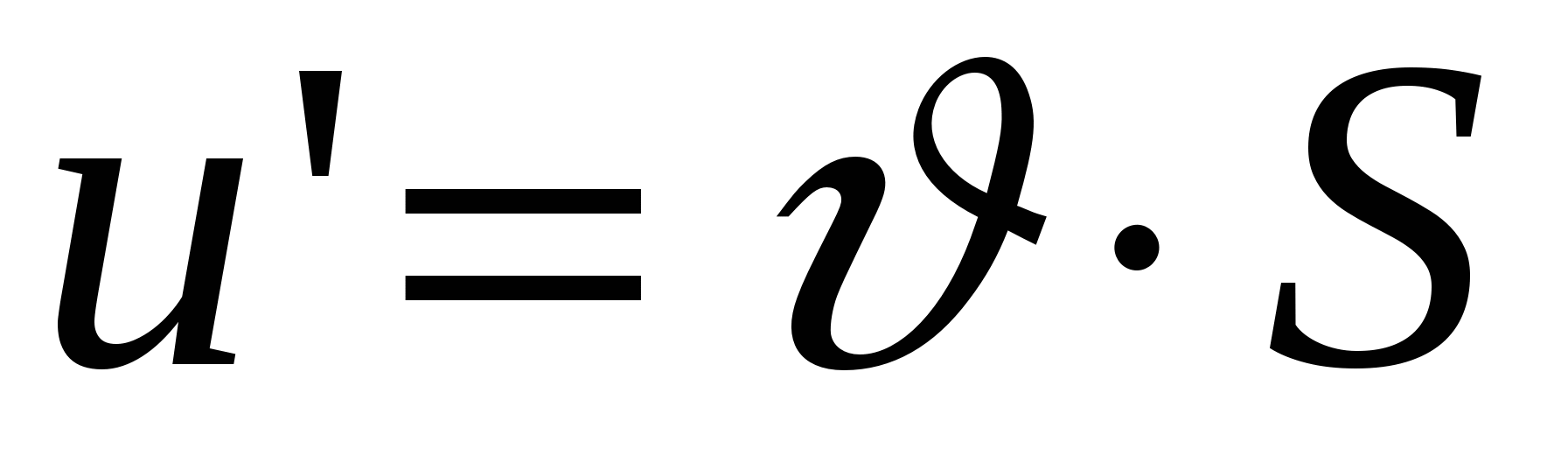 - объемная скорость течения раствора, S – площадь поперечного сечения ячейки. - объемная скорость течения раствора, S – площадь поперечного сечения ячейки.
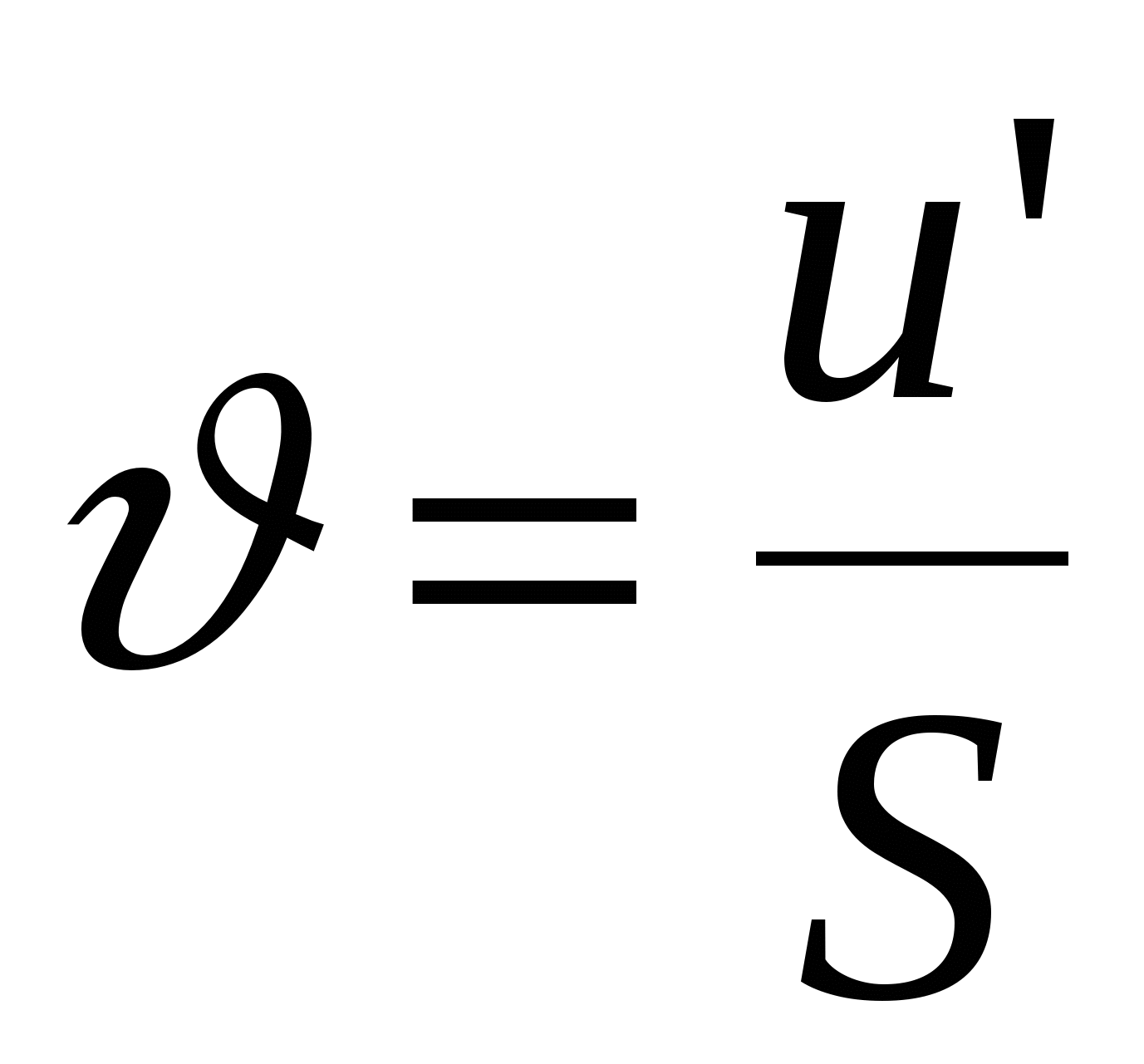
E – напряженность электрического поля.
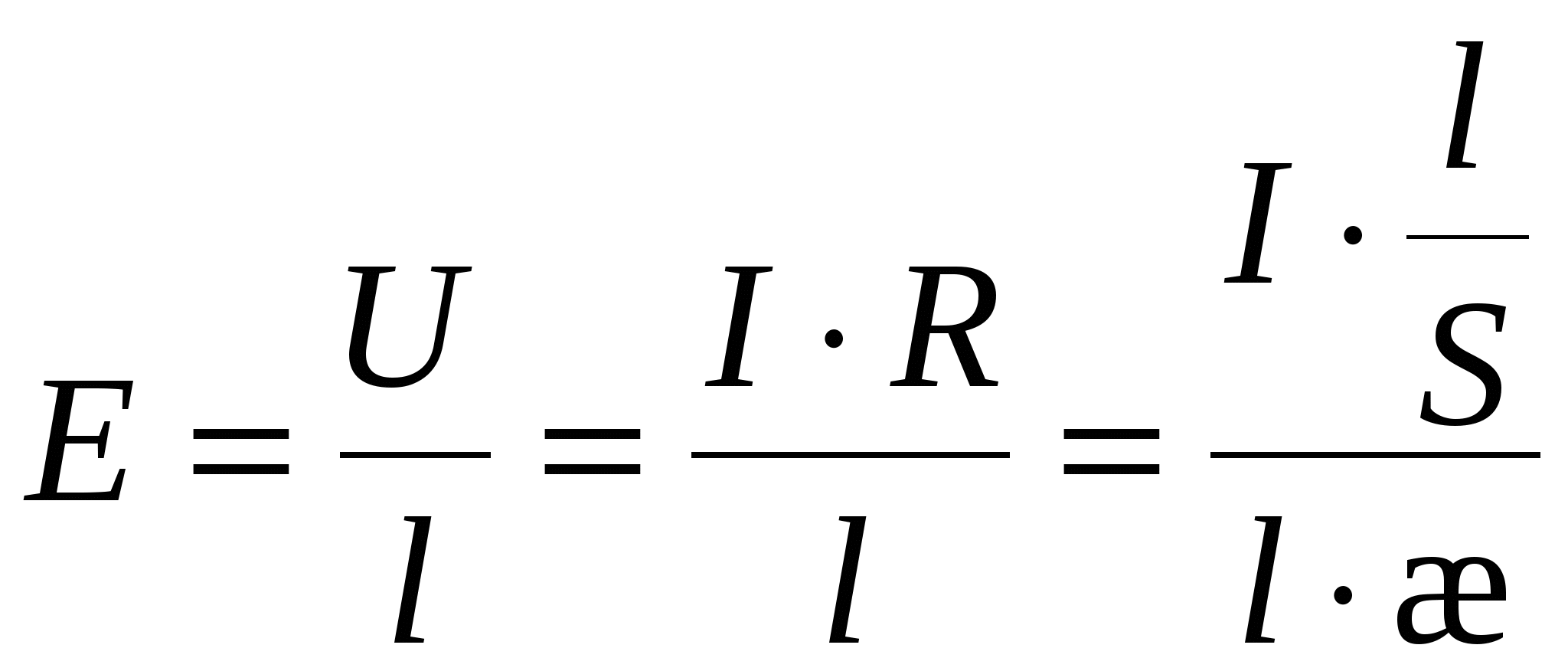
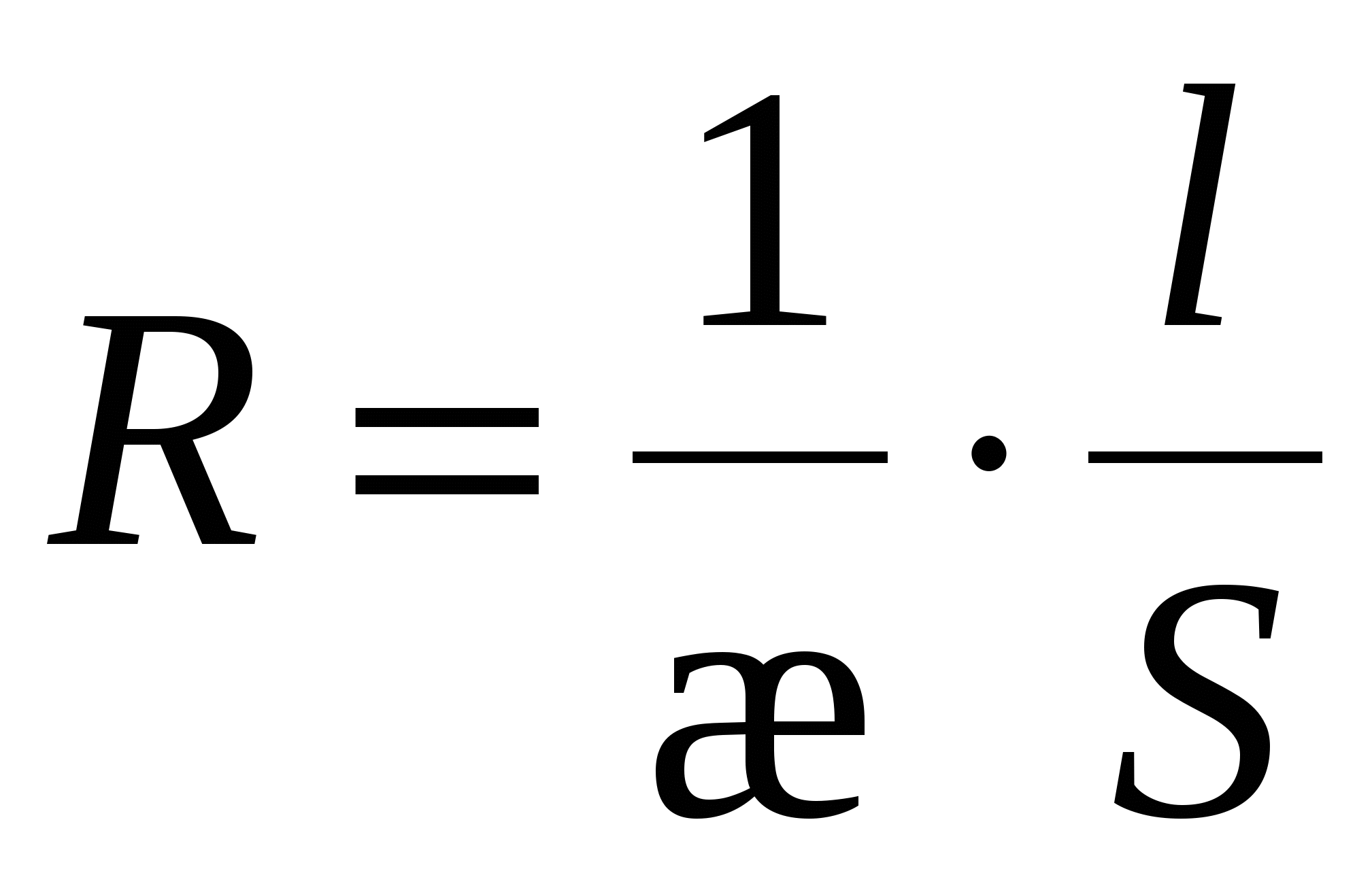
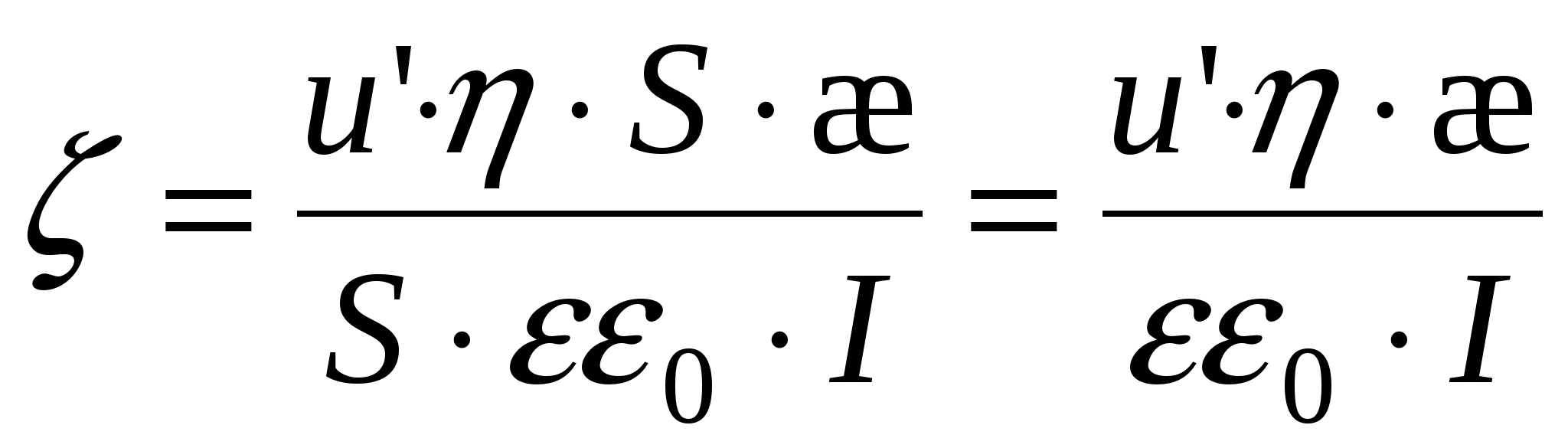 (для электроосмоса). (для электроосмоса).
Для потенциала течения:
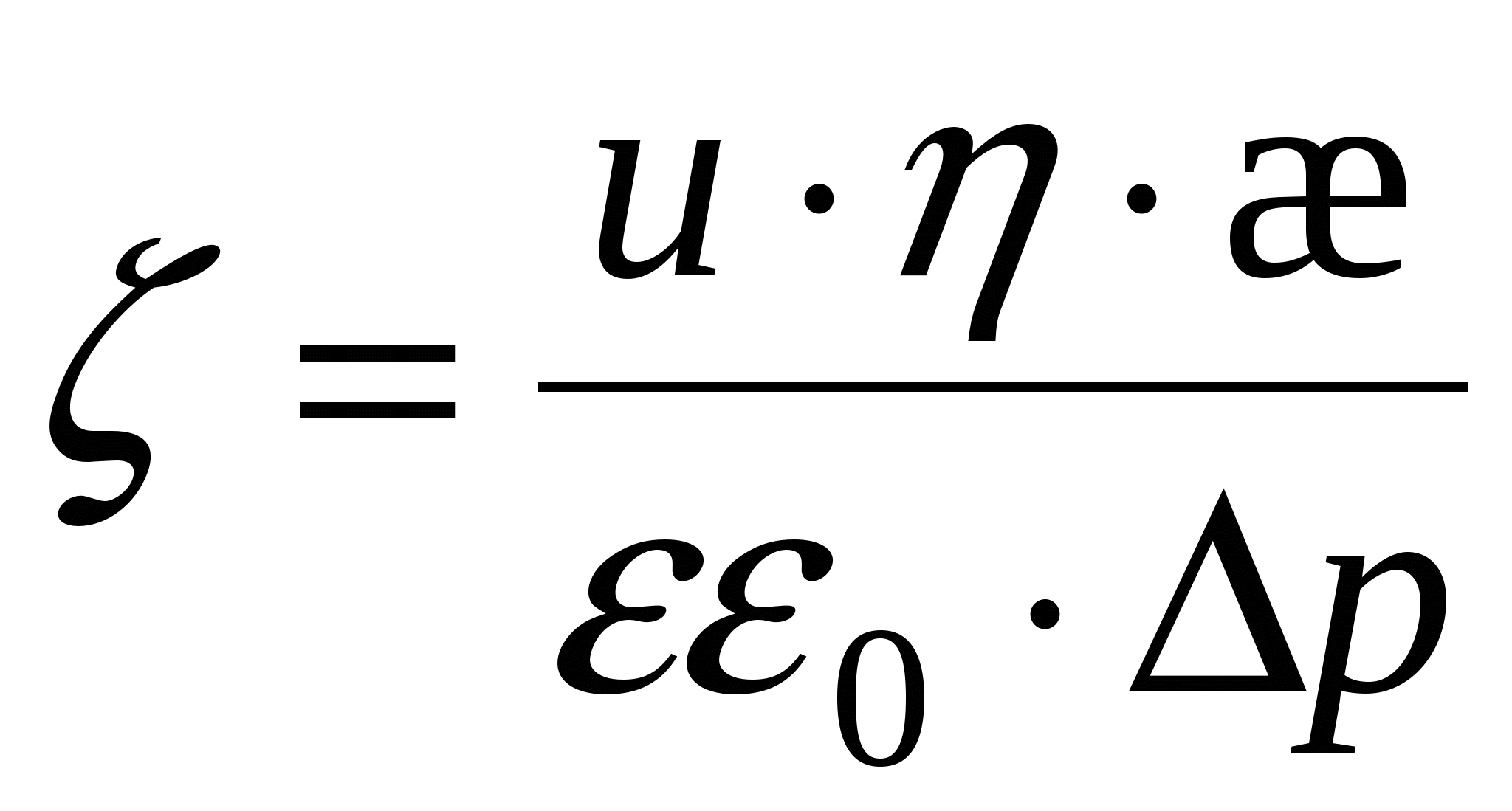
 - потенциал - потенциал
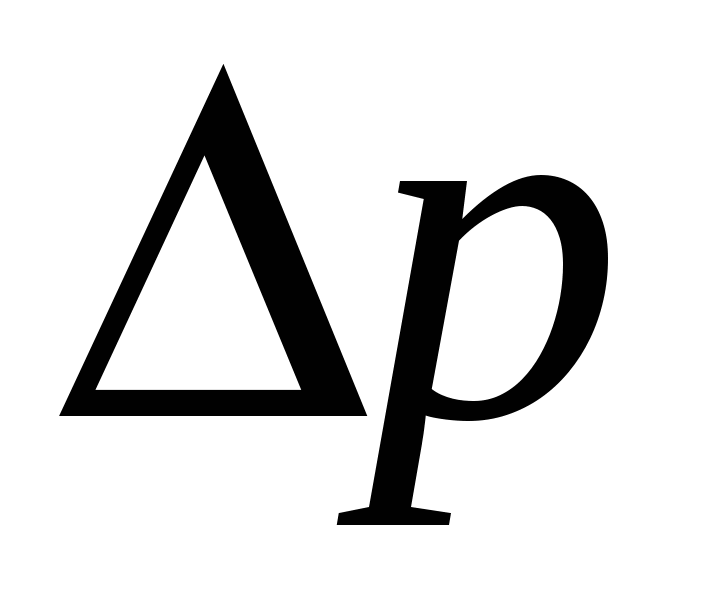 - давление на мембрану - давление на мембрану
Как правило, значение электрофоретических подвижностей и электроосмотических подвижностей меньше расчетных. Это происходит вследствие:
Релаксационного эффекта (при движении частицы дисперсной фазы нарушается симметрия ионной атмосферы).
Электрофоретического торможения (возникновение дополнительного трения в результате движения противоионов).
Искажение линий тока в случае электропроводных частиц.
Связь поверхностного натяжения с потенциалом. Уравнение Липпмана.
Образование ДЭС происходит самопроизвольно вследствие стремления системы снизить свою поверхностную энергию. В условиях постоянства T и p обобщенное уравнение первого и второго законов термодинамики выглядит:
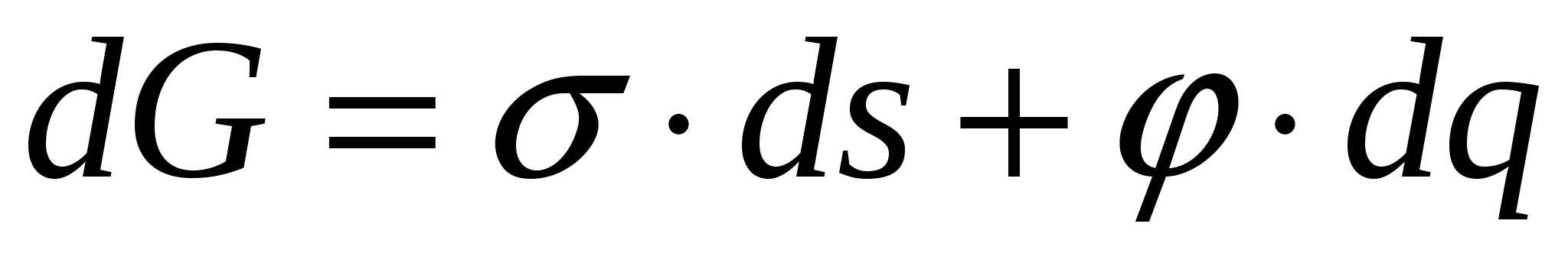 (1) (1)
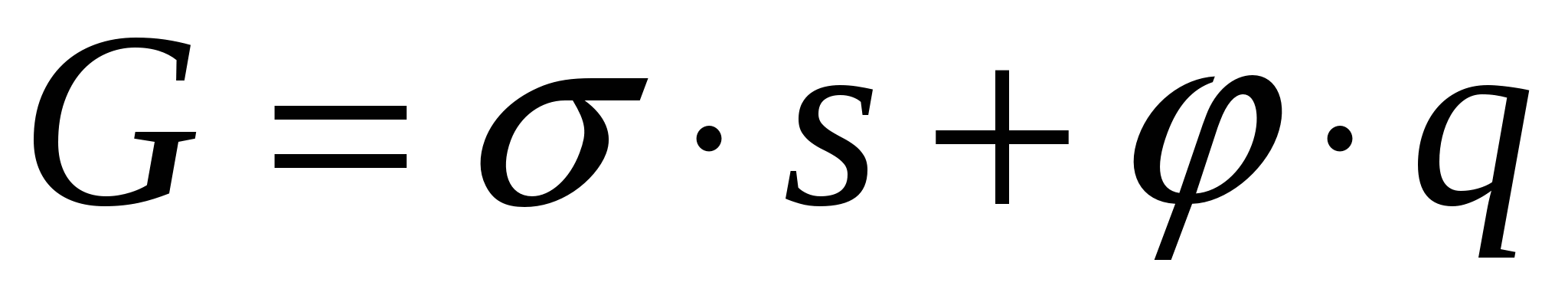 (2) (2)
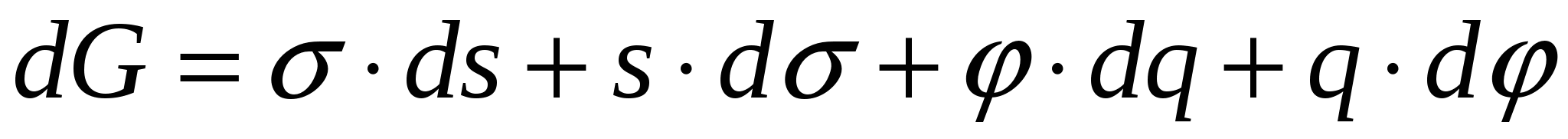 (3), (1)=(3) => (3), (1)=(3) =>
=> 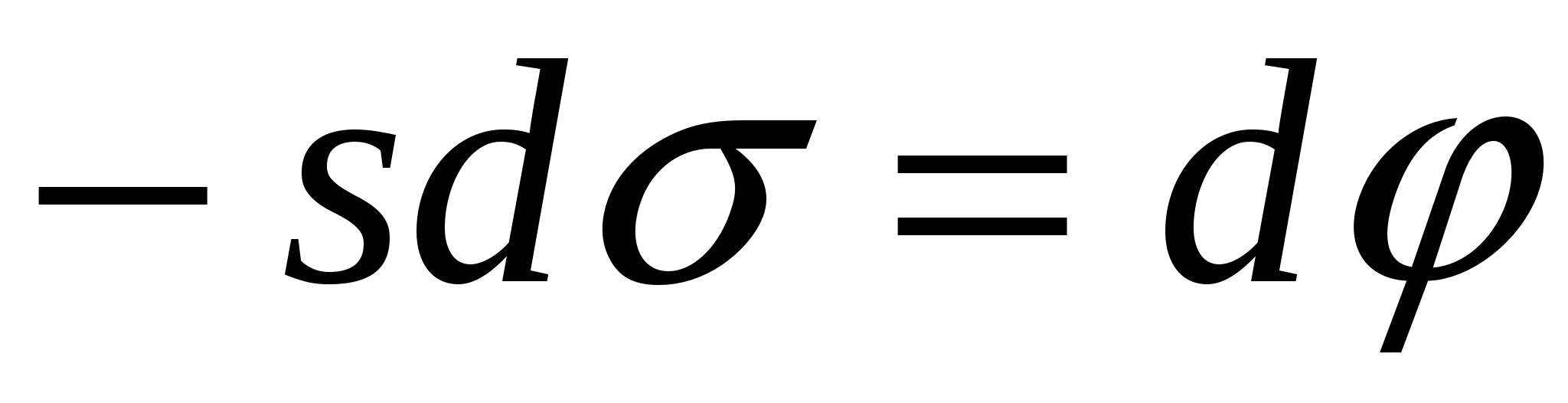
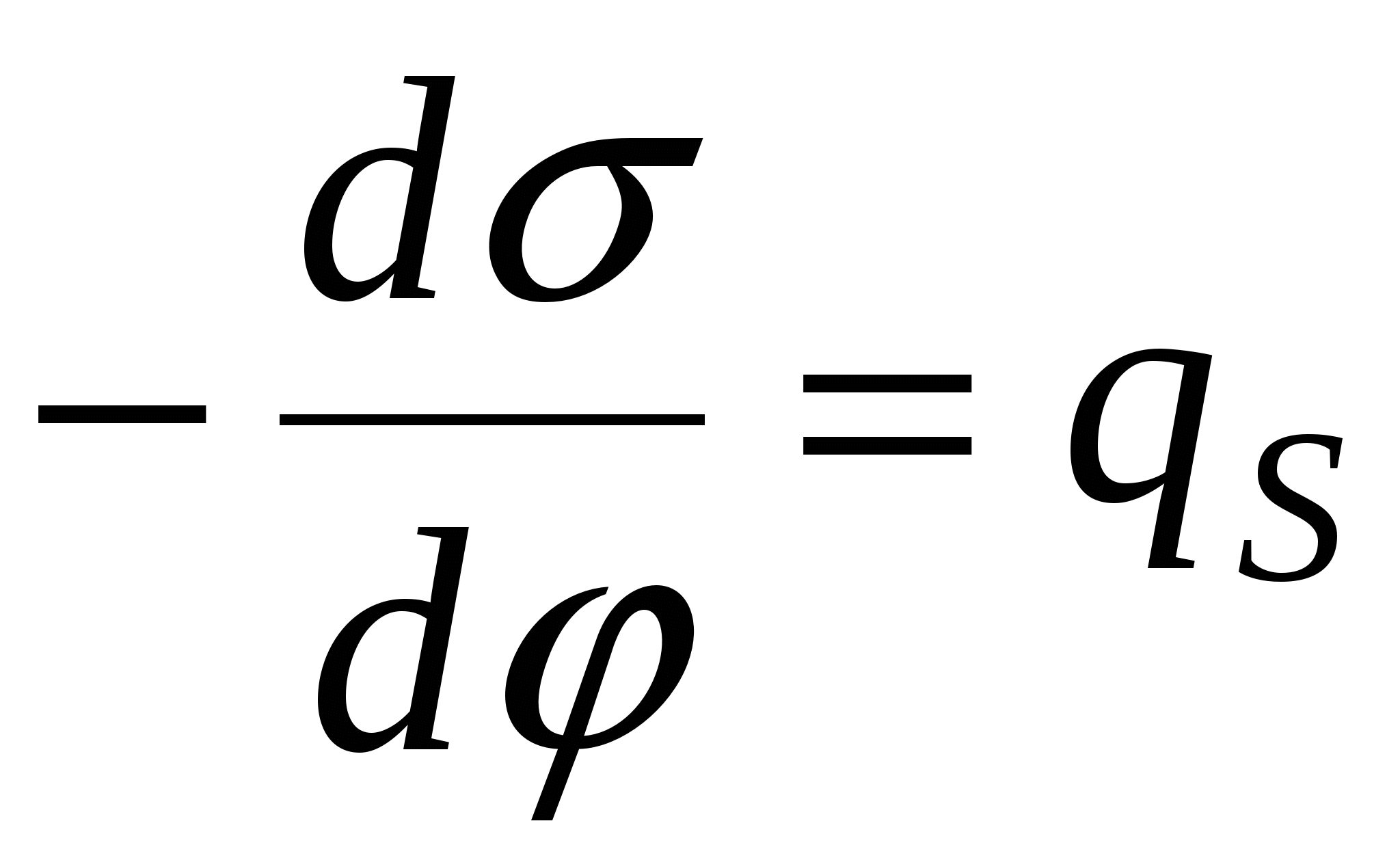 - 1-е уравнение Липпмана. - 1-е уравнение Липпмана.
 - поверхностная плотность заряда. - поверхностная плотность заряда.
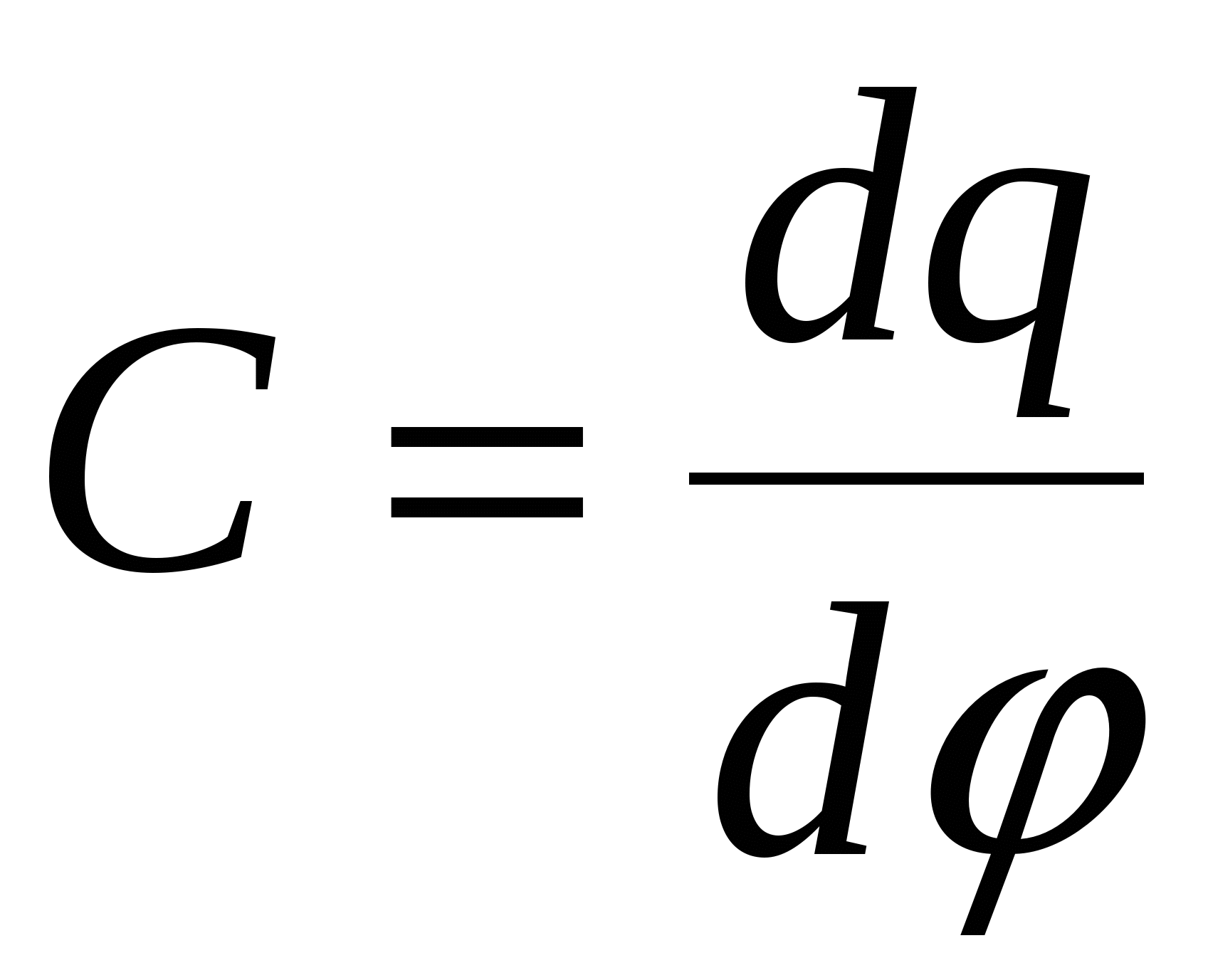 - дифференциальная емкость. - дифференциальная емкость.
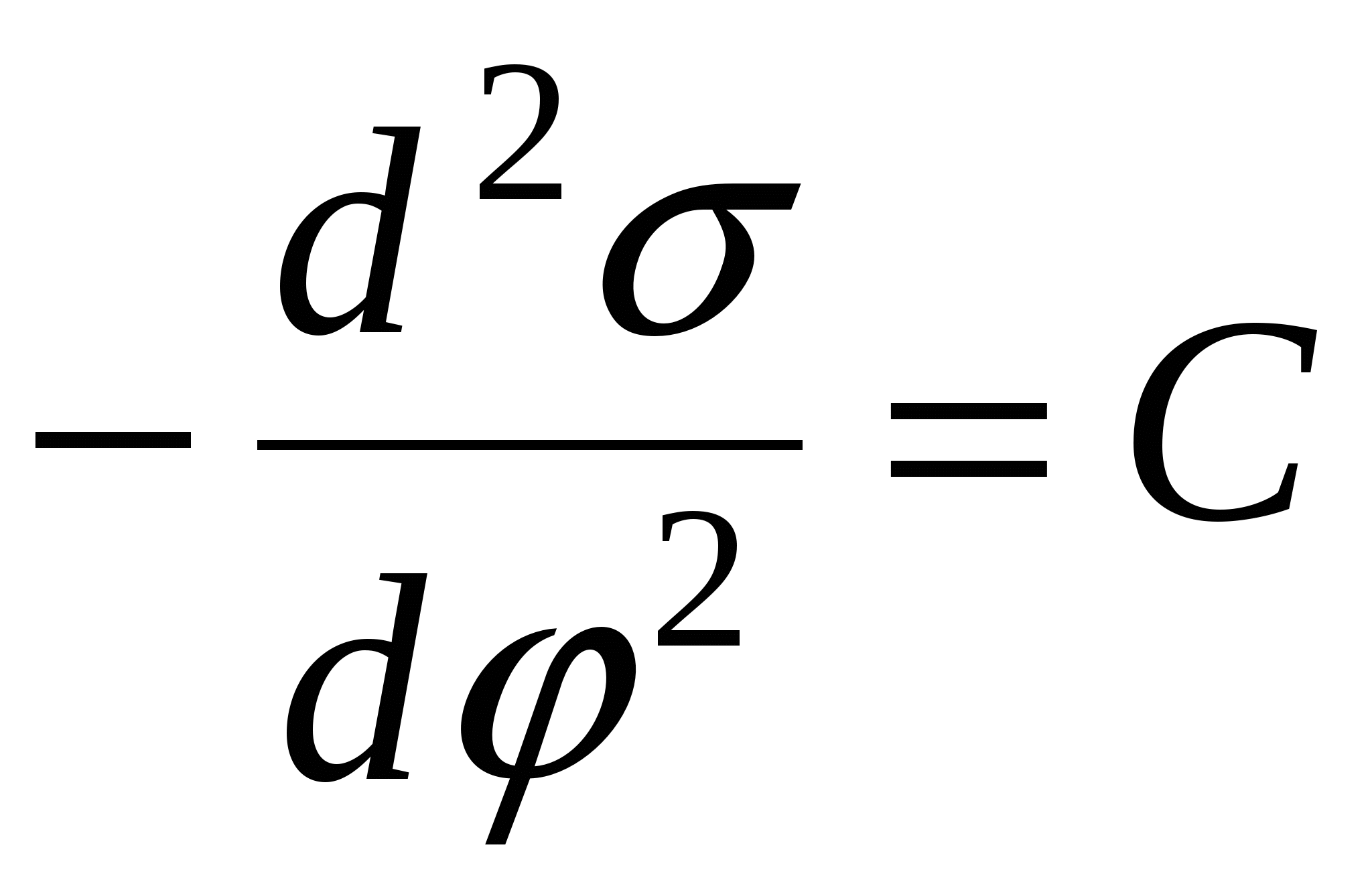 - 2-е уравнение Липпмана. - 2-е уравнение Липпмана.
С – емкость.
Решим 1-е уравнение Липпмана и фундаментальное уравнение адсорбции:
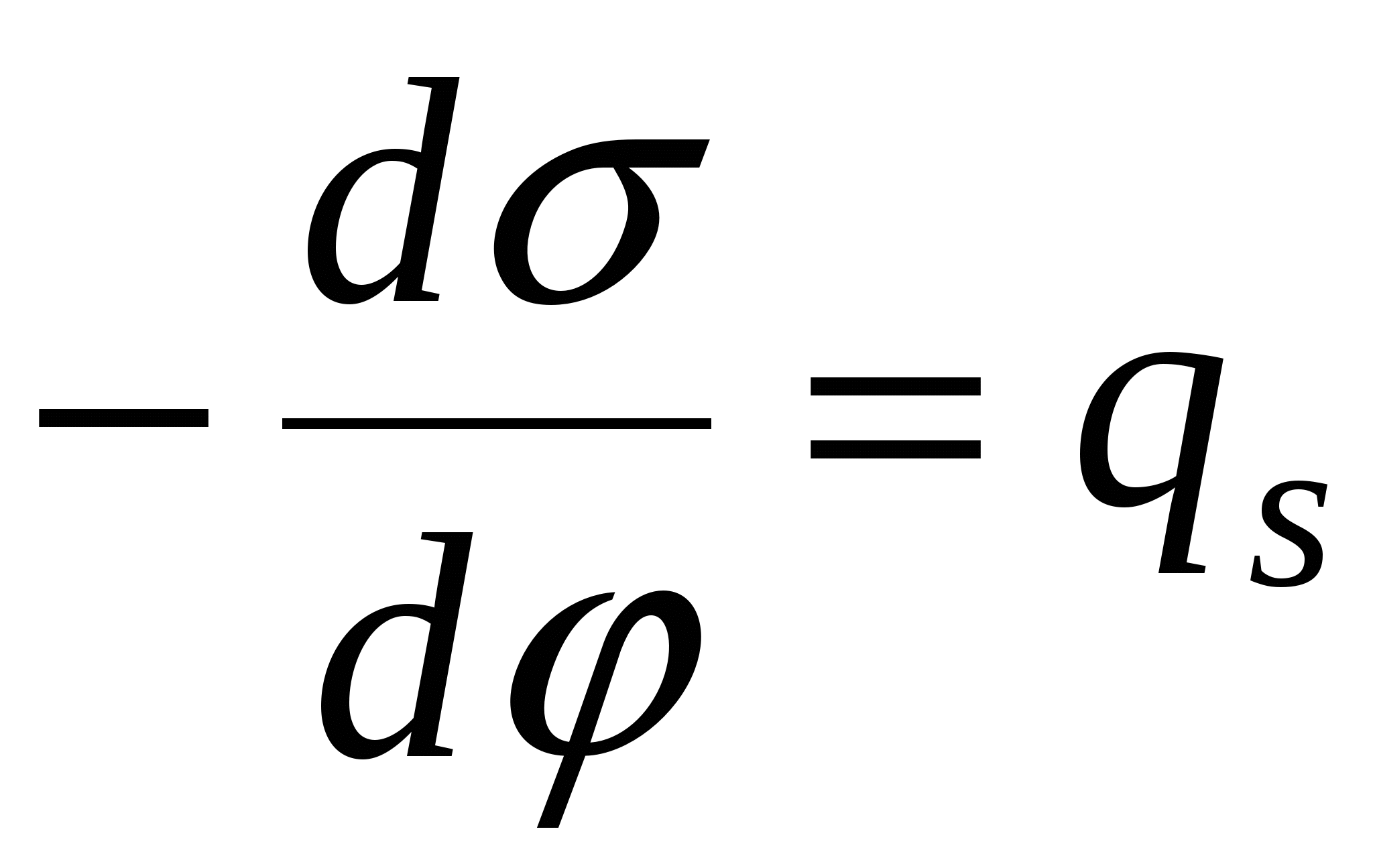 , ,  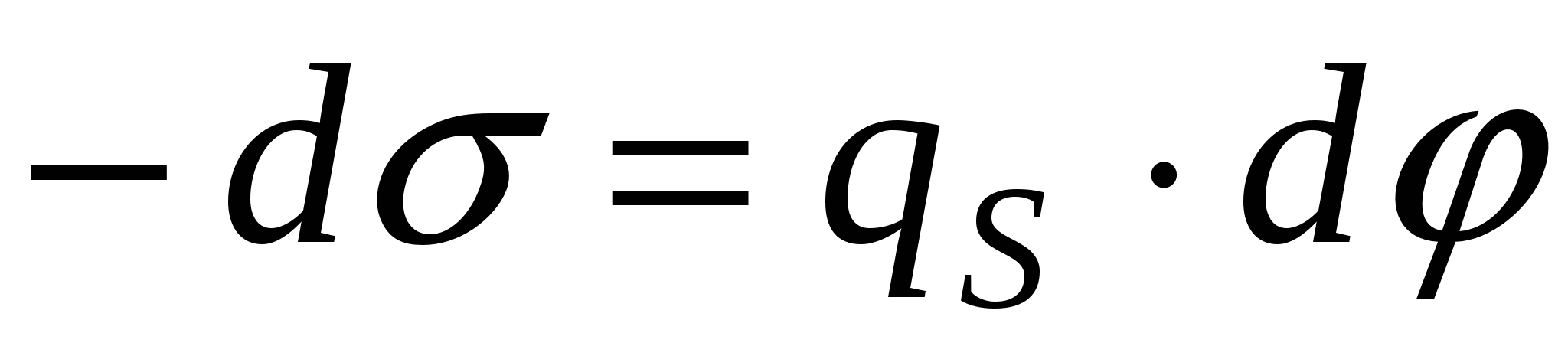
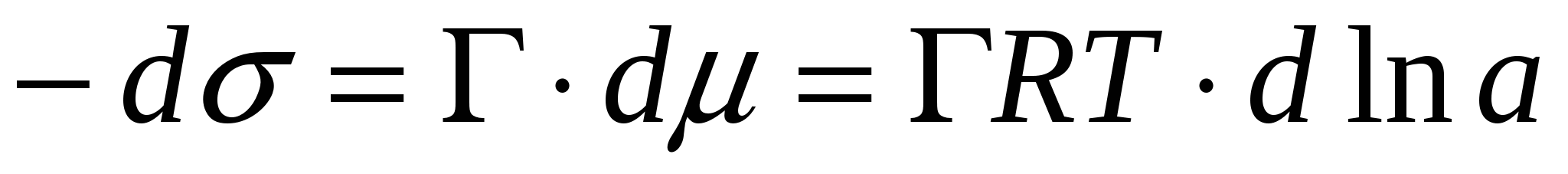
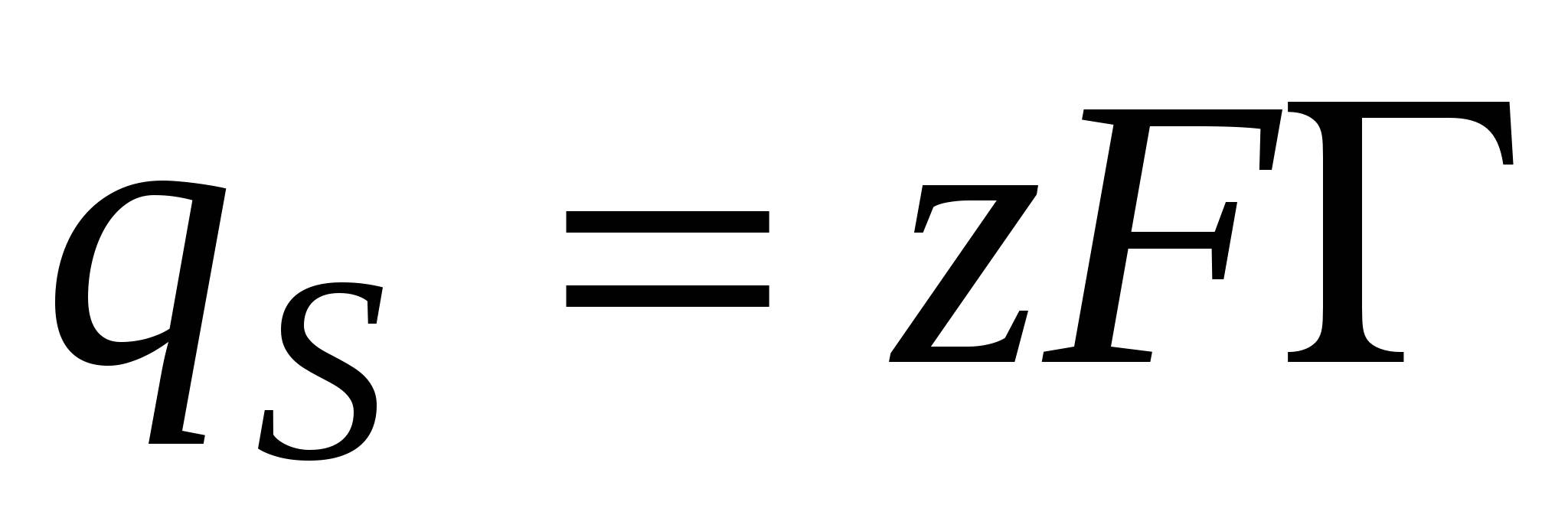 , тогда , тогда
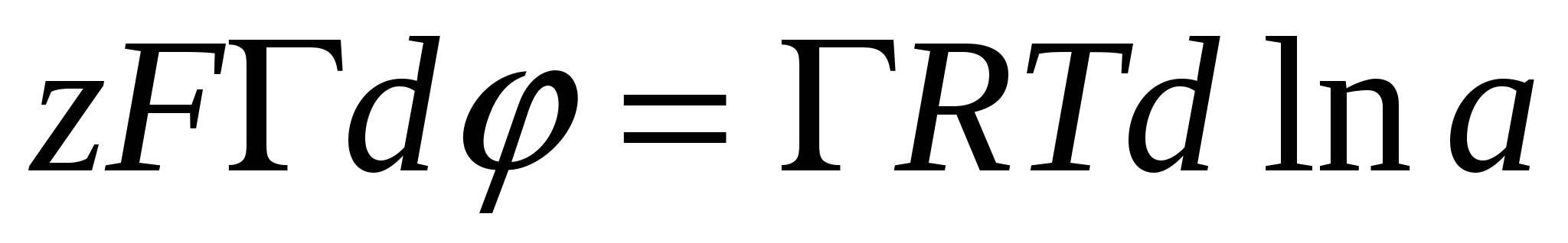
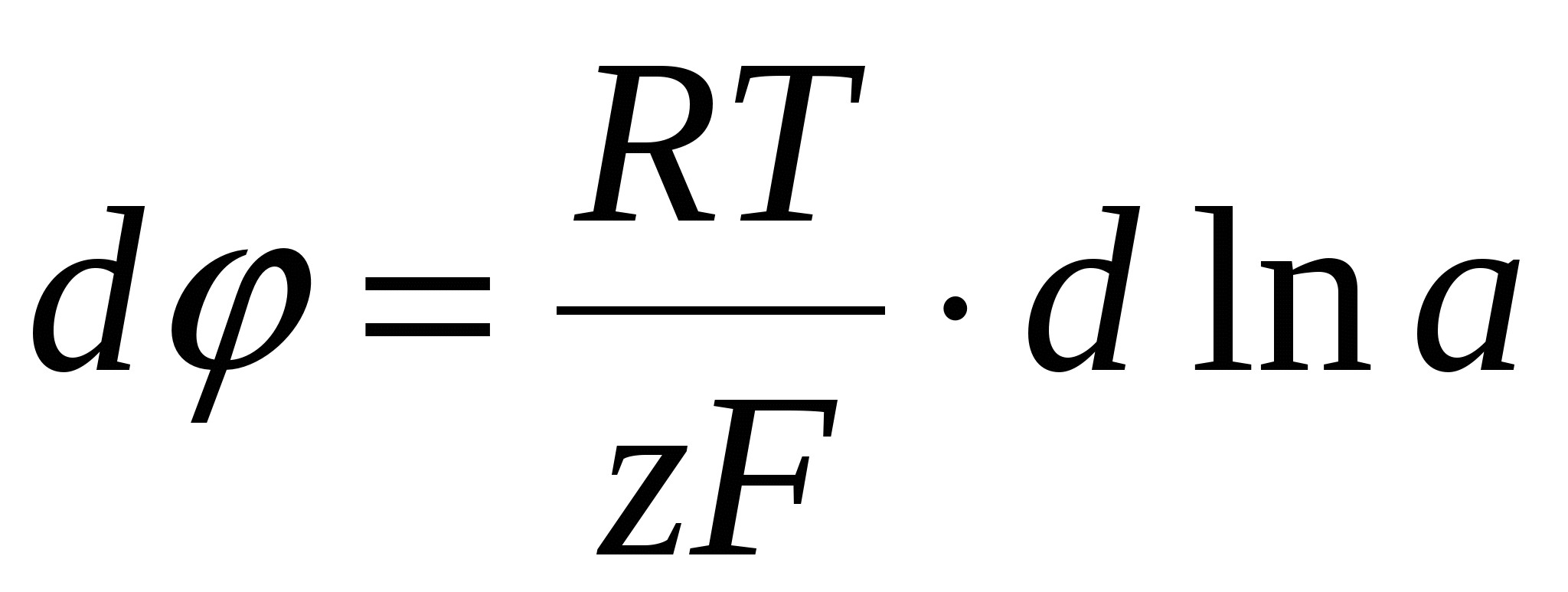 - уравнение Нернста - уравнение Нернста
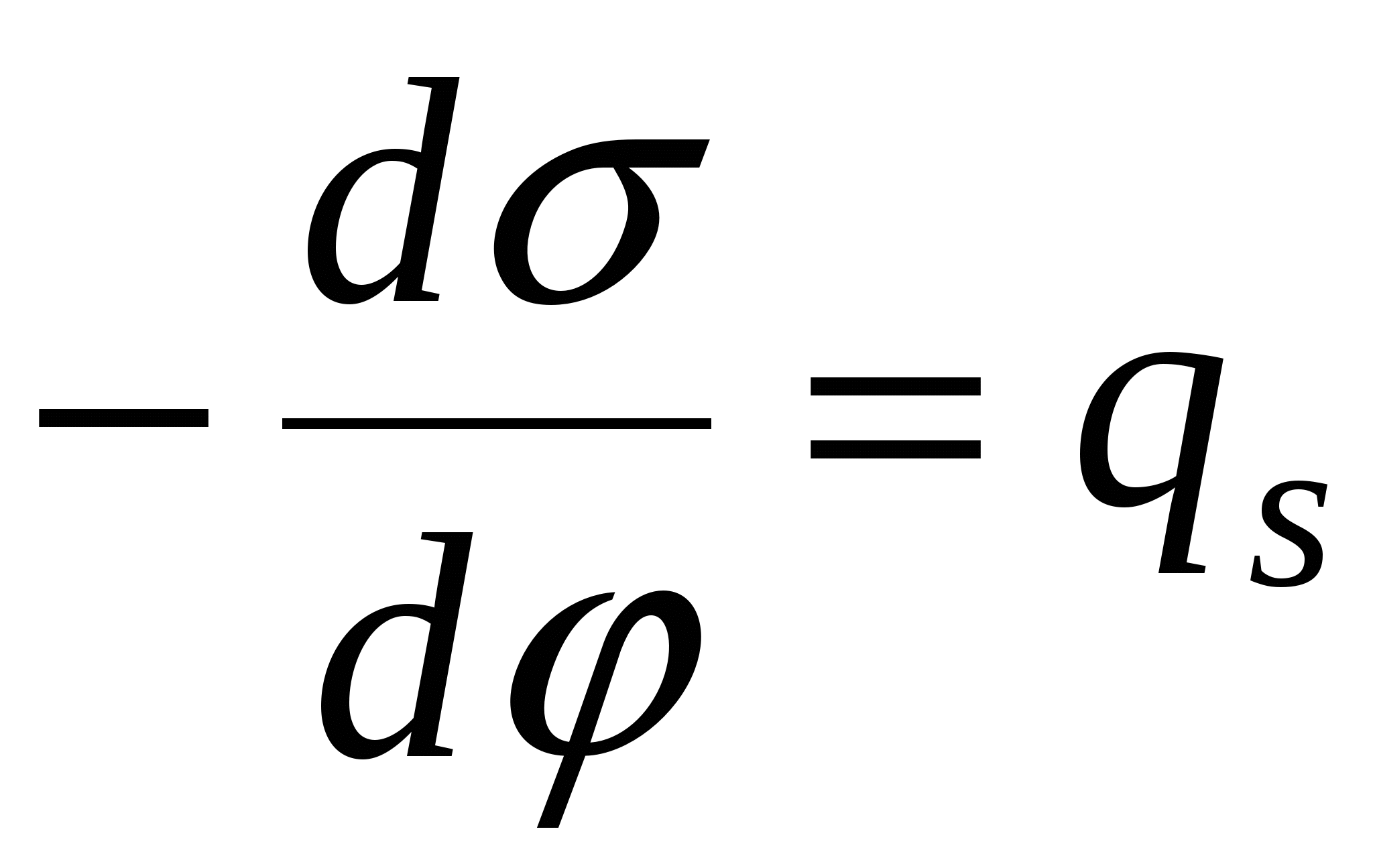 , , 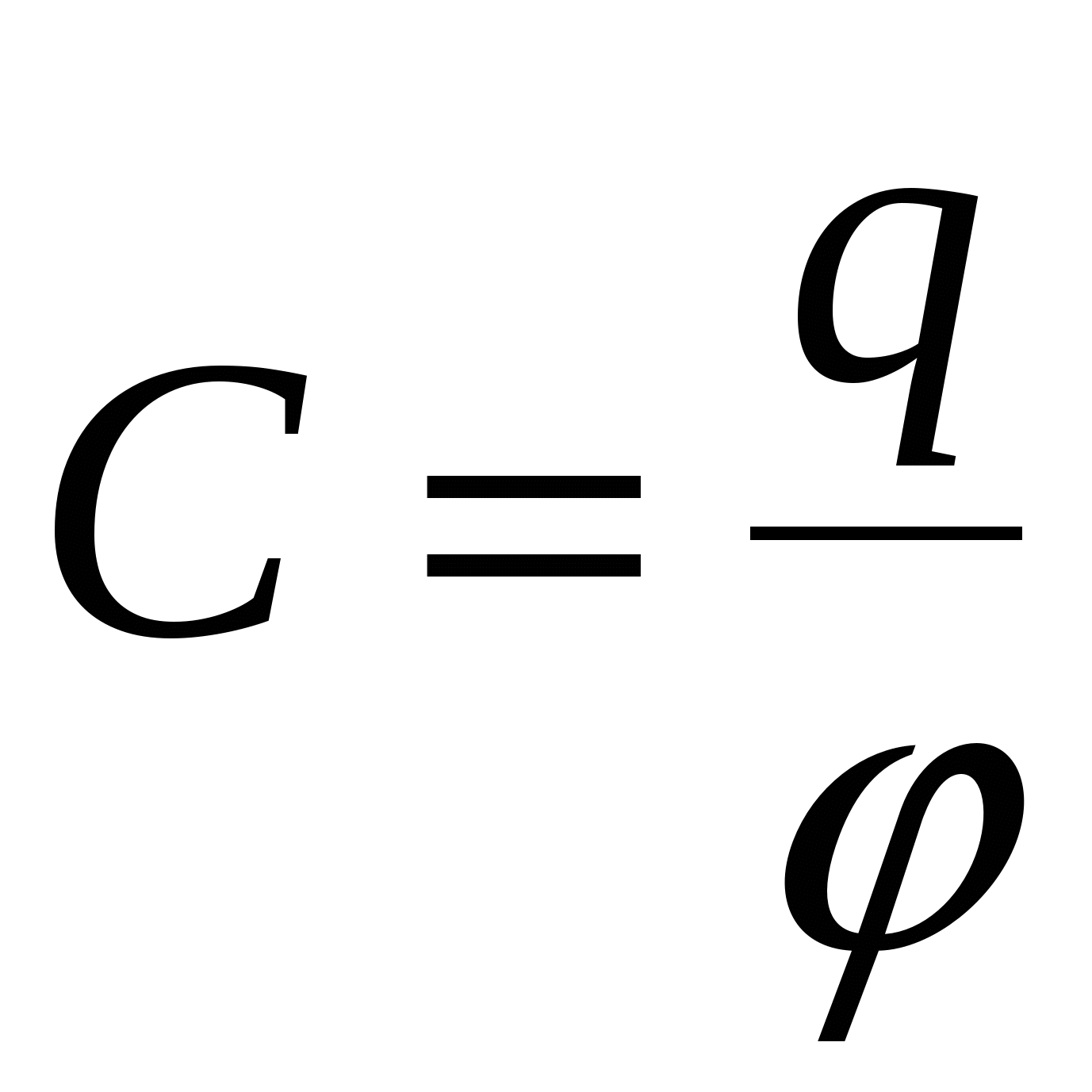 , ,  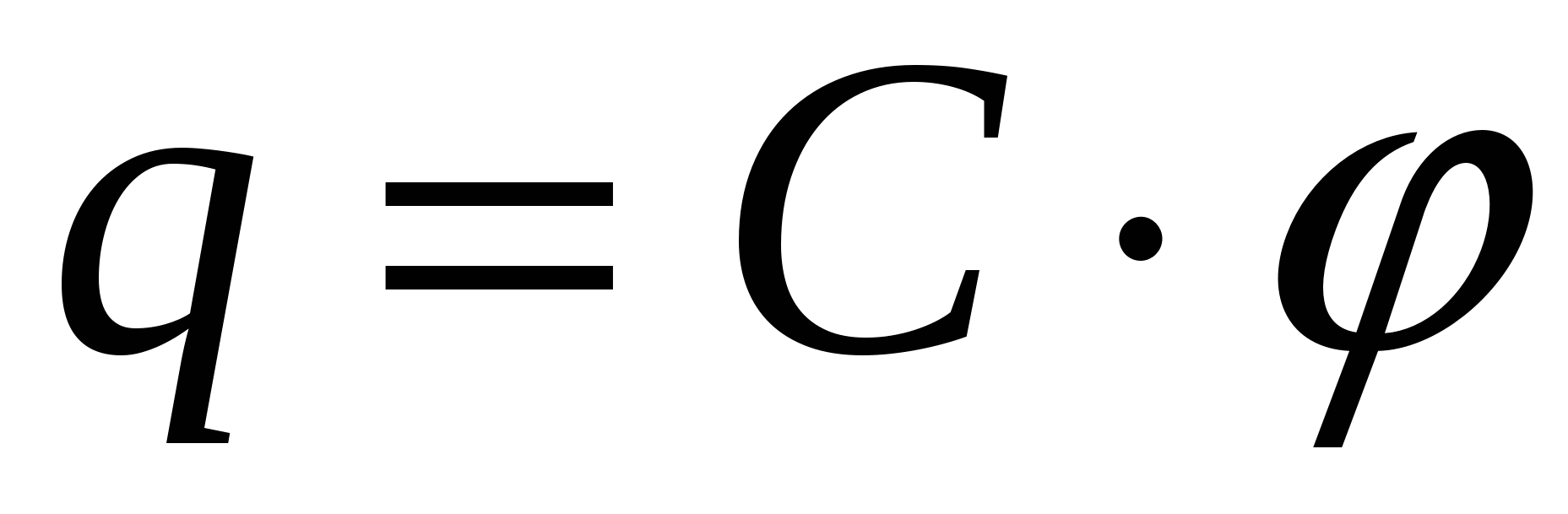
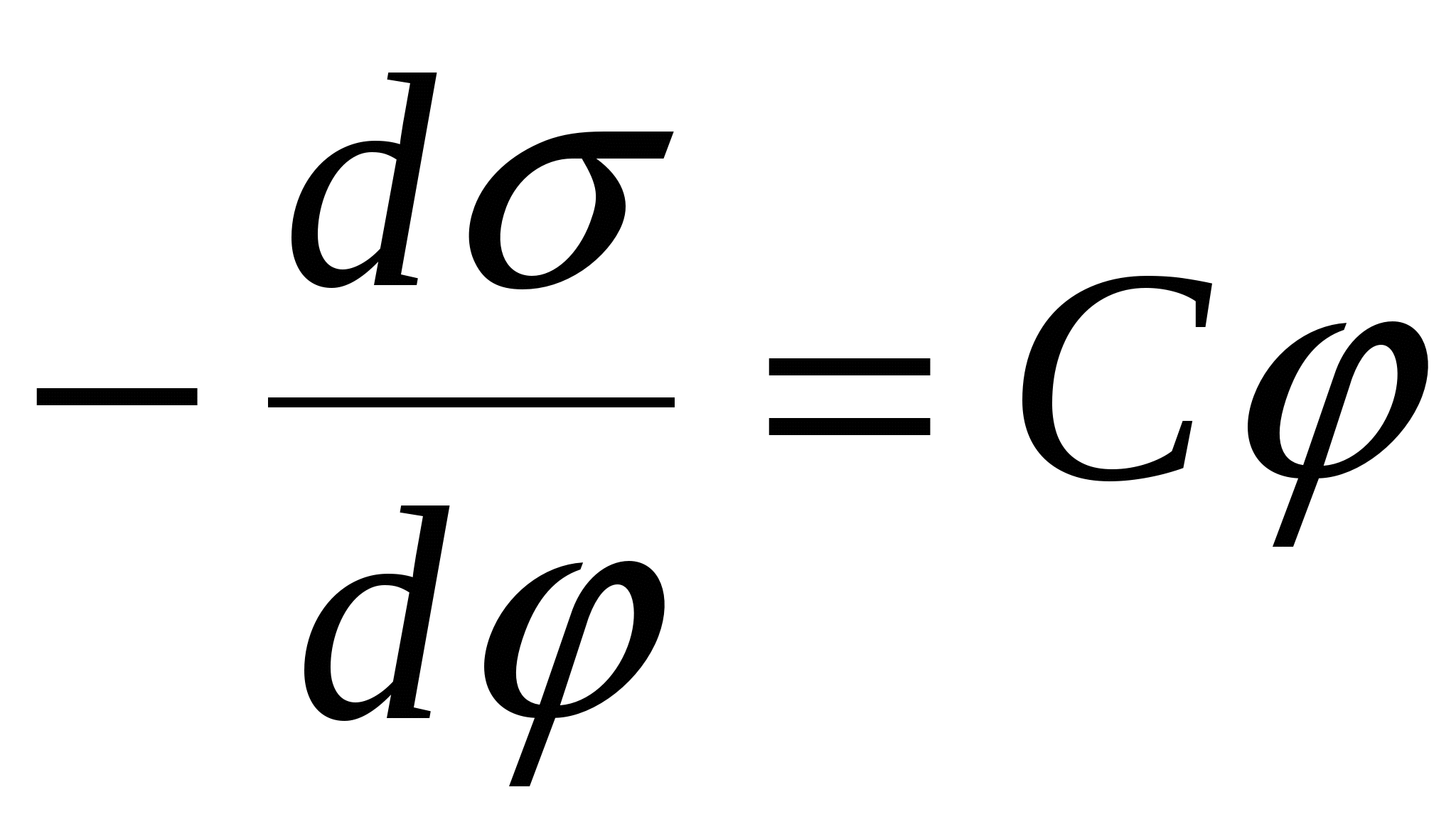
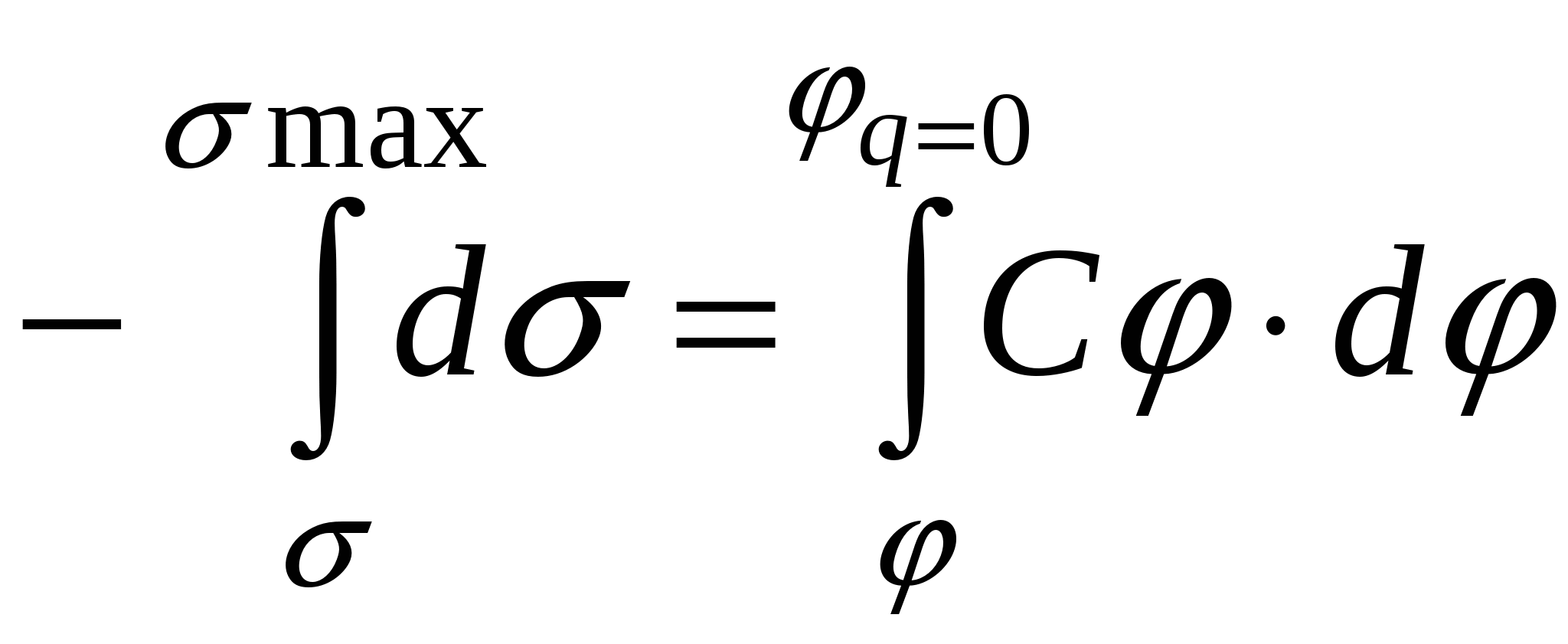
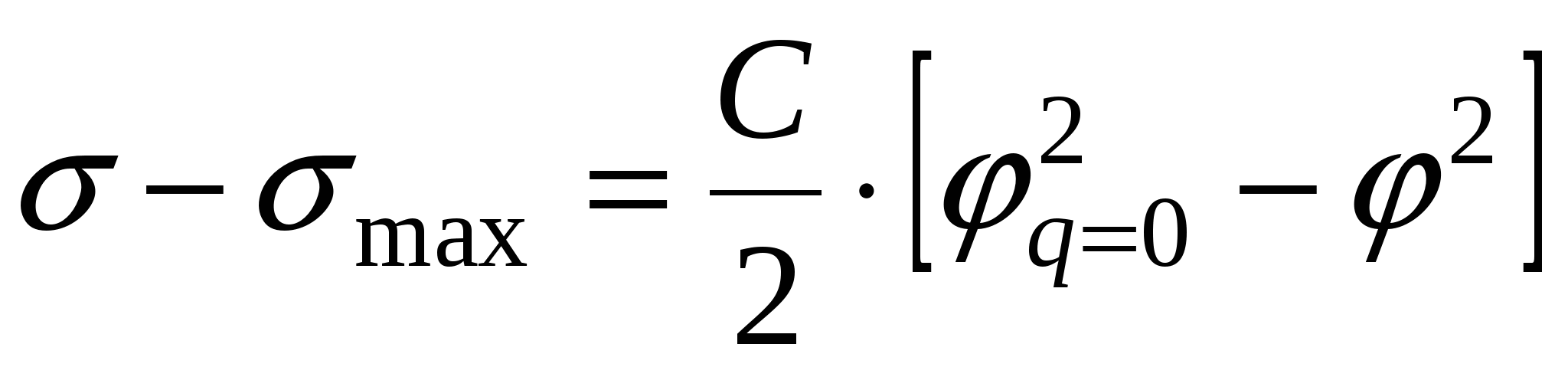 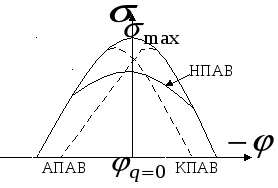 - уравнение электрокапиллярной кривой (ЭКК). - уравнение электрокапиллярной кривой (ЭКК).
В 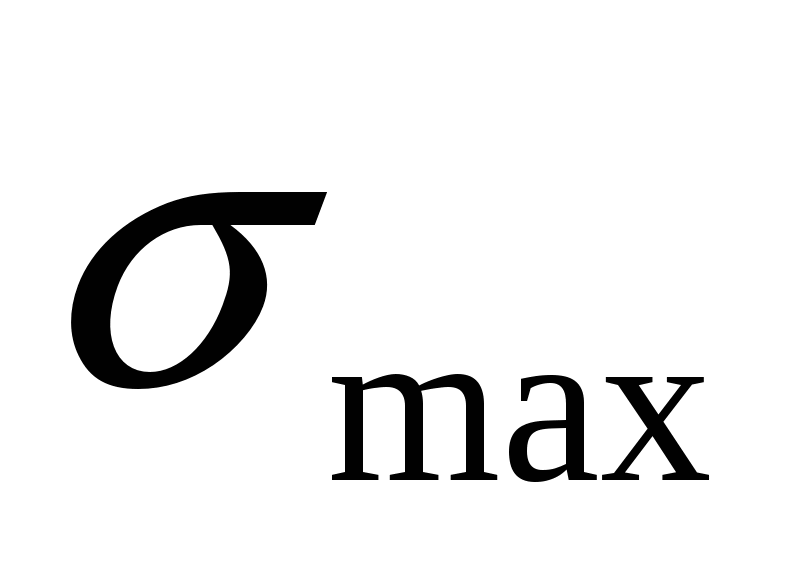 : : 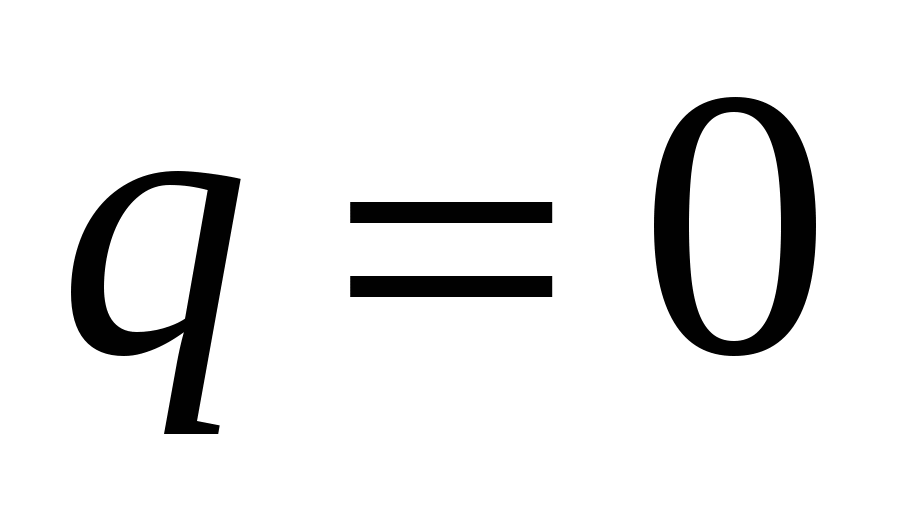 , но , но 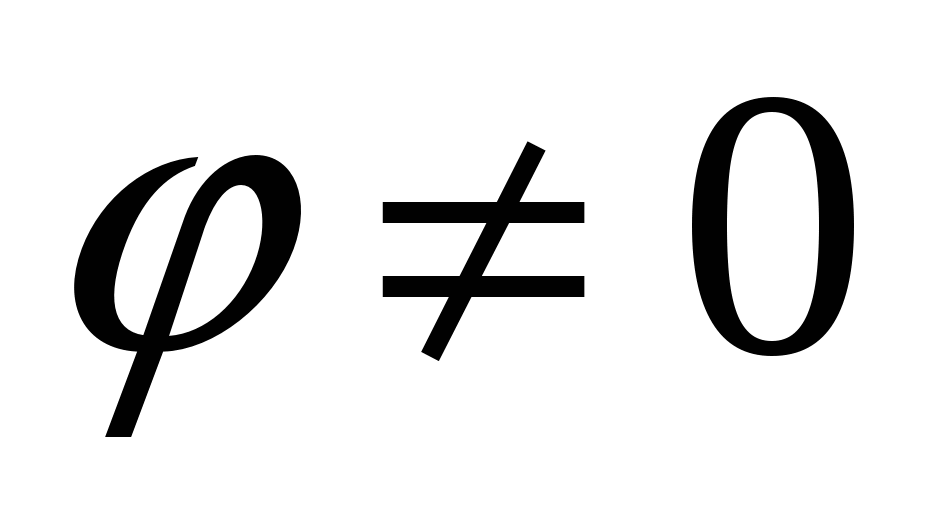
Катионные ПАВы (КПАВ) снижают катодную ветвь ЭКК.
Анионные ПАВы (АПАВ) снижают анодную ветвь ЭКК.
Неионогенные ПАВы (НПАВ) снижают среднюю часть ЭКК.
Устойчивость дисперсных систем. Расклинивающее давление.
Дисперсные системы можно разделить:
Термодинамически устойчивые (с условием: 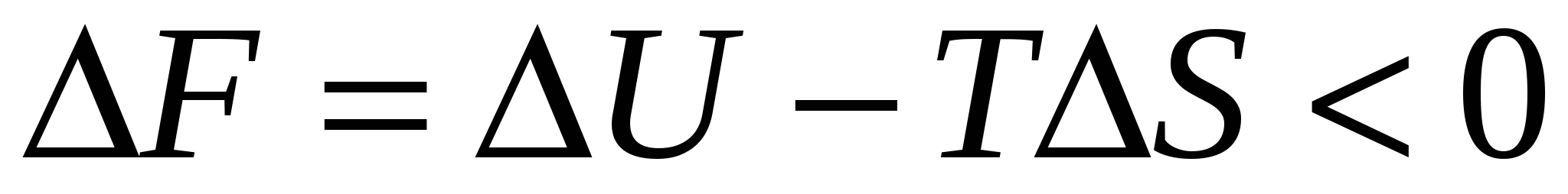 ). Преобладают адгезионные взаимодействия. ). Преобладают адгезионные взаимодействия.
Термодинамически неустойчивые (с условием: 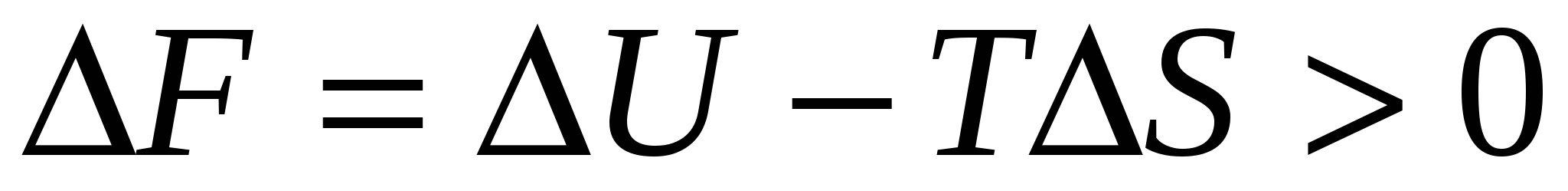 ). Преобладают кагезионные взаимодействия. ). Преобладают кагезионные взаимодействия.
Системы неустойчивые термодинамически могут быть устойчивы кинетически за счет перехода в метастабильное состояние.
Различают два вида устойчивости:
Седиментационная устойчивость (по отношению к силе тяжести).
Агрегативная устойчивость. (по отношению к слипанию)
Коагуляция – это процесс слипания частиц, приводящий к потере агрегативной устойчивости. Коагуляцию может вызвать изменение температуры, pH, перемешивание, ультразвук.
Различают коагуляцию:
Обратимая.
Необратимая.
Коагуляция протекает при введении электролитов.
Правила коагуляции:
Коагуляцию вызывает любой электролит, но наступает она при достижении значения 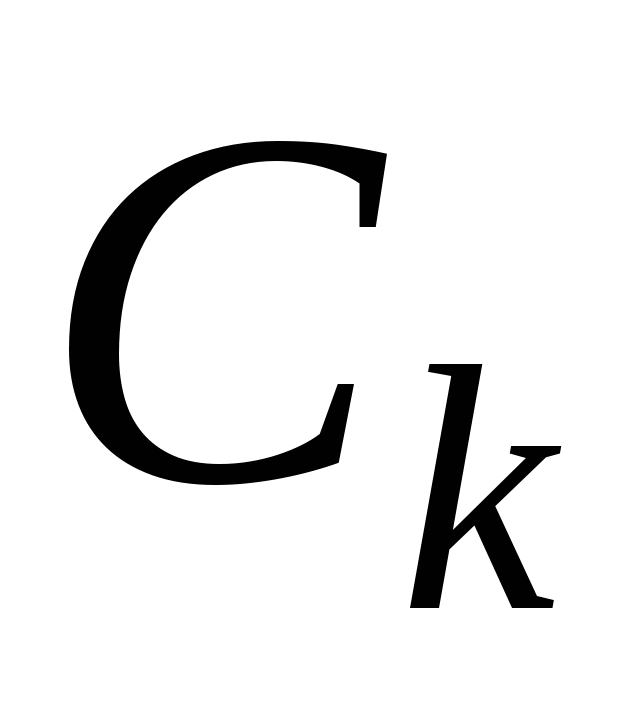 - порога коагуляции. - порога коагуляции.
Коагулирующим действием обладает ион, заряженный противоположно коллоидной частице. Для высокозаряженных поверхностей концентрация порога коагуляции 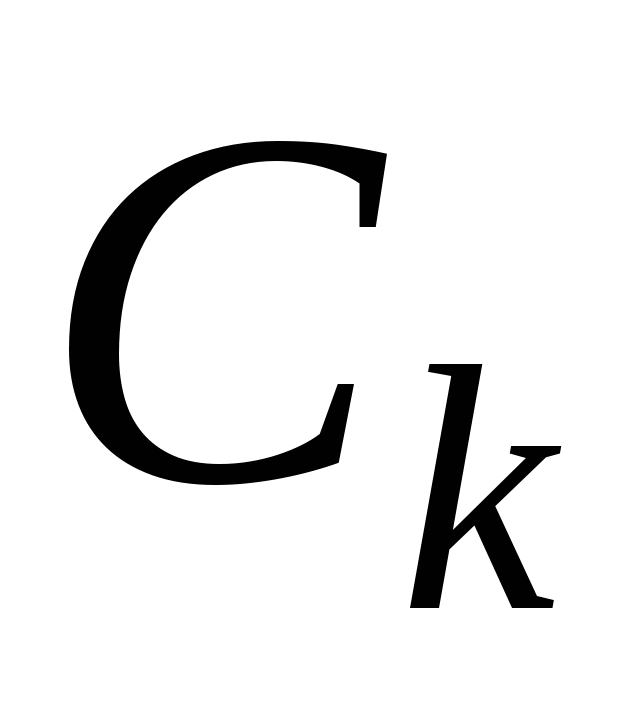 обратно пропорционально обратно пропорционально 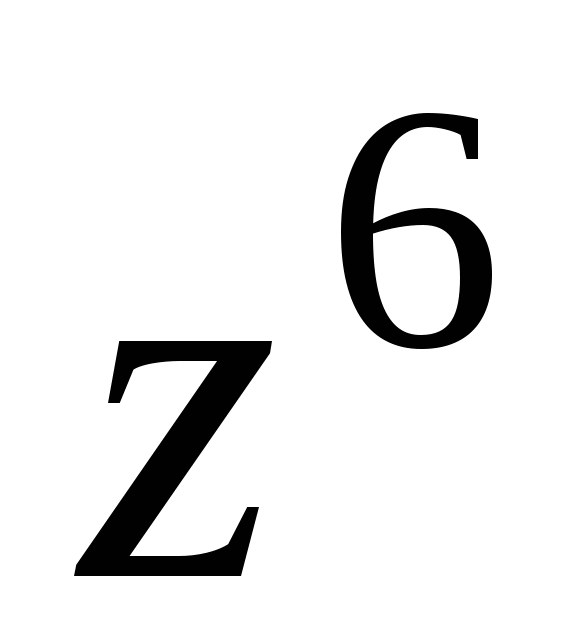 ( (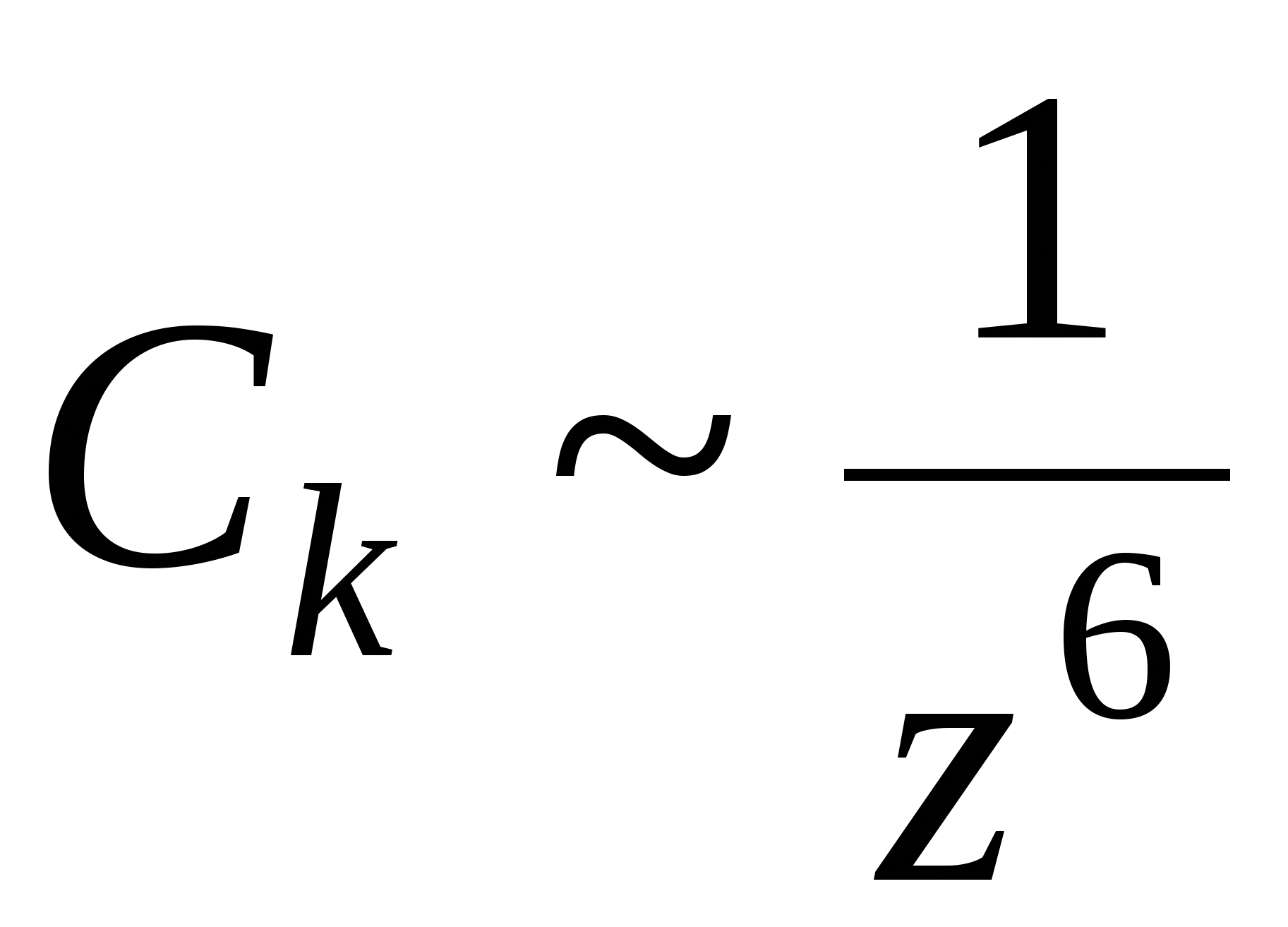 ) – правило Шульце-Гарди ) – правило Шульце-Гарди
Осадок, получаемый в результате коагуляции, всегда содержит некоторое количество иона-коагулятора.
Способность ионов вызывать коагуляцию тем выше, чем выше его адсорбционная способность.
Коагулирующее действие тем выше, чем меньше склонность ионов к гидратации.
Началу коагуляции соответствует снижение дзэта-потенциала.
Плёнка – это часть системы, находящаяся между двумя межфазными поверхностями.
Расклинивающее давление возникает при резком уменьшении толщины плёнки в результате взаимодействия сближающихся поверхностных слоев.
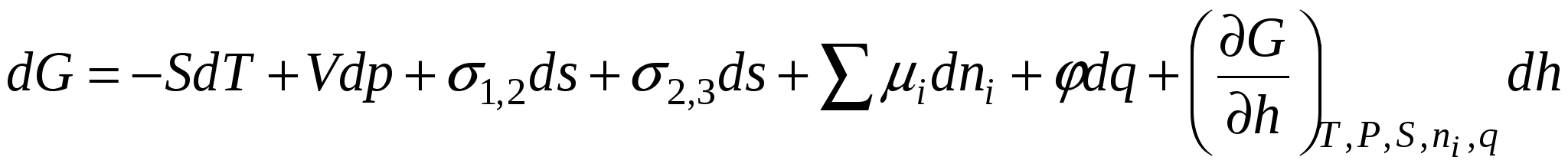
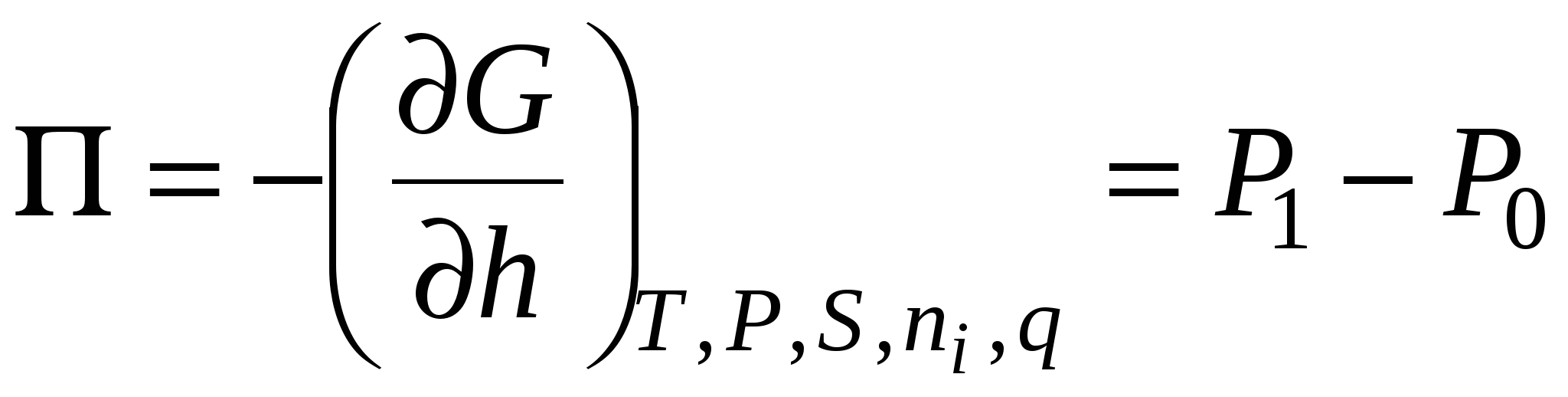
«-» - при уменьшении толщины пленки расклинивающее давление возрастает.
P0 – давление в объемной фазе, которая является продолжением прослойки.
P1 – давление в пленке.
Теория устойчивости. ДЛФО (Дерягин, Ландау, Фервей, Овербек).
Согласно теории ДЛФО в расклинивающем давлении выделяют две составляющие:
Электростатическая ПЭ (положительная, она обусловлена силами электростатического отталкивания). Соответствует уменьшению энергии Гиббса при возрастании толщины пленки.
Молекулярная ПМ (отрицательная, обусловлена действием сил притяжения). Обусловлена сжатием пленки за счет химических поверхностных сил, радиус действия сил десятые доли нм с энергией порядка 400 кДж/моль.
Полная энергия взаимодействия: 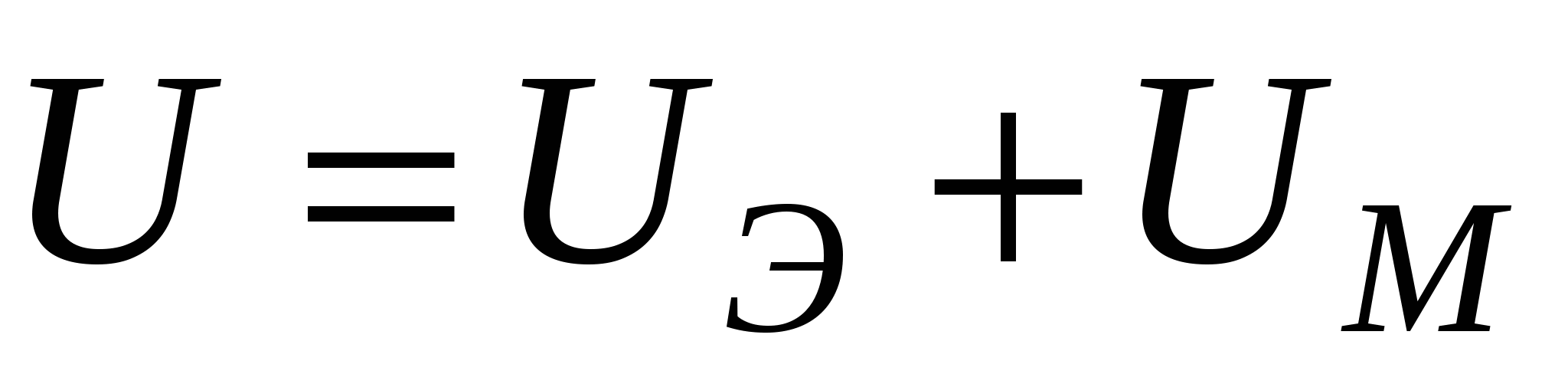
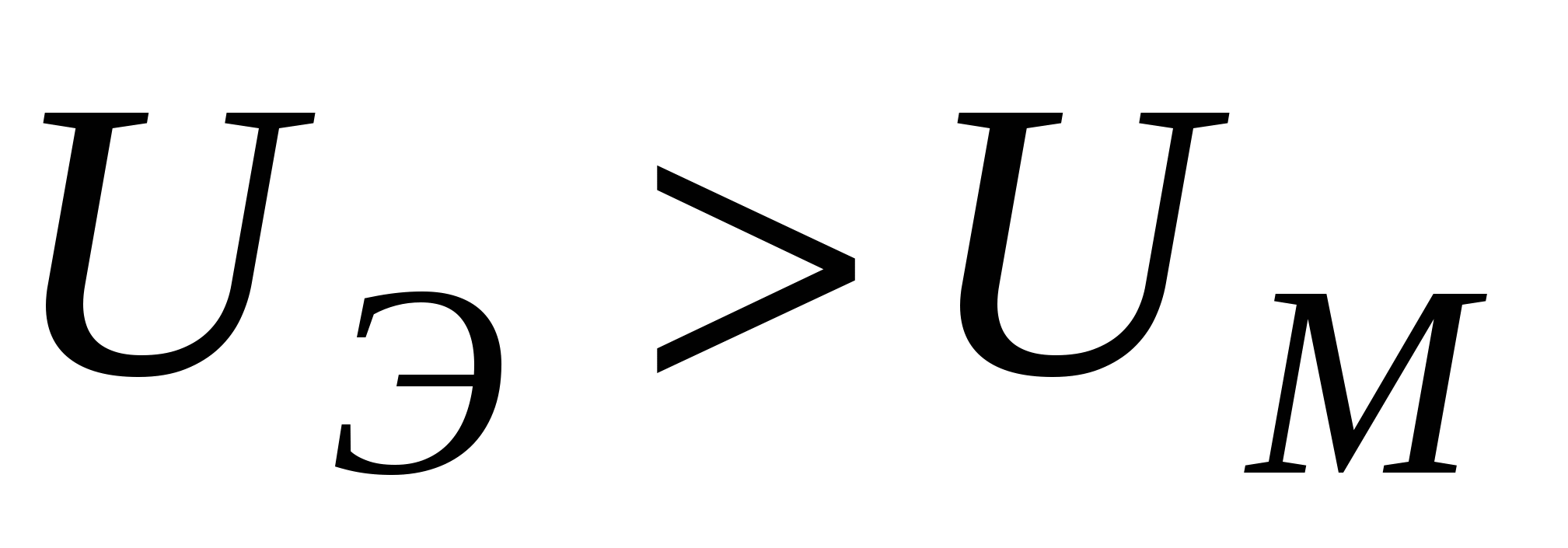 - система агрегативно устойчивая - система агрегативно устойчивая
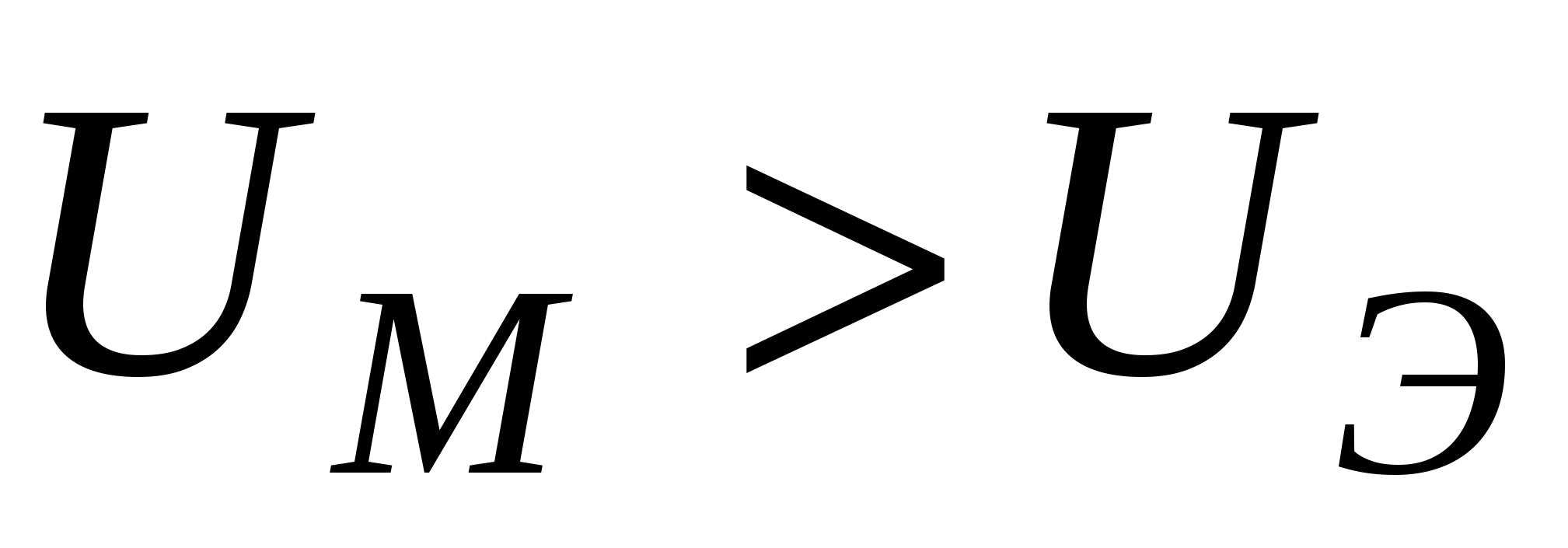 - неустойчивая система - неустойчивая система
П оложительная составляющая. оложительная составляющая.
Увеличение обусловлено увеличением потенциальной энергии при сжатии тонких пленок. Для пленок большой толщины избыточная энергия ионов скомпенсирована и равна энергетическому взаимодействию в объеме дисперсионной среды.
Если 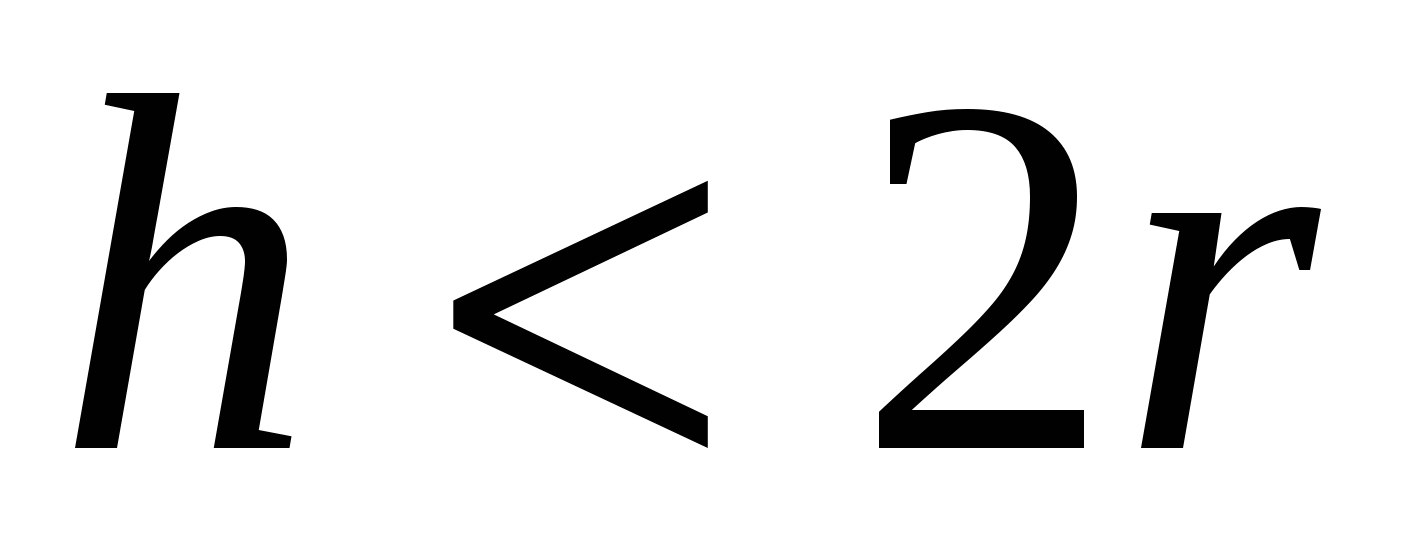 ( ( - толщина пленки, - толщина пленки, 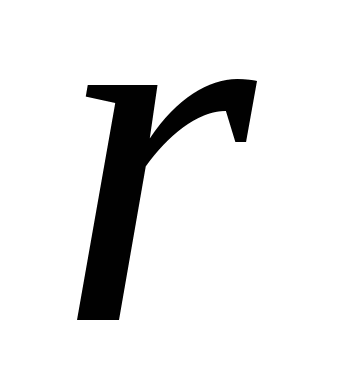 - радиус иона) утоньшение пленки приводит к исчезновению и уменьшению в ней молекул и ионов с минимальной поверхностной энергией. Число соседних частиц уменьшается, в результате чего потенциальная энергия оставшихся в пленке частиц возрастает. - радиус иона) утоньшение пленки приводит к исчезновению и уменьшению в ней молекул и ионов с минимальной поверхностной энергией. Число соседних частиц уменьшается, в результате чего потенциальная энергия оставшихся в пленке частиц возрастает.
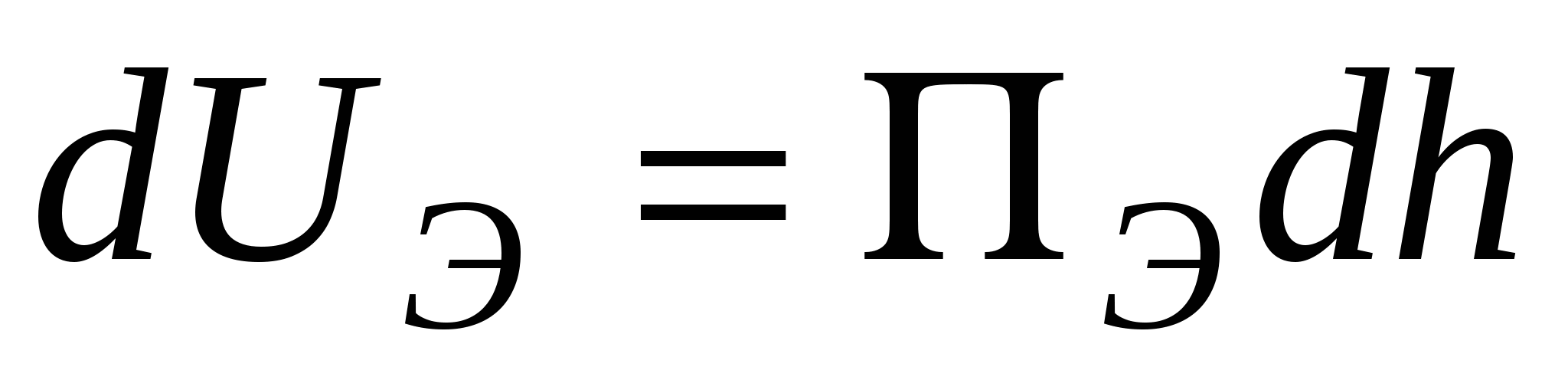
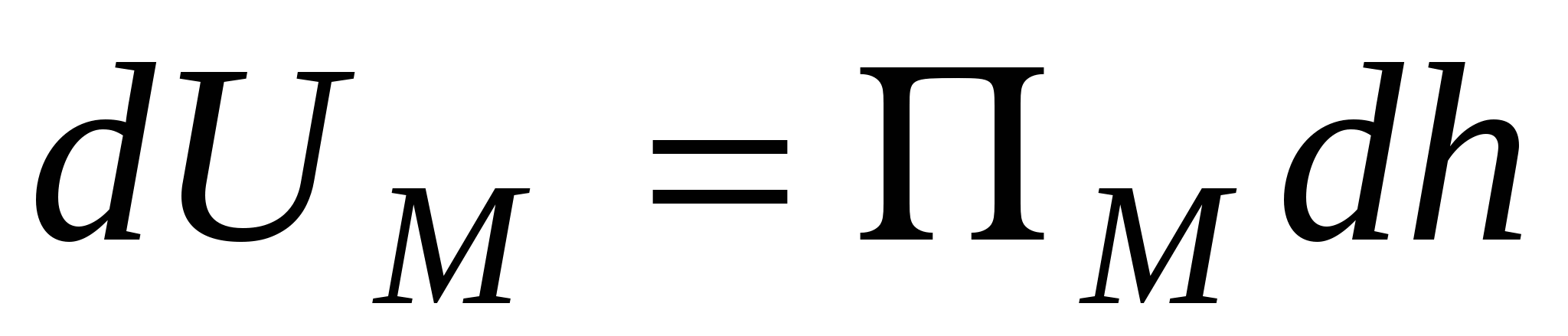
Теория ДЛФО взаимодействие частиц рассматривает как взаимодействие пластин.
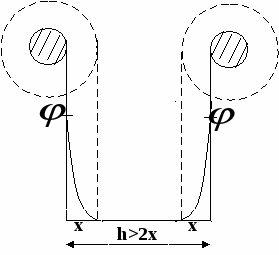
Частицы не взаимодействуют
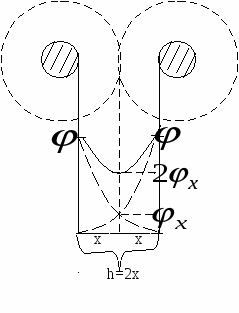
h=2x
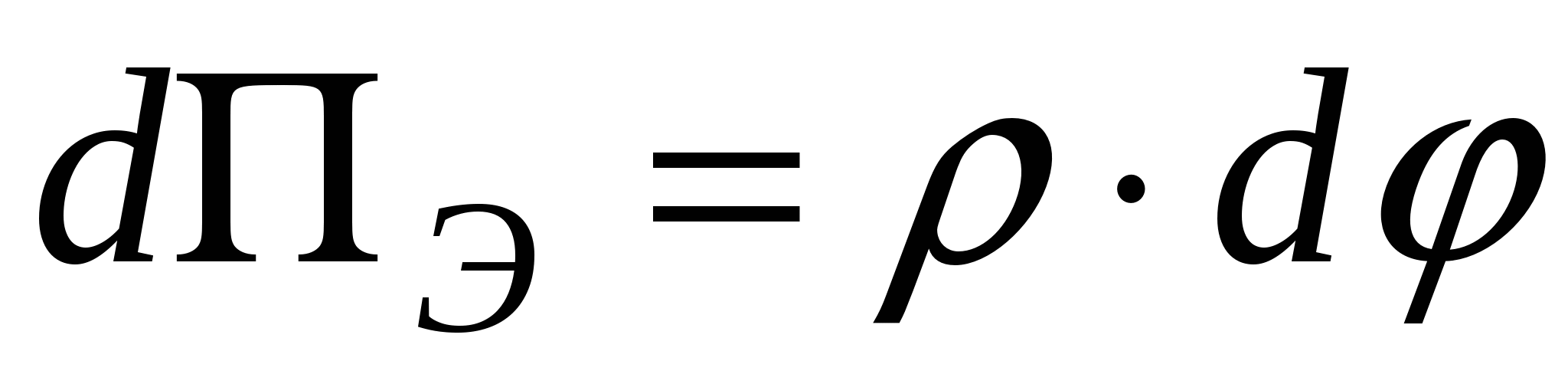
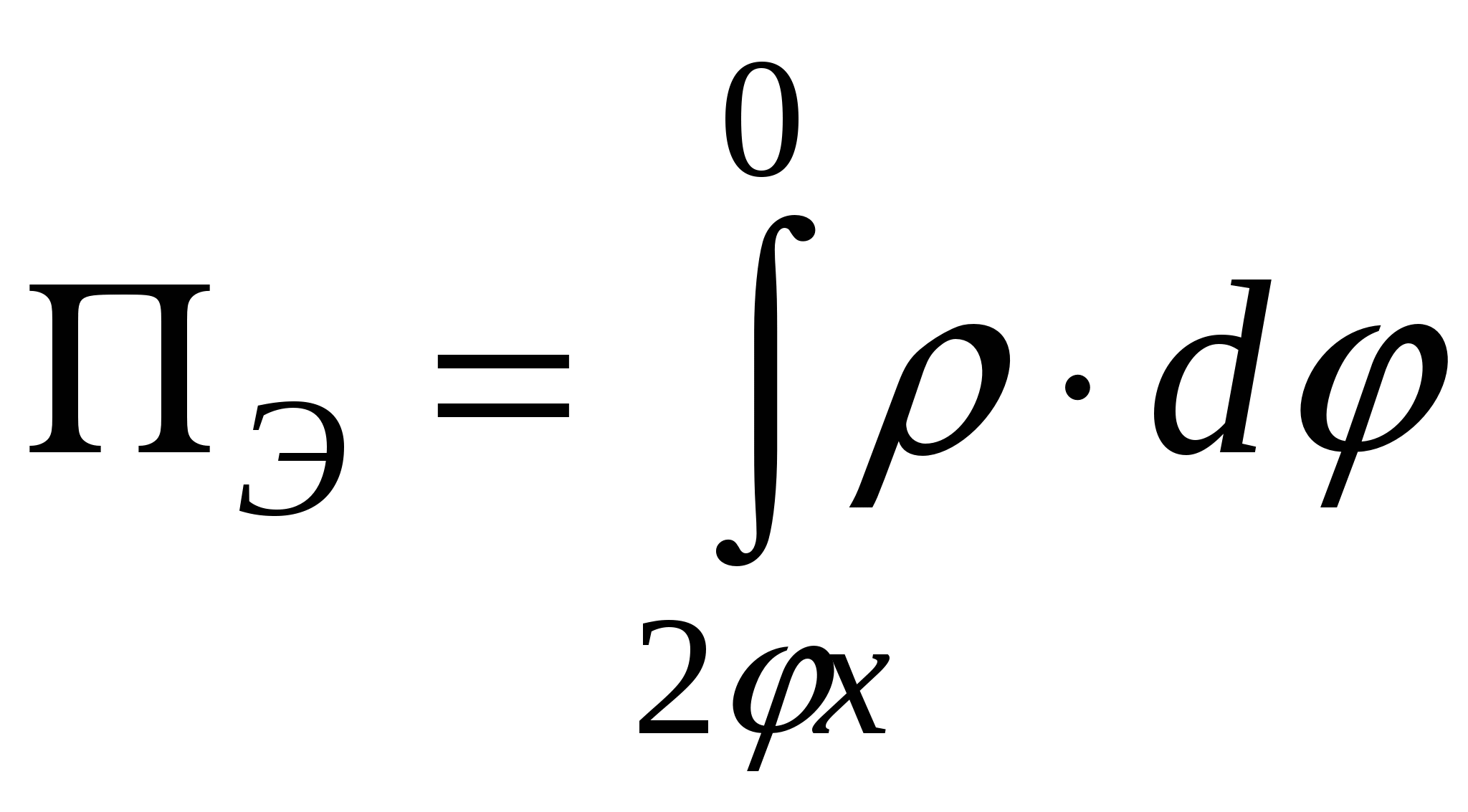
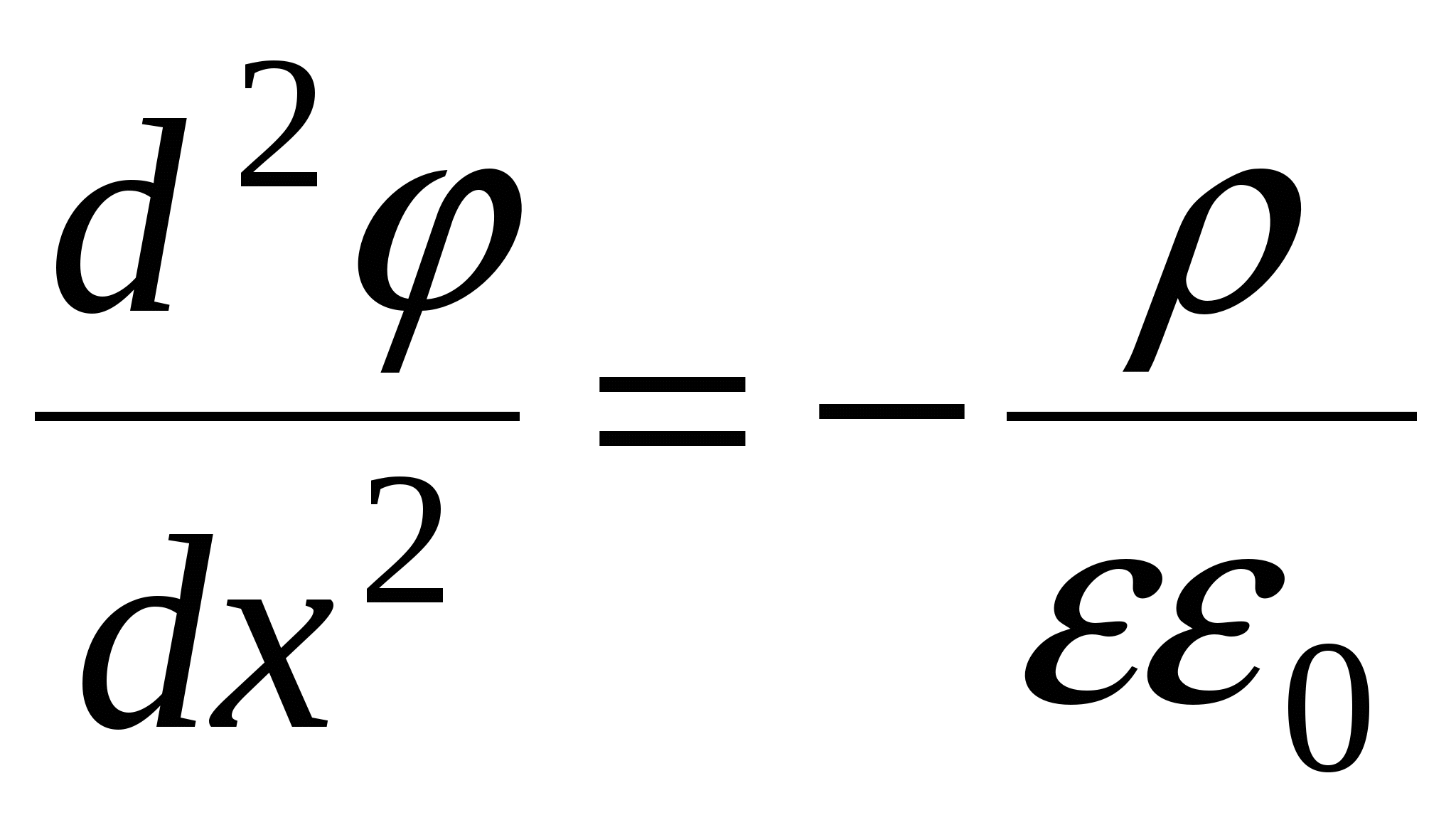 - уравнение Лапласа, - уравнение Лапласа, 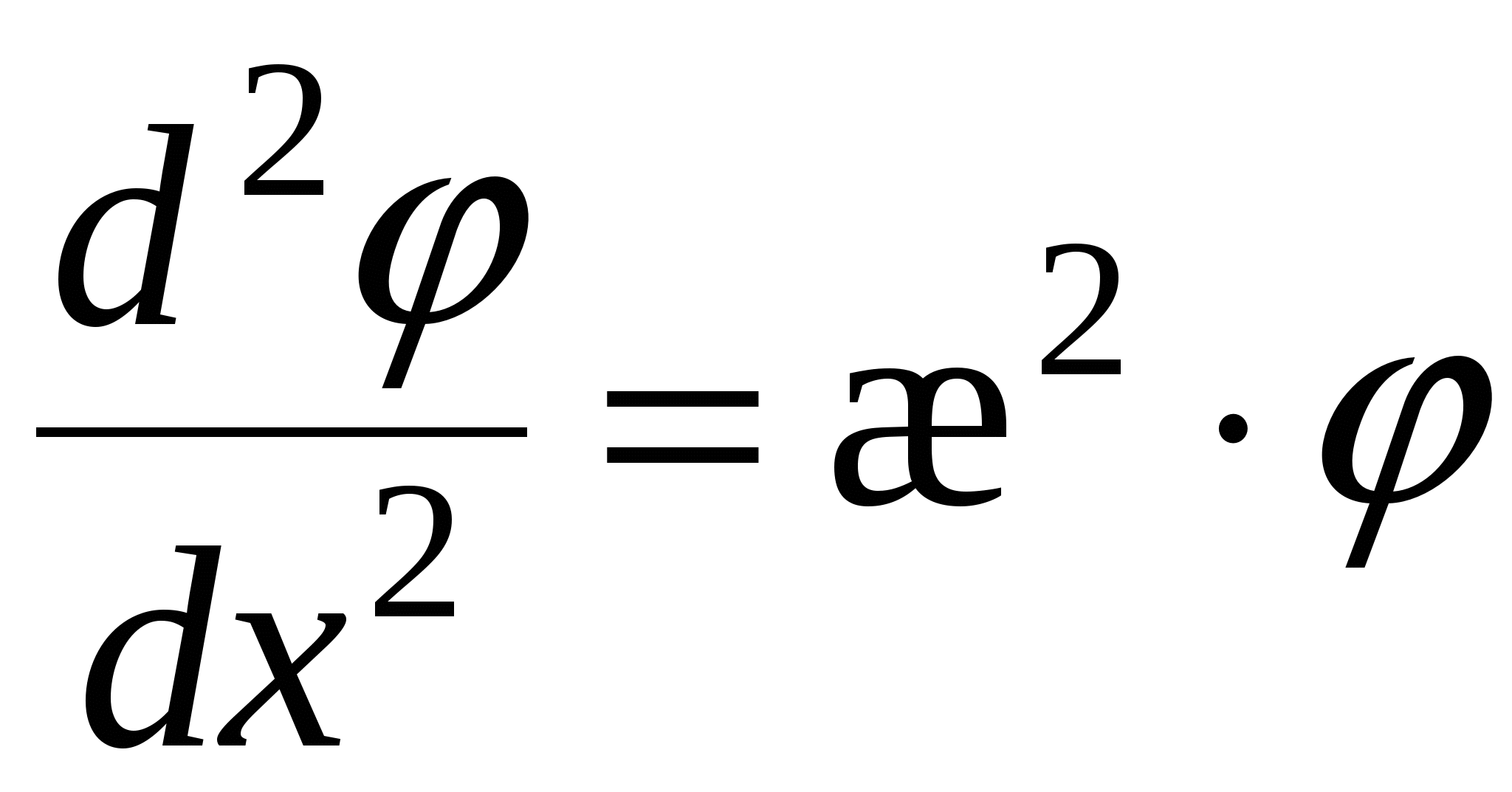 , , 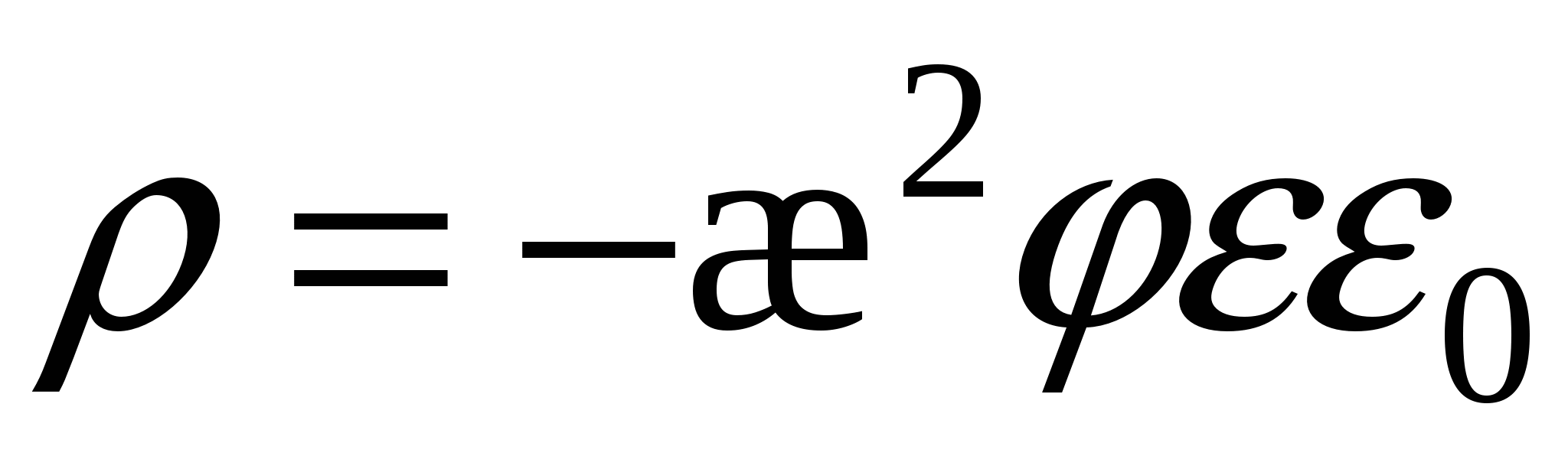
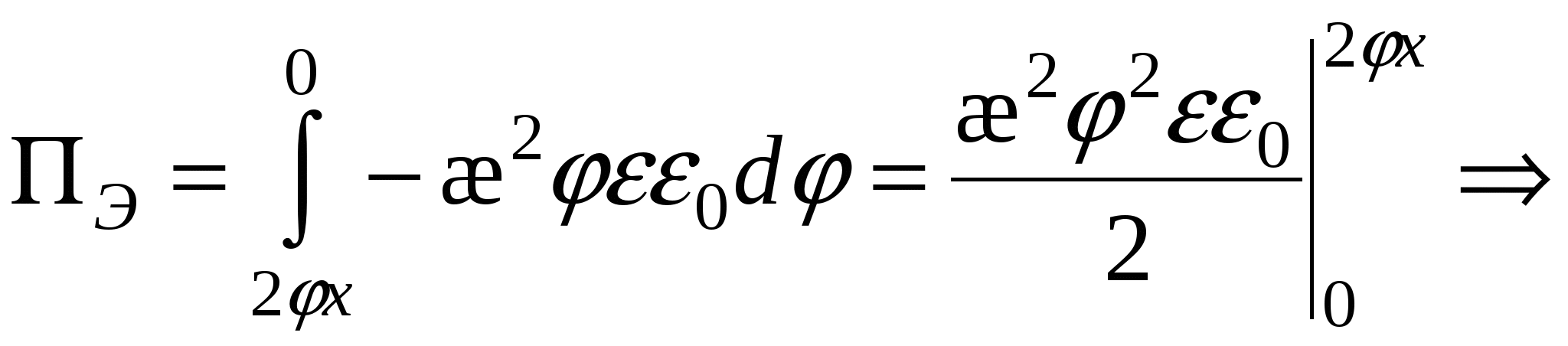
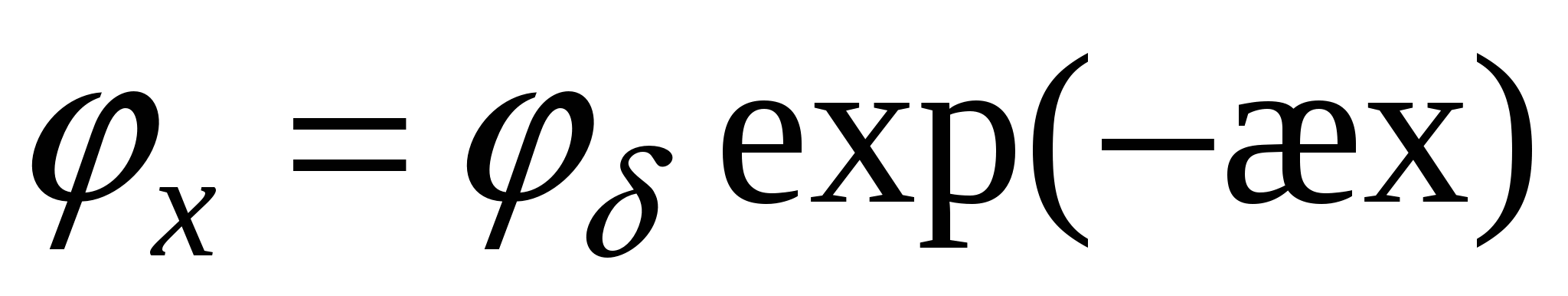
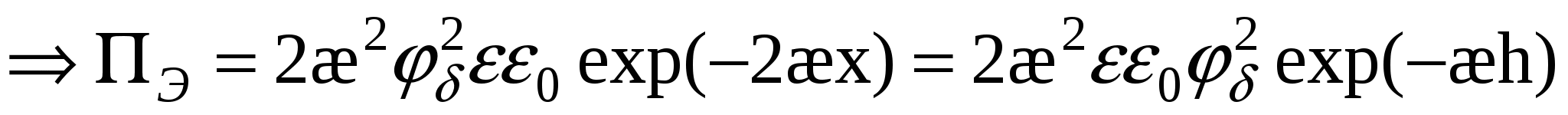
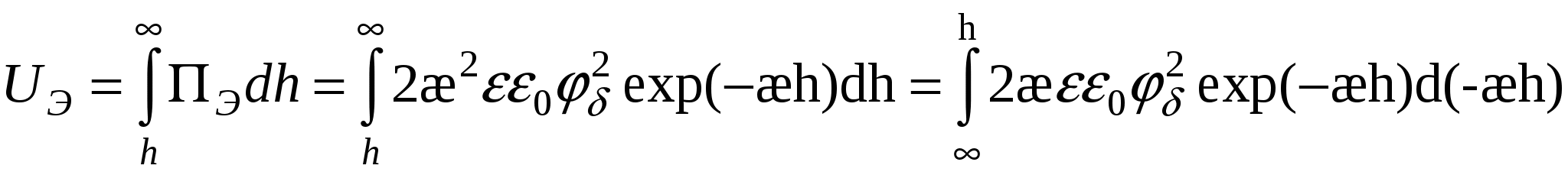
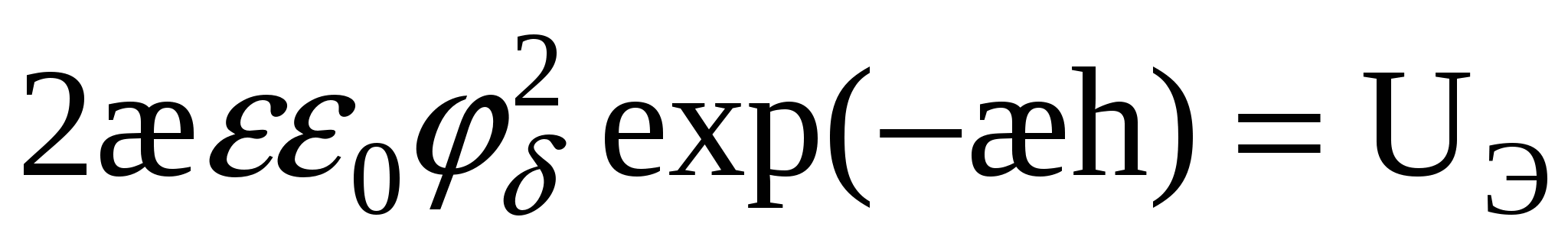 - для слабо заряженных поверхностей - для слабо заряженных поверхностей
Для сильно заряженных поверхностей:
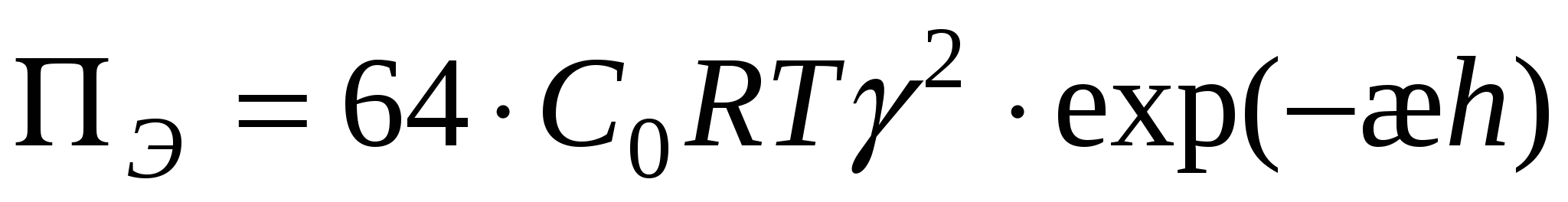
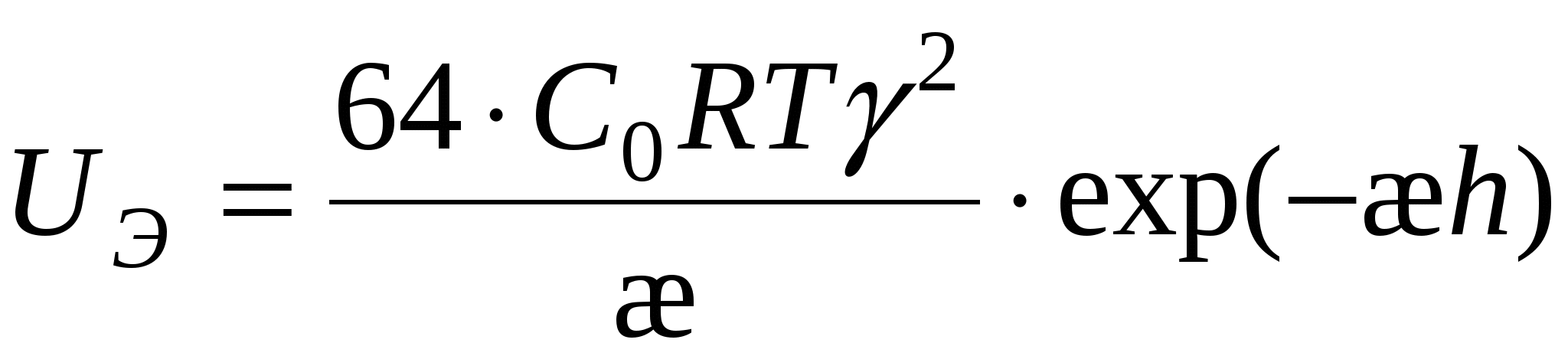
М олекулярная составляющая – взаимодействие двух атомов: олекулярная составляющая – взаимодействие двух атомов:
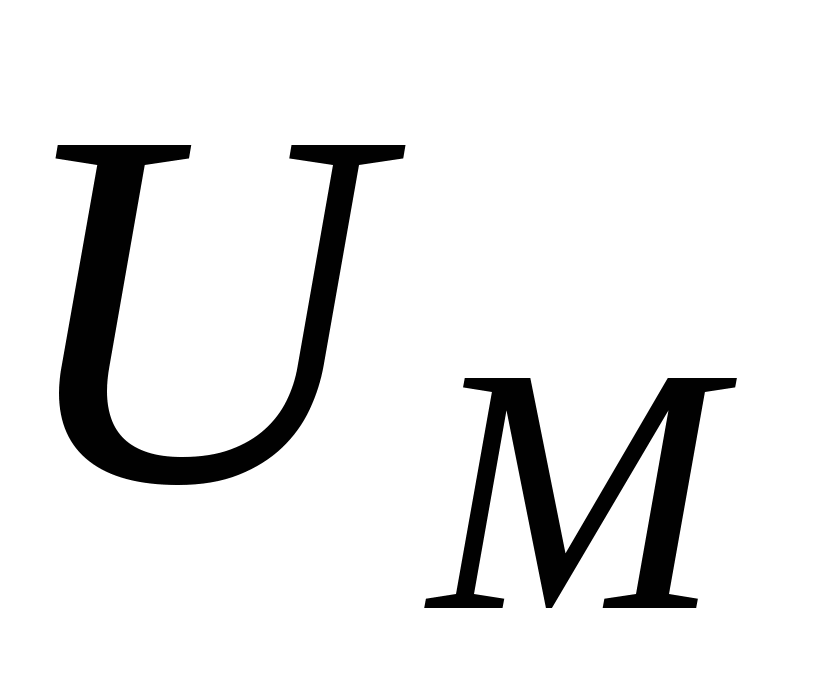 
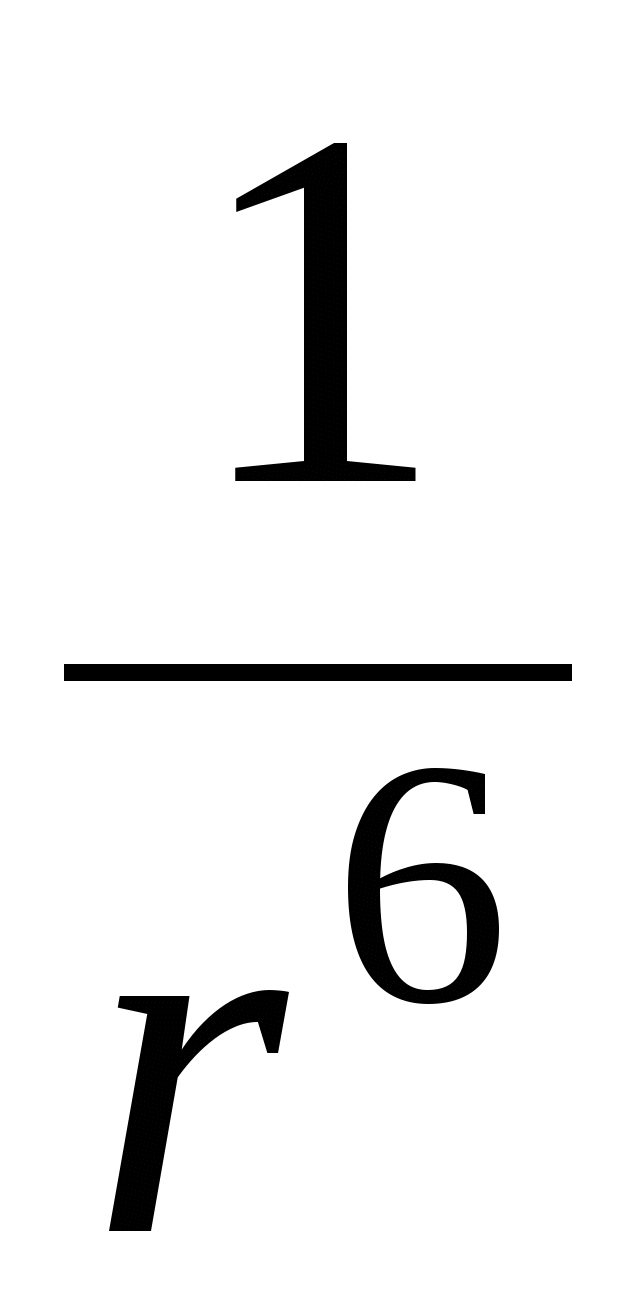
Взаимодействие атома с поверхностью:
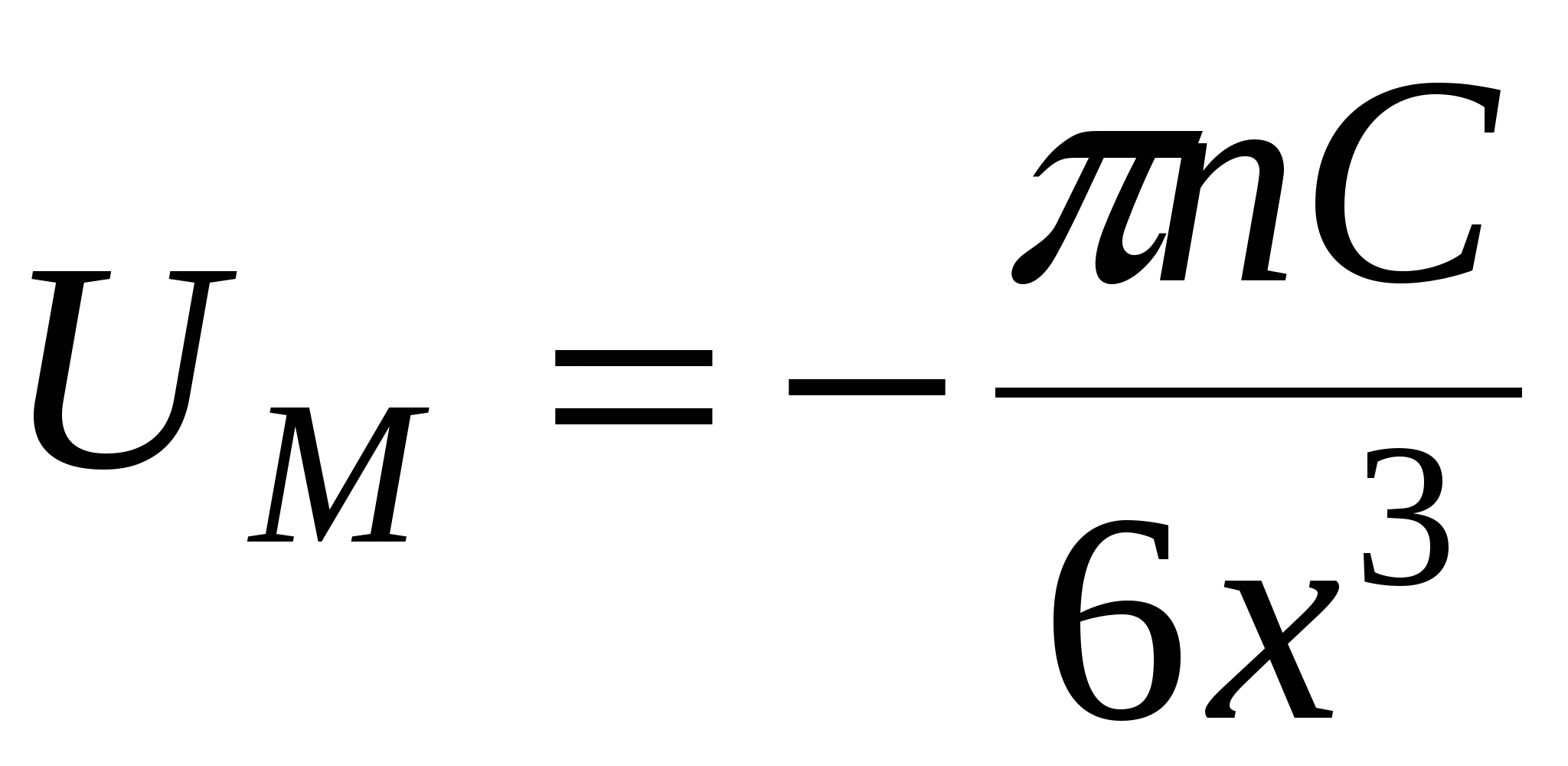
Возьмем две пластинки:
Д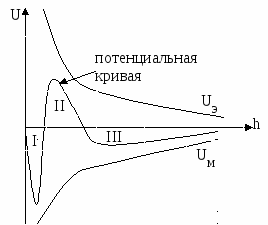 ля получения молекулярной составляющей необходимо провести суммирование всех энергий взаимодействия атомов правой и левой пластин. ля получения молекулярной составляющей необходимо провести суммирование всех энергий взаимодействия атомов правой и левой пластин.
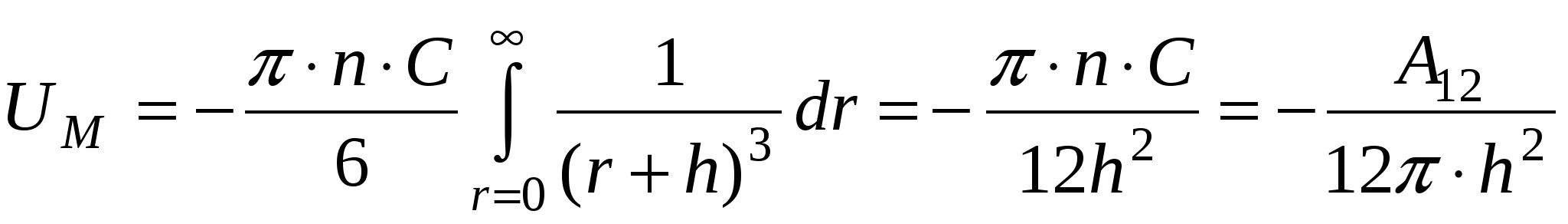 , ,
где 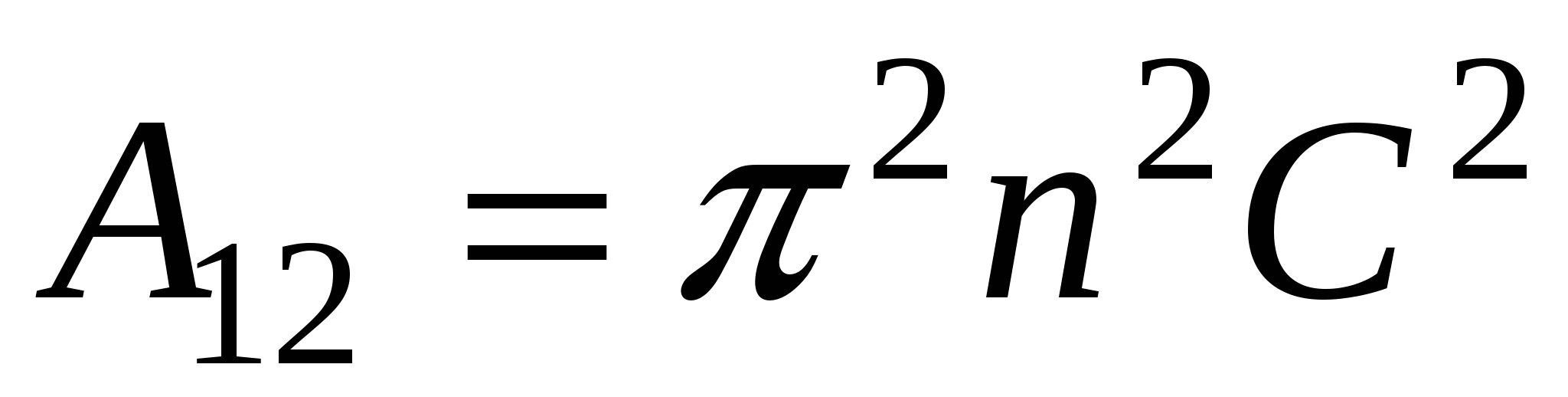 - постоянная Гамакера (учитывает природу взаимодействующих тел). - постоянная Гамакера (учитывает природу взаимодействующих тел).
Т.о. энергия взаимодействия частиц в системе может быть выражена с помощью потенциальных кривых.
I – первичный потенциальный минимум. Это зона необратимой коагуляции, силы притяжения преобладают.
II – зона агрегативной устойчивости, преобладают силы отталкивания.
III – вторичный потенциальный минимум (или зона флокуляции). Между частицами дисперсной фазы существует прослойка электролита, и частицы могут быть разделены и переведены в зону агрегативной устойчивости.
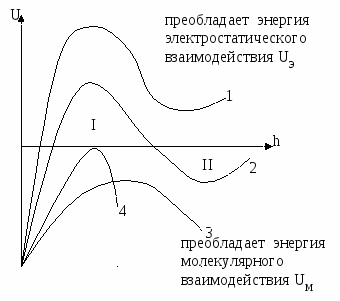
Кривая 1 – система агрегативно устойчива.
Кривая 2 – в зоне I устойчива, в зоне II не устойчива.
Кривая 3 – в системе произошла коагуляция.
Кривая 4 – в точке 4 суммарная энергия взаимодействия U=0, 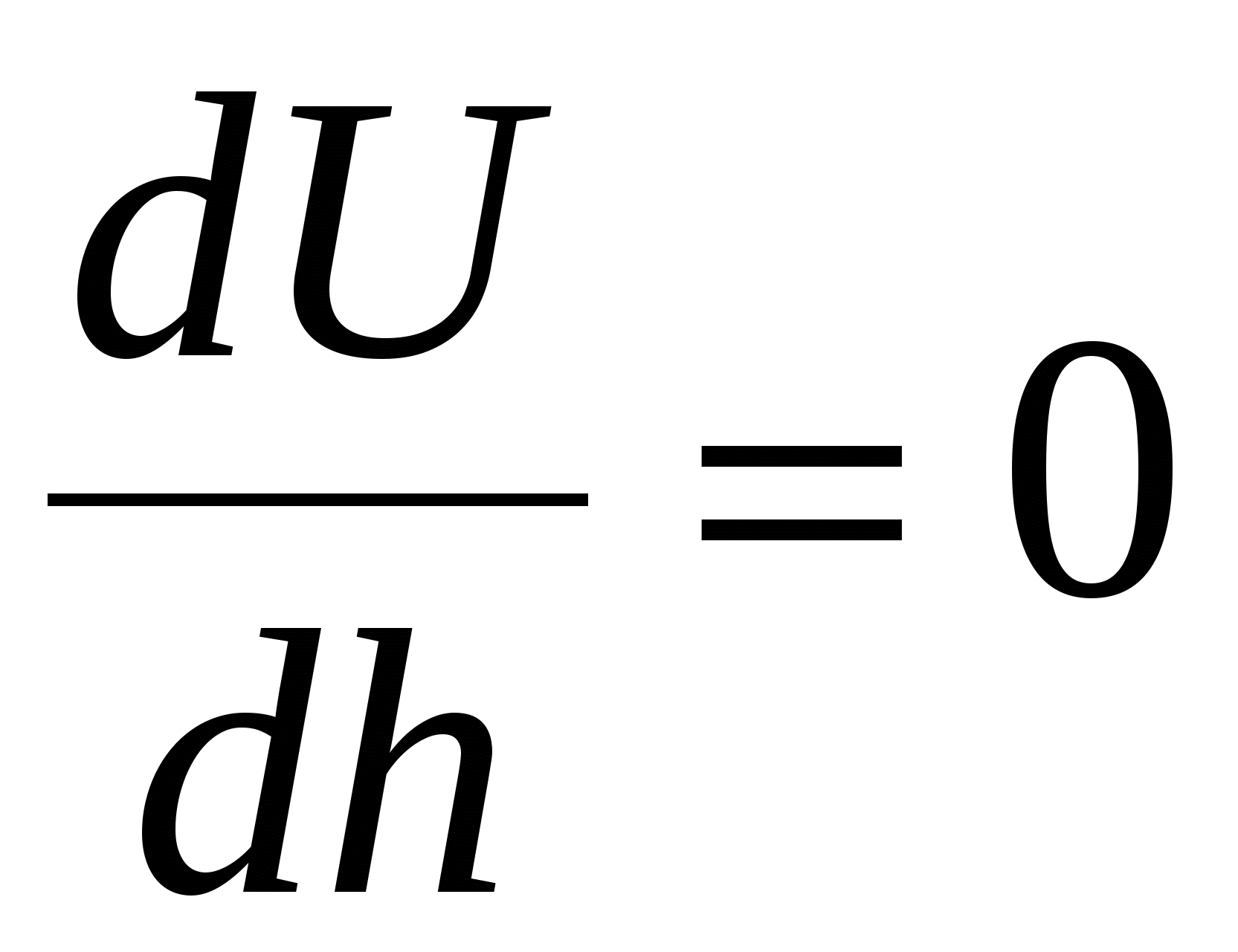 , эта точка экстремума соответствует началу быстрой коагуляции. , эта точка экстремума соответствует началу быстрой коагуляции.
Существует два случая:
1. Поверхности слабозаряженные:
U = UЭ + UM = 0
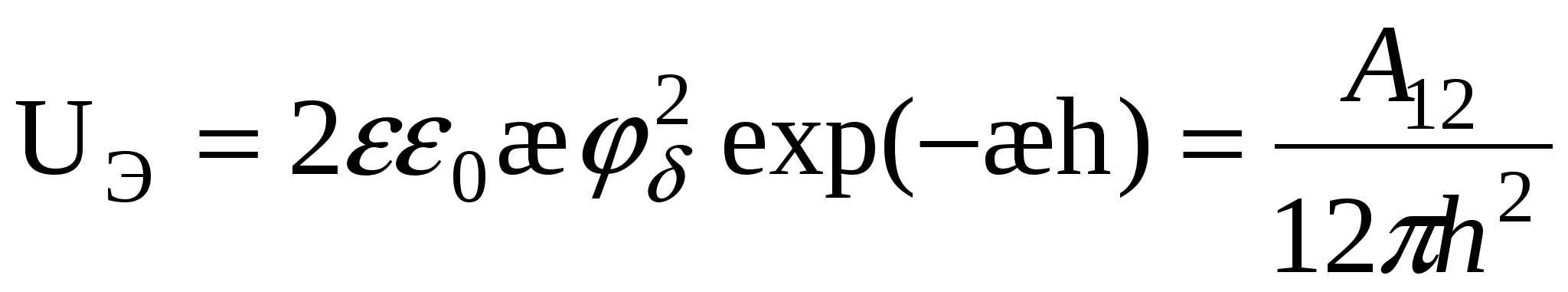 (1) (1)
2) 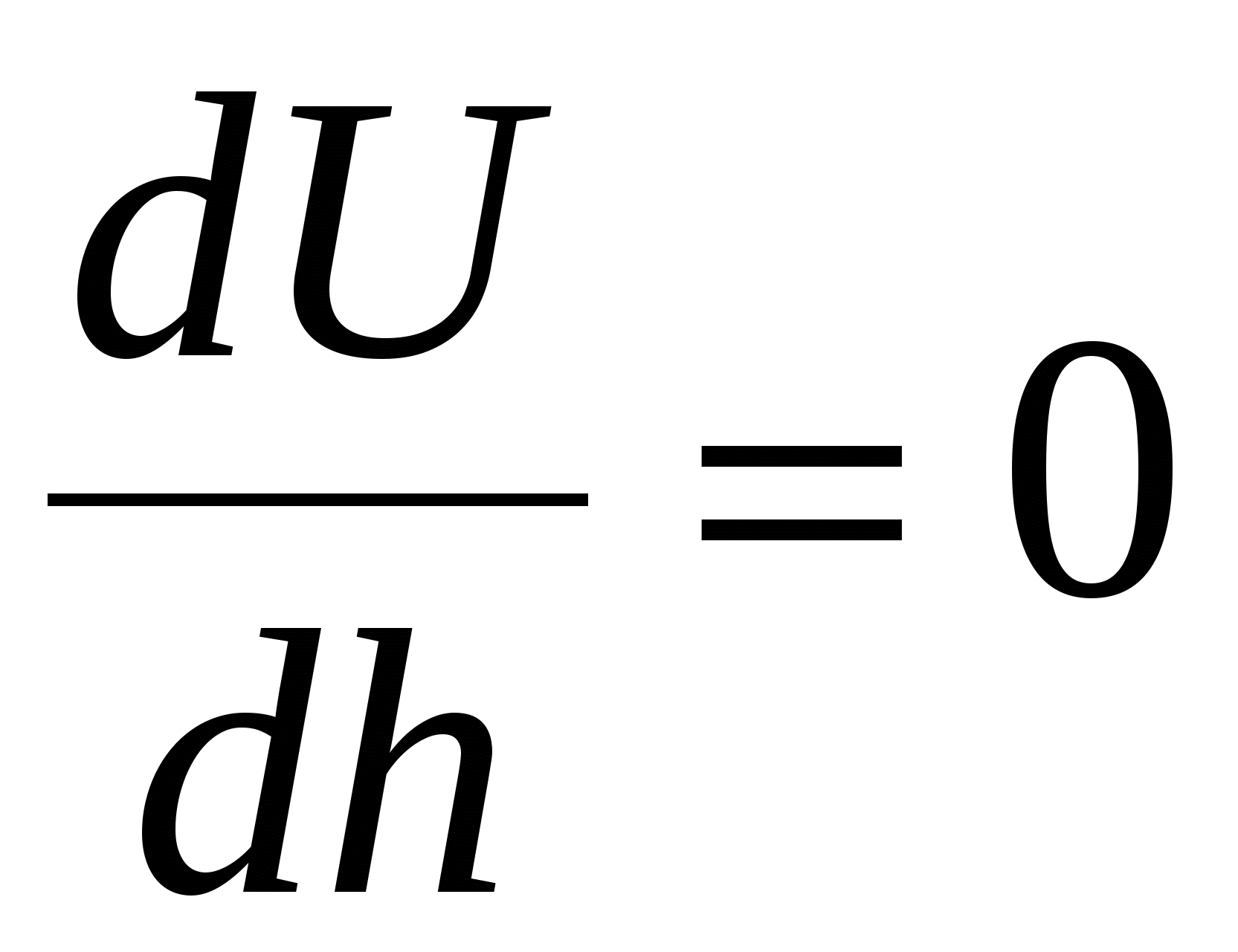
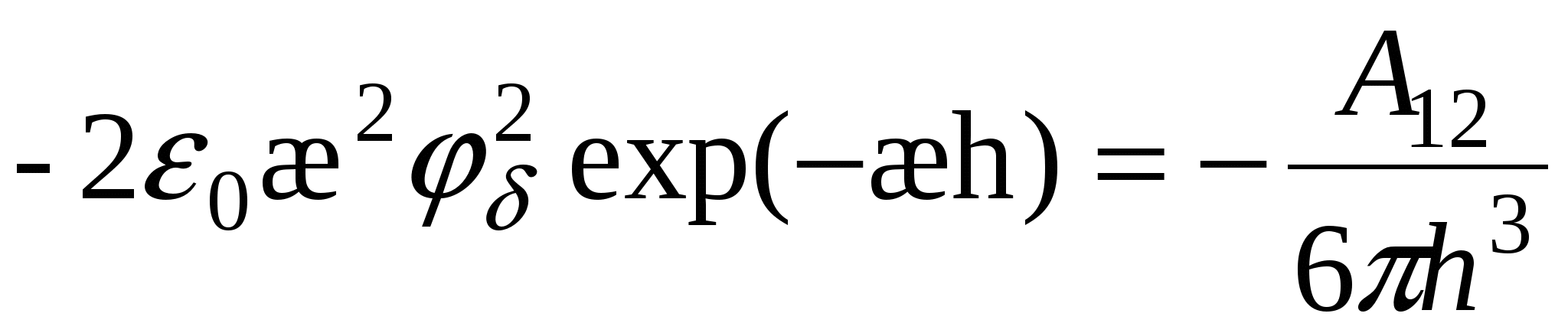 (2) (2)
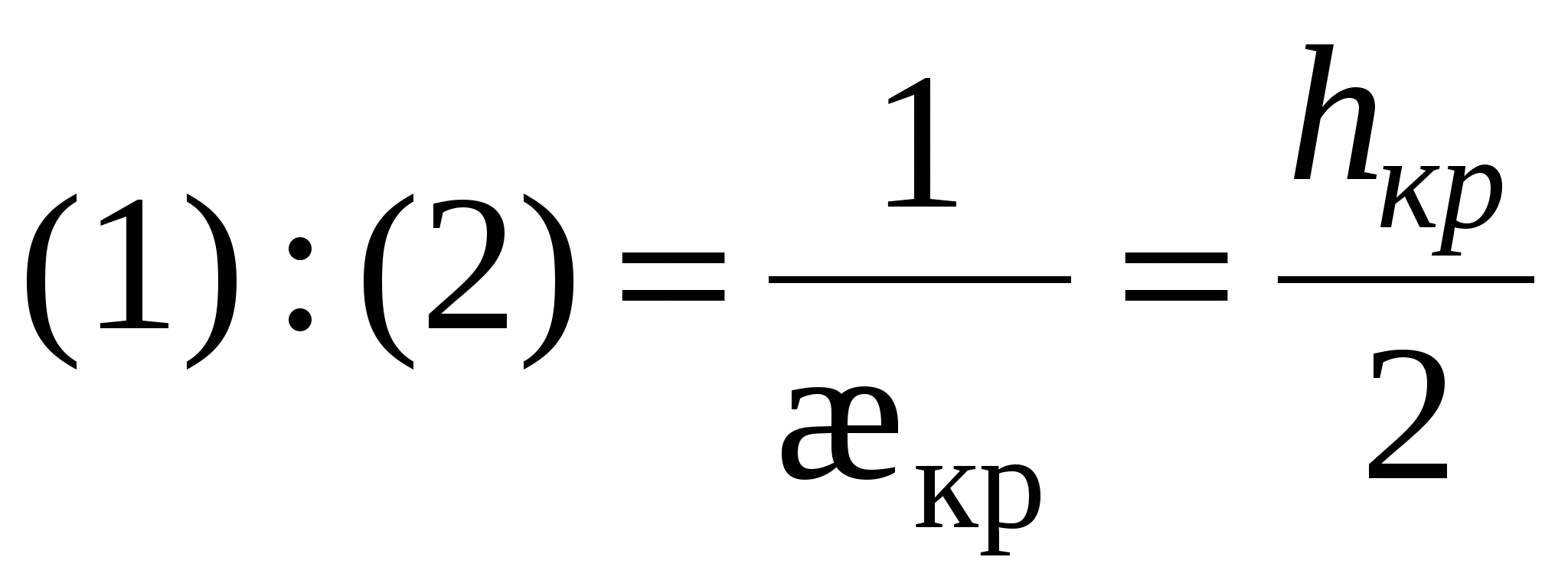  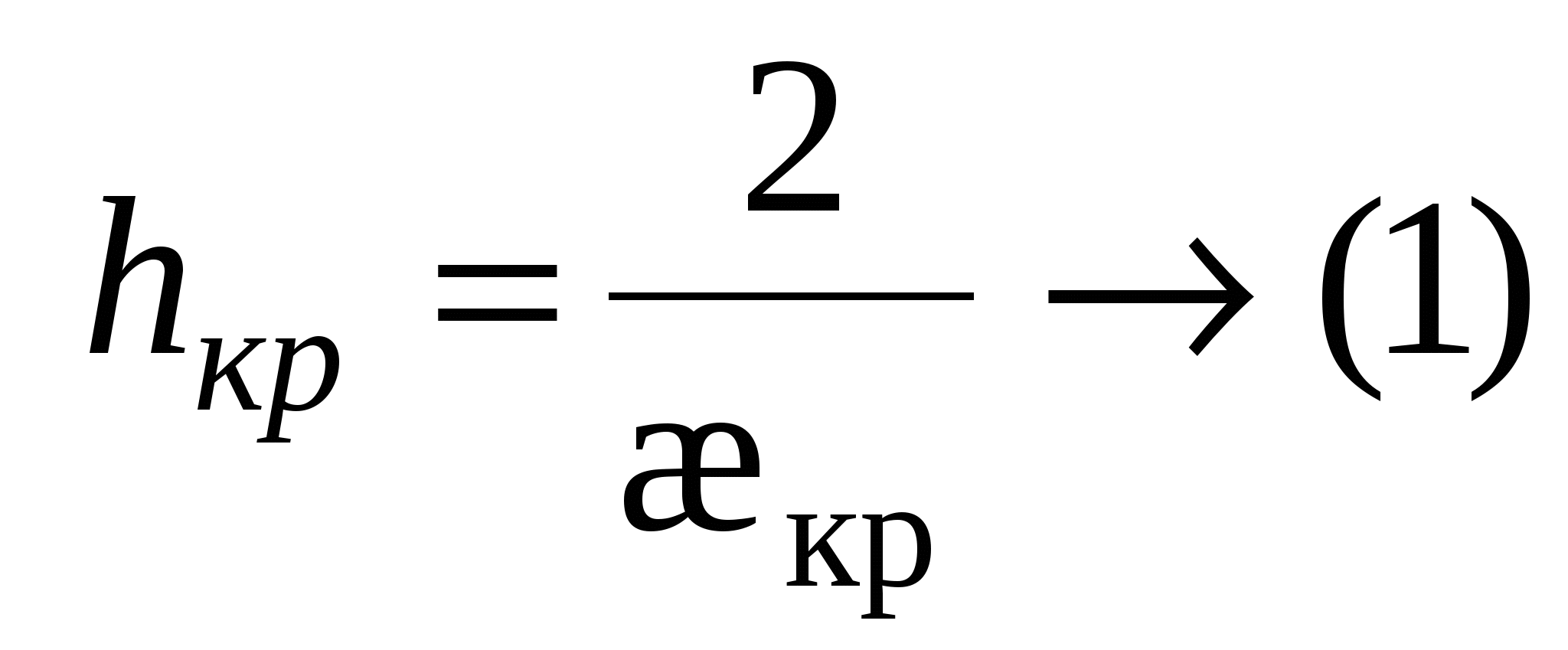
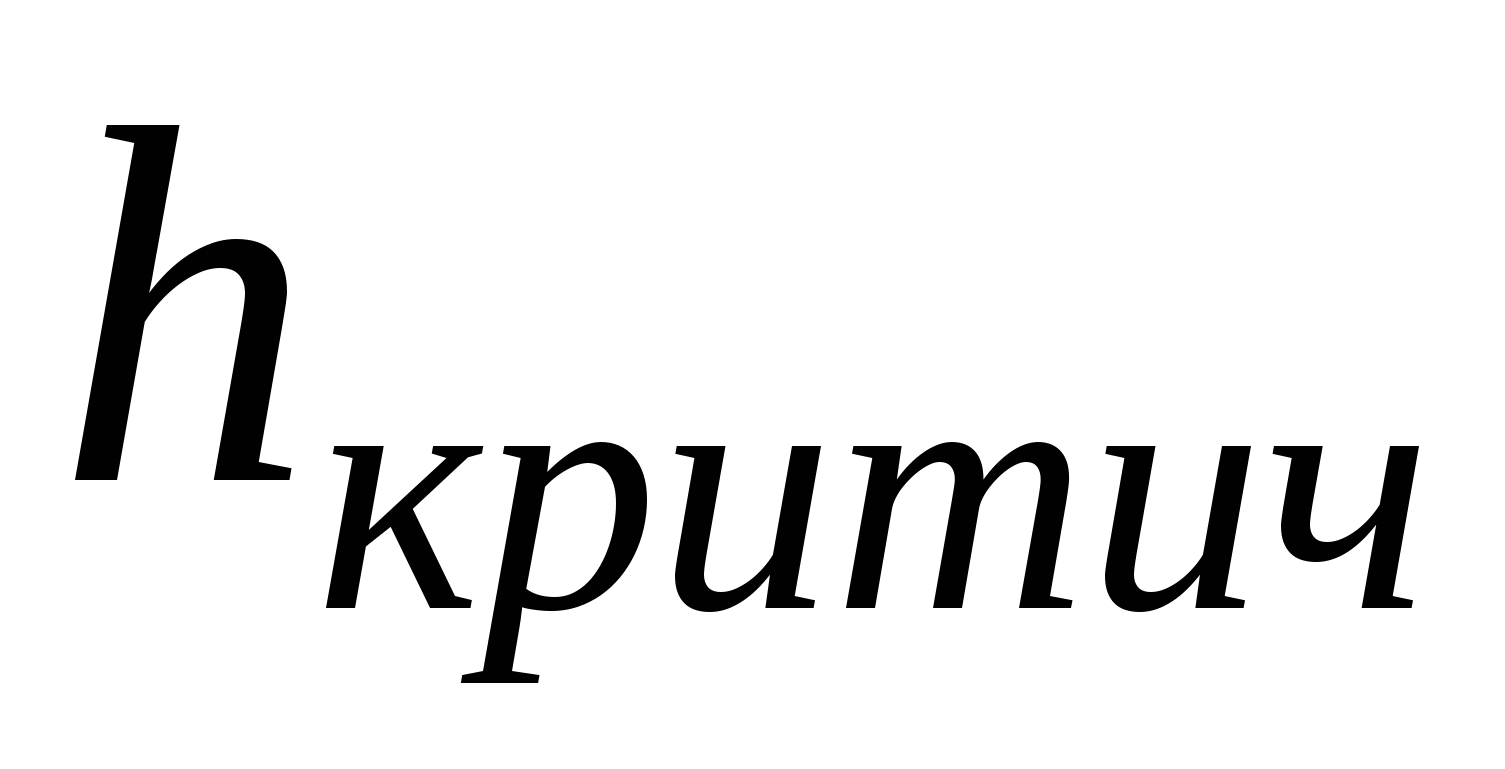 - это толщина прослойки соответствующая началу процессу коагуляции. - это толщина прослойки соответствующая началу процессу коагуляции.
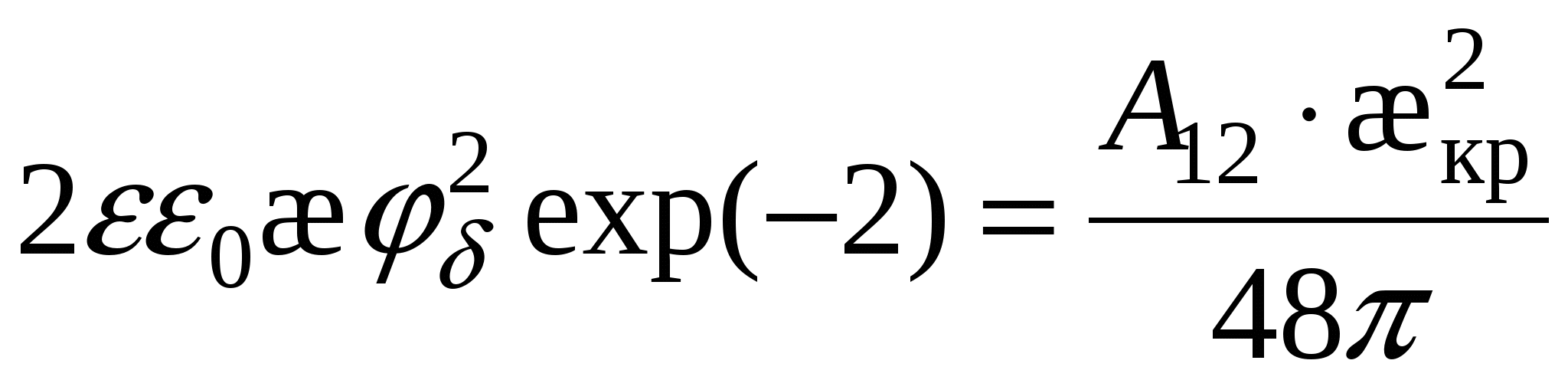
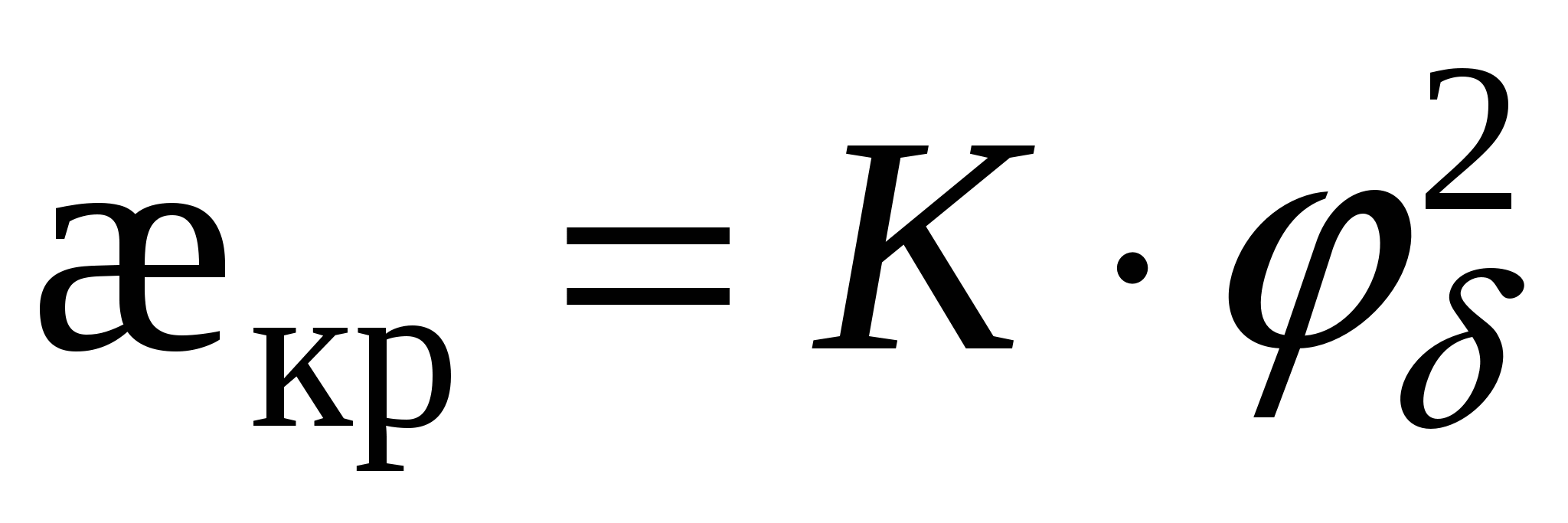
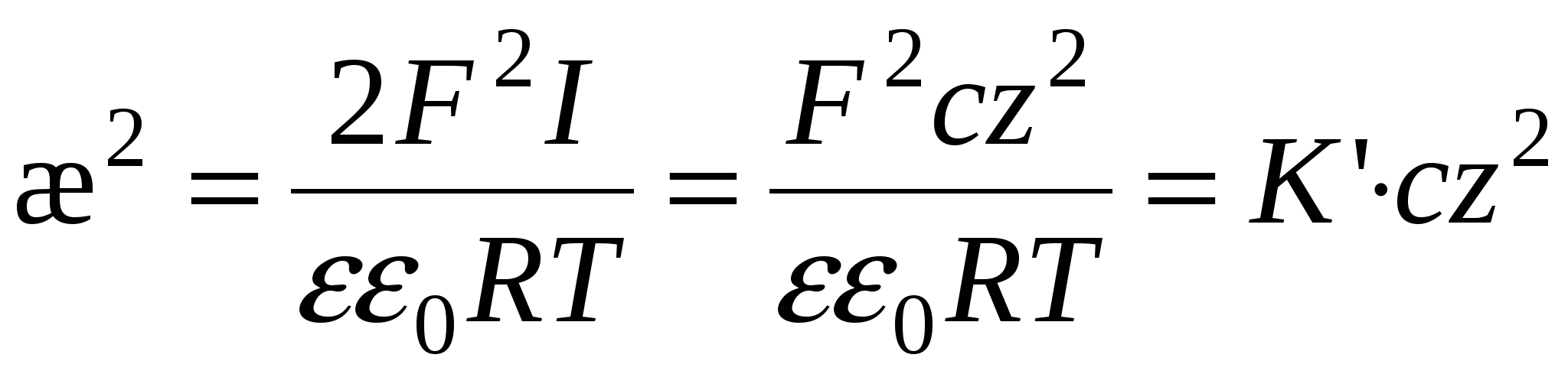
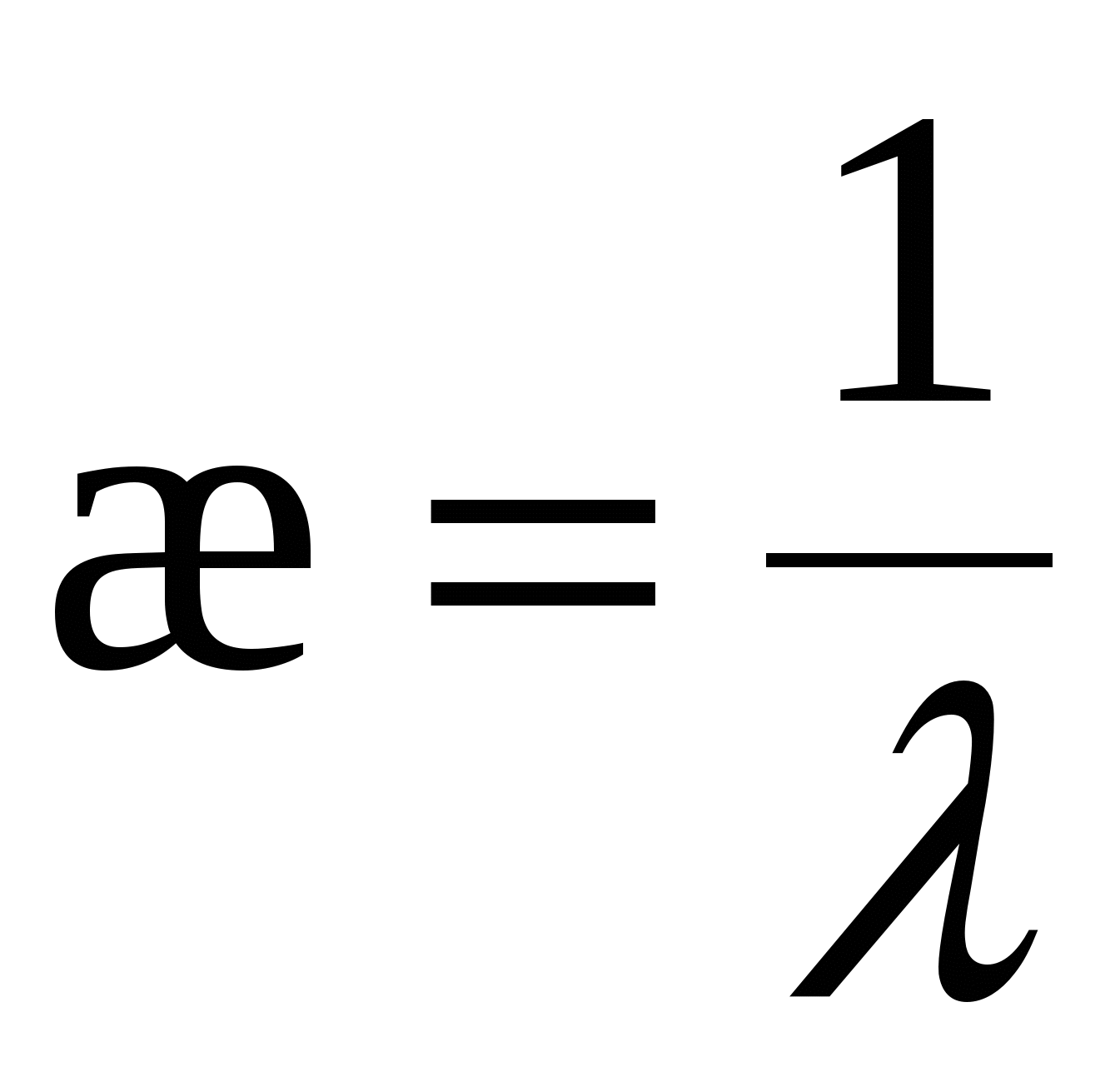
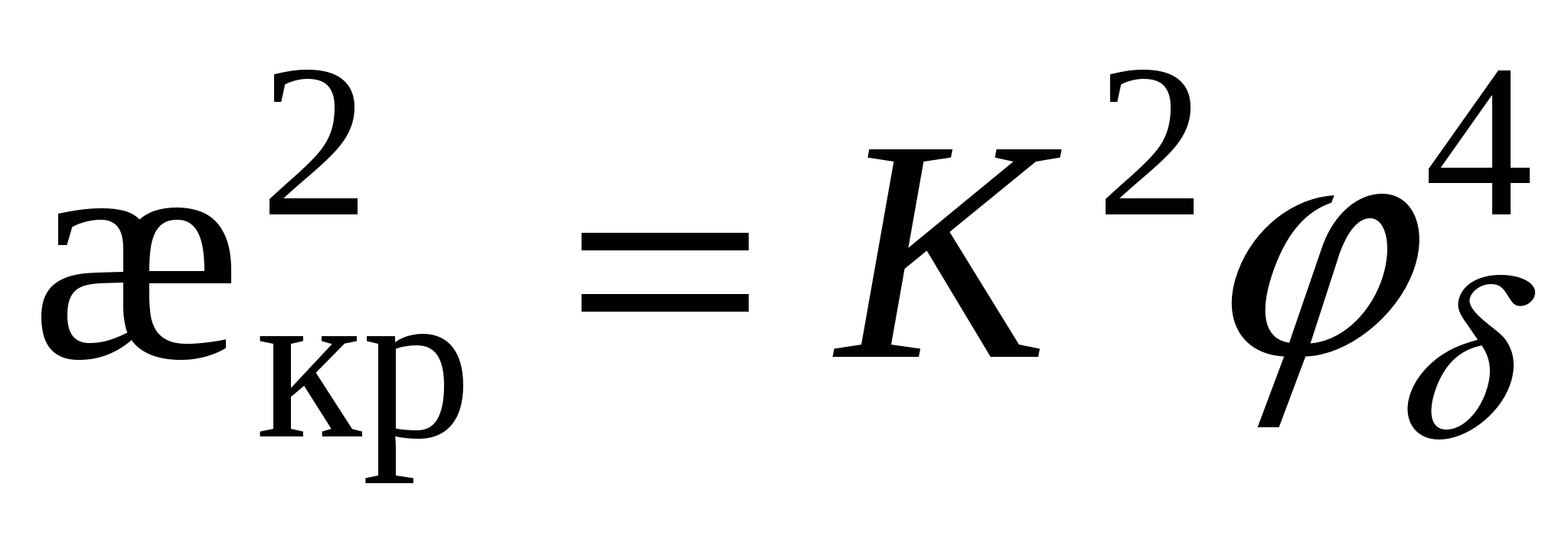
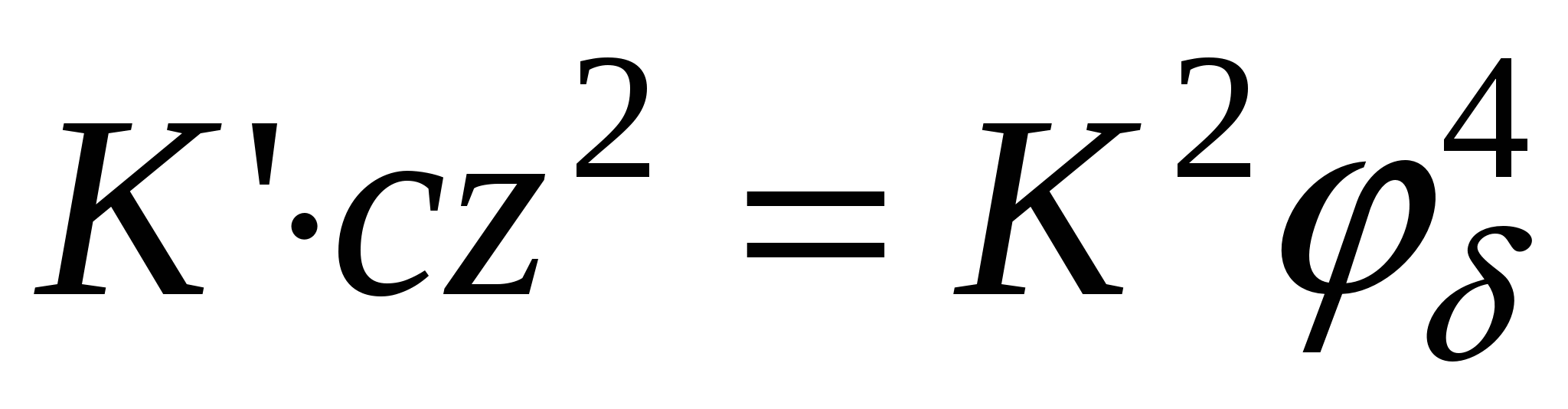
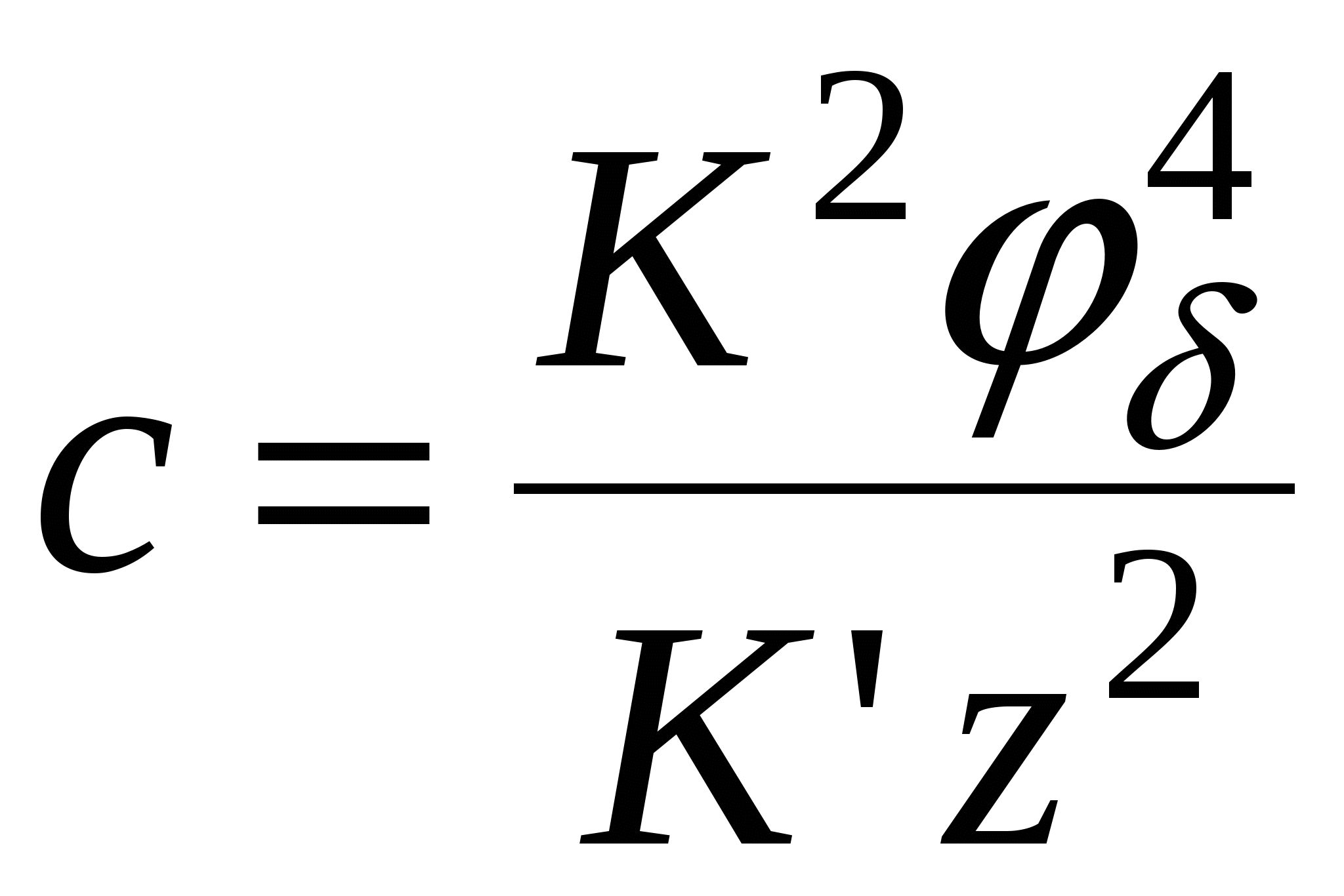 - для слабозаряженных поверхностей - для слабозаряженных поверхностей
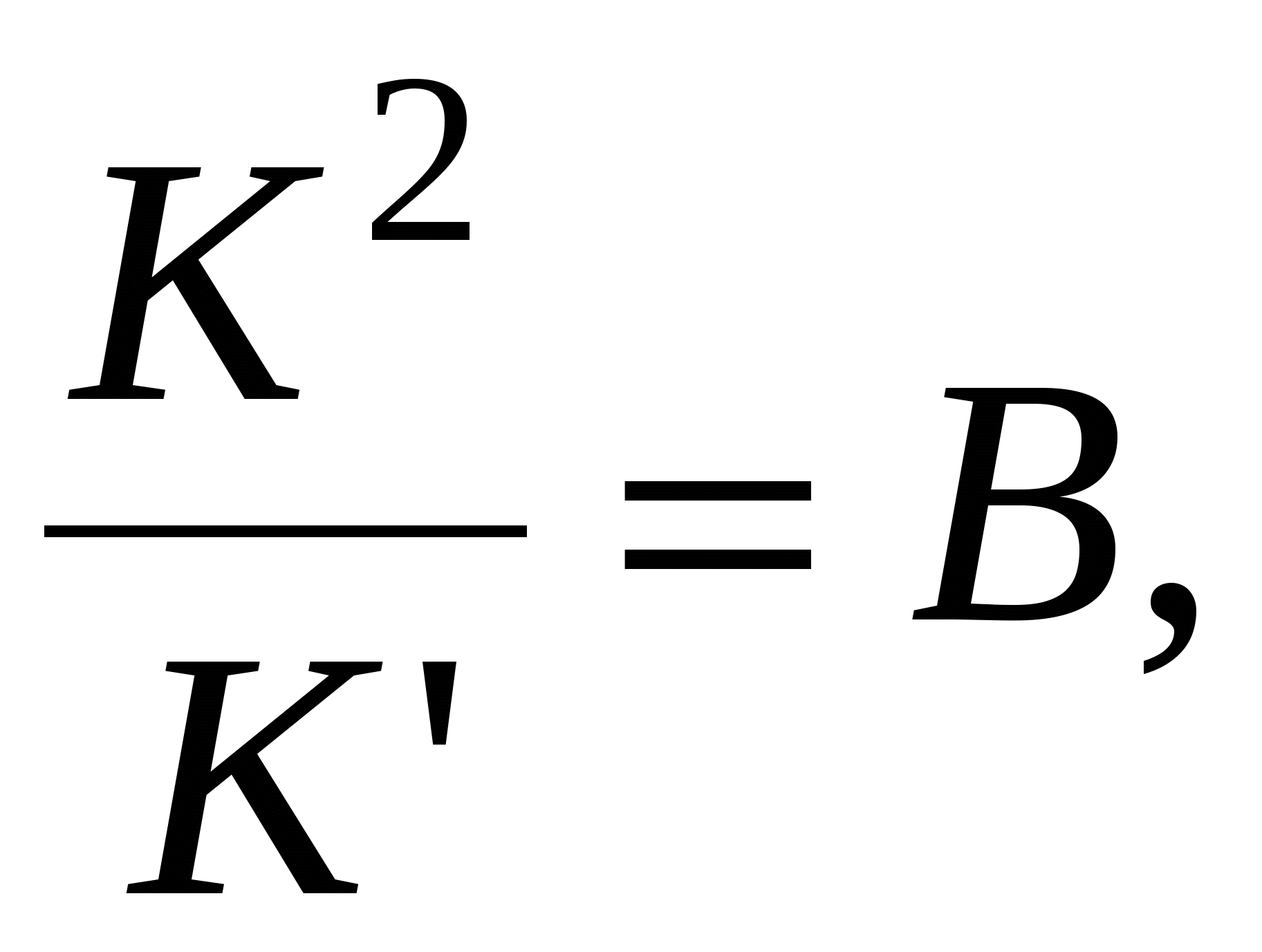 тогда тогда 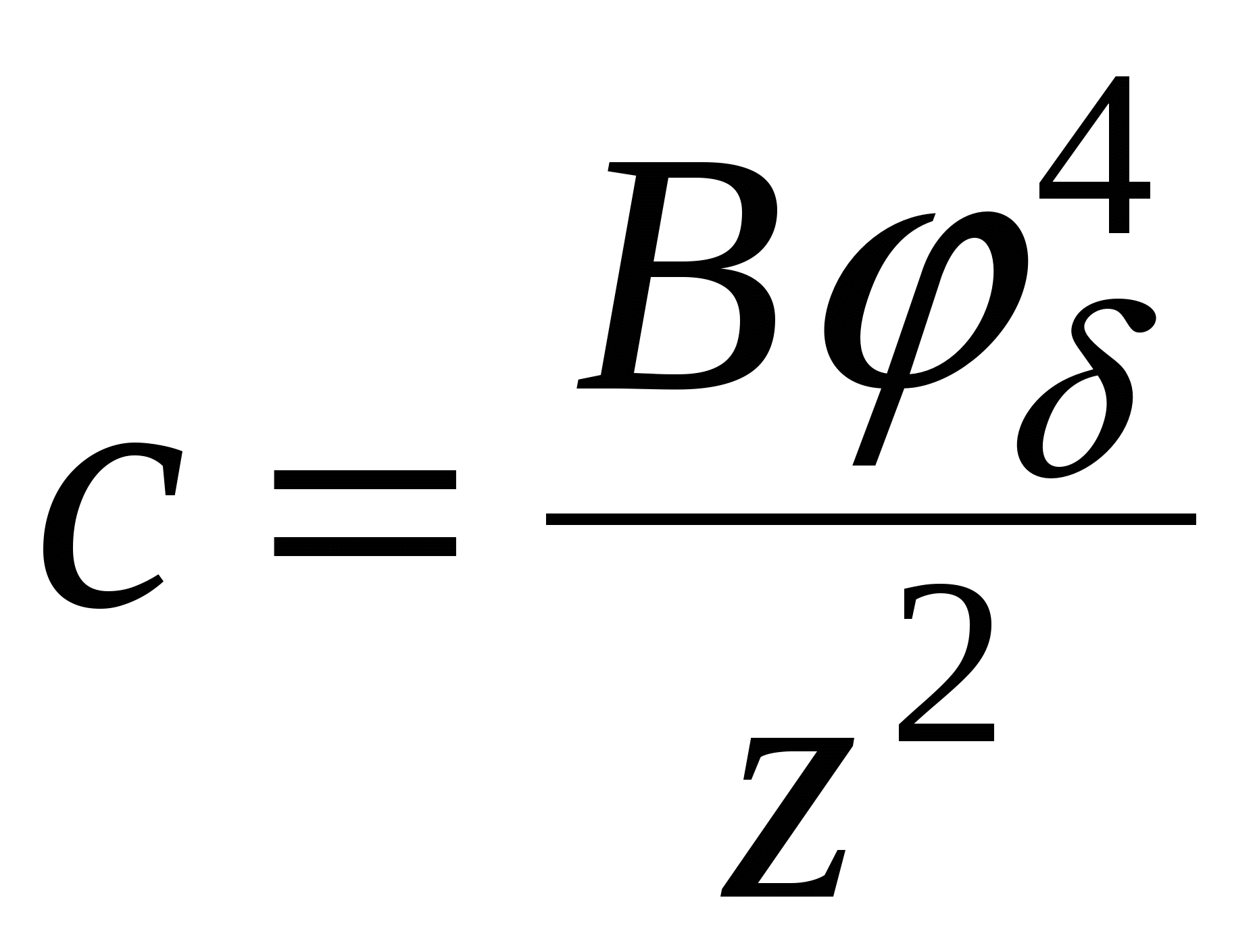
2. Для сильнозаряженных поверхностей:
1) UЭ = UМ
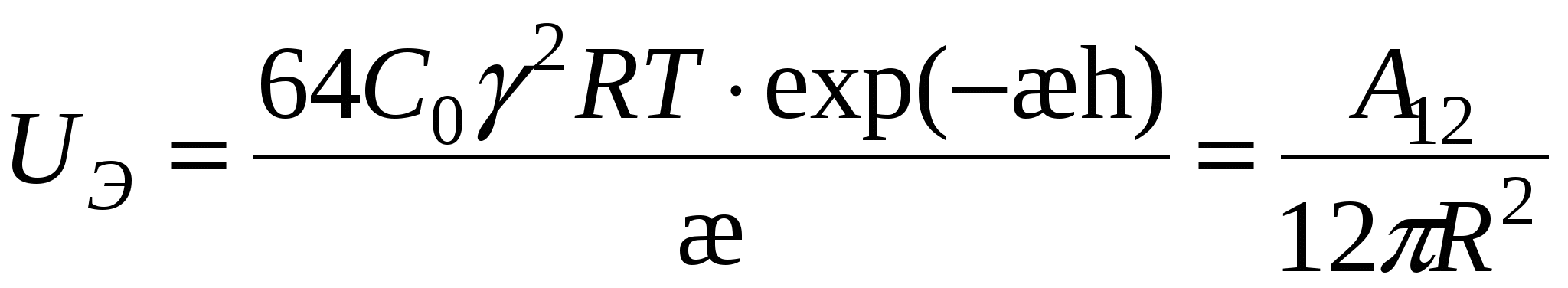 (1) (1)
2) 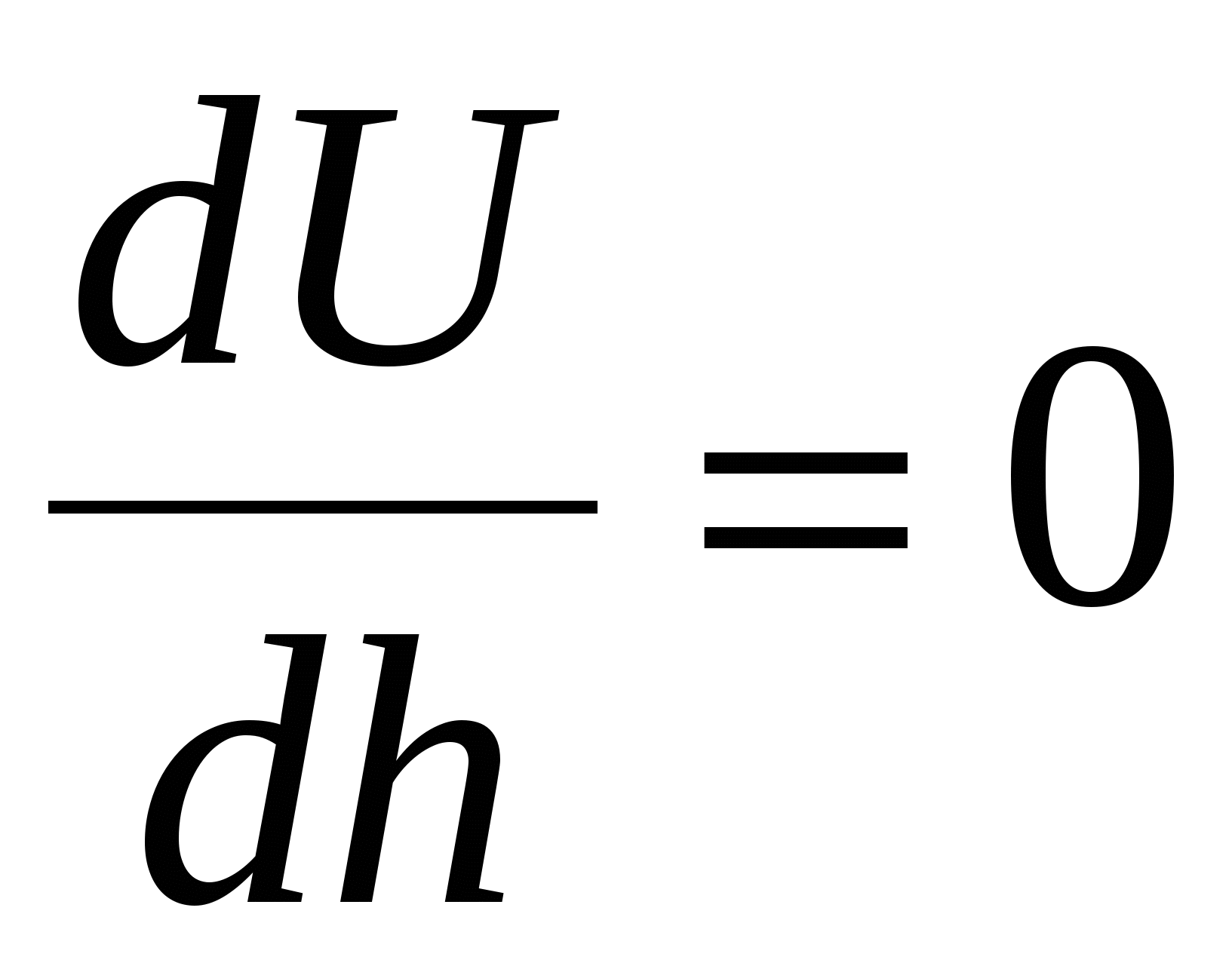
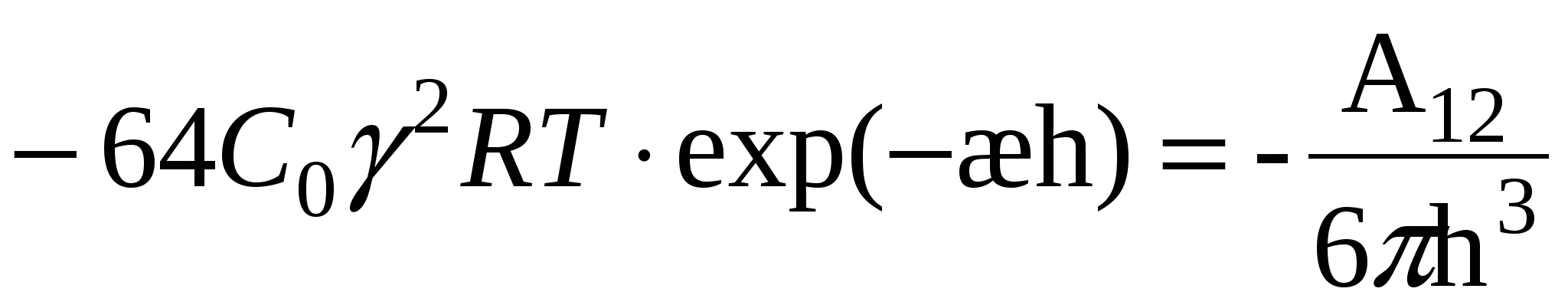 (2) (2)
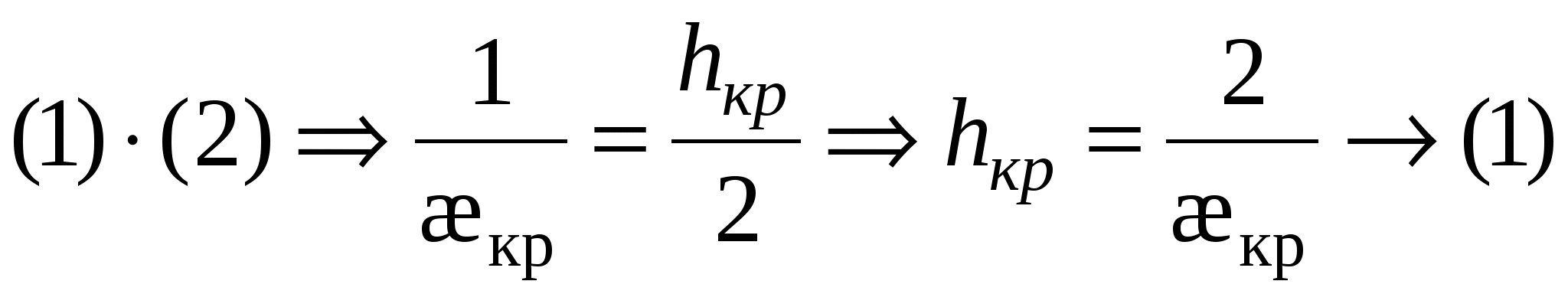
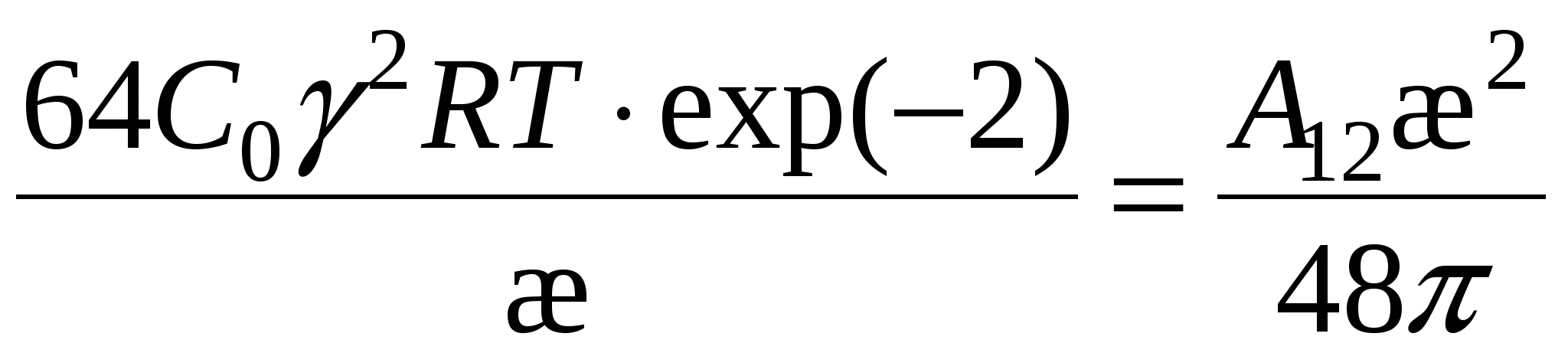
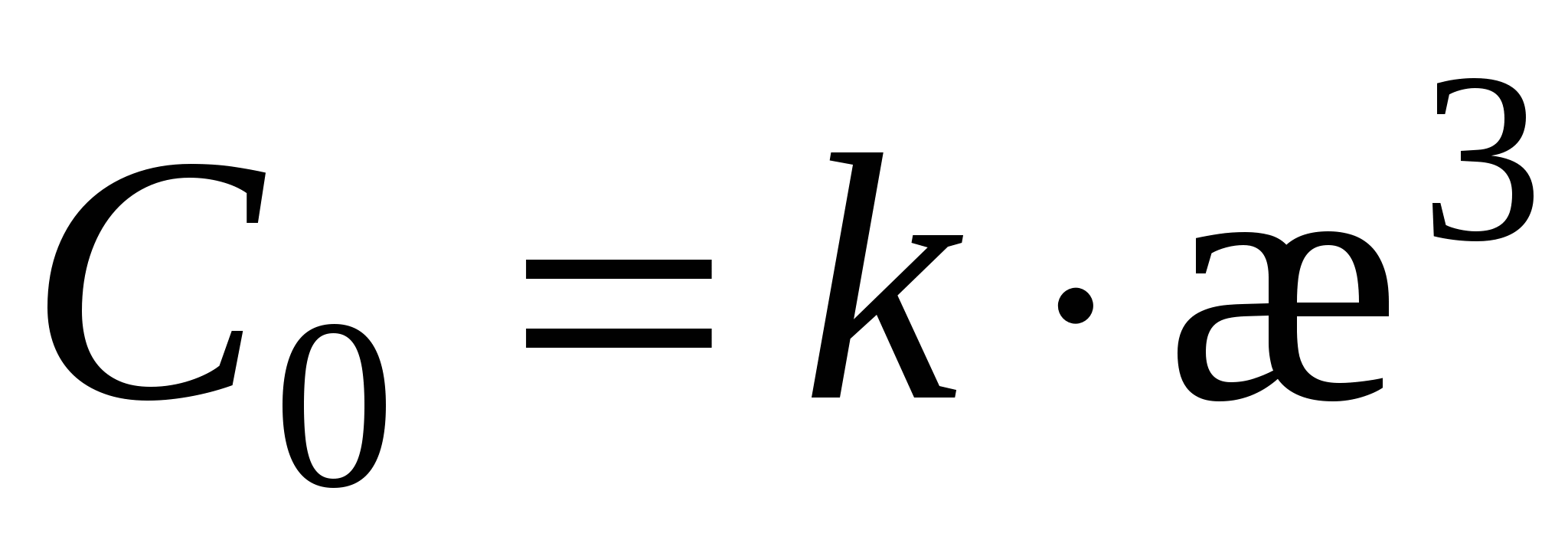 (3) (3)
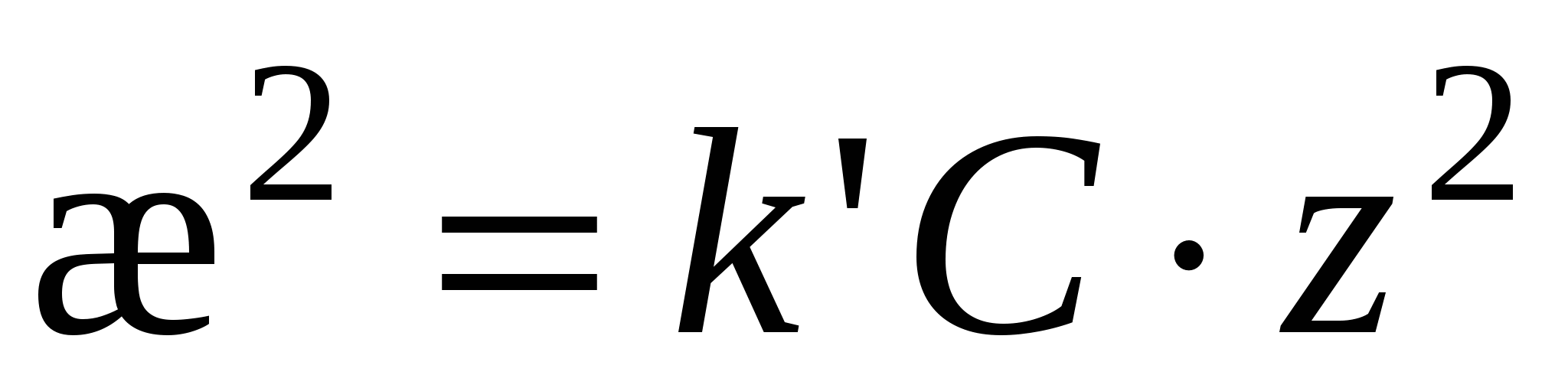 , ,
Возведем (3) в квадрат 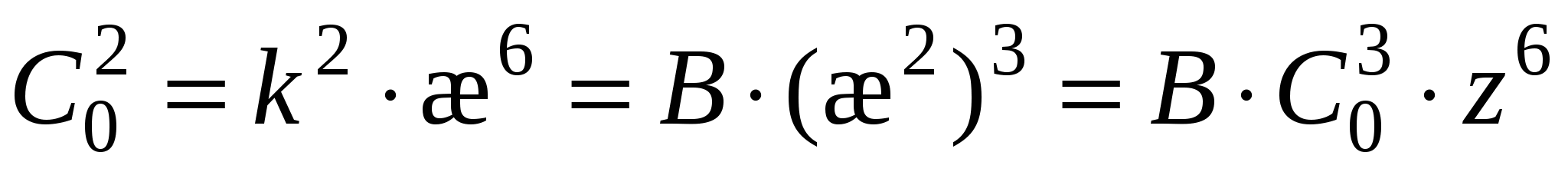
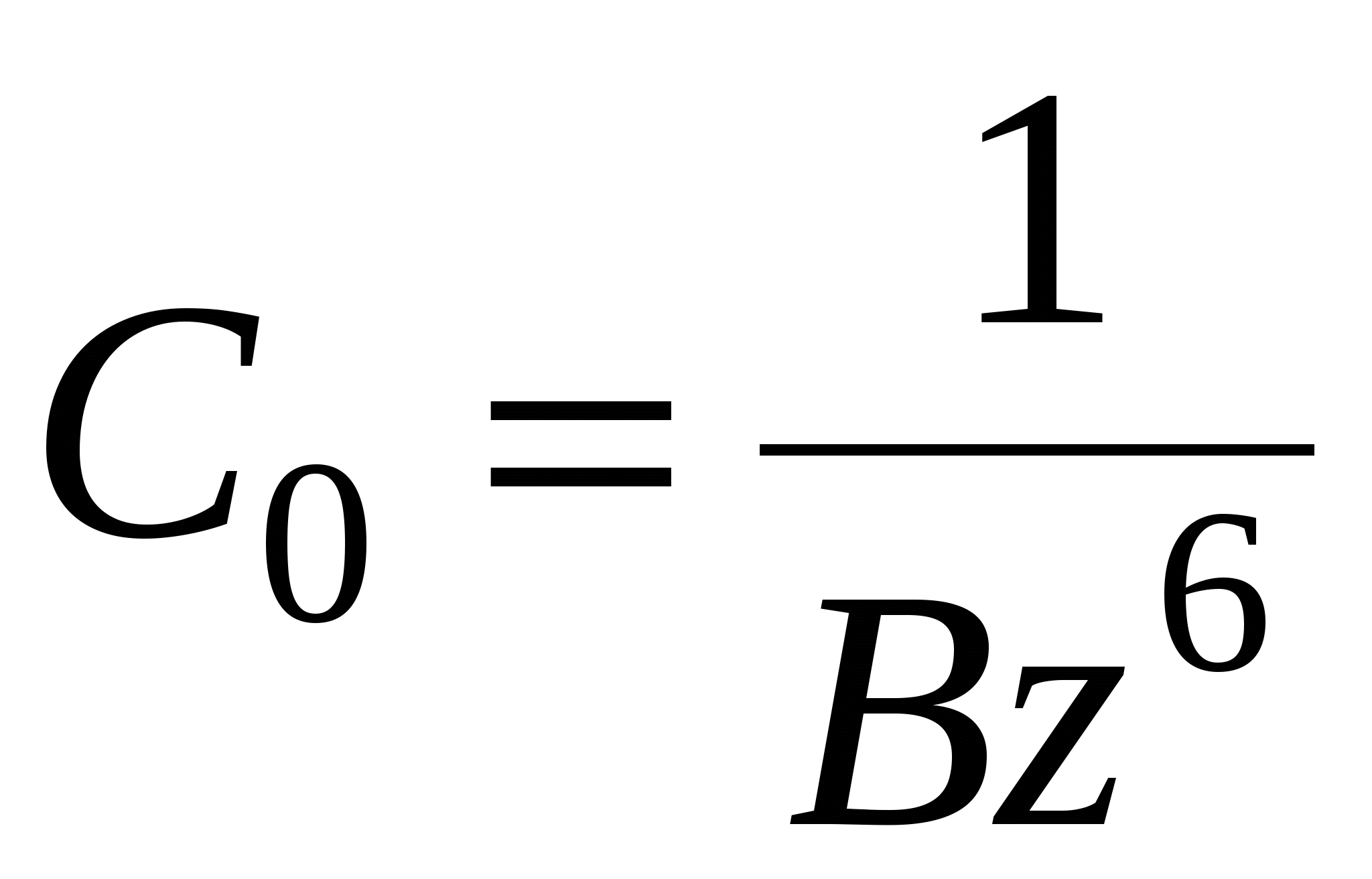
Коагуляция:
К онцентрационная (характерна для сильно заряженных поверхностей, происходит в случае введения в раствор индифферентного электролита и протекает при участии специфически адсорбирующихся ионов). онцентрационная (характерна для сильно заряженных поверхностей, происходит в случае введения в раствор индифферентного электролита и протекает при участии специфически адсорбирующихся ионов).
При специфической адсорбции ионы могут адсорбироваться в сверхэквивалентном количестве таким образом, что поверхность может изменить свой заряд. Происходит перезарядка поверхности.

В случае специфической адсорбции могут адсорбироваться ионы не только противоположных знаков, но и одного.
Если адсорбируются ионы того же знака, что и поверхность, то в поверхностном слое будет происходить не падение потенциала, а его рост.
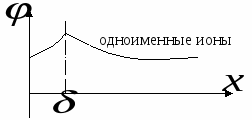
Нейтрализационная коагуляция (протекает с участием слабозаряженных частиц и зависит не только от заряда электролита-коагулятора, но и от потенциала на границе плотного и диффузного слоя).
|
|
|
 Скачать 1.77 Mb.
Скачать 1.77 Mb.