Курс практичксих занятий по инженерной термодинамики. параметры состояния тела
 Скачать 1.52 Mb. Скачать 1.52 Mb.
|
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 3.ТЕМА: « ГАЗОВЫЕ СМЕСИ » Состав газовой смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми или объемными долями. Массовая доля определяется отношением массы отдельного газа, входящего в смесь, к массе всей смеси: m1 = где М1, М2,, М3, . . ., Мп— массы отдельных газов и М — масса всей смеси. Объемной долей газа называют отношение объема каждого компонента, входящего в смесь, к объему всей газовой смеси при условии, что объем каждого компонента отнесен к давлению и температуре смеси (приведенный объем): r1 = где V1 , V2 ,V3 ,Vn — приведенные объемы компонентов газов, входящих в смесь; V— общий объем газовой смеси. Очевидно, что М1 +М2 +М3 +… + Мп= М; т1 + т2+ т3 +…+ тп= 1, а также V 1 +V 2 +V 3 +…+Vn =V; r1 + r2 + r3 + …+ rn = 1 Для перевода массовых долей в объемные пользуются формулой 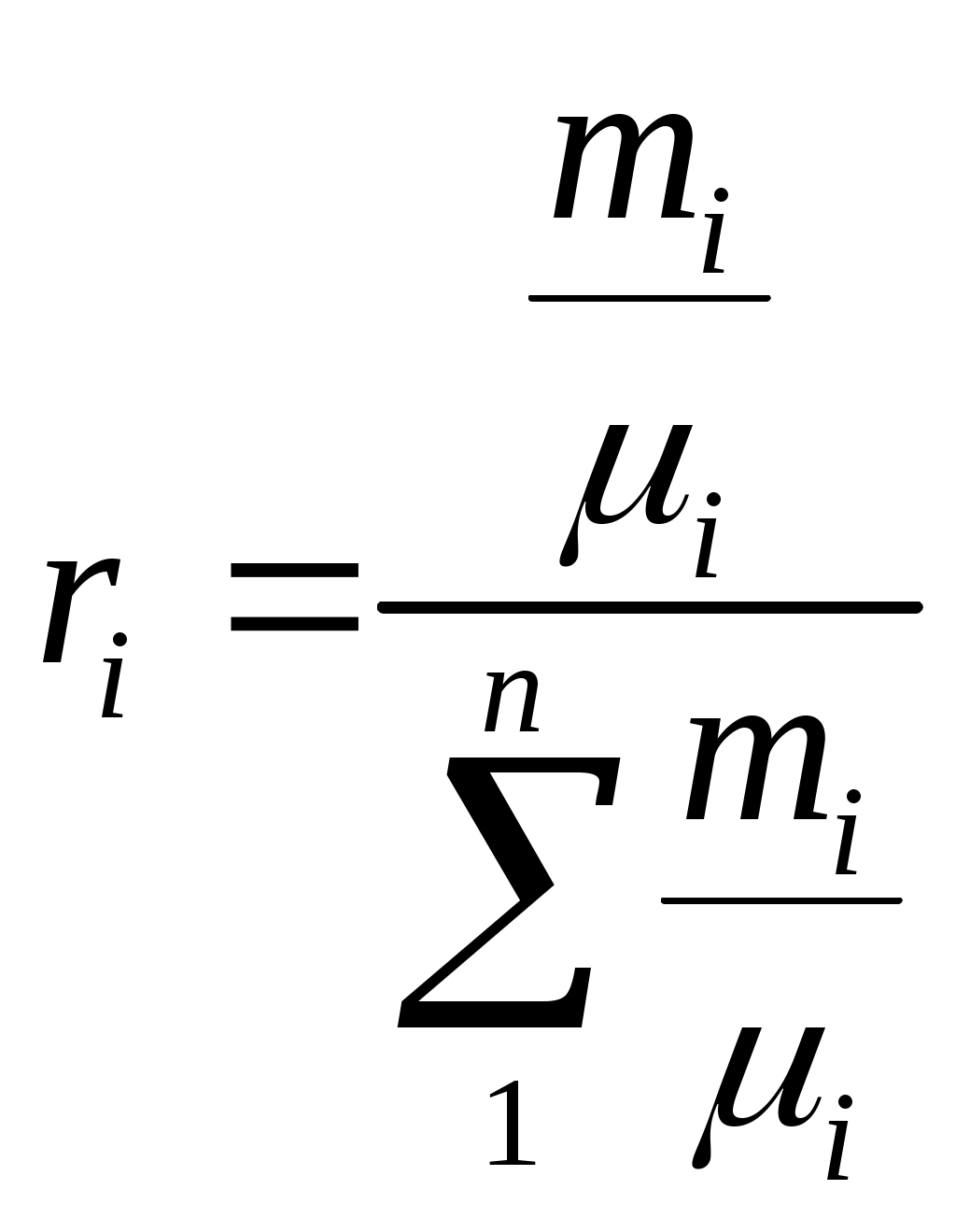 . (3.3) . (3.3)Объемные доли переводят в массовые по формуле 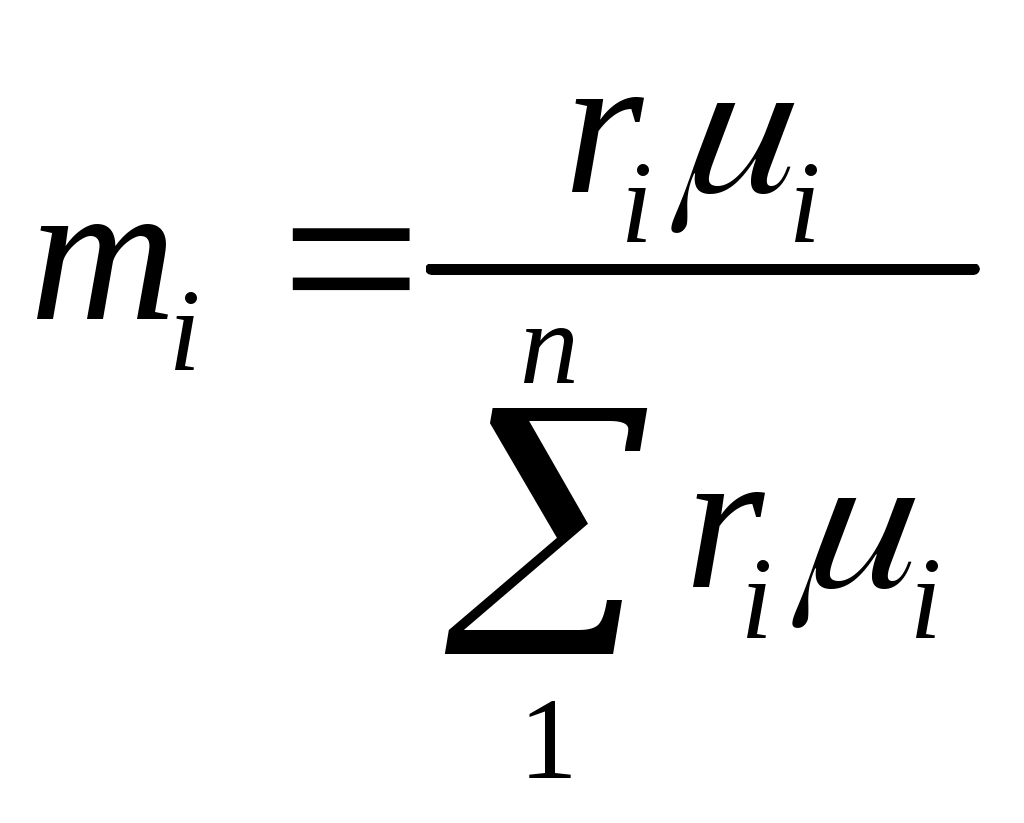 (3.4) (3.4)Плотность смеси определяют из выражения 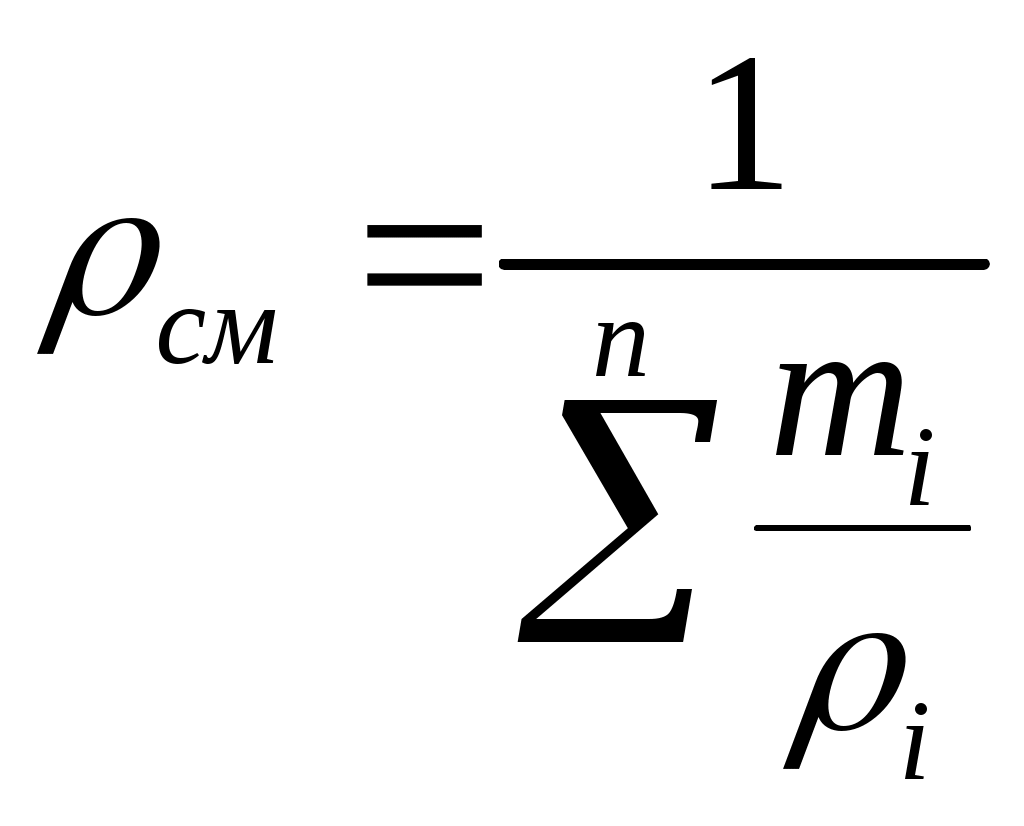 (3.6) (3.6)Удельный объем. смеси представляет величину, обратную ρсл,; поэтому, если дан объемный состав смеси, то 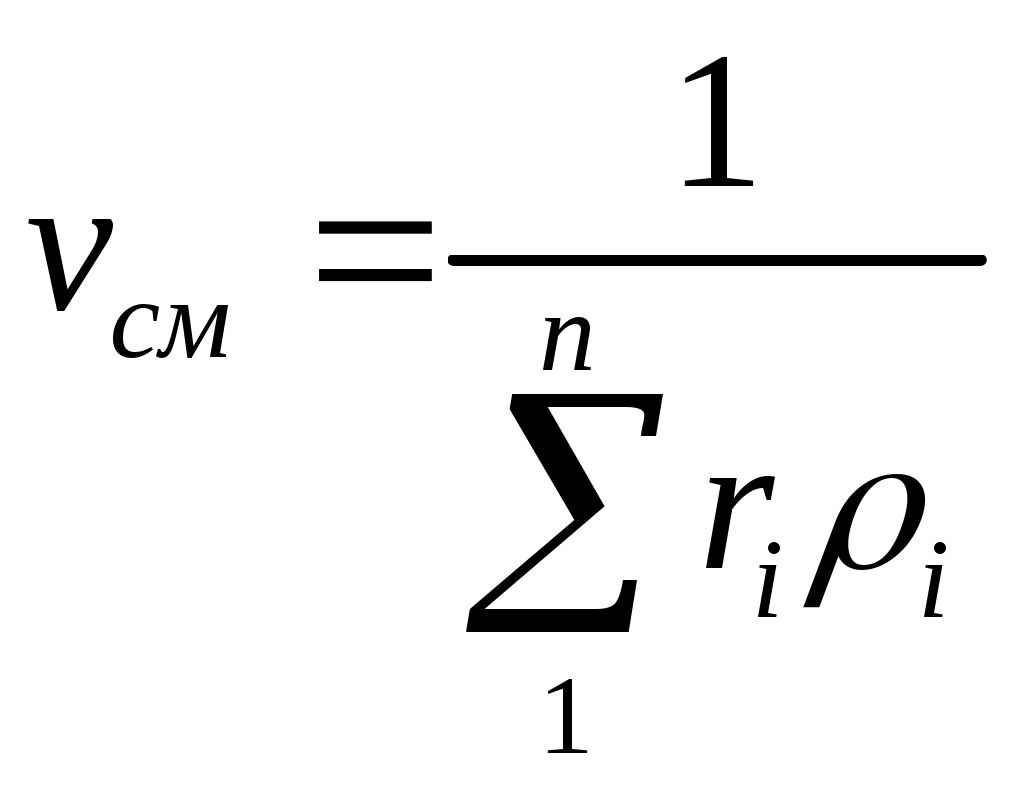 , м3/кг (3.7) , м3/кг (3.7)Если же известен массовый состав, то Из уравнения (3.5) легко получить значение так называемой кажущейся молекулярной массы газовой смеси 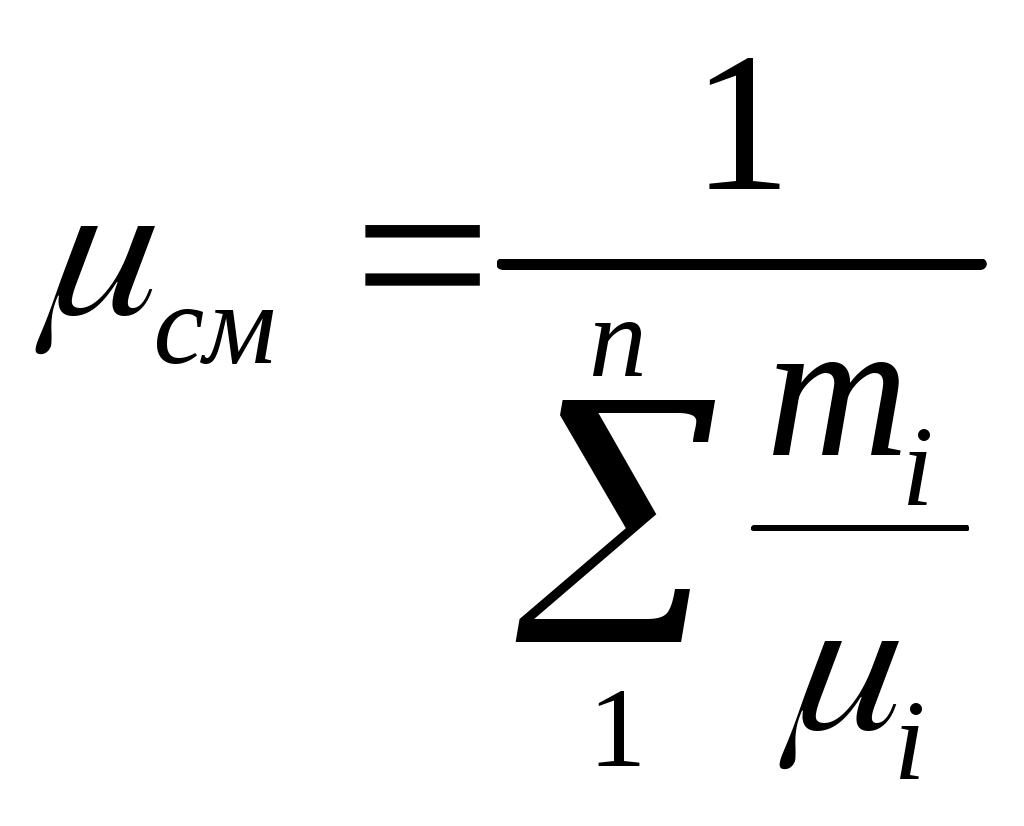 (3.10) (3.10)Газовую постоянную смеси газов (Rсм) можно выразить или через газовые постоянные отдельных компонентов., входящих в смесь, или через кажущуюся молекулярную массу смеси или 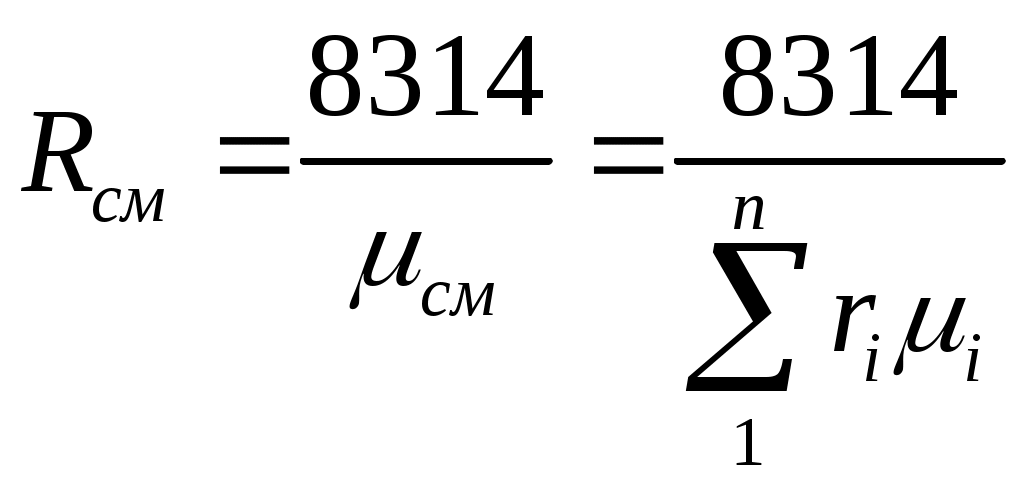 Дж/(кг·К) (3.12) Дж/(кг·К) (3.12)Связь между давлением газовой смеси и парциальными давлениями отдельных компонентов, входящих в смесь, устанавливается следующей зависимостью (закон Дальтона), легко получаемой из основного уравнения кинетической теории газов: p=р1+р2+р3+•••+рn, (3.13) где p - общее давление газовой смеси; р1, р2,…,рn - парциальные давления отдельных компонентов, входящих в смесь. Парциальные давления определяются проще всего, если известны объемные доли отдельных компонентов, входящих в смесь; p1=pr1, p2=pr2 и т.д. или вообще рi=pri, (3.14) где рl -парциальное давление любого газа, входящего в смесь. Если известны массовые доли, то парциальнoe давление любого газа, входящего в смесь, Задачи 3.1. Атмосферный воздух имеет примерно следующий массовый состав: то2=23,2%, тN2=76,8%. Определить объемный состав воздуха, его газовую постоянную, кажущуюся молекулярную массу и парциальные давления кислорода и азота. Если давление воздуха по барометру В=101325 Па. 3.2. B 1 м3 суxого воздуха содержится примеpно 0,21 м3 кислорода и 0,79 м3 азота. Определить массовый состав воздуха, его газовую постоянную и парциальные давления кислорода и азота. 3.3. Смесь газов состоит из водорода и окиси yглерода. Массовая доля водорода тн2 = 0,67°,%. Найти газовую постоянную смеси и ее удельный объем при нoрмальных условиях. 3.4. Определить газовую постоянную смеси газов, состоящей из 1 мз генераторного газа и 1,5 мз воздуха, взятых при ноpмальных условиях, и найти парциальные давления составляющих смеси. Плотность генерaторного газа ρ принять равной 1,2 кг/мз. 3.5. Объемный состав сухих продуктов сгоpания топлива (не содержащих водяных варов) следующий: СО2 = = 12,3°/о; 02 = 7,2%; N2 = 80,5%. Найти кажущуюся молекулярную массу и газовую постоянную, a также плотность и удельный объем продуктов сгорания при B = 100 кПа и t = 800° C. 3.6. Генераторный газ имеет следующий объемный состав: Н2 = 7,0%; СН4 = 2,0%; CO = 27,6%; СО2 = 4,8%; N2 = 58,6%. Определить массовые доли, кажущуюcя молекулярную массу, газовую постоянную, плотность и парциальные давления при 15° C и 0,1 МПа. 3.7. Газ коксовых печей имеет следующий объемный состав: Н2 = 57%; СН4 = 23%; СО = 6%; СО2 = 2°о; N2 = 12%. Найти кажущуюся молекулярную массу, массовые доли, газовую постоянную, плотность и парциальные давления при 15° C и 100 кПа. 3.8. Генераторный газ состоит из следующих объемных частей: Н2 = 18%; СО = 24%; СО2 = 6%; N2 = 52%. Определить газовую постоянную генераторного газа и массовый состав входящих в смесь газов. 3.9. Анализ продуктов сгорания топлива, произведенный c помощью аппарата Орса, показал следующий их состав; rco2=12,2%; ro2=7,1%; rco=0,4%; rN2=80,3%. Найти. массовый состав входящих в смесь газов. 3.10. Определить газовую постоянную, плотность при нормальных условиях и объемный состав смеси, если ее массовый состав следующий: H2 = 8,4 % ; СН4 = 48,7 % ;С2Н4 = 6,9%; СО = 17%; СО2 = 7,6%; 02 = 4,7%; N2= 6,7°%. 3.11. Найти газовую постоянную, удельный объем газовой смеси и парциальные давления ее составляющих, если объемный состав смеси следующий: С02 = 12%; СО = 1%; Н20 = 6%; 02 = 7%; N2 = 74%, а общее давление ее р = 100 кПа. 3.12. B резервуаре емкостью 125 мз находится коксовый газ при давлении р = 0,5 МПа и температуре t = 18° C. Объемный состав газа следующий: гн2 = 0,46; гсн4 = 0,32; rco = 0,15; rN2 = 0,07. После израсходования некотоpого количества гaзa давление его понизилось до 0,3 МПа, a темперaтура - до 12 C. Определить массу израсходованного коксового газа. 3.13. Массовый состав смеси следyющий: СО2 = 18%; О2 = 12% и N2 = 70%. До какого давления нужно сжать эту смесь, находящуюся при нормaльных условиях, чтобы при t = 180° C 8 кг ее занимали объем, равный 4 м3. 3.14. Определить массовый состав газовой смеси, состоящей из углекислого газа и азота, если известно, что парциальное давление углекислого газа рсо2 = 120 кПа, a давление смеси рсм = 300 кПа. 3.15. Газовая смесь имеет следующий массовый состав: СО2 = 12%; 02 = 8% и N2 = 80%. До какого давления нужно сжать эту смесь, находящуюся при нормальных условиях, чтобы плотность ее составляла 1,6 кг/мз ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 4. ТЕМА: «ТЕПЛОЕМКОСТЬ ГАЗОВ » Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С. За единицу количества энергии в системе СИ применяют джоуль (Дж). В системе СИ джоуль является универсальной единицей, применяемой для измерения всех видов энергии: тепловой, механической, лучистой и пр. В качестве тепловой единицы 1 Дж представляет собой такое ее количество, которое появляется в результате превращения механической работы 1 Дж в теплоту. В качестве единицы механической энергии джоуль представляет собой работу, совершаемую силой, равной 1 ньютону при перемещении ею тела на расстояние 1 м в направлении действия силы (1 Дж = Н-м = 1 кг-м2/с2). В зависимости от выбранной количественной единицы вещества различают мольную теплоемкость μc— кДж/(кмоль К), массовую теплоемкость с — кДж/(кг-К) и объемную теплоемкость с' — кДж/(м3-К). Как было указано выше, 1 м3 газа в зависимости от параметров его состояния имеет разные массы. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м8 его при нормальных условиях (рн= 101 325 Па (760 мм рт. ст.) и Т н = 273 К (t н = 0°С). Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо из них. Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость с= а объемная теплоемкость с/ = Объемная и массовая теплоемкости связаны между собой зависимостью с/ = с ·ρн где рн — плотность газа при нормальных условиях. Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость. Если q— количество теплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1до t2(или, что то же, от T1 до Т2), то cm = представляет собой среднюю теплоемкость в пределах t1 - t2 . Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью. Аналитически последняя определяется как с= Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса. Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления. Для газов особо важное значение имеют следующие два случая нагревания (охлаждения): 1) изменение состояния при постоянном объеме; 2) изменение состояния, при постоянном давлении. Обоим этим случаям соответствуют различные значения теплоемкостей. Таким образом, различают истинную и среднюю теплоемкости: а) мольную — при постоянном объеме (μсv и μcvm) и постоянном давлении (μcp и μсрт); б) массовую — при постоянном объеме (сvи cvm) и постоянном давлении (сpи срт); в) объемную—при постоянном объеме (c'vи c'vm) и постоянном давлении (с'ри с'рт). Между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость: μcp— μcv= μR Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (табл. 4.1). Таблица 4.1 Приближенные значения мольных теплоемкостей при постоянном объеме и постоянном давлении (с= cоnst)
В технической термодинамике большое значение имеет отношение теплоемкостей при постоянном давлении и постоянном объеме, обозначаемое буквой k: k = Если принять теплоемкость величиной постоянной, то на основании данных таблицы 4.1 получаем: для одноатомных газов k=1,67; для двухатомных газов k=1,4; для трех- и многоатомных газов k=1,29. Теплоемкость газов изменяется с изменением температуры, причем эта зависимость имеет криволинейный характер. Количество теплоты, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1до t2, q= (cm) (t2 -t1) = cm2 t2 - cm1t1, (4.5) где cm2 иcm1– соответственно средние теплоемкости в пределах 0°-t1 и 0°-t2. В таблице 4.2 приведены интерполяционные формулы для истинных и средних мольных теплоемкостей при постоянном давлении, а в таблице 4.3 – для средних массовых объемных теплоемкостей при постоянном объеме. 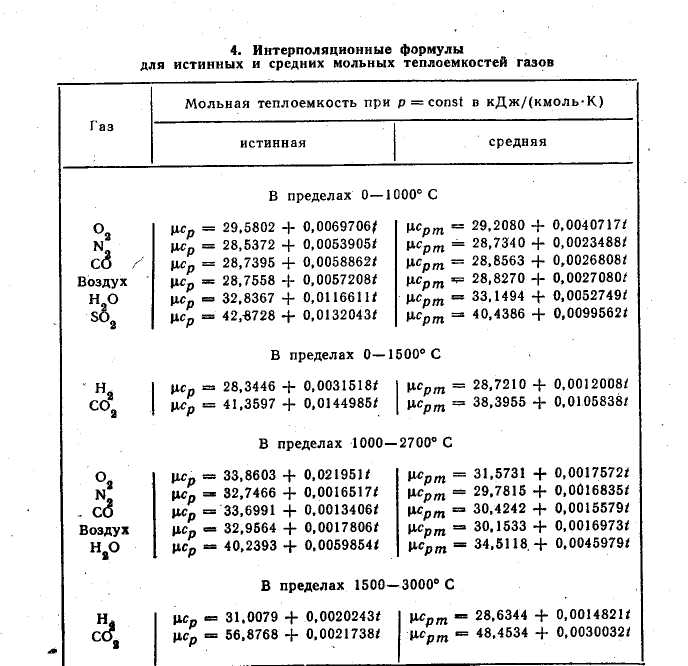 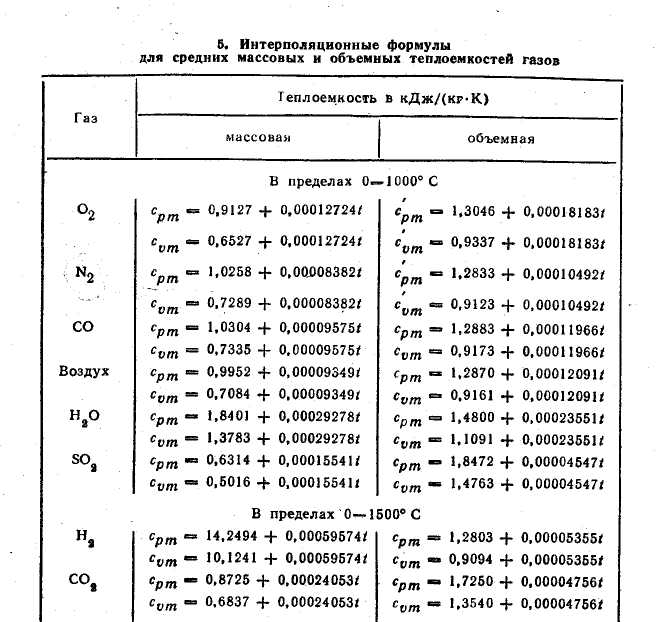 Теплоемкость газовой смеси Массовая ссм= Объемная с/см= 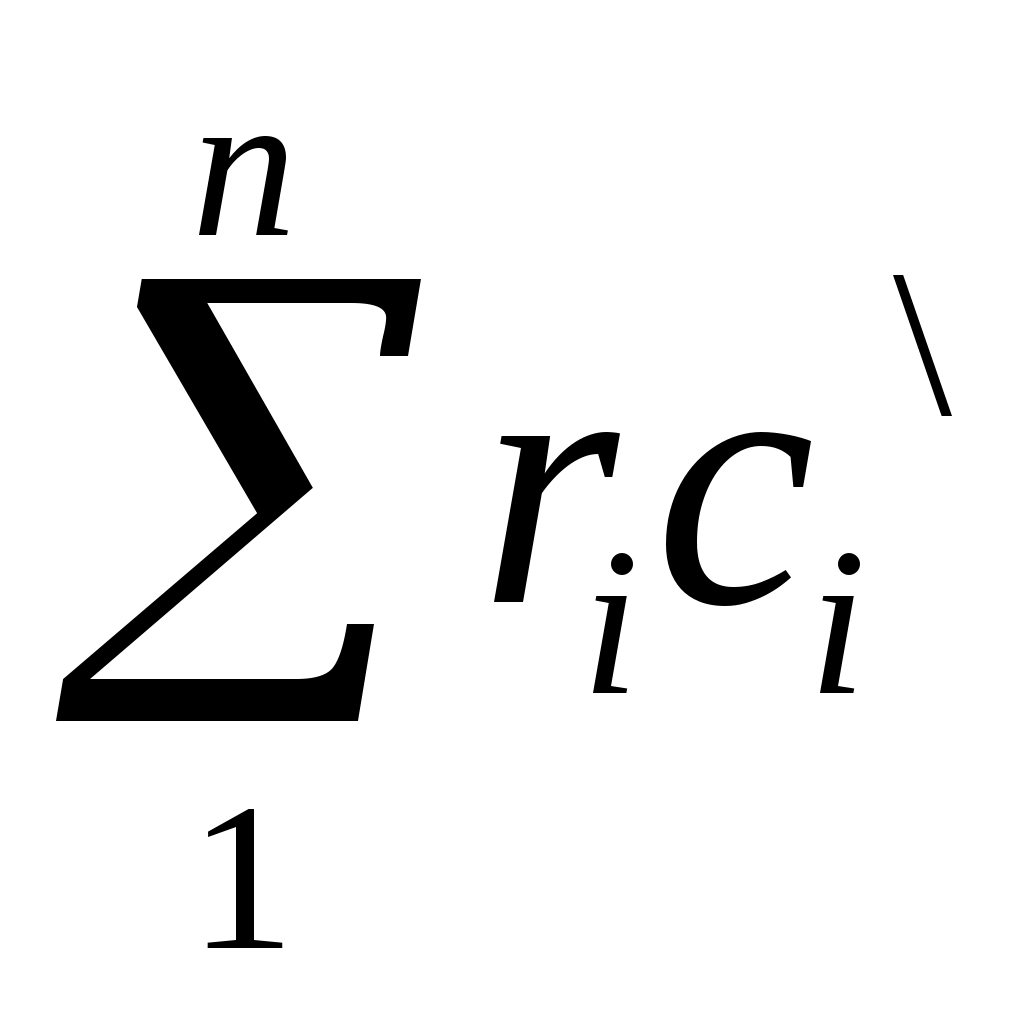 (4.7) (4.7)мольная μ cсм= Задачи 4.1. Найти объемную теплоемкость кислорода при постоянном объеме и постоянном давлении, считая с = cоnst. 4.2. Определить значение массовой теплоемкости кислорода при постоянном объеме и постоянном давлении, считая с = cоnst. 4.3. Вычислить среднюю массовую и сpеднюю объемную теплоемкость окиси углерода при постоянном объеме для интeрвала температур 0-1200°C если известно, что для окиси углерода (µсрm)01200=32,192кДж/(кмоль • К). 4.4. Определить среднюю массовую теплоемкость углекислого газа при постоянном давлении в пределаx 0-825°С, считая зависимость от температуры нелинейной. 4.5. Вычислить значение истинной мольной теплоемкости кислорода при постоянном давлении для температуры 1000°C, считая зависимость теплоемкости от температуры линейной 4.6. Вычислить среднюю теплоемкость срт для воздуха при постоянном давлении в пределах 200-800° C, считая зависимость теплоемкости от температуры нелинейной. 4.7. Вычислить среднюю теплоемкость срт для воздуха при постоянном давлении в пределах 200-800° C, считая зависимость теплоемкости от температуры линейной. 4.8. Определить среднюю массовую теплоемкость срт для кислорода при постоянном давлении в пределах от 350-1000° C, считая зависимость теплоемкости от температуры: а) нелинейной; 6) линейной. 4.9. Вычислить среднюю теплoемкость срm и сvmв пределах 200-800°С для СО, считая зависимость теплоемкости от температуры линейной. 4.10. Найти среднюю теплоемкость срm и сvmдля воздуха в пределах 400-1200° C, считая зависимость теплоемкоcти от температуры нелинейной. 4.11. Найти среднюю теплоемкость срm и сvmуглекислого газа в пределах 440- 1000° C, считая зависимость теплоемкости от температуры нелинейной. 4.12. Определить среднюю массовую теплоемкость при постоянном объеме для азота в пределах 200-800°С, считая зависимость теплоемкости от температуры нелинейной. 4.13. Воздух в количестве 6 м3 при давлении р1 = 0,3 МПа и температуре t = 25° C нагревaeтся при постоянном давлении до t2 = 130° C. Определить количество подведенной к воздуху теплоты, считая с = const. 4.14. В закрытом сосуде объемом V = 300 л находится воздух при давлении р1 = 0,8 МПа и температуре t1 = 20° С. Какое количество теплоты необходимо подвести, чтобы температyра воздуха поднялась до t = 120° С? Задачу решить, принимая теплоемкость воздуха постоянной, а также учитывая зависимость теплоемкость теплоемкости от температуры. 4.15. Воздух охлаждается от 1000 до 100° C в процессе c постоянным давлением. Какое количествo теплоты теряет 1 кг воздуха? Задачу решить, принимая теплоемкость воздуха постоянной, a также учитывая зависимость теплоемкоcти от температуры. 4.16. B сосуде объемом 300 л нaходится кислopод при давлении р1 = 0,2 МПа и температуре t1 = 20° C. Какое количество теплоты необходимо подвести, чтобы температура кислорода повысилась до t2 = 300° C? Какое давление установится при этом в сосуде? Зависимость теплоемкости от температуры принять нелинейной. 4.17. Найти количество теплоты, необходимое для нагрева 1 м3 (при нормальных условиях) газовой смеси состава гсо2 = 14, 5 % , ro2 = 6,5 % , r N 2 = 79,0 % от 200 до 1200°С при р = const и нелинeйной зависимости теплоемкости от температуры. 4.18. Газовая смесь имеет следующий состав по объему: СО 2 = 0,12; O 2 = 0, 07; N z = 0, 75; Н20 = 0,06.Определить сpеднюю массовую теплоемкость срт,если смесь нaгревается от 100 до 300° C. 4.19. B регенеративном подогревателе газовой турбины воздух нагревается от 150 до 600° C. Найти количество теплоты, сообщенное воздуху в единицу времeни, если расход его составляет. 360 кг/ч. Зависимость теплоемкoсти от темпеpатуры принять нелинейной 4.20. Продукты сгорания топлива поступают в газоход парового котла при температуре газов tг '= 1100° C и покидают газоход пpи температуре t2 ' '= 700° C. Состaв газов по объему: rco2 = 11 % ; ro2 = 6%; гн2о = 8%.; г N2 = 75%. Определить, какое количество теплоты теряет 1 м3 газовой смеси, взятой при нормальных условиях. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 5. | ||||||||||||||
