Курс практичксих занятий по инженерной термодинамики. параметры состояния тела
 Скачать 1.52 Mb. Скачать 1.52 Mb.
|
|
ТЕМА: «ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ » Первый закон термодинамики является частным случаем закона сохранения и превращения энергии, впервые установленного основоположником русской науки М. В. Ломоносовым в замечательной по своей широте и значению формулировке закона сохранения и неунич-тожаемости материи, движения и силы. Первый закон термодинамики устанавливает эквивалентность при взаимных превращениях механической и тепловой энергии и математически может быть выражен следующим образом: Q = L, (5.1) где Q — количество теплоты, превращенной в работу; L — работа, полученная за счет теплоты Q. Количества теплоты Q и работы L измерены в данном случае в соответствии с системой единиц СИ — в одних и тех же единицах — в джоулях. Так как за единицу работы принят Дж, то единицей мощности будет являться Дж/с. Эта единица носит название ватт (Вт). В технике применяют более крупные единицы энергии (работы) и мощности: килоджоуль (кДж), мегаджоуль (МДж), киловатт (кВт), мегаватт (МВт), киловатт-час (кВт-ч). В промышленности до последнего времени за единицу тепловой энергии принимали калорию (кал), за единицу механической работы килограмм-силу-метр, или килограммометр (кгС'М), а за единицу мощности — килограммометр в секунду (кгс-м/с). Так как эти единицы слишком малы, то в качестве практических единиц были приняты килокалория (ккал), мегакалория (Мкал), лошадиная сила (л. с.) и киловатт (кВт). Соответствующими единицами работы (энергии) были приняты киловатт-час (кВт-ч), лошадиная сила-час (л. с. ч.), а мощности — килограммометр в секунду (кгс · м/с). Соотношения между различными единицами энергии и мощности даны соответственно в табл. 5.1 и 5.2. Таблица 5.1. Соотношения между единицами энергии
Продолжение таблицы 5.1
Таблица 5.2 Соотношения между единицами мощности
Пользуясь первым законом термодинамики, можно определить коэффициент полезного действия (к. п. д.) теплосиловых установок ήст, характеризующий степень совершенства превращения ими теплоты в работу. К. п. д. может быть вычислен, если известны расход топлива на 1 кВт-ч и теплота сгорания топлива, т.е. то количество теплоты, которое выделяется при полном сгорании массовой или объемной единицы топлива. Если расход топлива на 1 кВт-ч (удельный расход топлива) b выражен в кг/(кВт-ч), а теплота сгорания топлива Qр н — в кДж/кг, то к. п. д. теплосиловой установки Аналитическое выражение первого закона термодинамики или основное уравнение теплоты в дифференциальной форме для любого тела dQ = dU + dL, (5.3) где dQ — количество теплоты, сообщенное извне рабочему телу массой М кг; dU — изменение внутренней энергии рабочего тела; dL — работа, совершенная рабочим телом по преодолению внешнего давления, «внешняя работа» расширения. Каждый из трех членов этого уравнения может быть в зависимости от характера изменения состояния положительным, или отрицательным, или равным нулю. Для бесконечно малого изменения состояния 1 кг любого газа уравнение (5.3) примет следующий вид: dq = du + dl. (5.4) Так как dl=pdv, то dq=du+pdv. (5.5) Для конечного изменения состояния уравнения (5.3) и (5.4) соответственно имеют вид Q = ΔU + L (5.6) и q = Δu + l. (5.7) Работа расширения 1 кг газа dl = pdv l = 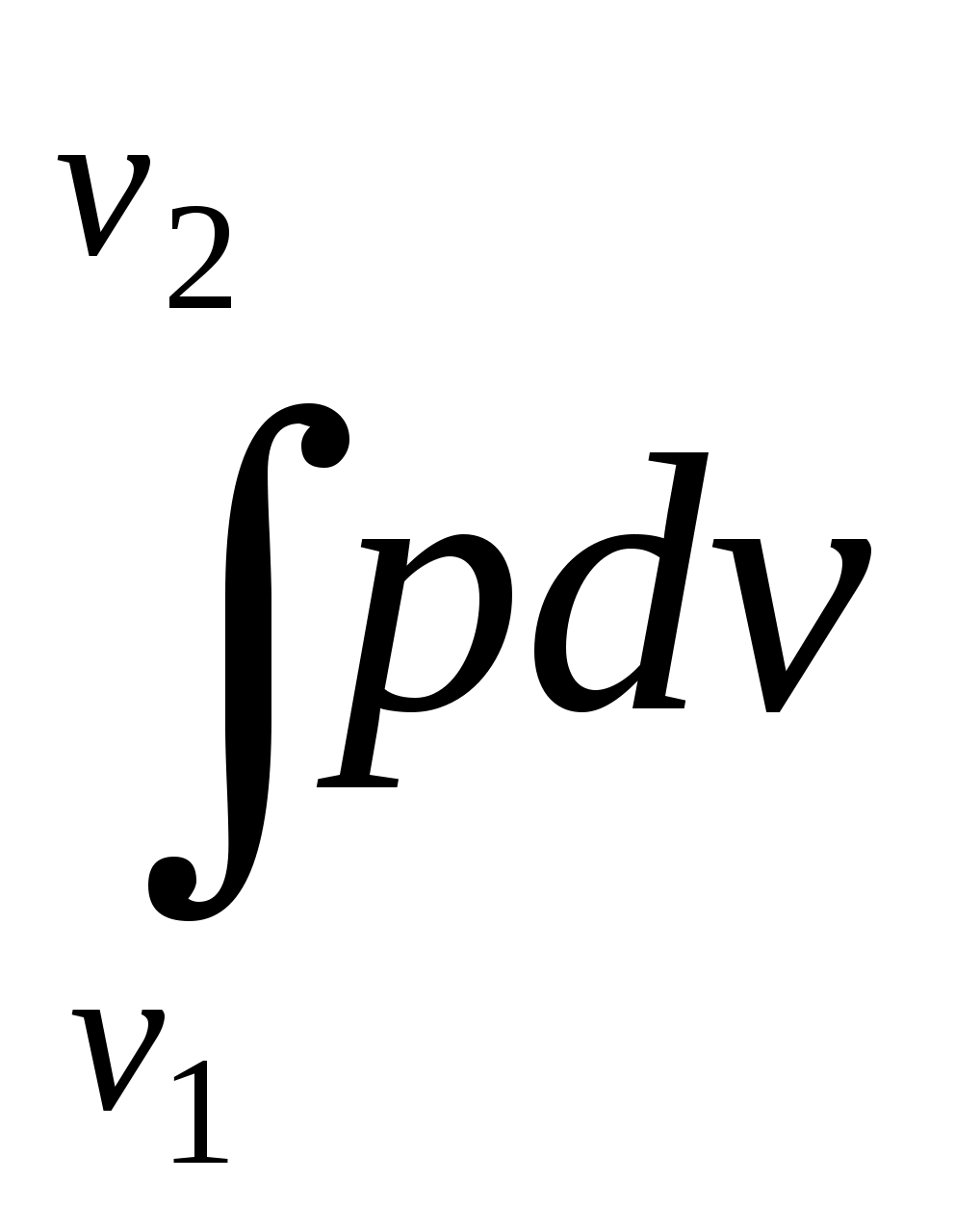 (5.8) (5.8) Изменение внутренней энергии идеального газа для любого процесса при бесконечно малом изменении состояния (для 1 кг) du= cv·dt (5.9) Интегрируя уравнение (5.9) в пределах t1 — t2, получаем Δu=cvm(t2-t1) (5.10) где сгт — средняя массовая теплоемкость при постоянном объеме в пределах t1 — t2. Таким образом, изменение внутренней энергии идеального газа для любого процесса равно произведению средней теплоемкости при постоянном объеме на разность температур газа. Задачи. 5.1. Найти часовой расход топлива, который необходим для работы паровой турбины мощностью 25 MВт, если теплота сгорания топлива Qр = 33,85 МДж/кг и известно, что на превращение тепловой энергии в меха- ническую используется только 35% теплоты сожженного топлива. 5.2. В котельной электрической станции за 20 ч работы сожжены 62 т каменного угля, имеющего теплотy сгорания 28 900 кДж/кг. Определить среднюю мощность станции, если в электрическую энергию превращено 18% теплоты, полученной при сгорании yгля. 5.3. Мощность турбогенератора 12 000 кВт, к. п. д. генератора 0,97. Какое количество воздуха нужно пропустить через генератор для его охлаждения, если конечная температура воздуха не должна превышать 55° C? Температура в машинном отделении равна 20° C; среднюю теплоемкость воздуха срт принять равной 1,0 кДж/(кг • К). 5.4. Теплота сгорания топлива, выражаемая в кДж/кг, может быть также выражена в кВт•ч/кг. Принимая теплоту сгорания нефти равной 41 900 кДж/кг, каменного угля 29 300 кДж/кг, подмосковного бурого угля 10 600 кДж/кг, выразить теплоту сгорания перечисленных топлив в кВт•ч/кг. 5.5. При испытании нефтяного двигателя было найдено, что удельный расход топлива равен 231 r/(кВт/ч). Определить эффективный к. п. д. этого двигателя, если теплота сгорания топлива Qрн = 41 000 кДж/кг (9800 ккал/кг). 5.6. Паросиловая установка мощностью 4200 кВт имеет к. п. д. ηст = 0,20. Определить часовой расход топлива, если его теплота сгорания Qрн = 25 000 кДж/кг. 5.7. B котельной электростанции за 10 ч работы сожжено 100 т каменного угля c теплотой сгорания Qрн = 29 300 кДж/кг. Найти количество выработанной электpоэнергии и среднюю мощность станции, если к. п. д. процесса преобразования тепловой энергии в электрическую составляет 20% . 5.8. B сосуд, содержащий 5 л воды при темпеpатуре 20° C, помещен электронагреватель мощностью 800 Вт. Определить, сколько времени потребуется, чтобы вода нагревалась до температуры кипения 100° C. Потерями теплоты сосуда в окpужающую среду пренебречь. 5.9. В калориметр, содержащий 0,6 кг воды пpи t = = 20° C, опускают стальной образец массой в 0,4 кг, нагретый до 200° C. Найти теплоемкость стали, если повышение температyры воды составило 12,5°. Массой собственно калориметра пренебречь. 5.10. Найти изменение внутренней энергии 1 кг воздуха при переходе его от начального состояния t1 = 300° C до конечного при t2 = 50° C. Зависимость теплоемкости от температyры принять линейной. Ответ дать в кДж. 5.11. Найти изменение внутренней энергии 2 м3 воздуха, если температура его понижается от t1= 250° C до t2 = 70° C. Зависимость теплоемкости от температуры принять линейной. Нaчальное давление воздуха р 1 = 0,6 МПа. 5.12. К газу, заключенному в цилиндре c подвижным поршнем, подводится извне 100 кДж теплоты. Величина произведенной работы при этом составляет 115 кДж. Определить изменение внутренней энеpгии газа, если количество его равно 0,8 кг. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 6. ТЕМА: « СМЕШЕНИЕ ГАЗОВ » Т= 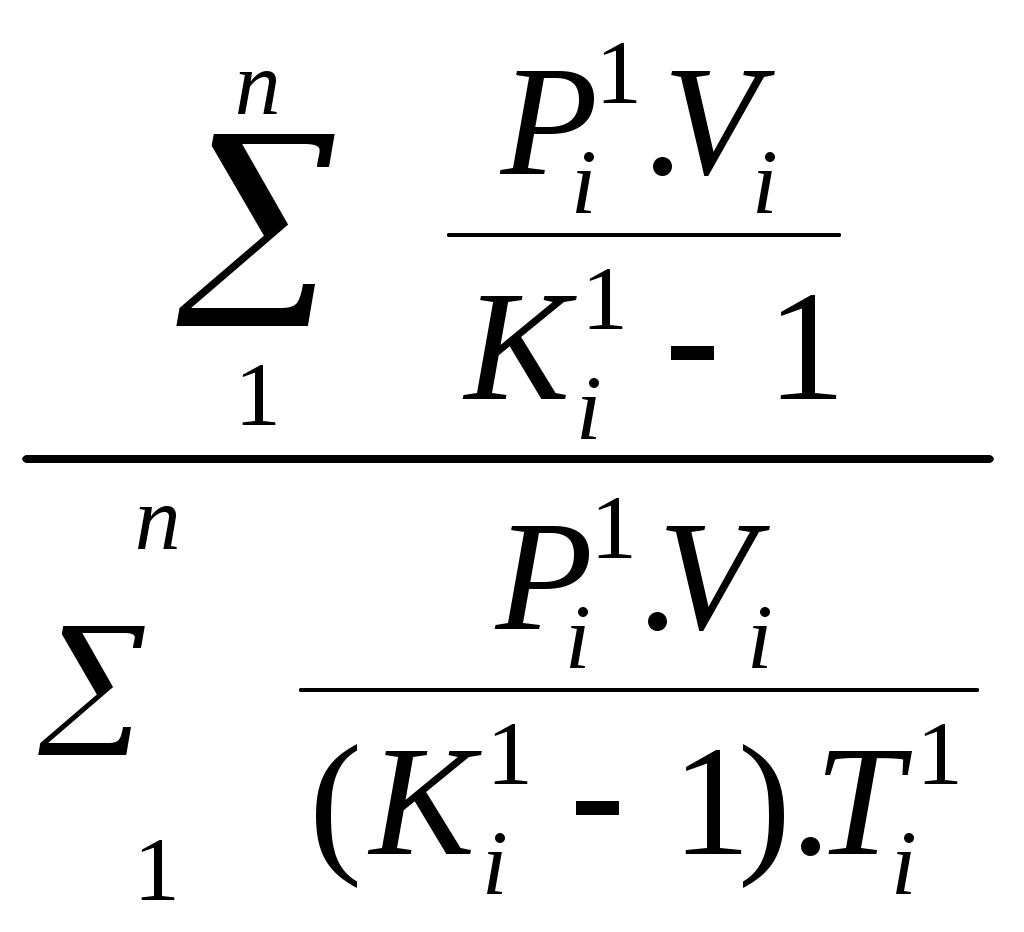 При смешении химически невзаимодействующих газов, имеющих различные давления и температуры, обычно приходится определять конечное состояние смеси. При этом различают два случая. 1. Смещение газов при V = const. Если суммарный объем, занимаемый газами до и после смещения, остается неизменным и газы до смещения занимают объемы V1, V2, ...,Vn м3 при давлениях p1, p2,..., pn и температурах T1, T2, ..., Tn,а отношения теплоемкостей этих газов cp/cv равны k1, k2, ...,kn, то параметры смеси определяют по формулам: температура (6.1) д P= авление (6.2) о V= бъем (6.3) Т= 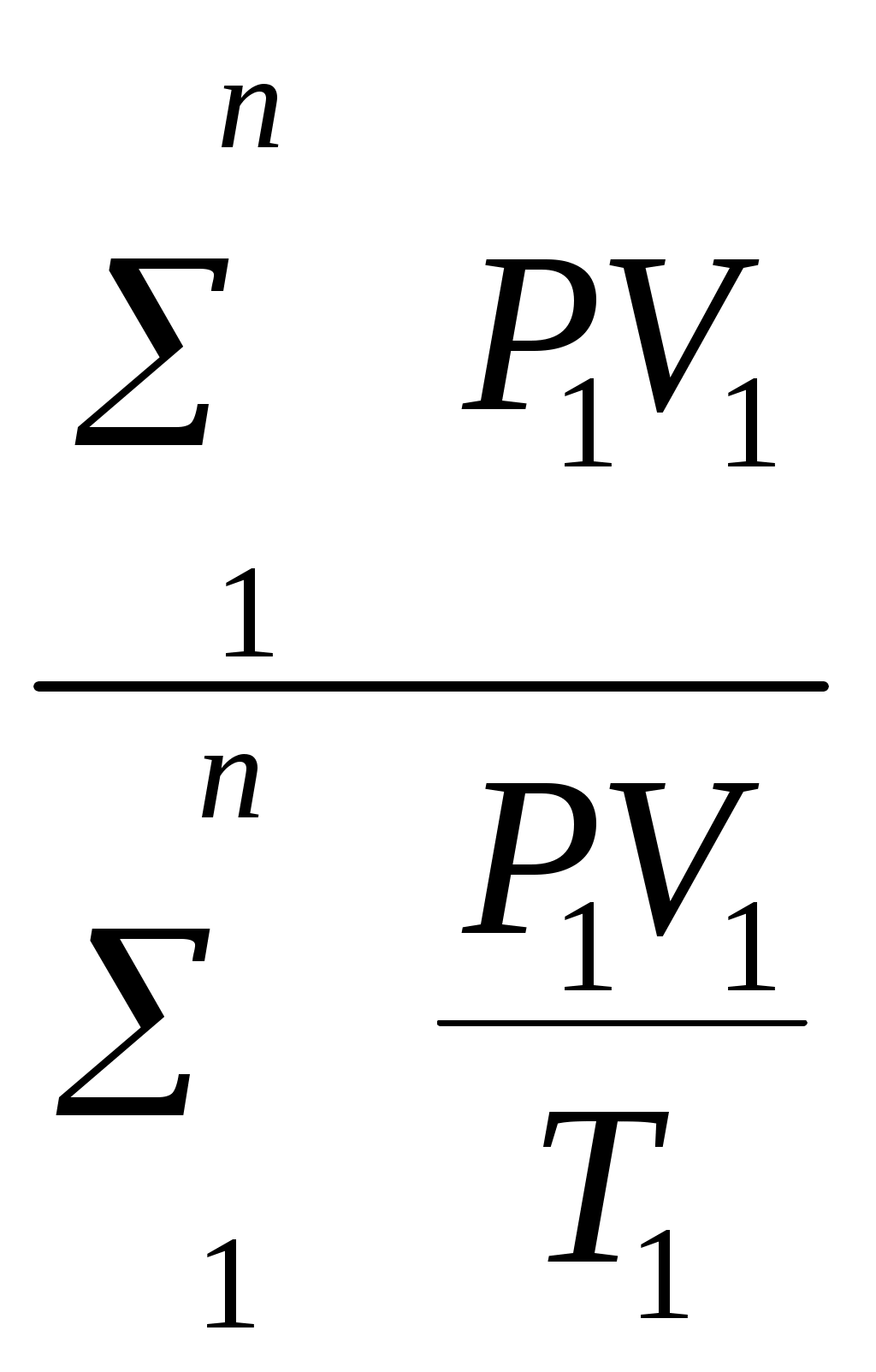 Для газов, у которых мольные теплоемкости равны, а следовательно, равны и значения к,формулы (6.2) и (6.3) принимают вид Температура (6.4) д Р= 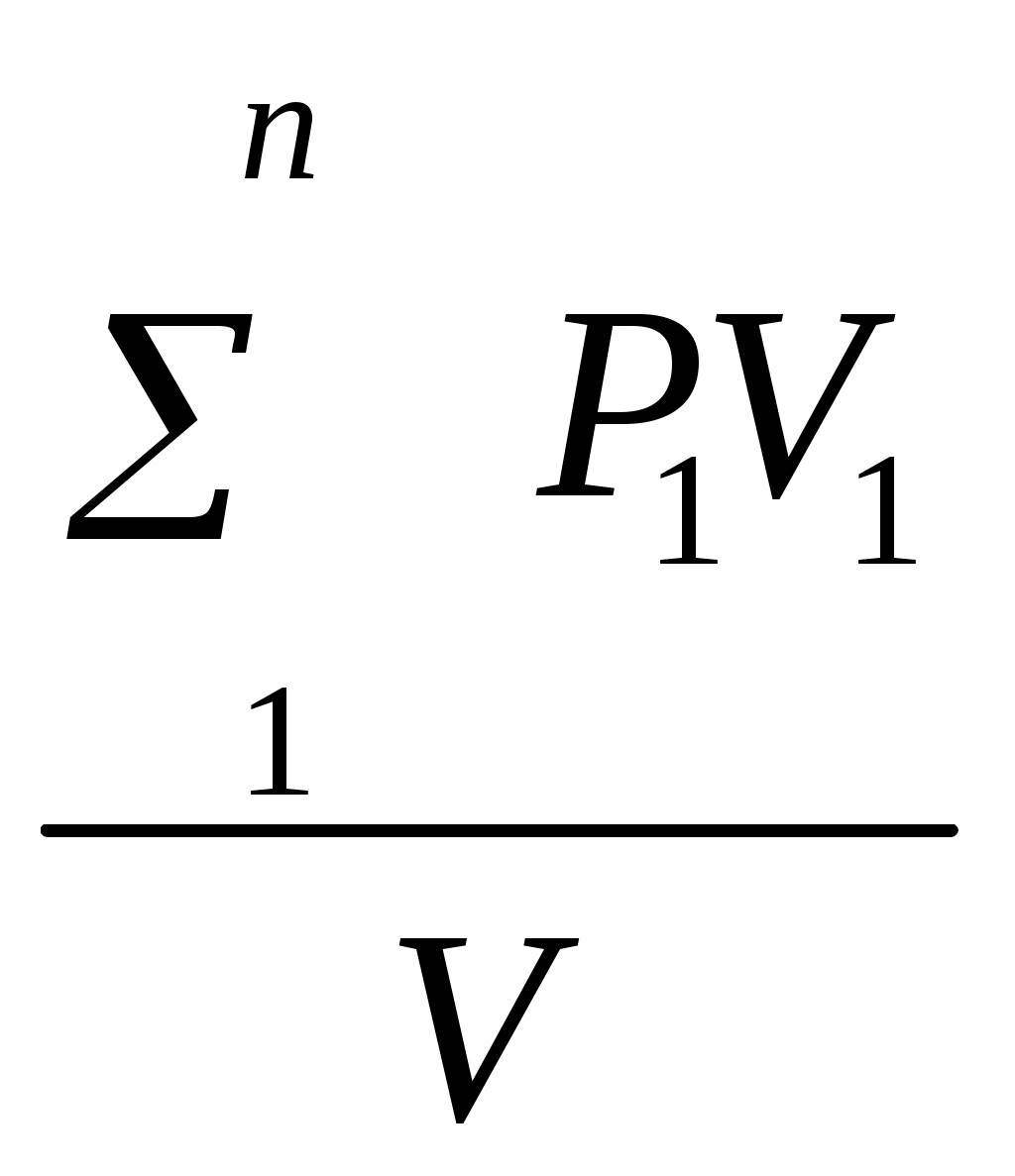 авление (6.5) Р= 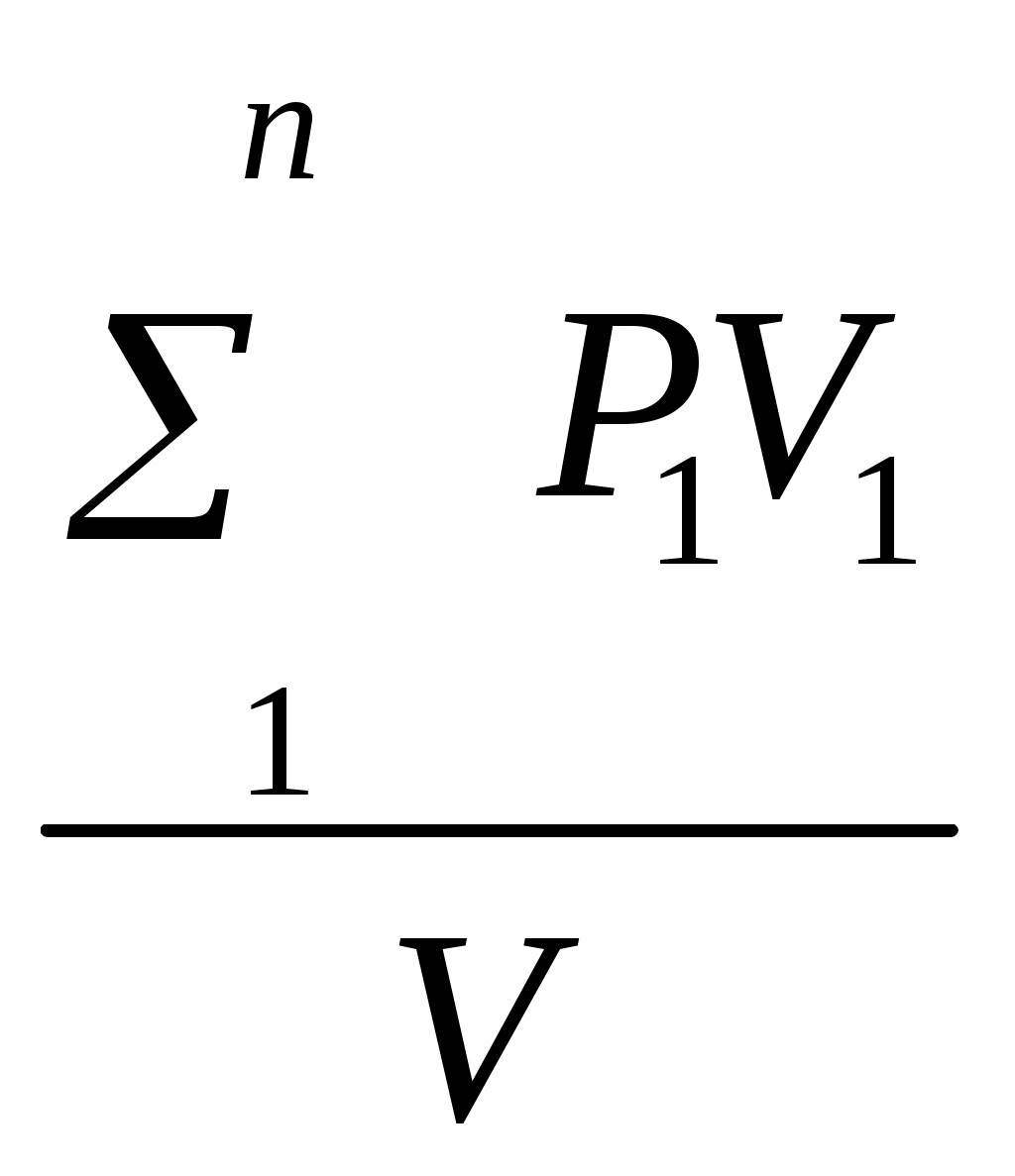 2. Смешение газовых потоков. Если массовые расходы смешивающихся потоков равны М1, М2, …, Мnкг/ч, объемные расходы – V1, V2, ..., Vnм3/ч, давления газов – p1, p2, ..., pn, температуры – T1, T2, ..., Tn, а отношения теплоёмкостей отдельных газов равны соответственно k1, k2, ..., kn, то температуры смеси определяют по формуле: Т 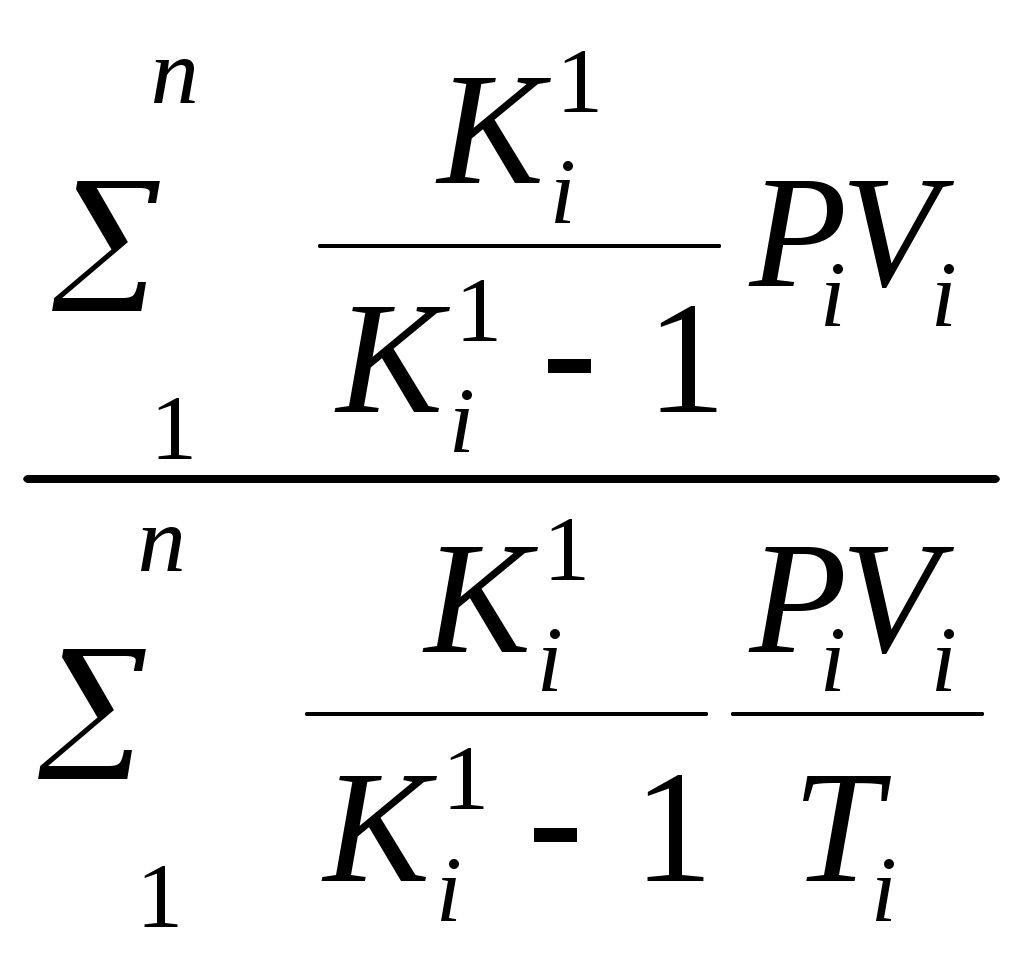 (6.6) (6.6)Объемный расход смеси в единицу времени при температуре T и давлении p: V 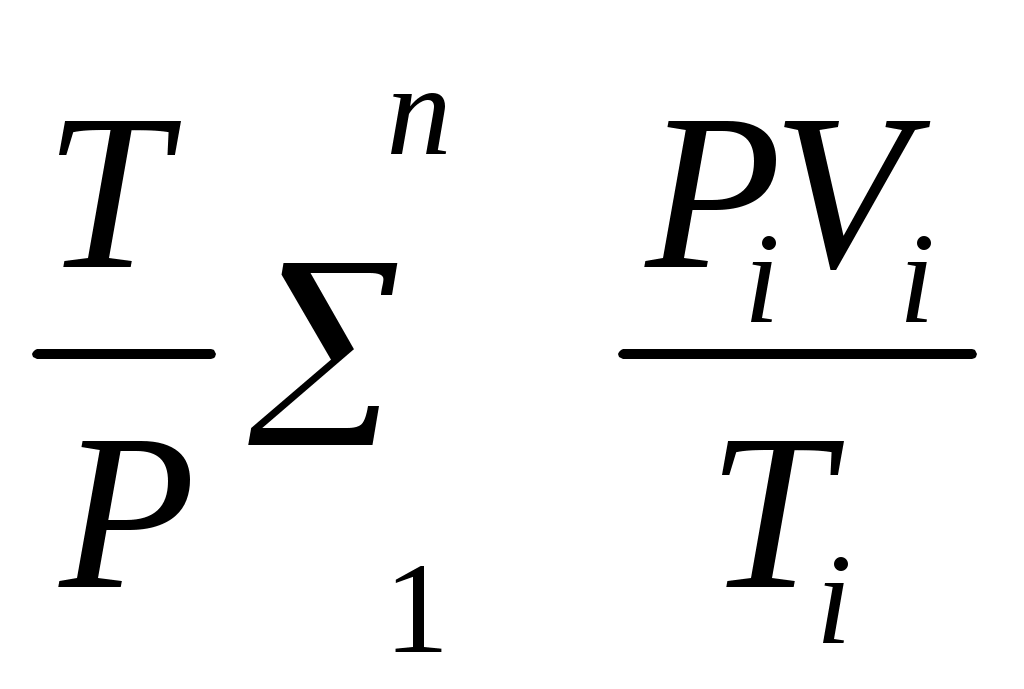 (6.7) (6.7)Для газов, у которых значения k равны, температуру смеси определяют по формуле (6.4). Если газовые потоки, помимо одинаковых значений k, имеют также равные давления, то формулы (6.6) и (6.7) принимают вид: T= 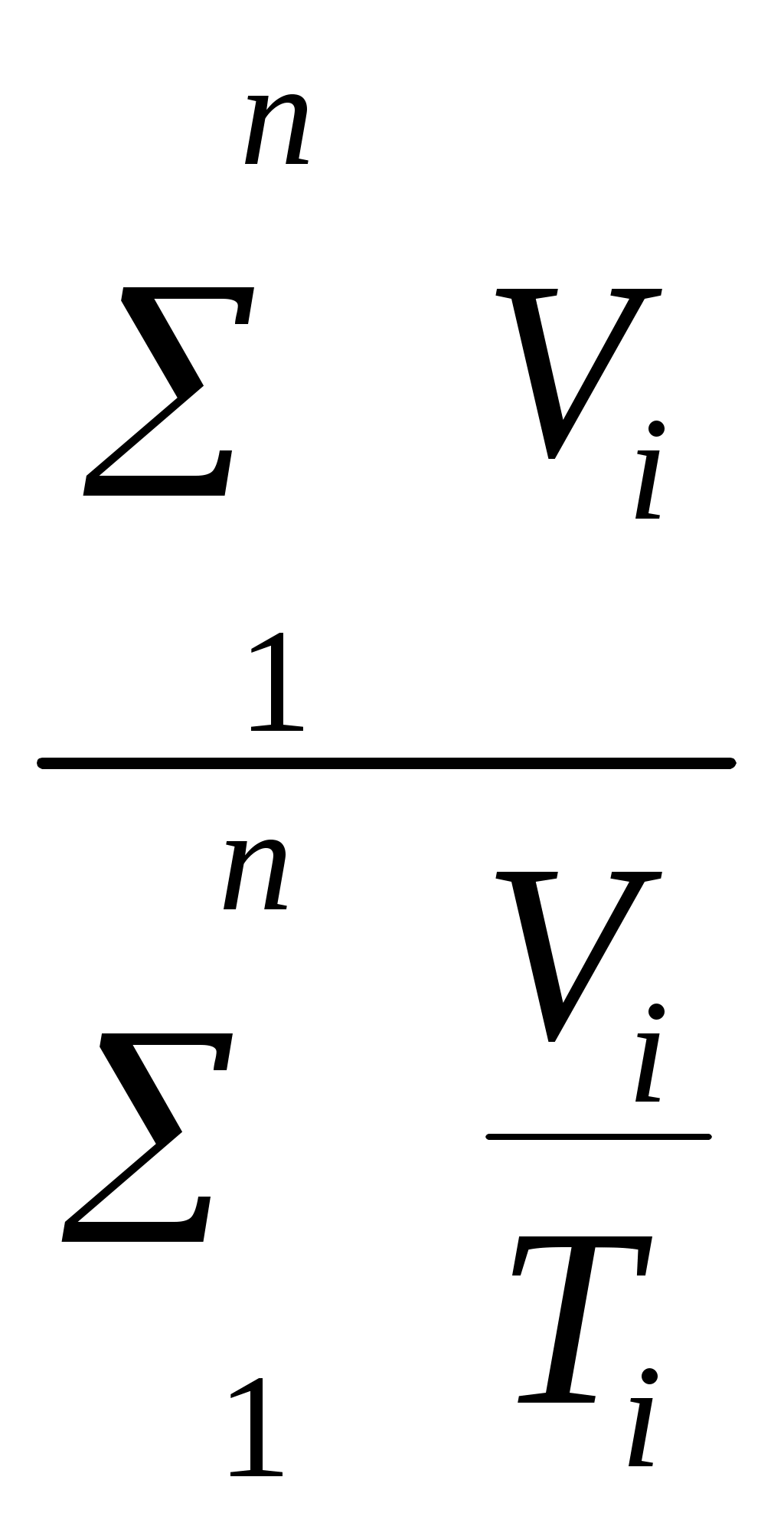 (6.8) (6.8)V=T 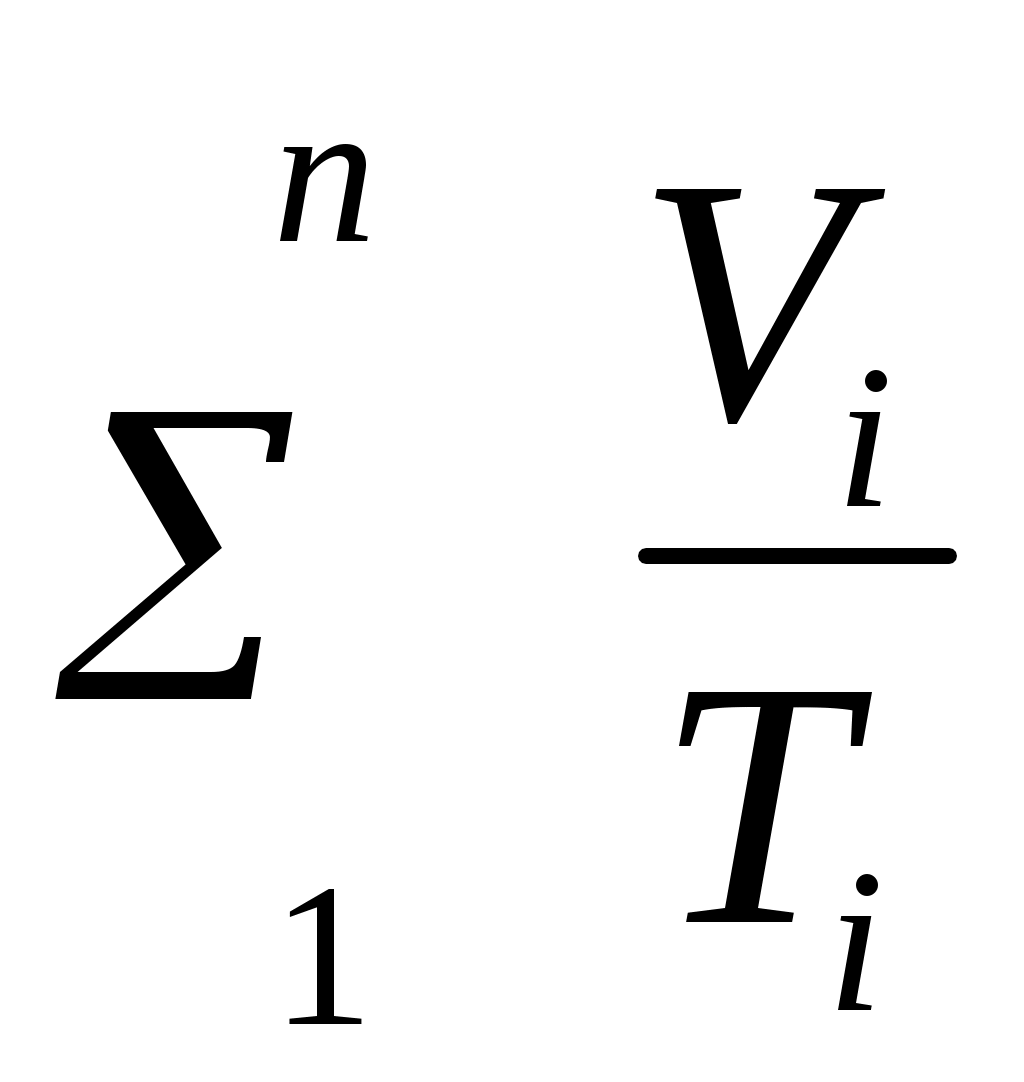 (6.9) (6.9)Все уравнения, относящиеся к смешению газов, выведены при условии отсутствии теплообмена с окружающей средой. Задачи 6.1. 2 м3 воздуха при давлении 0,5 МПа и температуре 50° C смешиваются с 10 м3 воздуха при давлении 0,2 МПа и температуре 100° C. Определить давление и температуру смеси. 6.2. В двух разобщенных между собой сосyдах А и B (рис. 9) содержатся следующие газы: в сосуде А - 50 л азотa при давлении р1 = 2 МПа и температуре t1= 200° C, в сосуде B - 200 л углекислого газа при давлении р2 = 0,5 МПа и температуре t2 = 600° C. Определить давление и температуру, которые установятся после соединения сосудов. Теплообменом c окружающей средой пренебречь 6.3. Три разобщенных между собой сосуда A, B, C заполнены различными газами. B сосуде A, имеющем объем 10 л, находится сернистый ангидрид SO2 при давлении 6 МПа и темпeратуре 100° С, в сосуде B c объемом 5 л - азот при давлении 0,4 МПа и температуре 200°С в сосуде C с объемом 5 л - азот при давлении 2 МПа и температуре 300° C. Определить давлeние и температуру, которые установятся после соединения сосудов между собой. Считать, что теплообмен со средой отсутствует. |
