ГЛАВА 21 ПАТОФИЗИОЛОГИЯ НЕРВНОЙ СИСТЕМЫ. Патофизиология нервной системы
 Скачать 1.03 Mb. Скачать 1.03 Mb.
|
|
21.2.2. Денервационный синдром Денервационный синдром представляет собой комплекс изменений, возникающих в постсинаптических нейронах, органах и тканях после выпадения нервных влияний на эти структуры. Денервированная структура (мышца, нейрон) приобретает повышенную чувствительность к физиологически активным веществам (закон Кеннона-Розенблюта). Основным проявлением денервационного синдрома в мышце является исчезновение концевой пластинки - зоны мышечного волокна, где сосредоточен весь его холинергический аппарат. Вместо нее появляются новые ацетилхолиновые рецепторы на всем протяжении мышечного волокна, и в связи с этим происходит повышение общей чувствительности к ацетилхолину всего волокна (А.Г. Гинецинский, Н.М. Ашмарина). Этот эффект связан главным образом с выпадением трофических влияний нерва. Другой характерный признак - фибриллярные подергивания денервированной мышцы. Этот эффект отражает реакцию мышечных денервированных волокон на поступающий к ним из разных сторонних источников ацетилхолин.
При денервации в мышце и других тканях появляются свойства, присущие ранним, в частности, эмбриональным стадиям развития. Это явление возникает как результат патологического растормаживания супрессированных в норме генов. 21.2.3. Деафферентация Импульсация, поступающая в нейрон, из какого бы источника она ни исходила, является для нейрона афферентной. Выключение этой афферентации представляет собой деафферентацию нейрона. Последняя может быть обусловлена либо выпадением поступающей импульсации (при перерыве нервных путей, нарушении выделения нейромедиаторов пресинаптическими окончаниями), либо блокадой воспринимающих рецепторов на постсинаптическом нейроне (при действии токсинов, фармакологических средств и др.). Многие явления при деафферентации нейрона представляют собой выражение денервационного синдрома. Полной деафферентации нейрона не происходит, так как нейроны ЦНС обладают огромным количеством афферентных входов. Тем не менее и при частичной деафферентации возникает повышение возбудимости нейрона или его отдельных участков и нарушение тормозных механизмов. В силу этого при деафферентации группа нейронов может приобрести свойства ГПУВ. В клинике под феноменом деафферентации имеют в виду синдромы, возникающие при выпадении афферентной стимуляции с периферии. Эти синдромы можно воспроизвести в эксперименте путем перерезки соответствующих задних корешков спинного мозга. Движения конечности, иннервируемой деафферентированными таким образом сегментами спинного мозга, становятся размашистыми, плохо координированными. Кроме того, такая конечность способна осуществлять спонтанные движения в такт с дыханием (феномен Орбели-Кунстман), что обусловлено растормаживанием и повышением возбудимости деафферентированных нейронов спинного мозга.
21.2.4. Спинальный шок Спинальный шок возникает после перерыва спинного мозга и представляет собой глубокое, но обратимое угнетение двигательных и вегетативных рефлексов, осуществляющихся ниже перерыва. Угнетение рефлексов связано с выпадением активирующей стимуляции со стороны головного мозга. У лягушек, у которых зависимость спинного мозга от головного значительно меньше, чем у высших животных, спинальный шок длится несколько минут, у человекообразных обезьян и человека - несколько месяцев. У человека полная арефлексия после перерыва спинного мозга является начальной стадией полной параплегии. В дальнейшем происходит постепенное восстановление двигательных и вегетативных рефлексов. Вначале появляются сгибательные рефлексы пальцев, имеющие характер патологических рефлексов (рефлекс Бабинского и др.), после этого осуществляются более значительные и затем генерализованные спинальные рефлексы и движения типа спинальных автоматизмов. 21.2.5. Нарушение нервной трофики. Нейродистрофический процесс Трофика клетки и дистрофический процесс. Трофика клетки - комплекс процессов, обеспечивающих ее жизнедеятельность и поддержание генетически заложенных свойств. Расстройство трофики представляет собой дистрофию, развивающиеся дистрофические изменения составляют дистрофический процесс. Нейродистрофический процесс. Это развивающееся нарушение трофики, которое обусловлено выпадением или изменением нервных влияний. Оно может возникать как в периферических тканях, так и в самой нервной системе. Выпадение нервных влияний заключается: 1) в прекращении стимуляции иннервируемой структуры в связи с нарушением выделения или действия нейромедиатора; 2) в нарушении секреции или действия комедиаторов - веществ, которые выделяются вместе с нейромедиаторами и играют роль нейромодуляторов, обеспечивающих регуляцию рецепторных, мембранных и метаболических процессов; 3) в нарушении выделения и действия трофогенов. Трофогены (трофины) - вещества различной, преимущественно белковой природы, осуществляющие собственно трофические эффекты поддержания жизнедеятельности и генетически заложенных свойств клетки. Источником трофогенов являются: 1) нейроны, из которых трофогены поступают с антероградным (ортоградным) аксоплазматическим током в клетки-реципиенты (другие нейроны или иннервируемые ткани на периферии); 2) клетки периферических тканей, из которых трофогены поступают по нервам с ретроградным аксоплазматическим током в нейроны (рис. 21-3); 3) глиальные и шванновские клетки, которые обмениваются с нейронами и их отростками трофическими веществами. Вещества, играющие роль трофогенов, образуются также из сывороточных и иммунных белков. Трофическое воздействие могут оказывать некоторые гормоны. В регуляции трофических процессов принимают участие пептиды, ганглиозиды, некоторые нейромедиаторы.
К нормотрофогенам относятся различного рода белки, способствующие росту, дифференцировке и выживанию нейронов и соматических клеток, сохранению их структурного гомеостаза (например, фактор роста нервов). В условиях патологии в нервной системе вырабатываются трофические вещества, вызывающие устойчивые патологические 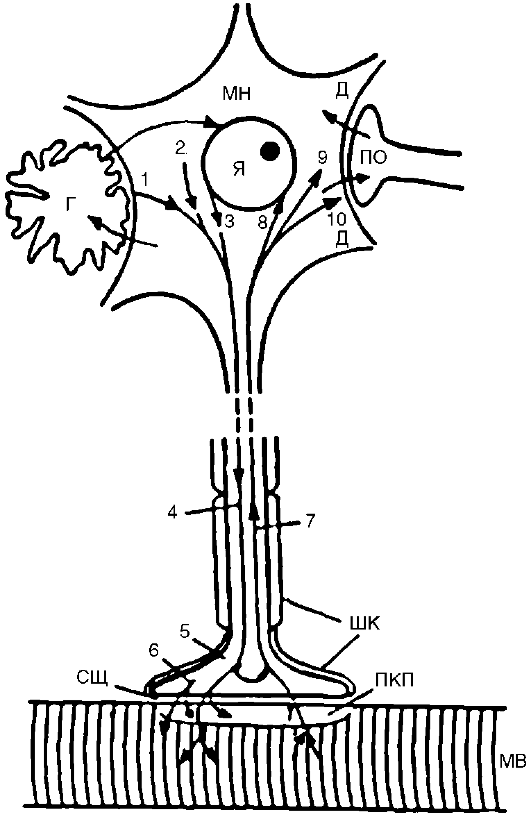 Рис. 21-3. Трофические связи мотонейрона и мышцы. Вещества из тела мотонейрона (МН), его мембраны 1, перикариона 2, ядра 3 транспортируются с антероградным аксоплазматическим током 4 в терминаль 5. Отсюда они, а также вещества, синтезируемые в самой терминали 6, поступают транссинаптически через синаптическую щель (СЩ) в концевую пластинку (КП) и в мышечное волокно (МВ). Часть неиспользованного материала поступает обратно из терминали в тело нейрона с ретроградным аксоплазматическим током Рис. 21-3. Трофические связи мотонейрона и мышцы. Вещества из тела мотонейрона (МН), его мембраны 1, перикариона 2, ядра 3 транспортируются с антероградным аксоплазматическим током 4 в терминаль 5. Отсюда они, а также вещества, синтезируемые в самой терминали 6, поступают транссинаптически через синаптическую щель (СЩ) в концевую пластинку (КП) и в мышечное волокно (МВ). Часть неиспользованного материала поступает обратно из терминали в тело нейрона с ретроградным аксоплазматическим током7. Вещества, образующиеся в мышечном волокне и концевой пластинке, поступают транссинаптически в обратном направлении в терминаль и далее с ретроградным аксоплазматическим током 7 в тело нейрона - к ядру 8, в перикарион 9, к мембране дендритов 10. Некоторые из этих веществ могут поступать из дендритов (Д) транссинаптически в другой нейрон через его пресинаптическое окончание (ПО) и из этого нейрона далее в другие нейроны. Между нейроном и мышцей происходит постоянный обмен веществами, поддерживающими трофику, структурную целостность и нормальную деятельность обоих образований. В этом обмене принимают участие глиальные клетки (Г). Все указанные образования создают регионарную трофическую систему (или трофический контур) изменения клеток-реципиентов (патотрофогены, по Г.Н. Крыжановскому). Такие вещества синтезируются, например в эпилептических нейронах - поступая с аксоплазматическим током в другие нейроны, они могут индуцировать у этих нейронов-реципиентов эпилептические свойства. Патотрофогены могут распространяться по нервной системе, как по трофической сети, что является одним из механизмов распространения патологического процесса. Патотрофогены образуются и в других тканях.
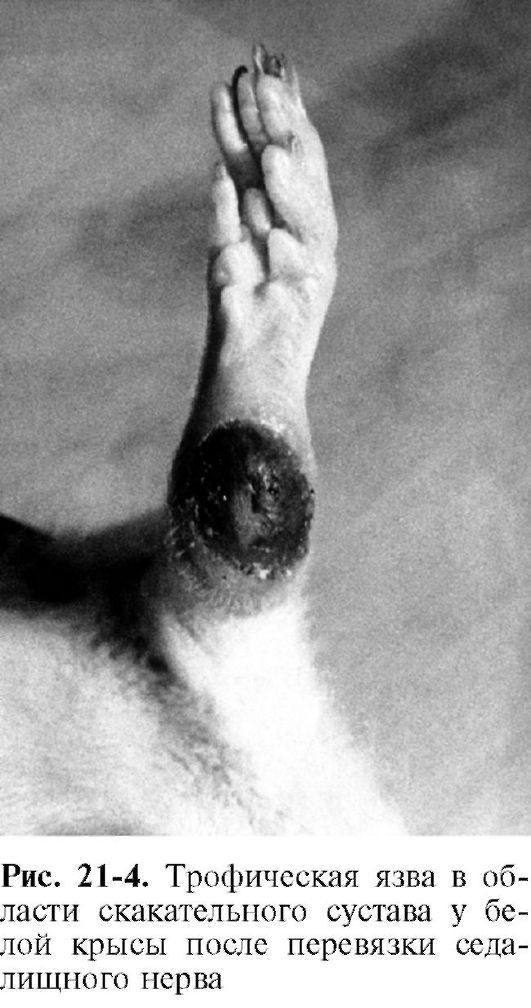
Дистрофический процесс в денервированной мышце. Синтезируемые в теле нейрона и транспортируемые в терминаль с аксоплазматическим током вещества, выделяются нервным окончанием и поступают в мышечные волокна (см. рис. 21-3), выполняя функцию трофогенов. Эффекты нейротрофогенов видны из опытов с перерезкой двигательного нерва: чем выше произведена перерезка, т.е. чем больше сохранилось трофогенов в периферическом отрезке нерва, тем позднее наступает денервационный синдром. Нейрон вместе с иннервируемой им структурой (например, мышечным волокном) образует регионарный трофический контур, или регионарную трофическую систему (см. рис. 21-3). Если осуществить перекрестную реиннервацию мышц с разными исходными структурно-функциональными характеристиками (реиннервация «медленных» мышц волокнами от нейронов, иннервировавших «быстрые» мышцы, и наоборот), то реиннервированная мышца приобретает в значительной мере новые динамические характеристики: «медленная» становится «быстрой», «быстрая» - «медленной». В денервированном мышечном волокне возникают новые трофогены, которые активируют разрастание нервных волокон (sprouting). Указанные явления исчезают после реиннервации. Нейродистрофический процесс в других тканях. Взаимные трофические влияния существуют между каждой тканью и ее нервным аппаратом. При перерезке афферентных нервов возникают дистрофические изменения кожи. Перерезка седалищного нерва, который является смешанным (чувствительным и двигательным), вызывает образование дистрофической язвы в области скакательного сустава (рис. 21-4). С течением времени язва может увеличиться в размерах и охватить всю стопу. Классический опыт Ф. Мажанди (1824), послуживший началом разработки всей проблемы нервной трофики, заключается в перерезке у кролика первой ветви тройничного нерва. В результа-
 те такой операции развивается язвенный кератит, вокруг язвы возникает воспаление, и со стороны лимба в роговицу врастают сосуды, которые в ней в норме отсутствуют. Врастание сосудов является выражением патологического растормаживания сосудистых элементов - в дистрофически измененной роговице исчезает фактор, который тормозит в норме рост в нее сосудов, и появляется фактор, который активирует этот рост. те такой операции развивается язвенный кератит, вокруг язвы возникает воспаление, и со стороны лимба в роговицу врастают сосуды, которые в ней в норме отсутствуют. Врастание сосудов является выражением патологического растормаживания сосудистых элементов - в дистрофически измененной роговице исчезает фактор, который тормозит в норме рост в нее сосудов, и появляется фактор, который активирует этот рост.Дополнительные факторы нейродистрофического процесса. К факторам, участвующим в развитии нейродистрофического процесса, относятся: сосудистые изменения в тканях, нарушения гемо- и лимфомикроциркуляции, патологическая проницаемость сосудистой стенки, нарушение транспорта в клетку питательных и пластических веществ. Важным патогенетическим звеном является возникновение в дистрофической ткани новых антигенов в результате изменений генетического аппарата и синтеза белка, образуются антитела к тканевым антигенам, возникают аутоиммунный и воспалительный процессы. В указанный комплекс патологических процессов входят также вторичное инфицирование язвы, развитие инфекционных повреждений и воспаления. В целом нейродистрофические поражения тканей имеют сложный многофакторный патогенез (Н.Н. Зайко). Генерализованный нейродистрофический процесс. При повреждениях нервной системы могут возникать генерализованные формы нейродистрофического процесса. Одна из них проявляется в виде поражения десен (язвы, афтозный стоматит), выпадения зубов, кровоизлияния в легких, эрозии слизистой и кровоизлияния в желудке (чаще в области привратника), в кишечнике, особенно в области буагиниевой заслонки, в прямой кишке. Поскольку такие изменения возникают сравнительно регулярно и могут иметь место при разных хронических нервных повреждениях, они получили название стандартной формы нервной дистрофии (А.Д. Сперанский). Часто указанные изменения возникают при повреждении высших вегетативных центров, в частности, гипоталамуса (при травмах, опухолях), в эксперименте при наложении стеклянного шарика на турецкое седло.
Все нервы (двигательные, чувствительные, вегетативные), какую бы функцию они ни выполняли, являются одновременно трофическими (А.Д. Сперанский). Нарушения нервной трофики составляют важное патогенетическое звено болезней нервной системы и нервной регуляции соматических органов, поэтому коррекция трофических изменений является необходимой частью комплексной патогенетической терапии. 21.3. ПАТОЛОГИЯ НЕЙРОНА 21.3.1. Нарушение проведения возбуждения Распространение возбуждения по нервному волокну обеспечивается последовательным сочетанием одних и тех же процессов: деполяризацией участка мембраны волокна, входом в этом участке Na+, деполяризацией соседнего участка мембраны, входом в этом участке Na+ и т.д. При недостаточном входе Na+ нарушается генерация потенциала действия, и проведение прекращается. Такой эффект имеет место при блокаде Na+-каналов местными анестетиками (новокаин, лидокаин и др.) и рядом других химических агентов. Специфическим блокатором Na+-каналов является тетродотоксин - яд, вырабатывающийся во внутренних органах рыбы фугу. Исходная разность концентрации Na+ и Ка+ по обе стороны мембраны (Na+ в 10-15 раз больше снаружи, К+ в 50-70 раз больше внутри), необходимая для генерации потенциала действия, восстанавливается и поддерживается активным транспортом ионов Na+/K+-насосом. Он выкачивает наружу Na+, поступивший внутрь (в цитоплазму) во время возбуждения, в обмен на наружный К+, который вышел наружу во время возбуждения. Деятельность насоса, роль которого выполняет встроенная в мембрану Na+/К+- АТФаза, обеспечивается энергией, высвобождающейся при рас- щеплении АТФ. Дефицит энергии ведет к нарушению работы насоса, что обусловливает неспособность мембраны генерировать потенциал действия и проводить возбуждение. Такой эффект вызывают разобщители окислительного фосфорилирования (например, динитрофенол) и другие метаболические яды, а также ишемия и длительное охлаждение участка нерва. Ингибируют насос и как следствие этого нарушают проводимость сердечные гликозиды (например, уабаин, строфантин) в больших дозах.
Проведение возбуждения по аксону нарушается при различных видах патологии периферических нервов и нервных волокон в ЦНС - при воспалительных процессах, рубцовых изменениях нерва, сдавлении нервных волокон, демиелинизации волокон (аллергические процессы, рассеянный склероз), ожогах и др. Проведение возбуждения прекращается при дегенерации аксона. 21.3.2. Нарушение аксонального транспорта и дендритов Аксональный транспорт из тела нейрона в нервное окончание и из нервного окончания в тело нейрона осуществляется при участии нейрофиламентов, микротрубочек и контрактильных актино- и миозиноподобных белков, сокращение которых зависит от содержания Са2+ в среде и от энергии расщепления АТФ. Вещества, разрушающие микротрубочки и нейрофиламенты (колхицин, винбластин и др.), недостаток АТФ, метаболические яды, создающие дефицит энергии (динитрофенол, цианиды), нарушают аксоток. Аксональный транспорт страдает при дегенерации аксона, вызываемой недостатком витамина В6 и витамина B1 (болезнь берибери), промышленными ядами (акриламидом, гексахлорофосом), солями тяжелых металлов (свинца), фармакологическими препаратами (дисульфирамом), алкоголем, при диабете, сдавлении нервов и дистрофических повреждениях нейрона. При перерыве аксона возникает уоллеровская дегенерация (распад) его периферической части и ретроградная дегенерация центральной части. Эти процессы связаны с нарушением трофики в обеих частях аксона. Расстройства аксонального транспорта трофогенов и веществ, необходимых для образования и выделения медиаторов нервным окончанием, обусловливают развитие дистрофических изменений нейронов и иннервируемых тканей и нарушение синаптических процессов. Распространение с аксональным транспортом патотрофогенов, антител к нервной ткани и к нейромедиаторам приводит
к вовлечению в патологический процесс нейронов в других отделах ЦНС. Дендриты и их шипики являются самыми ранимыми структурами нейрона. При старении шипики и ветви дендритов редуцируются, при некоторых дегенеративных и атрофических заболеваниях мозга (старческое слабоумие, болезнь Альцгеймера) они исчезают. Дендрошипиковый аппарат страдает при гипоксии, ишемии, сотрясении мозга, стрессорных и невротизирующих воздействиях. 21.3.3. Патология структурных элементов нейронов Значительную роль в патологии нейрона играют нарушения внутриклеточного структурного гомеостаза. В норме процессы изнашивания и распада внутриклеточных структур и нейрональных мембран уравновешиваются процессами их обновления и регенерации. Совокупность этих процессов составляет динамический структурный гомеостаз. Повреждения как клеточной (цитоплазматической), так и внутриклеточных мембран возникают при различных патогенных воздействиях и сами являются причиной дальнейшей патологии нейрона. Усиленное перекисное окисление липидов (ПОЛ) нейрональных мембран оказывает влияние не только на мембранные, но и на другие внутриклеточные процессы. Практически нет патологического процесса в нервной системе, при котором не возникало бы усиленного ПОЛ. Оно имеет место при эпилепсии, эндогенных психозах (например, шизофрении, маниакально-депрессивном синдроме), при неврозах, стрессах и повреждениях, при ишемии, хронической гипоксии, функциональных перегрузках нейронов и пр. С ним связана дальнейшая гиперактивация нейронов. Вследствие увеличения проницаемости мембран происходит выход из нейрона различных веществ, в том числе антигенов, которые вызывают образование антинейрональных антител, что приводит к развитию аутоиммунного процесса. Нарушение барьерных свойств мембран обусловливает возрастание тока ионов Са2+ и Na+ в нейрон и К+ - из нейрона; эти процессы в сочетании с недостаточностью энергозависимых Na+-, K+- и Са2+-насосов (их деятельность изменяется также под влиянием усиленного ПОЛ) приводят к частичной деполяризации мембраны. Увеличенный вход Ca2+ не
только вызывает гиперактивацию нейрона, но и при чрезмерном его содержании в клетке ведет к патологическим изменениям метаболизма и внутриклеточным повреждениям (см. главу 3). Нормализация перекисного окисления липидов и стабилизация нейрональных мембран должны быть частью комплексной патогенетической терапии различных форм патологии нервной системы. Для жизнедеятельности нейрона, который как высокодифференцированная клетка не способен митотически делиться, внутриклеточная регенерация является единственным способом структурного обновления нейронов и поддержания их целостности. К ней относятся синтез белков, образование внутриклеточных органелл, митохондрий, мембранных структур, рецепторов, рост нервных отростков (аксоны, дендриты, дендритные шипики) и др. Процессы внутриклеточной регенерации требуют высокого энергетического и трофического обеспечения и полноценного метаболизма клетки. При повреждениях нейрона, возникновении энергетического и трофического дефицита, нарушениях деятельности генома страдает внутриклеточная регенерация, падает пластический потенциал клетки, распад внутриклеточных структур не уравновешивается ими. |
