Патологическая анатомия содержание, задачи, объекты и методы исследования. Патологическая анатомия
 Скачать 1.54 Mb. Скачать 1.54 Mb.
|
|
Системные липидозы (наследственные ферментопатии, болезни накопления, лизосомные болезни) 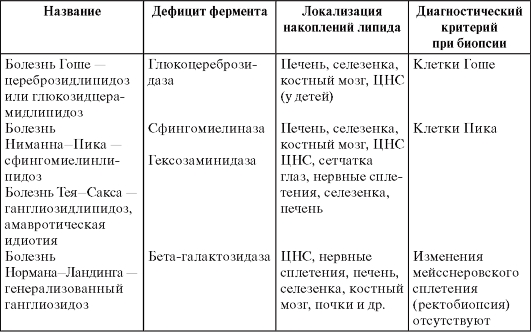 Паренхиматозные углеводные дистрофии Углеводы делят на полисахариды, из которых в животных тканях выявляют лишь гликоген, гликозаминогликаны (мукополисахариды) и гликопротеиды. Среди гликозаминогликанов различают нейтральные, прочно связанные с белками, и кислые, к которым относят гиалуроновую, хондроитинсерную кислоты и гепарин. Кислые гликозаминогликаны как биополимеры способны вступать в непрочные соединения с рядом метаболитов и осуществлять их транспорт. Главные представители гликопротеидов - муцины и мукоиды. Паренхиматозная углеводная дистрофия может быть связана с нарушением обмена гликогена или гликопротеидов. Углеводные дистрофии, связанные с нарушением обмена гликогена Основные запасы гликогена находятся в печени и скелетных мышцах. Гликоген клеток условно делят на лабильный и стабильный. Гликоген печени и мышц расходуется в зависимости от потребностей организма (лабильный гликоген). Гликоген нервных клеток, проводящей системы сердца, аорты, эндотелия, эпителиальных покровов, слизистой оболочки матки, соединительной ткани, эмбриональных тканей, хряща и лейкоцитов - необходимый компонент клеток, и его содержание не подвержено заметным колебаниям (стабильный гликоген). Регуляция обмена углеводов осуществляется нейроэндокринным путем. Основная роль принадлежит гипоталамической области, гипофизу (адренокортикотропный гормон - АКТГ), тиреотропный, соматотропный гормоны), β-клеткам поджелудочной железы (инсулин), надпочечникам (глюкокортикоиды, адреналин) и щитовидной железе. Нарушения содержания гликогена проявляются уменьшением или увеличением его количества в тканях и появлением там, где его обычно не выявляют – гликогенозы. При сахарном диабете, который связывают с патологией β-клеток островков поджелудочной железы, недостаточно используется глюкоза тканями, увеличиваются ее содержание в крови (гипергликемия) и выведение с мочой (глюкозурия). Тканевые запасы гликогена резко уменьшаются. Это в первую очередь касается печени, в которой нарушается синтез гликогена, что ведет к инфильтрации ее жирами, развивается жировая дистрофия печени. При этом в ядрах гепатоцитов появляются включения гликогена, они становятся светлыми - «дырчатые», «пустые» ядра. С глюкозурией связаны характерные изменения почек при сахарном диабете. Они проявляются гликогенной инфильтрацией эпителия канальцев, главным образом их узкого и дистального сегментов. Эпителий становится высоким, со светлой пенистой цитоплазмой; зерна гликогена видны и в просвете канальцев. При сахарном диабете страдают не только почечные канальцы, но и клубочки, их капиллярные петли, базальная мембрана которых становится значительно проницаемой для сахаров и белков плазмы. Возникает одно из проявлений диабетической микроангиопатии - интеркапиллярный (диабетический) гломерулосклероз. Наследственные углеводные дистрофии, в основе которых лежат нарушения обмена гликогена, называются гликогенозами. Гликогенозы обусловлены отсутствием или недостаточностью фермента, участвующего в расщеплении депонированного гликогена, и их относят к наследственным ферментопатиям, или болезням накопления. Хорошо изучены 6 типов гликогенозов, обусловленных наследственной недостаточностью 6 различных ферментов. Гликогенозы (наследственные ферментопатии или болезни накопления) 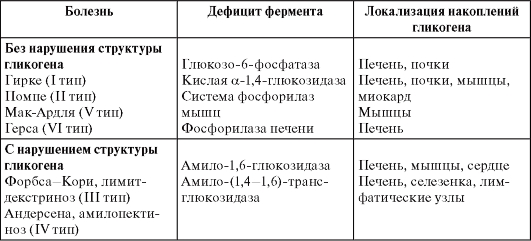 Морфологическая диагностика гликогеноза возможна при биопсии с помощью гистоферментативных методов. Углеводные дистрофии, связанные с нарушением обмена гликопротеидов При нарушении обмена гликопротеидов в клетках или в межклеточном веществе происходит накопление муцинов и мукоидов, называемых также слизистыми или слизеподобными веществами. В связи с этим нарушение обмена гликопротеидов - слизистая дистрофия. Микроскопическое исследование позволяет выявить не только усиленное слизеобразование, но и изменения физико-химических свойств слизи. Многие секретирующие клетки погибают и десквамируются, выводные протоки желез обтурируются слизью, что ведет к образованию кист. Нередко присоединяется воспаление. Слизь может закрывать просветы бронхов, вследствие чего в легких появляются ателектазы и очаги пневмонии. Причины слизистой дистрофии разнообразны, но чаще всего это воспаление слизистых оболочек в результате действия различных патогенных раздражителей. Слизистая дистрофия лежит в основе наследственного системного заболевания - муковисцидоза, для которого характерно изменение качества слизи, выделяемой эпителием слизистых желез. Слизь становится густой и вязкой, она плохо выводится, что обусловливает образование ретенционных кист и склероза (кистозного фиброза). Поражаются экзокринный аппарат поджелудочной железы, железы бронхиального дерева, пищеварительной системы и мочевыводящих, желчных путей, потовые и слезные железы. Исход в значительной мере определяется степенью и длительностью повышенного слизеобразования. В одних случаях регенерация эпителия приводит к полному восстановлению слизистой оболочки, в других - она атрофируется, подвергается склерозу, что отражается на функции органа. 6. Стромально-сосудистые дистрофии: определение, классификация, причины и механизмы развития, макро- и микроскопическая характеристика. Клиническое, функциональное значение и исходы Стромально-сосудистые (мезенхимальные) дистрофии – результат нарушений обмена веществ в соединительной ткани стромы органов и стенок сосудов. Они развиваются на территории гистиона, который образован отрезком микроциркуляторного русла с окружающими его элементами соединительной ткани (основным веществом, волокнистыми структурами, клетками) и нервными волокнами. Среди механизмов развития стромально-сосудистых дистрофий преобладают нарушения транспортных систем трофики, общность морфогенеза, возможность не только сочетания различных видов дистрофии, но и перехода одного вида в другой. При нарушениях обмена веществ в соединительной ткани, преимущественно в ее межклеточном веществе, накапливаются продукты метаболизма, которые могут быть принесены с кровью и лимфой, быть результатом извращенного синтеза или появляться в результате дезорганизации основного вещества и волокон соединительной ткани. В зависимости от вида нарушенного обмена мезенхимальные дистрофии делят на белковые (диспротеинозы), жировые (липидозы) и углеводные. Стромально-сосудистые белковые дистрофии (диспротеинозы) Коллаген - неотъемлемая часть базальных мембран (эндотелия, эпителия) и эластических волокон, в состав которых, помимо коллагена, входит эластин. Коллаген синтезируется клетками соединительной ткани, среди которых главную роль играют фибробласты. Кроме коллагена, эти клетки синтезируют гликозаминогликаны основного вещества соединительной ткани, которое содержит белки и полисахариды плазмы крови. В соединительной ткани, помимо ее клеток, синтезирующих коллаген и гликозаминогликаны (фибробласт, ретикулярная клетка) и ряд биологически активных веществ (лаброцит, или тучная клетка), находятся клетки гематогенного происхождения, осуществляющие фагоцитоз (макрофаги, гистиоциты, полиморфно-ядерные лейкоциты) и иммунные реакции (лимфоциты, плазмобласты и плазмоциты). К стромально-сосудистым диспротеинозам относят мукоидное набухание, фибриноидное набухание (фибриноид) и гиалиноз. Ранее к ним относили и амилоидоз. В основе этого процесса лежат накопление продуктов плазмы крови в основном веществе в результате повышения тканево-сосудистой проницаемости (плазморрагия), деструкция элементов соединительной ткани и образование белковых (белково-полисахаридных) комплексов. Амилоидоз отличается от этих процессов тем, что в состав образующихся белково-полисахаридных комплексов входит не встречающийся обычно фибриллярный белок, синтезируемый клетками-амилоидобластами (рис. 2.7). 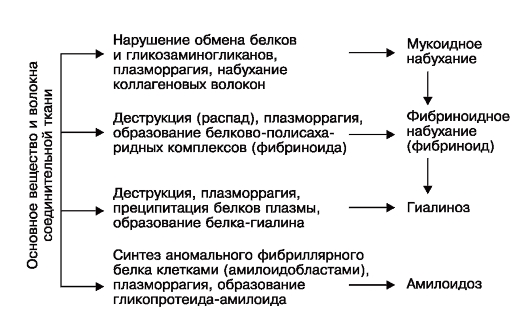 Схема морфогенеза стромально-сосудистых диспротеинозов Мукоидное набухание – поверхностная и обратимая дезорганизация соединительной ткани. При этом в основном веществе происходят накопление и перераспределение гликозаминогликанов за счет увеличения содержания, прежде всего, гиалуроновой кислоты. Гликозаминогликаны обладают гидрофильными свойствами, накопление их обусловливает повышение тканевой и сосудистой проницаемости. В результате этого к гликозаминогликанам примешиваются белки плазмы (главным образом глобулины) и гликопротеиды. Развиваются гидратация и набухание основного межуточного вещества. Микроскопическое исследование. Коллагеновые волокна набухают и подвергаются фибриллярному разволокнению. Они становятся малоустойчивыми к действию коллагеназы и при окраске пикрофуксином выглядят желто-оранжевыми, а не кирпично-красными. Изменения основного вещества и коллагеновых волокон при мукоидном набухании сопровождаются клеточными реакциями - появлением лимфоцитарных, плазмоклеточных и гистиоцитарных инфильтратов. Внешний вид ткани или органа при мукоидном набухании сохранен, характерные изменения устанавливают гистохимическими реакциями при микроскопическом исследовании. Причины. Большую роль в развитии мукоидного набухания играют гипоксия, инфекции, особенно стрептококковая, иммунопатологические реакции (реакции гиперчувствительности). Исход двоякий: полное восстановление ткани или переход в фибриноидное набухание. Функция органа при этом страдает (например, нарушения функции сердца в связи с развитием ревматического эндокардита, вальвулита). Фибриноидное набухание (фибриноид) Фибриноидное набухание - глубокая и необратимая дезорганизация соединительной ткани, в основе которой лежит деструкция ее основного вещества и волокон, сопровождаемая резким повышением сосудистой проницаемости и образованием фибриноида. Фибриноид - сложное вещество, в состав которого входят белки и полисахариды распадающихся коллагеновых волокон, основного вещества и плазмы крови, и клеточные нуклеопротеиды. Обязательный его компонент - фибрин. Микроскопическая картина. При фибриноидном набухании пучки коллагеновых волокон, пропитанные белками плазмы, становятся гомогенными, образуя с фибрином прочные нерастворимые соединения. В исходе фибриноидного набухания обычно развивается фибриноидный некроз - полная деструкция и гомогенизация соединительной ткани. Вокруг очагов некроза обычно выражена реакция макрофагов. Внешний вид органов и тканей, в которых встречается фибриноидное набухание, меняется мало. Характерные изменения обнаруживают обычно лишь при микроскопическом исследовании. Причины. Чаще всего фибриноидные изменения - проявление инфекционно-аллергических (например, фибриноида сосудов при туберкулезе с гиперергическими реакциями), аллергических и аутоиммунных (фибриноидных изменений соединительной ткани при ревматических болезнях, капилляров почечных клубочков при гломерулонефрите) и ангионевротических (фибриноида артериол при гипертонической болезни и артериальных гипертензиях) реакций. В таких случаях фибриноидное набухание имеет распространенный (системный) характер. Местно фибриноидное набухание может возникать при воспалении, особенно хроническом (фибриноид в червеобразном отростке при аппендиците, в дне хронической язвы желудка, трофических язв кожи и т.д.). Исходы фибриноидных изменений: некроз, замещение очага деструкции соединительной тканью (склероз) или гиалиноз. Фибриноидное набухание ведет к нарушению и прекращению функции органа (например, острая почечная недостаточность при злокачественной гипертонии, характеризуемой фибриноидным некрозом и изменениями артериол клубочков). Гиалиноз При гиалинозе (от греч. hyalos - прозрачный, стекловидный), или гиалиновой дистрофии, в соединительной ткани образуются однородные, плотные, полупрозрачные массы (гиалин), напоминающие гиалиновый хрящ. Ткань уплотняется, поэтому гиалиноз рассматривают как разновидность склероза. Гиалин - фибриллярный белок, в котором обнаруживают не только белки в плазме крови, фибрин, но и компоненты иммунных комплексов (иммуноглобулины, фракции комплемента) и липиды. Ведущие механизмы развития гиалиноза - деструкция волокнистых структур и увеличение тканево-сосудистой проницаемости (плазморрагия) в связи с ангионевротическими (дисциркуляторными), метаболическими и иммунопатологическими процессами. С плазморрагией связано образование белка - гиалина. Классификация. Различают гиалиноз сосудов и гиалиноз собственно соединительной ткани. Каждый из них может быть распространенным (системным) и местным. Гиалиноз сосудов наблюдают преимущественно в мелких артериях и артериолах. Ему предшествуют повреждение эндотелия, его мембраны и гладкомышечных клеток стенки сосуда и пропитывание ее плазмой крови. Микроскопически гиалин обнаруживают в субэндотелиальном пространстве, он оттесняет кнаружи и разрушает эластическую пластинку, средняя оболочка истончается, в финале артериолы превращаются в утолщенные стекловидные трубочки с резко суженным или полностью закрытым просветом. Гиалиноз мелких артерий и артериол носит системный характер и наиболее выражен в почках, головном мозге, сетчатке глаза, поджелудочной железе. Сосудистый гиалин - преимущественно гематогенное вещество, в образовании которого играют роль не только гемодинамические и метаболические, но и иммунные механизмы. Руководствуясь особенностями патогенеза гиалиноза сосудов, выделяют 3 вида сосудистого гиалина: — простой гиалин - образуется вследствие инсудации (пропитывания) неизмененных или малоизмененных компонентов плазмы крови, встречаются часто при гипертонической болезни доброкачественного течения, атеросклерозе и у здоровых людей; — липогиалин - содержит липиды и β-липопротеиды, его обнаруживают часто при сахарном диабете; — сложный гиалин - состоит из иммунных комплексов, фибрина и разрушающихся структур сосудистой стенки, характерен для болезней с иммунопатологическими нарушениями, например ревматических заболеваний. Гиалиноз собственно соединительной ткани развивается обычно в исходе фибриноидного набухания, ведущего к деструкции коллагена и пропитыванию ткани белками плазмы и полисахаридами. Микроскопически находят набухание соединительнотканных пучков, они теряют фибриллярность и сливаются в однородную, плотную, хрящеподобную массу; клеточные элементы сдавлены и атрофированы. Этот механизм развития системного гиалиноза соединительной ткани особенно часто встречается при заболеваниях с иммунными нарушениями (ревматических болезнях). Гиалиноз может завершать фибриноидные изменения в дне хронической язвы желудка, в червеобразном отростке при аппендиците, он подобен механизму местного гиалиноза в очаге хронического воспаления. Внешний вид органов при выраженном гиалинозе меняется. Гиалиноз мелких артерий и артериол ведет к атрофии, деформации и сморщиванию органа (например, развитию артериолосклеротического нефроцирроза). При гиалинозе собственно соединительной ткани она становится плотной, белесоватой, полупрозрачной (например, гиалиноз клапанов сердца при ревматическом пороке). Исход в большинстве случаев неблагоприятный, но возможно и рассасывание гиалиновых масс. Гиалин в рубцах - келоиды, которые могут разрыхляться и рассасываться. Гиалиноз молочной железы обратим, причем рассасывание гиалиновых масс происходит в условиях гиперфункции желез. Функциональное значение различно в зависимости от локализации, степени и распространенности гиалиноза. Распространенный гиалиноз артериол может привести к функциональной недостаточности органа - почечной недостаточности при артериолосклеротическом нефроциррозе. Местный гиалиноз (например, клапанов сердца при его пороке) тоже может быть причиной функциональной недостаточности органа. Стромально-сосудистая жировая дистрофия Стромально-сосудистая жировая дистрофия - липидоз, возникает при нарушении обмена нейтральных жиров или холестерина и его эфиров. Нарушения обмена нейтральных жиров проявляются общим или местным увеличением их запасов в жировой ткани. Нейтральный жир - лабильный жир, обеспечивающий энергетические запасы организма. Он сосредоточен в жировых депо - подкожной клетчатке, брыжейке, сальнике, эпикарде, костном мозге. Жировая ткань выполняет не только обменную, но и опорную, механическую функции, поэтому она способна замещать атрофированные ткани. Ожирение, или тучность, - увеличение объема нейтрального жира в жировых депо, имеющее общий характер. Оно выражается в обильном отложении жира в подкожной клетчатке, сальнике, брыжейке, средостении, эпикарде. Жировая ткань появляется там, где она обычно отсутствует или имеется лишь в небольшом количестве, например в строме миокарда, поджелудочной железе. Большое клиническое значение имеет ожирение сердца при тучности. Жировая ткань, разрастаясь под эпикардом, окутывает сердце, как футляром. Она внедряется в строму миокарда, особенно в субэпикардиальных отделах, что ведет к атрофии мышечных клеток. Ожирение обычно больше выражено в правой половине сердца. Классификация ожирения учитывает причину, внешние проявления (типы ожирения), степень превышения идеальной массы тела, морфологические изменения жировой ткани (варианты ожирения). По этиологическому принципу выделяют первичное и вторичное ожирение. Причина первичного ожирения неизвестна, поэтому его называют идиопатическим. Виды вторичного ожирения: — алиментарное ожирение, причины которого - несбалансированное питание и гиподинамия; — церебральное ожирение развивается при травме, опухолях мозга, ряде нейротропных инфекций; — эндокринное ожирение - синдромы Фрелиха и Иценко-Кушинга, адипозогенитальная дистрофия, гипогонадизм, гипотиреоз; — наследственное ожирение - синдром Лоренса-Муна-Бидля и болезнь Гирке. По внешним проявлениям различают симметричный (универсальный), верхний, средний и нижний типы ожирения. При симметричном типе жир относительно равномерно откладывается в разных частях тела. Верхний тип - накопление жира преимущественно в области подкожной клетчатки лица, затылка, шеи, верхнего плечевого пояса, молочных желез. При среднем типе жир откладывается в подкожной клетчатке живота в виде фартука, при нижнем типе - в области бедер и голеней. По превышению массы тела больного выделяют несколько степеней ожирения. При I степени ожирения избыточная масса тела составляет 20-29%, при II - 30-49%, при III - 50-99% и при IV - до 100% и более. Характеристика морфологических изменений жировой ткани при ожирении учитывает количество адипозоцитов и их размер. На этом основании выделяют гипертрофический и гиперпластический варианты общего ожирения. При гипертрофическом варианте жировые клетки увеличены и содержат в несколько раз больше триглицеридов, чем обычно, при этом количество адипозоцитов не меняется. Адипозоциты мало чувствительны к инсулину, но высокочувствительны к липолитическим гормонам. Течение болезни злокачественное. При гиперпластическом варианте количество адипозоцитов увеличено, число жировых клеток достигает максимума в пубертатном периоде и в дальнейшем не меняется. Однако функция адипозоцитов не нарушена, их метаболические изменения отсутствуют, течение болезни доброкачественное. Причины и механизмы развития. Причины общего ожирения - несбалансированное питание и гиподинамия, нарушение нервной и эндокринной регуляции жирового обмена, наследственные семейно-конституциональные факторы. Непосредственный механизм ожирения - нарушение равновесия липогенеза и липолиза в жировой клетке в сторону липогенеза. Значение. Общее ожирение определяет развитие тяжелых осложнений. Например, избыточная масса тела - один из факторов риска ишемической болезни сердца. Исход общего ожирения редко бывает благоприятным. Антипод общего ожирения - истощение, его основа - уменьшение объема органов и тканей. Яркое проявление истощения - кахексия (от греч. kakos - плохой, hexis - состояние), развивающаяся при голодании (алиментарная кахексия) или при злокачественных опухолях. Увеличение объема жировой клетчатки, имеющее местный характер, - липоматоз. Наибольший интерес представляет болезнь Деркума, при которой в подкожной клетчатке конечностей и туловища появляются узловатые, болезненные отложения жира, похожие на липомы. В основе заболевания лежит полигландулярная эндокринопатия. 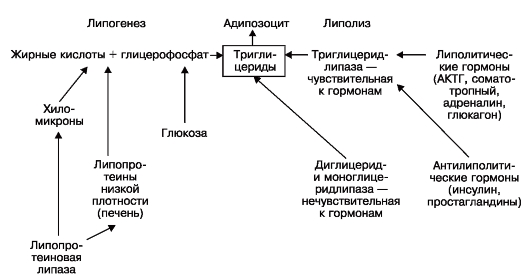 Рис. 2-17. Схема липогенеза и липолиза жировой клетки Антипод липоматоза - регионарная липодистрофия, сущность которой - очаговая деструкция жировой ткани и распад жиров нередко с воспалительной реакцией и образованием липогранулем. Нарушения обмена холестерина и его эфиров Нарушения обмена холестерина и его эфиров лежат в основе тяжелого заболевания - атеросклероза. В интиме артерий крупного и среднего калибра накапливаются не только холестерин и его эфиры, но и липопротеиды низкой плотности и белки в плазме крови, чему способствует повышение сосудистой проницаемости. Накапливание высокомолекулярных веществ ведут к деструкции интимы, распадаются и омыляются. В результате этого в интиме образуется жиробелковый детрит (athere - «кашицеобразная масса»), разрастается соединительная ткань (sclerosis - «уплотнение») и формируется фиброзная бляшка, суживающая просвет сосуда. Стромально–сосудистая углеводная дистрофия связана с нарушением баланса гликопротеидов и гликозаминогликанов. Стромально-сосудистая дистрофия, связанная с нарушением обмена гликопротеидов, - ослизнение тканей. Причина. Ослизнение тканей происходит часто вследствие дисфункции эндокринных желез, истощения (например, слизистого отека, или микседемы, при недостаточности щитовидной железы; ослизнения соединительнотканных образований при кахексии любого генеза). Исход. Процесс может быть обратимым, однако прогрессирование его приводит к колликвации и некрозу ткани с образованием полостей, заполненных слизью. Функциональное значение определяется тяжестью процесса, его продолжительностью и характером ткани, подвергшейся дистрофии. Наследственные нарушения обмена гликозаминогликанов (мукополисахаридов) представлены большой группой болезней накопления - мукополисахаридозов. Основа мукополисахаридозов - недостаточность специфического фактора, определяющего обмен гликозаминогликанов. |
