9- Патология эндокринной системы. Патология эндокринной системы
 Скачать 126.69 Kb. Скачать 126.69 Kb.
|
|
Патология эндокринной системы Эндокринные расстройства могут возникать при нарушении функции любого звена данной системы — от коры больших полушарий до пострецепторных процессов в клетках-мишенях. Соответственно могут быть выделены три основных патогенетических варианта эндокринопатий:
Этиологические факторы, вызывающие указанные нарушения, весьма многочисленны и разнообразны. Часть из них не имеет какой-либо специфической тропности к эндокринным органам и относится к «универсальным» повреждающим воздействиям. В других случаях патогенные факторы более специфичны или даже строго специфичны по своему происхождению или направленности на определенные объекты нейроэндокринной системы. Таким образом, причины и механизмы эндокринных расстройств отличаются большим разнообразием. При этом далеко не всегда в основе этих расстройств лежит недостаточная или избыточная продукция соответствующих гормонов, но всегда — неадекватность их периферических эффектов в клетках-мишенях, приводящая к сложному переплетению метаболических, структурных и функциональных нарушений. 1. Нарушение центральной регуляции деятельности эндокринных желез. Нарушения регулирующей функции коры больших полушарий, приводящие к эндокринным расстройствам, могут быть вызваны механическими повреждениями, воспалительными процессами, расстройствами кровообращения и другими патогенными воздействиями подобного рода. Однако такие воздействия в большинстве случаев затрагивают не только кору мозга, но и другие его отделы, поэтому определить вклад эндокринопатии в патогенез именно коркового компонента бывает затруднительно или даже невозможно. Более специфичными для кортикального генеза эндокринных нарушений являются функциональные расстройства высшей нервной деятельности в виде психозов, неврозов, нервно-психических стрессор ных состояний различного рода. Такие состояния нередко приводят к нарушениям функции половых желез, щитовидной железы и другим эндокринопатиям. Первичные корковые нарушения при этом обычно реализуются через вовлечение лимбической системы и гипоталамических центров. Какой-либо выраженной специфичности в этиологии нарушений, регулирующих эндокринную систему функций гипоталамуса, как правило, выявить не удается. Причинами таких нарушений могут быть наряду с перечисленными выше факторами кровоизлияния, опухоли, инфекционные процессы непосредственно в гипоталамусе и инфекционно-токсические его повреждения, экзо- и эндогенные неинфекционные интоксикации. Нарушения гипоталамической регуляции могут проявляться у потомков в случаях, когда мать перенесла инфекционное заболевание или подвергалась интоксикации во время беременности. Определенное значение может иметь наследственная предрасположенность. Нарушения нейроэндокринной регуляции на уровне гипоталамуса и гипофиза могут выражаться в недостаточном или избыточном образовании либеринов, статинов, тропных гормонов и соответствующих нарушениях функции периферических эндокринных желез. При этом нередко нарушается механизм обратной связи, и изменения концентрации гормонов периферических желез не влияют на секрецию рилизинг-факторов и тропных гормонов. 2. Первичные нарушения функции периферических эндокринных желез. Различные патологические процессы могут развиваться в самой железе и приводить к нарушению образования и секреции соответствующих гормонов. Важное место среди причин поражения периферических эндокринных желез занимают инфекции. Некоторые из них (например, туберкулез, сифилис) могут локализоваться в различных железах, вызывая их постепенное разрушение, в других случаях наблюдается определенная избирательность поражения (например, менингококковый сепсис нередко сопровождается кровоизлиянием в надпочечники, вирусный паротит часто вызывает орхит и атрофию тестикул, а орхит может возникать также при гонорее и т.д.). Частой причиной повреждения желез и нарушений гормонообразования служат опухоли, которые могут развиваться в любой железе. Характер эндокринных расстройств при этом зависит от природы опухоли. Если опухоль происходит из секреторных клеток, обычно продуцируются избыточные количества гормонов и возникает картина гиперфункции железы. Если же опухоль не секретирует гормон, а лишь сдавливает и вызывает атрофию или разрушает ткань железы, развивается ее прогрессирующая гипофункция. Нередко опухоли носят метастатический характер. В некоторых случаях опухоли эндокринных желез продуцируют гормоны, не свойственные данной железе, возможны также эктопические очаги образования гормонов в опухолях неэндокринных органов. Эндокринные расстройства могут быть обусловлены врожденными дефектами развития желез или их атрофией. Последняя вызывается различными причинами: склеротическим процессом, хроническим воспалением, возрастной инволюцией, гормонально-активной опухолью парной железы, длительным лечением экзогенными гормонами и др. В основе повреждения и атрофии железы иногда лежат аутоиммунные процессы (например, при некоторых формах сахарного диабета, заболеваний надпочечников, щитовидной железы и др.). Аутоиммунные процессы могут вызывать и гиперпродукцию гормонов (например, щитовидной железой). Образование гормонов нарушается в связи с наследственными дефектами ферментов, необходимых для их синтеза, или инактивацией (блокадой) этих ферментов. Таким путем возникают, например, некоторые формы кортико-генитального синдрома, эндемического кретинизма и другие эндокринные заболевания. Возможно также образование в железе аномальных форм гормонов. Такие гормоны обладают неполноценной активностью или полностью ее лишены. В некоторых случаях нарушается внурижелезистое превращение прогормона в гормон, в связи с чем в кровь выделяются неактивные его формы. Причиной нарушений биосинтеза гормонов может стать дефицит специфических субстратов, входящих в их состав (например, йода, необходимого для образования гормонов щитовидной железы). Одной из причин эндокринных расстройств является истощение биосинтеза гормонов в результате длительной стимуляции железы и ее гиперфункции. Таким путем возникают некоторые формы недостаточности р-клеток островкового аппарата поджелудочной железы, стимулируемых длительной гипергликемией. 3. Внежелезистые (периферические) формы эндокринных расстройств. Даже при вполне нормальной функции периферических желез и адекватной потребности организма в секреции гормонов могут возникать различные эндокринопатии. Причинами таких вне-железистых «периферических» эндокринных расстройств могут быть нарушения связывания гормонов с белками на этапе их транспорта к клеткам-мишеням, инактивация или разрушение циркулирующего гормона, нарушения рецепции гормонов и их метаболизма, нарушения пермиссивных механизмов. Инактивация циркулирующих гормонов, по современным представлениям, чаще всего связана с образованием антител к ним. Такая возможность установлена в отношении экзогенных гормонов: инсулина, АКТГ, СТГ. В настоящее время доказана возможность образования аутоантител к собственным гормонам. Не исключена возможность и других путей инактивации гормонов на этапе их циркуляции. Важная форма внежелезистых эндокринных расстройств связана с нарушениями рецепции гормона в клетках-мишенях — на их поверхности или внутри клетки. Такие явления могут быть следствием генетически обусловленного отсутствия или малочисленности рецепторов, дефектов их структуры, различных повреждений клетки, конкурентной блокады рецепторов «антигормонами», грубых сдвигов физико-хлмических свойств околоклеточной и внутриклеточной среды. Большое значение придается в настоящее время антирецепторным антителам. Считается, что механизмы выработки антирецепторных антител могут быть связаны с некоторыми особенностями самой иммунной системы. Причиной образования антител может быть вирусная инфекция; предполагают, что в таких случаях вирус соединяется с гормональным рецептором на поверхности клетки и провоцирует образование антирецепторных антител. Одна из форм недостаточности гормональных эффектов может быть связана с нарушением пермиссивного «посреднического» действия гормонов. Так, недостаток кортизола, оказывающего мощное и разностороннее пермиссивное действие в отношении катехоламинов, резко ослабляет гликогенолитические и липолитические эффекты адреналина, прессорное действие и некоторые другие эффекты катехоламинов. При отсутствии необходимых количеств тиреоидных гормонов не может нормально реализоваться действие соматотропного гормона на ранних этапах развития организма. Нарушение «взаимопомощи» гормонов может приводить и к другим эндокринным расстройствам. Эндокринопатии могут возникать в результате нарушения метаболизма гормонов. Значительная часть гормонов разрушается в печени, и при ее поражениях (гепатитах, циррозах и др.) нередко наблюдаются признаки эндокринных нарушений. Возможна и чрезмерная активность ферментов, участвующих в метаболизме гормонов. 6. Гиперпитуитаризм. Гиперпродукция аденогипофизарных гормонов, как правило, носит парциальный характер и выражается в следующих наиболее частых формах. Гипофизарный гигантизм развивается в результате чрезмерной секреции соматотропина, на ранних стадиях развития организма приводит к гипофизарному гигантизму. Главное проявление заболевания — усиленный рост, выходящий за пределы норм верхней границы для данного возраста, пола, расы. Известны случаи, когда больные достигали к 10-летнему возрасту роста 190 см, к 18-летнему — 250 см. Встречаются гипофизарные гиганты ростом свыше 260 см. Грубых диспропорций телосложения обычно не наблюдается, но чрезмерной относительной длиной отличаются предплечья и голени, голова относительно мала, с удлиненным лицом. Мышечная система в начале заболевания в большинстве случаев развита хорошо, но в дальнейшем возникают мышечная слабость, быстрая утомляемость, иногда мышечная гипотрофия. В некоторых случаях размеры внутренних органов непропорционально велики, в других случаях — отстают от роста тела и возникает их относительная функциональная недостаточность (в частности, сердечно-сосудистой системы). В большинстве случаев наблюдается гипергликемия, может развиться сахарный диабет. Со стороны половой сферы обычно отмечаются явления более или менее выраженного гипогенитализма. Часто отмечаются различные не резко выраженные отклонения в психической сфере. Гигантизм может сопровождаться патологией других периферических эндокринных желез. Причиной гигантизма являются опухолевые процессы (эозинофильная аденома) и гиперплазия эозинофильных клеток передней доли гипофиза, связанная с чрезмерными стимулирующими влияниями гипоталамуса. Нередко прослеживается связь с перенесенными в детстве инфекционными заболеваниями. Определенное значение имеет наследственная предрасположенность. Нередко этиология гигантизма остается неизвестной. Акромегалия развивается в результате чрезмерной продукции соматотропина у взрослых. Заболевание характеризуется возобновлением периостального роста костей, вследствие чего происходят их утолщение и деформация. Анаболическое действие СТГ проявляется также в увеличении массы мягких тканей и внутренних органов. Акромегалия, как правило, сопровождается стойкой гипергликемией и часто — сопутствующим сахарным диабетом, обусловленным недостаточностью инсулярного аппарата; нередко наблюдаются симптомы нарушений функций других эндокринных желез. Проявления акромегалии характеризуются многочисленными субъективными симптомами: головной болью, слабостью, сонливостью, болями в суставах, снижением остроты зрения, половыми расстройствами. Весьма характерны постепенные изменения внешности: укрупнение черт лица и увеличение дистальных отделов конечностей (кистей и стоп). Утолщаются кости черепа, выступают надбровные и скуловые дуги, челюсти выдаются вперед. Увеличиваются нос, губы, уши, язык; грубеет голос, возникают трофические расстройства кожи и др. Этиология акромегалии такая же, как у гипофизарного гигантизма. Как и при вызванном эозинофильной аденомой гигантизме, разнообразные проявления акромегалии связаны как с определяющим значением увеличенного образования соматотропина и некоторых других гормонов, так и непосредственно с ростом интракраниальной опухоли. Раннее половое созревание и другие нарушения в половой сфере обусловлены чрезмерной секрецией аденогипофизом гонадотропинов. Ранние формы патологии проявляются в явно преждевременном половом созревании. Уже в возрасте 6—7 лет развиваются половые железы, у мальчиков начинается сперматогенез; у девочек — созревание фолликулов, овуляция и менструации, появляются свойственные пубертатному периоду вторичные половые признаки. Гиперпродуклия гонадотропинов у взрослых проявляется в основном у женщин в виде нарушений овариально-менструального цикла и нормального течения беременности. Синдром персистируюшей лактации вызван избыточной продукцией пролактина. Он проявляется у женщин двумя главными симптомами: непрерывным выделением молока из молочных желез, не связанным с беременностью и кормлением ребенка (галактореей), и отсутствием менструаций (аменореей). У мужчин возникает снижение половой активности и реже — гинекомастия. Наиболее частой причиной заболевания служит пролактин-продуцирующая аденома гипофиза пролактинома. Гиперсекреция меланотропин а промежуточной долей гипофиза. приводящая к потемнению кожи, самостоятельного патологического значения не имеет и является лишь признаком некоторых других эндокринных нарушений. 5. Парциальный гипопитуитаризм. Парциальный гипопитуитаризм возникает в результате недостаточности какого-либо одного тропного гормона (хотя строго моногормональные формы патологии почти не встречаются). Приведем наиболее характерные и частые заболевания, в основе которых лежит частичная аденогипофизарная недостаточность. Гипофизарная карликовость, или гипофизарный нанизм (от греч. nanos — карлик), — заболевание, характеризующееся резкой задержкой роста, а также половым недоразвитием в результате недостаточного образования соматотропина и гонадотропинов, возникающего уже на стадии внутриутробного развития. Поэтому масса новорожденных обычно значительно меньше нижней границы нормы, в дальнейшем отставание в росте и массе прогрессирует, и физическое развитие рано прекращается. Рост ниже 130 см принято считать карликовым, встречаются больные ниже 100 см. Гипофизарная карликовость обычно не сопровождается грубыми нарушениями телосложения, однако у взрослых карликов сохраняются пропорции тела, свойственные младшему детскому возрасту с преобладанием длины туловища над длиной конечностей. Характерно морщинистое лицо, рано приобретающее старческий вид, часто бывает трудно определить по лицу пол карлика и его возраст. Как правило, наблюдается недоразвитие половой системы (половых желез, половых органов и вторичных половых признаков), приводящее к бесплодию. В психическом развитии существенных нарушений обычно не происходит, хотя часто отмечаются некоторая инфантильность в поведении, снижение памяти и умственной работоспособности. Каких-либо специфических этиологических факторов гипофизарного нанизма не выявлено, и в качестве причин данного заболевания могут, по-видимому, выступать многие патогенные воздействия и патологические процессы, в том числе у матери во время беременности. Гипофизарный гипогонадизм, или недостаточность гонадотропинов проявляются на ранних стадиях развития у мужских особей в виде евнухоидизма, у женских — гипофизарного инфантилизма. Для мальчиков и юношей, страдающих евнухоидизмом, характерны высокий рост, длинные тонкие кости конечностей, узкие плечи и относительно широкий таз, слабое развитие скелетной мускулатуры, тонкая бледная кожа. Специфические признаки гипогонадизма проявляются в недоразвитии половых желез, наружных половых органов и вторичных половых признаков, характерны скудный рост волос на лице, высокий тембр голоса. Нередко отмечаются поведенческие особенности, не свойственные мужским особям. Признаки евнухоидизма сохраняются и у взрослых больных, обычно не способных к деторождению. Для гипофизарного женского инфантилизма также характерно слабое, субтильное телосложение без выраженных признаков, свойственных женскому организму. Недоразвиты молочные железы, поздно появляются менструации; как правило, имеются различные нарушения менструального цикла. Характерны легкая психическая ранимость, неустойчивость настроения. Выраженные формы гипофизарного инфантилизма сопровождаются неспособностью к зачатию либо различными нарушениями беременности. Каких-либо специфических этиологических факторов гипофизарного гипогонадизма не установлено, и в качестве таковых могут выступать различные патогенные агенты, реализующие свое действие на уровне гипоталамуса и гипофиза. Нейроэндокринное ожирение может проявляться многочисленными вариантами, отличающимися по своим патогенетическим механизмам. В основе некоторых из них лежит недостаточный биосинтез в аденогипофизе жиромобилизующего полипептида липотропина в результате поражения самого гипофиза или гипоталамических центров с вторичным вовлечением гипофиза. Для гипофизарного ожирения характерно избыточное отложение жира на животе, спине и в проксимальных отделах конечностей при относительной «худобе» дистальных отделов — предплечий и голеней. Адипозогенитальная дистрофия (болезнь Фрелиха) — заболевание, проявляющееся двумя основными синдромами — ожирением и гипогонадизмом. Болезнь развивается при врожденных изменениях гипототаламуса и гипофиза или поражениях межуточного мозга различными патогенными факторами, в том числе инфекциями, в эмбриональном и пост-эмбриональном периодах. Встречаются случаи этого заболевания без видимых изменений гипоталамуса и гипофиза. Адипозогенитальная дистрофия проявляется диффузным ожирением с преимущественным отложением жира в области груди, живота, таза, бедер и лица. Развитие первичных и вторичных половых признаков резко задержано; при возникновении заболевания в более поздние периоды жизни отмечается обратное развитие гениталий. Дефицит кортикотропина (АКТП) и тиреотропина (ТТЛ) приводит соответственно к вторичным или третичным (гипофизарным или гипоталамическим формам гипокортицизма и гипотиреоза (данные формы патологии рассматриваются в подразделах, посвященных патофизиологии надпочечников и щитовидной железы). Недостаточность продукции меланотропина клинического значения не имеет. 4. Тотальный гипопитуитаризм. Гипопитуитаризм. Причинами гипопитуитаризма могут служить хромофобные (гормонально неактивные) аденомы передней доли гипофиза, состояния после хирургического лечения гипофизарных аденом и послеродовые некрозы аденогипофиза. Тотальный гипопитуитаризм может быть также вызван механической травмой, тромбозом сосудов, кровоизлиянием, инфекциями и интоксикациями, длительным голоданием. Иногда тяжелая гипофизарная недостаточность возникает вследствие патологических процессов в гипоталамусе. Проявления тотального гипопитуитаризма (гипофизарной кахексии, болезни Симмондса) характеризуются картиной резкого истощения, преждевременного старения, тяжелыми обменно-трофическими расстройствами, нарушениями функции периферических гипофиззависимых эндокринных желез. Похудание происходит за счет исчезновения подкожного жирового слоя и других жировых отложений, атрофии мышц и внутренних органов. Оно может развиваться постепенно (с потерей массы тела примерно 3 — 6 кг в месяц), но встречаются и так называемые галопирующие формы, когда больные теряют до 20—25 кг в течение одного месяца. Часто развиваются диспепсические расстройства: рвота, поносы, боли в животе, атония кишечника, отвращение к пище. Возникает выраженная артериальная гипотензия вплоть до коллапса. 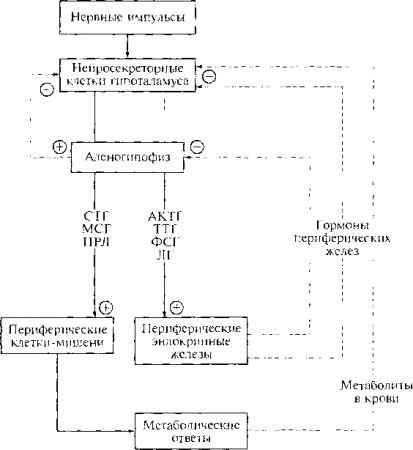 Рис. 15.1. Упрошенная схема гипоталамо-гипофизарной нейроэндокринной регуляции: Истощение в терминальной стадии заболевания может быть настолько резко выражено, что больные напоминают скелет, обтянутый кожей, полностью безразличны к окружающему и к собственной участи, неподвижно лежат в состоянии полной прострации. Своеобразной формой пангипопитуитаризма является болезнь, или синдром, Шихена, возникающая в качестве послеродового осложнения. В основе заболевания обычно лежит значительная и своевременно не возмещенная кровопотеря во время родов, сопровождающаяся спазмом сосудов передней доли гипофиза. При длительном спазме сосудов могут развиваться ишемический некроз гипофиза и типичная картина гипофизарной кахексии, но в большинстве случаев расстройства не столь резко выражены. Атрофия гипофиза, сопровождающаяся кахексией, вызывается длительным голоданием (особенно белковым). Вариантом подобного патогенеза тотального гипопитуитаризма является психогенная анорексия, развивающаяся вначале на почве каких-либо психотравмирующих ситуаций, а затем переходящая в стойкое отвращение к еде. Возможно, во всех подобных случаях существует предрасположенность как со стороны нервно-психической сферы, так и гипоталамо-гипофизарной системы. 7. Типовые формы нарушений функций гипофиза. Типовые формы нарушений функции аденогипофиза. Существуют следующие важнейшие формы нарушений функций аденогипофиза:
Типовые формы нарушения функции нейрогипофиза.Нарушение функций нейрогипофиза. Недостаточность эффектов антидиуретического гормона клинически проявляется в виде так называемого несахарного диабета. Существуют две различные по этиологии формы этого заболевания:
Реже встречаются еще две формы заболевания, связанные либо с генетически обусловленным дефектом почечных рецепторов АДГ, либо с приобретенным понижением их чувствительности к гормону. Главным проявлением несахарного диабета является постоянная полиурия, достигающая в некоторых случаях 20 л/сут и более. Она сопровождается вторичной резко выраженной жаждой. Необходимость в частых мочеиспусканиях (особенно ночью) и постоянном питье вызывают у больных крайне тягостное субъективное состояние. В случае невозмещения потери воды и электролитов легко возникает дегидратация организма. Гиперсекреция АДГ, называемая гипергидропексическим синдромом (синдромом Пархона), может возникать после повреждений мозга (в частности, после нейрохирургических вмешательств), при повышении внутричерепного давления, возможно, после инфекционных заболеваний, а также в результате эктопической продукции АДГ или подобных ему веществ опухолями неэндокринных органов (особенно легких). Заболевание проявляется олигурией, гипергидратацией и связанной с гемодилюцией гипонатриемией. Гипосекреция окситоцина может возникать при первичных формах несахарного диабета, однако характерных проявлений она не имеет. Лишь в некоторых случаях появляются затруднения при грудном кормлении. Гиперсекреция окситоцина у человека не описана. 8. Гипофункциональные состояния коры надпочечников. Гипофункция коры надпочечников. Острая тотальная недостаточность. Такая патология возникает при двустороннем грубом повреждении коры надпочечников в результате травмы, кровоизлияния, связанного с родовой травмой, общей капилляропатией или неадекватным применением антикоагулянтов, при тромбозесосудов (вен), ДВС-синдроме, тяжелых инфекциях. Удаление надпочечника, пораженного гормонально активной опухолью, также может привести к острой недостаточности в связи с атрофией парного надпочечника. При отсутствии эффективной терапии быстро развиваются прогрессирующая мышечная слабость, тяжелая артериальная гипотензия, диспепсические явления и наступает смерть от острой недостаточности кровообращения. Хроническая форма недостаточности надпочечников(болезнь Аддисона). Эта болезнь может быть связана с двусторонним туберкулезным процессом, метастазамиопухолей, токсическими поражениями надпочечников (например, при хронической интоксикации некоторыми инсектицидами — ДДТ и др.), амилоидозом и др. Часто встречается идиопатическая атрофия надпочечников аутоиммунного происхождения. У некоторых таких больных есть антитела против всех стероидогенных клеток и гипокортицизм комбинируется у них с гипогонадизмом. Нередко встречаются комбинации с другими аутоиммунными заболеваниями (тиреоидитом, сахарным диабетом и др.). Парциальные формы гипокортицизма обычно связаны с ферментными дефектами. Вторичные (центральные) формы недостаточности функции надпочечников обусловлены дефицитом АКТГ вследствие повреждения аденогипофиза или (редко) гипоталамуса. Имеются случаи резистентности к кортизолу, связанные с аномалиями глюкокортикоидных рецепторов. Хронический гипокортицизм проявляется астенизацией, апатией, снижением работоспособности, мышечной слабостью, артериальной гипотензией, анорексией, похуданием. Нередко наблюдается лолиурия в сочетании с почечной недостаточностью, характерная гиперпигментация кожи и слизистых оболочек. В зависимости от причины и эффективности лечения хронические формы недостаточности функции надпочечников продолжаются длительное время или переходят в острую форму. В основе проявления тотального гипокортицизма лежит недостаточность эффектов всех гормонов надпочечников. Мышечная слабость связана с нарушением электролитного баланса (при дефиците альдостерона) и гипогликемией (дефицит глюкокортикостероидов), а также с уменьшением мышечной массы (вследствие дефицита андрогенов). Артериальная гипотензия связана с гипонатриемией, выпадением пермиссивного эффекта глюкокортикостероидов и вследствие этого снижением реактивных свойств сосудистой стенки к прессорным влияниям. Гипотензия может усугубиться ослаблением сократительной функции сердца. Потеря натрия сопровождается полиурией, гипогидратацией, сгущением крови. Наряду с артериальной гипотензией ухудшение реологических свойств крови приводит к уменьшению клубочкового кровотока, эффективного фильтрационного давления и общего объема фильтрации. Отсюда наряду с полиурией возникает недостаточность выделительной функции почек. Пищеварительные расстройства связывают с недостаточной секрецией пищеварительных соков и интенсивным выделением слизистой оболочкой кишечника иона натрия (недостаток альдостерона), что приводит к профузным поносам и также способствует гипогидратации. Гипоальдостеронизм.Изолированная (парциальная) недостаточность продукции альдостерона встречается сравнительно редко. Она может возникнуть вследствие нарушения механизмов, стимулирующих его секрецию (система «ренин — ангиотензин»), первичного ферментного дефекта в клубочковой зоне коры надпочечников с нарушением последних этапов биосинтеза альдостерона при нормальном образовании кортизола и кортикостерона. Встречается также врожденный так называемый псевдогипоальдостеронизм, обусловленный низкой чувствительностью эпителия почечных канальцев к альдостерону. Изолированный гипоальдостеронизм возникает после удаления одного из надпочечников по поводу опухоли альдостеромы, когда в другом надпочечнике клубочковая зона атрофируется. Проявления гипоальдостеронизма определяются недостаточной продукцией альдостерона на фоне нормальной или повышенной секреции других гормонов, в частности глюкокортикоидов. Отмечаются быстрая утомляемость, мышечная слабость, артериальная гипотензия, периодические обморочные состояния, брадикардия до полной атриовентрикулярной блокады (приступы Адамса —Стокса), гипонатриемия и гиперкалиемия. 9. Гиперальдостеронизм. Гиперфункция коры надпочечниковГиперальдостеронизм.Различают две формы избыточной секреции альдостерона: первичный и вторичный гиперальдостеронизм. Причиной первичного гиперальдостеронизма (синдром Конна) обычно является гормонально-активная опухоль, происходящая из клубочковой зоны — альдостерома. Проявления первичного гиперальдостеронизма сводятся к трем основным группам симптомов: сердечно-сосудистым, почечным, нервно-мышечным. Основными причинами этих нарушений служат почечная задержка натрия и потеря калия. Накопление натрия в клетках стенок сосудов приводит к их гипергидратации, сужению просвета, увеличению периферического сопротивления и повышению артериального давления. Артериальной гипертензии способствует также увеличение чувствительности сократительных элементов сосудистых стенок к действию прессорных аминов. В результате гипертензии часто встречаются (особенно у детей) изменения глазного дна, приводящие к нарушению зрения вплоть до слепоты. Нередко наблюдаются нарушения ритма сердца, характерные для гипокалиемии изменения ЭКГ. В начальной стадии болезни суточный диурез понижен. Позднее олигурия сменяется стойкой полиурией, которая обусловлена дегенерацией эпителия почечных канальцев и снижением их чувствительности к АДГ. Как правило, существуют нарушения в нервно-мышечной системе — мышечная слабость, парестезии, судороги; иногда вялые параличи. Вторичный гиперальдостеронизм может возникать при некоторых физиологических состояниях: сильном физическом напряжении, менструации, беременности и лактации, высокой внешней температуре с интенсивным потоотделением и др. Патологический гиперальдостеронизм возникает при острой кровопотере, различных формах сердечной недостаточности, нефрозе с выраженной протеинурией и гипопротеинемией. В этих случаях усиленная продукция альдостерона связана с активацией ренин-ангиотензиновой системы в ответ на гиповолемию. Активация данной системы возникает и при заболеваниях почек, сопровождающихся их ишемией. Повышение уровня альдостерона при заболеваниях печени (в основном — циррозе) связано с тем, что этот гормон, как и многие другие, метаболизируется в основном в печени. Вторичный гиперальдостеронизм также проявляется задержкой натрия, артериальной гипертензией, гипергидратацией и некоторыми другими симптомами, свойственными первичному гиперальдостеронизму. Однако при этом в отличие от синдрома Конна в крови наблюдается высокий уровень ренина и ангиотензина; развиваются отеки, что связано с особенностями этиологии и патогенеза этих двух видов гиперальдостеронизма. 10. Кортикогенитальные синдромы. Гиперпродукция гормонов сетчатой зоны. Адреногенитальный (кортикогенитальный) синдром (КГС). Данный вид расстройств функций коры надпочечников встречается в двух основных формах: врожденной вирилизирующей гиперплазии коры надпочечников и гормонально-активной опухоли — ан-дростеромы (андробластомы). Врожденная форма кортико-генитального синдрома связана с нарушениями синтеза гормонов в коре надпочечников, в результате в кровь поступает избыточное количество стероидов с андрогенными свойствами. Основные проявления патологии обусловлены вирилизирующим и анаболическим действием данных гормонов. В этиологии врожденного кортико-генитального синдрома главную роль играет наследственность. Развитию данного заболевания могут способствовать также различные неблагоприятные факторы во время беременности матери (токсикоз, применение гормональных препаратов и др.). В основе врожденного кортико-генитального синдрома лежит дефицит ферментов 21-гидроксилазы, 11-гидроксилазы и, возможно, 3-дегидрогеназы, участвующих в многоэтапном синтезе кортикостероидов. Различают три клинические формы заболевания:
Считается, что две первые формы связаны с дефицитом 21-гидроксилазы, а третья форма — с дефицитом 11-р-гидроксилазы. Во всех случаях нарушается синтез кортизола, кортикостерона и альдостерона, что сопровождается накоплением андрогенных предшественников и увеличением образования гипофизарного АКТГ. Последнее обусловлено по механизму обратной связи дефицитом кортизола: в то же время андрогены не обладают тормозящим влиянием на синтез АКТГ. Избыток АКТГ дополнительно стимулирует сетчатую зону, усиливая образование андрогенов и вызывая гиперплазию надпочечников. Из-за дефицита необходимых для синтеза кортизола ферментов стимулирующее влияние AKTT на пучковую зону и синтез кортизола реализоваться при этом не может. Проявления кортико-генитального синдрома наиболее ярко выражены у женщин и в большинстве случаев обнаруживаются сразу после рождения (хотя встречаются и случаи значительно более позднего проявления признаков болезни). Как правило, дети с этим заболеванием рождаются крупными в результате анаболического действия андрогенов. Если гиперпродукция андрогенов возникла на раннем этапе развития плода, изменения наружных половых органов у девочек выражены настолько резко, что бывает трудно установить пол новорожденного (женский псевдогермафродитизм). В случаях, когда избыток андрогенов проявляется только после рождения, наружные половые органы имеют нормальный вид и их изменение происходит постепенно по мере нарастания дисфункции надпочечников. Ранним признаком вирилизации у девочек является также появляющееся в возрасте 2 — 5 лет, а иногда и раньше, ненормальное, избыточное оволосение — гипертрихоз (или гирсутизм), рост волос на лобке, в подмышечных впадинах, на лице, спине, конечностях. В более поздние сроки избыток андрогенов сказывается и на строении тела девочек. В связи с усилением анаболизма вначале отмечается быстрый рост, однако в результате преждевременного окостенения эпифизов трубчатых костей рост вскоре прекращается и в конечном итоге обычно наблюдается низкорослость. Характерны чрезмерное развитие скелетной мускулатуры и большая физическая сила. При отсутствии или неэффективности лечения андрогенизация прогрессирует и девочки приобретают еще более мужеподобный вид, усиливается рост волос на лице (усы, борода) и теле, грубеет голос. Молочные железы не развиваются, менструации не наступают. У взрослых женщин также наблюдаются аменорея, атрофия матки и молочных желез, телосложение приближается к мужскому типу, часто появляется облысение. Имеются также определенные отклонения в поведенческих особенностях. Мальчики с врожденной гиперплазией надпочечников обычно рождаются с нормальной дифференциацией наружных половых органов. В дальнейшем происходит раннее ложное половое созревание по изосексуальному типу: явно преждевременно развиваются вторичные половые признаки и наружные половые органы (макрогенитосомия). В то же время из-за торможения избытком андрогенов образования гипофизарных гонадотропинов половые железы остаются недоразвитыми и сперматогенез может полностью отсутствовать. Весьма характерен внешний вид больных: низкий рост, короткие нижние конечности и сильно развитая мускулатура (так называемый «ребенок-геркулес»). При гипотензивной (сольтеряющей) форме кортико-генитального синдрома в связи с резким уменьшением продукции альдостерона наряду с описанными выше характерными признаками заболевания наблюдаются серьезные нарушения электролитного баланса: потеря натрия, гиперкалиемия, гипогидратация и, как следствие, артериальная гипотензия. Нередко развиваются кризы с судорогами и расстройствами гемодинамики вплоть до коллапса, иногда — со смертельным исходом. Кортико-генитальный синдром с гипертензивным синдромом характеризуется значительным избытком дезоксикортикостерона, что ведет к стойкому повышению артериального давления. Имеются также отчетливые признаки вирилизации вплоть до псевдогермафродитизма у девочек и макро-генитосомии у мальчиков. Нередко встречаются стертые формы кортико-генитального синдрома, проявляющиеся нерезко выраженными симптомами гиперпродукции андрогенов: умеренным гипертрихозом, нарушением менструального цикла и др. Приобретенная форма КГС вызывается гормонально-активной опухолью — андростеромой, происходящей из сетчатой зоны надпочечников и продуцирующей большое количество андрогенов. Опухоль может носить доброкачественный или злокачественный характер и развиваться в любом возрасте. Проявления заболевания у женщин весьма характерны и совпадают с врожденным кортико-генитальным синдромом. При раннем возникновении опухоли у мальчиков также имеются характерные признаки данного заболевания. У взрослых мужчин с нормально развитыми вторичными половыми признаками при возникновении андростеромы бывает трудно выявить прогрессирование вирилизма, в связи с чем заболевание часто своевременно не диагностируется. В отличие от врожденного кортико-генитального синдрома при андростероме обычно нет значительного повышения содержания АКТГ в плазме, но резко увеличено выделение с мочой 17-кетостероидов. 11. Расстройства функций мозгового слоя надпочечников. Нарушения функции мозгового вещества надпочечников.Мозговое вещество надпочечников синтезирует и выделяет два гормона, являющихся производными аминокислоты тирозина, — катехоламины адреналин и норадреналин. В нормальных условиях надпочечники выделяют значительно больше адреналина (около 80 %). Метаболические и физиологические эффекты катехоламинов многообразны. Они обладают выраженным прессорным (гипертензивным) действием, стимулируют работу сердца, влияют на гладкую мускулатуру, регуляцию углеводного обмена, катаболизмбелков, окислительные процессы, гормональную активность некоторых эндокринных желез и другие процессы. Метаболические и физиологические эффекты адреналина и норадре-налина в основном совпадают, хотя между ними есть и ряд отличий. Эти отличия, однако, сказываются лишь на некоторых деталях реально встречающихся эндокринных расстройств и существенного значения не имеют. Недостаточность гормонообразования мозгового вещества надпочечников.Как самостоятельная форма эндокринопатий эта патология практически не встречается. Даже двустороннее удаление мозгового вещества обычно не сопровождается видимыми расстройствами. Это связано с тем, что в организме, помимо мозгового слоя надпочечников, есть достаточное количество хромафинной ткани, способной продуцировать адреналин. Чрезмерная секреция катехоламинов. Данная патология возникает при опухоли, исходящей из мозгового вещества надпочечников — феохромоцитоме и некоторых других (редких) опухолях хромаффинной ткани. Усиленное выделение гормонов может провоцироваться психической или физической нагрузкой, болевым раздражением и другими стрессорными факторами. В некоторых случаях гиперсекреция гормонов связана с незначительными воздействиями или происходит непрерывно. Для данного заболевания характерны прежде всего сердечно-сосудистые расстройства: тахикардия, спазм периферических сосудов и резкое повышение артериального давления. При пароксизмальной форме больные ощущают тревогу, страх, резкие пульсирующие головные боли, а также боли в подложечной области; возникает мышечная дрожь, возможны тошнота, рвота, нарушения дыхания, временное прекращение выделения мочи. В крови отмечается гипергликемия, обусловленная усилением гликогенолиза под влиянием избытка адреналина. При сохраненном диурезе или после его восстановления возникает глюкозурия. В связи с чрезвычайным увеличением периферического сопротивления и перенапряжением левого желудочка может возникнуть его острая недостаточность с застоем крови в малом круге и отеком легких. В случаях с постоянно повышенным артериальным давлением возникают изменения сосудов (в частности — глазного дна) и другие нарушения, свойственные тяжелой прогрессирующей артериальной гипертензии. При наличии стойкой гипергликемии также могут возникать соответствующие осложнения, включая сахарный диабет. |
