Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
68 вопросβ - окисление высших жирных кислот (ВЖК). Энергетическая эффективность процесса окисления предельных и непредельных жирных кислот. Влияние тканевого окисления ВЖК на утилизацию глюкозы тканями. β-Окисление - специфический путь катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода в виде ацетил-КоА. Метаболический путь - β-окисление - назван так потому, что реакции окисления жирной кислоты происходят у β-углеродного атома. Реакции β-окисления и последующего окисления ацетил-КоА в ЦТК служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования. β-Окисление жирных кислот происходит только в аэробных условиях. Продуктами каждого цикла β-окисления являются FADH2, NADH и ацетил-КоА. Хотя реакции в каждом "цикле" одни и те же, остаток кислоты, который входит в каждый последующий цикл, короче на 2 углеродных атома. В последнем цикле окисляется жирная кислота из 4 атомов углерода, поэтому образуются 2 молекулы ацетил-КоА, а не 1, как в предыдущих. Суммарное уравнение β-окисления, например пальмитоил-КоА может быть представлено таким образом: С15Н31СО-КоА + 7 FAD + 7 NAD+ + 7 HSKoA → 8 СН3-СО-КоА + 7 FADH2 + 7 (NADH + H+). Если рассчитывать выход АТФ при окислении пальмитиновой кислоты (табл. 8-7), то из общей суммы молекул АТФ необходимо вычесть 2 молекулы, так как на активацию жирной кислоты тратится энергия 2 макроэргических связей. Таблица 8-7. Синтез АТФ при полном окислении пальмитиновой кислоты
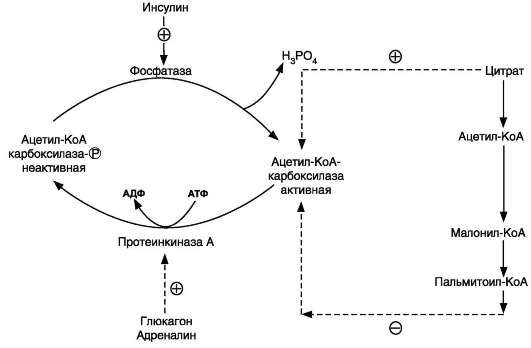
Влияние тканевого окисления ВЖК на утилизацию глюкозы тканями. Жирные кислоты угнетают поглощение глюкозы мышцами. При гипогликемии происходит мобилизация жирных кислот и увеличение окисления их в мышцах при одновременном снижении утилизации глюкозы, а прием углеводов и повышение уровня глюкозы в крови приводят к снижению липолиза и усилению липогенеза. Цикл «глюкоза - свободные жирные кислоты» – цикл Рэндла – является одним из механизмов, обеспечивающих гомеостаз глюкозы. Повышенное окисление свободных жирных кислот в мышечной ткани приводит к истощению запасов НАД+, что способствует ингибированию цикла Кребса и увеличению внутриклеточного содержания цитрата и ацетил-КоА. Последний в свою очередь угнетает активность пируватдегидрогеназы, вследствие чего пируват конвертируется в лактат или аланин. Повышенное содержание цитрата, которое образуется в цикле Кребса из ацетил-КоА и оксалоацетата, угнетает активность фосфофруктокиназы., способствуя повышению концентрации глюкозо-6-фосфата, ингибируя гексокиназу, снижая утилизацию глюкозы и соответственно – гликолиз. 69 вопросБиосинтез высших жирных кислот. Строение пальмитатсинтазного комплекса. Химизм и регуляция процесса. Биосинтез жирных кислот. В цитозоле ацетил-КоА превращается в жирные кислоты в 3 этапа: 1 этап: перенос ацетил-КоА из митохондрий в цитозоль с помощью цитратного челночного механизма. Образующаяся ЩУК может вернуться в митохондрии с помощью транслоказы, но чаще восстанавливается до малата. Далее малат декарбоксилируется НАДФ-зависимой малатдегидрогеназой (маликфермент). Кроме этого, генераторами НАДФН+Н+ являются пентозофосфатный путь и изоцитратдегидрогеназа. 2 этап: ацетил-КоА карбоксилируется под действием ацетил-КоА-карбоксилазы, сложного фермента, коферментом которого является витамин Н-биотин. Эта реакция лимитирует скорость всего процесса синтеза жирных кислот: активатор – цитрат, ингибитор – синтезированная жирная кислота. 3 этап: протекает при участии мультиферментного синтазного комплекса. Он состоит из двух полипептидных цепей. Каждая полипептидная цепь содержит по 6 ферментов синтеза жирных кислот (трансацилаза, кетоацил-синтаза, кетоацил-редуктаза, гидратаза, еноил-редуктаза, тиоэстераза). Ферменты связаны между собой ковалентными связями. Ацилпереносящий белок является также частью полипептидной цепи, но это не фермент. Его функция связана только с переносом ацильных радикалов. В процессе синтеза важную роль играют SH-группы. Одна из них принадлежит 4-фосфопантетеину, входящему в состав АПБ (ацилпереносящий белок) и вторая – цистеину кетоацил-синтазы. Первую называют центральной, а вторую – периферической SH-группой. Функциональная единица синтеза жирных кислот состоит из половины одного мономера, взаимодействующей с комплементарной половиной второго мономера. Следовательно, на синтазном комплексе одновременно синтезируются 2 жирные кислоты. Активной является только димерная форма комплекса. Перенос субстрата от фермента к ферменту происходит при участии АПБ. При участии трансацилазы остатки малонила переносятся на центральную SН-группу, а ацетила – на периферическую. Кетоацил-синтаза переносит ацетильный остаток с периферической SH-группы на остаток малонила. Это реакция конденсации. Энергия для нее освобождается при одновременном декарбоксилировании. Для удаления О2 далее проходят 3 последовательные реакции: восстановление – дегидратация – восстановле-ние. Первая реакция восстановления происходит при участии кетоацил-редуктазы с коферментом НАДФН, при этом кетогруппа восстанавливается в спиртовую. Удаление Н2О происходит при участии гидроксиацилгидратазы. Далее следует восстановление двойной связи еноилредуктазой (кофермент НАДФН). В итоге произошло удлинение на 2 углеродных атома. Если нужна масляная кислота (бутират), то тиоэстераза (деацилаза) отщепляет масляную кислоту с центральной SH-группы на цитоплазмати-ческий КоА. Если необходима жирная кислота с более длинной цепью, трансацилаза переносит остаток масляной кислоты на периферическую SH-группу, а к центральной SH-группе вновь переносится малонил-КоА и процесс присоединения 2-х углеродных атомов повторяется. Этот процесс продолжается до образования пальмитиновой кислоты (часто весь комплекс называют пальмитат-синтазным комплексом). Она отщепляется тиоэстеразой и соединяется с цитоплазматическим КоА. Полученный пальмитоил-КоА может ингибировать пальмитатсинтазу, вызывая диссоциацию на две полипептидных цепи. Итоговое уравнение синтеза пальмитиновой кислоты: Дальнейшая судьба пальмитоил-КоА двоякая: 1) участие в процессах эстерификации с образованием ацилглицеринов и эфиров холестерина; 2) дальнейшее удлинение цепи (элонгация и десатурация). Строение пальмитатсинтазного комплекса. Синтез жирной кислоты из ацетил-КоА и малонил-КоА с помощью пальмитатсинтазного комплекса (состоит из 2-ух полипептидных цепей. Каждая содержит 6 ферментов синтеза и ацилпереносящий белок. Выделяют понятия центральная и периферическая SH-группы. Синтез идет на центральной SH-группе). Химизм процесса. 1. Транспорт ацетил-КоА из митохондрий в цитозоль (ацилкарнитиновый механизм; цитрат - транспортная система); Перенос ацетил-КоА из митохондрий в цитозоль с помощью цитратного челночного механизма. Образующаяся ЩУК может вернуться в митохондрии с помощью транслоказы, но чаще восстанавливается до малата. Далее малат декарбоксилируется НАДФ-зависимой малатдегидрогеназой (маликфермент). Кроме этого, генераторами НАДФН+Н+ являются пентозофосфатный путь и изоцитратдегидрогеназа. 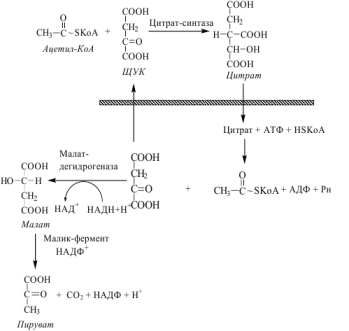 2. Образование малонил-КоА; фермент: ацетил-КоА-карбоксилаза Ацетил-КоА + СО2 + АТФ → Малоиил-КоА +АДФ + Фн 3. Собственно синтез жирных кислот, удлинение жирной кислоты на 2 атома углерода за счет малонил-КоА до образования пальмитиновой кислоты. 1) фермент: ацетил-ацилпереносящий 6елок(АПБ)-трансфераза HS-AПБ-SH + Ацетил-КоА ↔ Ацетил-АПБ-SH + HS-KoASH 2) фермент: малонил-АПБ-трансфераза Ацетил-АПБ-SH + Малонил-КоА ↔ Ацетил-АПБ-малонил + HS-KoASH 3) фермент: β-кетоацил-АПБ-сиитаза 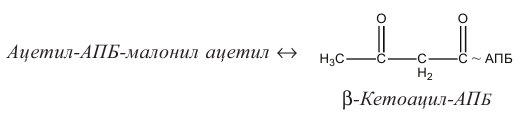 4) фермент: β-кетоацил-АПБ - редуктаза β-кетоацил-АПБ + НАДФН ↔ β-гидроксиацил-АПБ + НАДФ+ 5) фермент: β-гидроксиацил-АПБ - дегидратаза β-Гидрокеиацил-АПБ ↔ Транс-еноил-АПБ 6) фермент: еноил-АПБ - редуктаза Транс-еноил-АПБ + НАДФН2↔ Бутирил-АПБ + НАДФ+ После этого ацил-АПБ вступает в новый цикл синтеза. К свободной SH-группе ацилпереносящего белка присоединяется новая молекула малонил-КоА. Затем происходит отщепление ацильного остатка, и он переносится на малонильный остаток с одновременным декарбоксилированием, и цикл реакций повторяется. Таким образом, углеводородная цепочка будущей жирной кислоты постепенно растет (за каждый цикл – на два углеродных атома). Это происходит до момента, пока она не удлинится до 16 углеродных атомов (в случае синтеза пальмитиновой кислоты) или более (синтез других жирных кислот). Вслед за этим происходит тиолиз, и образуется в готовом виде активная форма жирной кислоты – ацил-КоА. Регуляция синтеза жирных кислот Регуляторный фермент синтеза жирных кислот - ацетил-КоА-карбоксилаза. Этот фермент регулируется несколькими способами. Ассоциация/диссоциация комплексов субъединиц фермента. В неактивной форме ацетил-КоА-карбоксилаза представляет собой отдельные комплексы, каждый из которых состоит из 4 субъединиц. Активатор фермента - цитрат; он стимулирует объединение комплексов, в результате чего активность фермента увеличивается. Ингибитор - пальмитоил-КоА; он вызывает диссоциацию комплекса и снижение активности фермента (рис. 8-40). Фосфорилирование/дефосфорилирование аце-тил-КоА-карбоксилазы. В постабсорбтивном состоянии или при физической работе глюкагон или адреналин через аденилат-циклазную систему активируют протеинки-назу А и стимулируют фосфорилирование субъединиц ацетил-КоА карбоксилазы. Фосфорилированный фермент неактивен, и синтез жирных кислот останавливается. В абсорбтивный период инсулин активирует фосфатазу, и ацетил-КоА карбоксилаза переходит в дефосфорилированное состояние (рис. 8-41). Затем под действием цитрата происходит полимеризация протомеров фермента, и он становится активным. Кроме активации фермента, цитрат выполняет и другую функцию в синтезе жирных кислот. В абсорбтивный период в митохондриях клеток печени накапливается цитрат, в составе которого остаток ацетила транспортируется в цитозоль.
Индукция синтеза ферментов. Длительное потребление богатой углеводами и бедной жирами пищи приводит к увеличению секреции инсулина, который стимулирует индукцию синтеза ферментов: ацетил-КоА-карбоксилазы, синтазы жирных кислот, цит-ратлиазы, глюкозо-6-фосфатдегидрогеназы. Следовательно, избыточное потребление углеводов приводит к ускорению превращения продуктов катаболизма глюкозы в жиры. Голодание или богатая жирами пища приводит к снижению синтеза ферментов и, соответственно, жиров. |