Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
5%) выделяется с мочой.86 вопросГормоны мозгового слоя надпочечников. Синтез и секреция катехоламинов. Механизм действия, биологические функции. Подобно задней доле гипофиза, мозговой слой надпочечников - производное нервной ткани. Его можно рассматривать как продолжение симпатической нервной системы, так как преганглионарные волокна чревного нерва оканчиваются на хромаффинных клетках мозгового слоя надпочечников. Своё название эти клетки получили потому, что они содержат гранулы, окрашивающиеся бихроматом калия в красный цвет. Такие клетки находятся также в сердце, печени, почках, половых железах, постганглионарных нейронах симпатической нервной системы и в ЦНС. При стимуляции преганглионарного нейрона хромаффинные клетки продуцируют катехол-амины - дофамин, адреналин и норадреналин. У большинства видов животных хромаффинные клетки секретируют в основном адреналин ( | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Печень | Мышцы | Жировая ткань |
| Активация | ||
| 1 . Фосфодиэстераза | 1 . Фосфодиэстераза | 1 . ЛП-липаза |
| 2. Фосфофруктокиназа | 2. Фосфофруктокиназа | 2. Фосфофруктокиназа |
| 3. Пируваткиназа | 3. Пируваткиназа | 3. Пируваткиназа |
| 4. Пируватдегидрогеназный комплекс | 4. Пируватдегидрогеназный комплекс | 4. Ацетил-КоА-карбоксилаза |
| 5. Фосфатаза гликогенсинтазы и гликогенфосфорилазы | 5. Фосфатаза гликогенсинтазы | |
| б.Ацетил-КоА-карбоксилаза | | |
| Индукция | ||
| 1 . Глюкокиназа | | 1 . Глицеральдегидфосфат- дегидрогеназа |
| 2. Цитратлиаза | | 2. Пальмитатсинтаза |
| 3. Пальмитатсинтаза | | |
| 4. Пируваткиназа | | |
| 5. Ацетил-КоА-карбоксилаза | | |
| 6. Глюкозо-6-фосфатдегидрогеназа | | |
| Репрессия | ||
| Фосфоенолпируваткарбоксикиназа | | |
Транспорт глюкозыв клетки происходит при участии специальных белков-переносчиков (см. раздел 7). Переносчик, регулируемый инсулином (ГЛЮТ-4), содержится только в мышцах и жировой ткани (инсулинзависимые ткани). В отсутствие инсулина ГЛЮТ-4 находятся в цитозольных везикулах. Под влиянием инсулина происходит транслокация везикул в плазматическую мембрану; при снижении концентрации гормона глюкотранспортёры возвращаются в цитозоль, и транспорт глюкозы прекращается.
В клетках печени инсулин индуцирует синтез глюкокиназы. В результате фосфорилирования концентрация свободной глюкозы в клетках поддерживается на низком уровне, что способствует её транспорту из крови по градиенту концентрации.
Влияние инсулина на метаболизм глюкозы.Инсулин стимулирует утилизацию глюкозы в клетках разными путями. Около 50% глюкозы используется в процессе Гликолиза, 30-40% превращается в жиры и около 10% накапливается в форме гликогена. Общий результат стимуляции этих процессов - снижение концентрации глюкозы в крови.
Влияние инсулина на метаболизм глюкозы осуществляется путём повышения активности и количества ключевых ферментов гликолиза: глюкокиназы, фосфофруктокиназы, пируват-киназы (см. раздел 7). В мышцах инсулин активирует гексокиназу П. В печени и мышцах под влиянием инсулина снижается концентрация цАМФ в результате активации фосфодиэс-теразы. Кроме того, инсулин активирует фос-фатазы, дефосфорилирующие гликогенсинтазу,
3. Механизм действия инсулина
Действие инсулина начинается с его связывания со специфическим гликопротеиновым рецептором на поверхности клетки-мишени (см. раздел 5). Рецепторы инсулина обнаружены почти во всех типах клеток, но больше всего их в гепатоцитах и клетках жировой ткани. Так как концентрация инсулина в крови составляет 10-10 М, количество рецепторов, связанных с инсулином, зависит от их количества на мембране клетки. Клетки с разным содержанием рецепторов реагируют по разному на одну и ту же концентрацию гормона.
Инсулиновый рецептор (IR) постоянно синтезируется и разрушается. Т1/2 рецептора составляет 7-12 ч. При высокой концентрации инсулина в плазме крови, например, при ожирении, число инсулиновых рецепторов может уменьшаться, и клетки-мишени становятся менее чувствительными к инсулину, что может быть одной из причин сахарного диабета II типа (см. ниже подраздел V).
Снижение чувствительности клеток к гормону (десенситизация) опосредуется 2 механизмами. Первый включает утрату рецепторов путём их интернализации. Комплекс инсулин-рецептор захватывается внутрь клетки эндоцитозом. В результате интернализации часть рецепторов подвергается разрушению в лизосомах, а часть возвращается в плазматическую мембрану. Второй механизм десенситизации - ковалентная модификация рецептора в результате фосфорилирования. Так, фосфорилирование IR по остаткам серина и треонина снижает его сродство к инсулину.
Рецептор инсулина относят к типу рецепторов, обладающих тирозинкиназной активностью (см. раздел 5). Стимулированное инсулином аутофосфорилирование β-субъединицы IR по остаткам тирозина приводит к фосфорилированию других внутриклеточных белков - субстратов инсулинового рецептора (IRS). Известно несколько таких субстратов: IRS-1, IRS-2, а также некоторые белки семейства STAT.
Эффекты инсулина могут проявляться в течение секунд и минут (транспорт веществ, фосфорилирование и дефосфорилирование белков, активация и ингибирование ферментов, синтез РНК) или через несколько часов (синтез ДНК, белков, рост клеток).
4. Глюкагон
Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит в α-клетках островков Лангерханса, в нейроэндокринных клетках кишечника и в некоторых отделах ЦНС. Неактивный предшественник проглюкагон в результате частичного протеолиза превращается в несколько пептидов. В клетках поджелудочной железы главный пептид - глюкагон; в клетках кишечника образуются глюкагонопо-добные пептиды (от англ. GLP - glucagon like peptide): GLP-1, GLP-2, глицентин и другие. GLP-1 ингибирует секрецию глюкагона и стимулирует синтез и секрецию инсулина. На секрецию глюкагона влияют и многие другие соединения, включая аминокислоты, жирные кислоты, кетоновые тела и нейромедиаторы. При приёме пищи, богатой углеводами, секреция глюкагона снижается. Белковая пища стимулирует секрецию инсулина и глюкагона; однако некоторые аминокислоты в большей степени влияют на секрецию одного из них. Например, аланин стимулирует секрецию глюкагона, но не инсулина.
В плазме крови глюкагон не связан с каким-либо транспортным белком. Т1/2 гормона составляет 5 мин. В печени глюкагон быстро разрушается под действием специфических протеаз.
Эффекты глюкагона в основном противоположны эффектам инсулина. Основные клетки-мишени глюкагона - печень и жировая ткань. Связываясь с рецепторами на плазматической мембране клеток-мишеней, глюкагон повышает содержание цАМФ (см. раздел 5). В гепатоцитах это приводит к активации фосфорилазы гликогена и к снижению активности гликогенсинтазы. В результате ускоряется мобилизация гликогена. Фосфорилирование пируваткиназы и БИФ вызывает торможение гликолиза и ускорение глюконеогенеза. Кроме того, глюкагон стимулирует глюконеогенез, индуцируя синтез ферментов: глюкозо-6-фосфатазы, фосфоенол-пируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы (см. раздел 7). В клетках жировой ткани глюкагон через аденилатциклазный каскад активирует гормончувствительную ТАГ-липазу и стимулирует липолиз (см. раздел 8). Таким образом, в противоположность инсулину глюкагон стимулирует мобилизацию основных энергоносителей - углеводов и жиров.
88 вопрос
Взаимосвязь обмена белков, жиров и углеводов. Концентрация основных метаболитов: пределы изменений в норме и при патологии. Пункты взаимосвязей метаболизма глюкозы и липидов, углеводов и аминокислот, аминокислот и липидов. Значение в этих процессах цикла трикарбоновых кислот, пентозофосфатного пути, глюконеогенеза.
Как известно, живой организм и условия его существования находятся в постоянной зависимости от условий окружающей среды. «Жизнь есть способ существования белковых тел, и этот способ существования состоит по своему существу в постоянном самообновлении химических составных частей этих тел». (Маркс К, Энгельс Ф. Соч. — 2-е изд., т. 20, с. 82.) Выше было указано, что обмен веществ в организме человека протекает не хаотично, а «тонко Настроен». Все превращения органических веществ, процессы анаболизма и катаболизма тесно связаны друг с другом. В частности, процессы синтеза и распада взаимосвязаны, координированы и регулируются нейрогуморальными механизмами, придающими химическим процессам нужное направление. В организме человека, как и в живой природе вообще, не существует самостоятельного обмена белков; жиров, углеводов и нуклеиновых кислот. Все они объединены в единый процесс метаболизма, подчиняющийся диалектическим закономерностям взаимозависимости и взаимообусловленности, допускающими также взаимопревращения между отдельными классами органических веществ. Однако, помимо взаимных переходов между разными классами веществ в организме, доказано существование более сложных форм связи. В частности, интенсивность, направление любой химической реакции определяются ферментами, т. е. белками, которые оказывают прямое влияние на обмен липидов, углеводов и нуклеиновых кислот. В свою очередь синтез любого фермента — белка — требует участия ДНК и почти всех трех типов рибонуклеиновых кислот — тРНК, мРНК и рРНК. Если к этому добавить влияние гормонов, продуктов распада какого-либо одного класса веществ (например, биогенных аминов) на обмен других классов органических веществ, то становятся понятными удивительная согласованность и координированность огромного разнообразия химических процессов, совершающихся в организме. Многие из этих процессов были освещены выше раздельно при описании обмена отдельных классов веществ; здесь же будут представлены вкратце примеры взаимных переходов отдельных структурных элементов белков, жиров, углеводов и нуклеиновых кислот после соответствующей химической перестройки. Основные пути взаимопревращения белков, жиров и углеводов схематически представлены ниже.
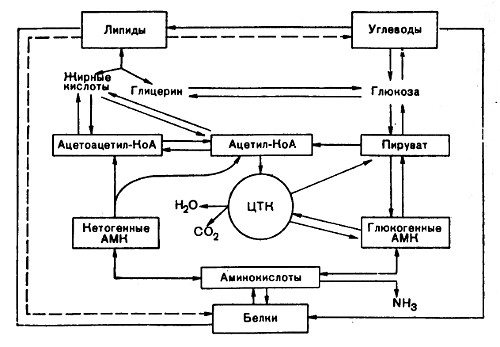 Помимо прямых переходов метаболитов этих классов веществ друг в друга, существует тесная энергетическая связь, когда энергетические потребности организма могут обеспечиваться окислением какого-либо одного класса органических веществ при недостаточном поступлении с пищей других. Существенность белков (в частности, ферментов, гормонов и др.) в обмене всех типов химических соединений слишком очевидна и не требует доказательств. Выше также было указано на важность белков и аминокислот для синтеза ряда специализированных соединений (пуриновых и пиримидиновых нуклеотидов, порфиринов, биогенных аминов и др.). Кетогенные аминокислоты, образующие в процессе обмена ацетоуксусную кислоту (ацетоацетил-КоА), могут непосредственно участвовать в синтезе жирных кислот и стеринов. Аналогично могут использоваться глюкогенные аминокислоты через ацётил-КоА, но после предварительного превращения в пировиноградную кислоту или другую кетокислоту, переходящую в пируват. Некоторые структурные компоненты специализированых липоидов, в частности фосфолипидов, имеют своим источником аминокислоты и их производные, например серии, этаноламин, сфингозин и холин. Необходимо подчеркнуть, что путь превращения углеродных скелетов кетогенных или глюкогенных аминокислот в жирные кислоты является необратимым процессом, хотя нельзя исключить возможность частичного синтеза глутамата и опосредованно других аминокислот из продуктов распада жирных кислот — ацетил-КоА, через цикл трикарбоновых кислот, включая α-кетоглутарат. В то же время из глицерина нейтральных жиров через пируват полностью осуществляется синтез глюкогенных аминокислот. Получены доказательства синтеза глюкозы из большинства аминокислот. В некоторых случаях (аланин, аспарагиновая и глутаминовая кислоты) эта связь является непосредственной, в других — она осуществляется через побочные каналы. Следует особо подчеркнуть, что три α-кетокислоты (пируват, оксалоацетат и кетоглутарат), образующиеся соответственно из аланина, аспартата и глутамата, не только служат исходным материалом для синтеза глюкозы, но и являются своеобразными катализаторами в превращении ацетильных остатков от всех классов пищевых веществ в цикле Кребса для образования энергии. Синтез незаменимых аминокислот из продуктов обмена углеводов и жиров в организме не происходит. Этим объясняется незаменимость белков для человека и животных. В то же время организм может нормально развиваться при одностороннем белковом питании, что также свидетельствует о возможности синтеза углеводов из белков. Процесс синтеза углеводов из аминокислот получил название глюконеогенеза, который доказан прямыми опытами в опытах на животных с экспериментальным диабетом, когда более 50% введенного белка превращается в глюкозу. Как известно, при диабете организм теряет способность утилизировать глюкозу и энергетические потребности покрываются за счет окисления аминокислот и жирных кислот. Доказано также, что исходными субстратами для глюконеогенеза являются те аминокислоты, распад которых сопровождается образованием прямо или опосредованно пировиноградной кислоты. Энергетическая ценность пищи оказывает определенное влияние на белковый обмен, контролируемый азотистым балансом. Так, если потребляемая энергия пищи находится ниже минимального уровня, то наблюдается увеличение экскреции азота, и, наоборот, при увеличении калорийности пищи экскреция азота с мочой снижается. Калорийность пищи, следовательно, является лимитирующим фактором в утилизации пищевых белков. Из приведенной выше схемы видно также, что имеются различные пути взаимопревращений жиров и углеводов. Практика откорма сельскохозяйственных животных давно подтвердила возможность синтеза жиров из углеводов лищи. С энергетической точки зрения превращение углеводов в жиры следует рассматривать как депонирование энергии, хотя синтез жира сопровождается затратой энергии, которая вновь освобождается при окислении жиров в организме. Глицерин, входящий в состав триглицеридов и фосфолипидов, может легко образоваться из промежуточных метаболитов гликолиза, в частности из 3-фосфоглицеринового альдегида. Следует, однако, подчеркнуть, что основным путем превращения углеводов в жиры является путь образования высших жирных кислот из ацетил-КоА, который образуется при окислительном декарбоксилировании пировиноградной кислоты. Поскольку эта последняя реакция является необратимой, образования углеводов из высших жирных кислот практически не происходит. Таким образом, синтез углеводов из жиров в принципе может происходить только из глицерина, хотя в обычных условиях реакция протекает в обратную сторону, т. е. в сторону синтеза жиров из глицерина, образующегося при окислении углеводов. Укажем также, что ацетил-КоА, образующийся в процессе обмена углеводов, жиров и ряда аминокислот, служит пусковым субстратом как для синтеза жирных кислот и холестерина (а следовательно, и липидов вообще), так и для цикла трикарбоновых кислот. Для окисления ацетил-КоА в этом цикле требуется щавелевоуксусная кислота, которая является вторым ключевым субстратом в цикле Кребса. Щавелевоуксусная кислота может синтезироваться из пировиноградной кислоты и СO2 благодаря реакции карбоксилирования или образоваться из аспарагиновой кислоты в процессе трансаминирования. Две молекулы ацетил-КоА, конденсируясь, образуют ацетоуксусную кислоту, которая является источником других ацетоновых тел в организме. Следует упомянуть также об использовании галактозы и частично глюкозы для биосинтеза цереброзидов и гликолипидов. Таким образом, преобладание распада одних питательных веществ и биосинтеза других прежде всего определяется физиологическим состоянием и потребностями организма в энергии и метаболитах. Этими факторами в значительной степени может быть объяснено существование постоянного динамического состояния химических составных компонентов организма как единого целого.
Помимо прямых переходов метаболитов этих классов веществ друг в друга, существует тесная энергетическая связь, когда энергетические потребности организма могут обеспечиваться окислением какого-либо одного класса органических веществ при недостаточном поступлении с пищей других. Существенность белков (в частности, ферментов, гормонов и др.) в обмене всех типов химических соединений слишком очевидна и не требует доказательств. Выше также было указано на важность белков и аминокислот для синтеза ряда специализированных соединений (пуриновых и пиримидиновых нуклеотидов, порфиринов, биогенных аминов и др.). Кетогенные аминокислоты, образующие в процессе обмена ацетоуксусную кислоту (ацетоацетил-КоА), могут непосредственно участвовать в синтезе жирных кислот и стеринов. Аналогично могут использоваться глюкогенные аминокислоты через ацётил-КоА, но после предварительного превращения в пировиноградную кислоту или другую кетокислоту, переходящую в пируват. Некоторые структурные компоненты специализированых липоидов, в частности фосфолипидов, имеют своим источником аминокислоты и их производные, например серии, этаноламин, сфингозин и холин. Необходимо подчеркнуть, что путь превращения углеродных скелетов кетогенных или глюкогенных аминокислот в жирные кислоты является необратимым процессом, хотя нельзя исключить возможность частичного синтеза глутамата и опосредованно других аминокислот из продуктов распада жирных кислот — ацетил-КоА, через цикл трикарбоновых кислот, включая α-кетоглутарат. В то же время из глицерина нейтральных жиров через пируват полностью осуществляется синтез глюкогенных аминокислот. Получены доказательства синтеза глюкозы из большинства аминокислот. В некоторых случаях (аланин, аспарагиновая и глутаминовая кислоты) эта связь является непосредственной, в других — она осуществляется через побочные каналы. Следует особо подчеркнуть, что три α-кетокислоты (пируват, оксалоацетат и кетоглутарат), образующиеся соответственно из аланина, аспартата и глутамата, не только служат исходным материалом для синтеза глюкозы, но и являются своеобразными катализаторами в превращении ацетильных остатков от всех классов пищевых веществ в цикле Кребса для образования энергии. Синтез незаменимых аминокислот из продуктов обмена углеводов и жиров в организме не происходит. Этим объясняется незаменимость белков для человека и животных. В то же время организм может нормально развиваться при одностороннем белковом питании, что также свидетельствует о возможности синтеза углеводов из белков. Процесс синтеза углеводов из аминокислот получил название глюконеогенеза, который доказан прямыми опытами в опытах на животных с экспериментальным диабетом, когда более 50% введенного белка превращается в глюкозу. Как известно, при диабете организм теряет способность утилизировать глюкозу и энергетические потребности покрываются за счет окисления аминокислот и жирных кислот. Доказано также, что исходными субстратами для глюконеогенеза являются те аминокислоты, распад которых сопровождается образованием прямо или опосредованно пировиноградной кислоты. Энергетическая ценность пищи оказывает определенное влияние на белковый обмен, контролируемый азотистым балансом. Так, если потребляемая энергия пищи находится ниже минимального уровня, то наблюдается увеличение экскреции азота, и, наоборот, при увеличении калорийности пищи экскреция азота с мочой снижается. Калорийность пищи, следовательно, является лимитирующим фактором в утилизации пищевых белков. Из приведенной выше схемы видно также, что имеются различные пути взаимопревращений жиров и углеводов. Практика откорма сельскохозяйственных животных давно подтвердила возможность синтеза жиров из углеводов лищи. С энергетической точки зрения превращение углеводов в жиры следует рассматривать как депонирование энергии, хотя синтез жира сопровождается затратой энергии, которая вновь освобождается при окислении жиров в организме. Глицерин, входящий в состав триглицеридов и фосфолипидов, может легко образоваться из промежуточных метаболитов гликолиза, в частности из 3-фосфоглицеринового альдегида. Следует, однако, подчеркнуть, что основным путем превращения углеводов в жиры является путь образования высших жирных кислот из ацетил-КоА, который образуется при окислительном декарбоксилировании пировиноградной кислоты. Поскольку эта последняя реакция является необратимой, образования углеводов из высших жирных кислот практически не происходит. Таким образом, синтез углеводов из жиров в принципе может происходить только из глицерина, хотя в обычных условиях реакция протекает в обратную сторону, т. е. в сторону синтеза жиров из глицерина, образующегося при окислении углеводов. Укажем также, что ацетил-КоА, образующийся в процессе обмена углеводов, жиров и ряда аминокислот, служит пусковым субстратом как для синтеза жирных кислот и холестерина (а следовательно, и липидов вообще), так и для цикла трикарбоновых кислот. Для окисления ацетил-КоА в этом цикле требуется щавелевоуксусная кислота, которая является вторым ключевым субстратом в цикле Кребса. Щавелевоуксусная кислота может синтезироваться из пировиноградной кислоты и СO2 благодаря реакции карбоксилирования или образоваться из аспарагиновой кислоты в процессе трансаминирования. Две молекулы ацетил-КоА, конденсируясь, образуют ацетоуксусную кислоту, которая является источником других ацетоновых тел в организме. Следует упомянуть также об использовании галактозы и частично глюкозы для биосинтеза цереброзидов и гликолипидов. Таким образом, преобладание распада одних питательных веществ и биосинтеза других прежде всего определяется физиологическим состоянием и потребностями организма в энергии и метаболитах. Этими факторами в значительной степени может быть объяснено существование постоянного динамического состояния химических составных компонентов организма как единого целого. 89 вопрос
Сахарный диабет. Типы, причины возникновения и основные проявления. Нарушения метаболизма при сахарном диабете, обмена углеводов, липидов, аминокислот. Механизмы возникновения кетонемии, кетонурии, гиперхолестеринемии, гипергликемии и других нарушений при сахарном диабете. Гликозилированные белки. Их значение при возникновении ангиопатии, сахарные кривые в диагностике диабета. Особенности сахарного диабета в детском возрасте.
Основные клинические формы сахарного диабета
Согласно данным Всемирной организации здравоохранения, сахарный диабет классифицируют с учётом различия генетических факторов и клинического течения на две основные формы: диабет I типа - инсулинзависимый (ИЗСД), и диабет II типа - инсулиннезависимый (ИНСД).
1. Инсулинзависимый сахарный диабет
Инсулинзависимый сахарный диабет - заболевание, вызываемое разрушением р-клеток островков Лангерханса поджелудочной железы.
Деструкция β-клеток - результат аутоиммунных реакций. В аутоиммунной реакции принимают участие лимфоциты и макрофаги (моноциты). Эти клетки продуцируют цитокины, которые либо непосредственно повреждают β-клетки, либо опосредуют клеточные реакции против β-клеток.
Провоцировать возникновение диабета I типа может вирусная инфекция, вызывающая деструкцию b-клеток. К таким вирусам, называемым β-цитотропными, относят вирусы оспы, краснухи, кори, цитомегаловирус, эпидемического паротита, Коксаки, аденовирус. Некоторые р-цитотропные вирусы вызывают лизис β-клеток.
Известны некоторые токсические вещества, например, такие как производные нитрозомочевины и другие нитро- или аминосодержащие соединения, избирательно поражающие β-клетки и индуцирующие аутоиммунную реакцию. Кроме того, ИЗСД может быть результатом частичного генетически обусловленного дефекта системы иммунологического надзора и сочетаться с другими аутоиммунными заболеваниями.
Инсулинонезависимый сахарный диабет
Инсулинонезависимый сахарный диабет - общее название нескольких заболеваний, развивающихся в результате относительного дефицита инсулина, возникающего вследствие нарушения секреции инсулина, нарушения превращения проинсулина в инсулин, повышения скорости катаболизма инсулина, а также повреждения механизмов передачи инсулинового сигнала в клетки-мишени (например, дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала и др.). ИНСД поражает людей, как правило, старше 40 лет. Сахарный диабет II типа характеризуется высокой частотой семейных форм. Риск ИНСД у ближайших родственников больного достигает 50%, тогда как при ИЗСД он не превышает 10%. Заболевание поражает преимущественно жителей развитых стран, особенно горожан.
Возможными причинами ИНСД могут быть: образование антител к рецепторам инсулина; генетический дефект пострецепторного аппарата инсулинзависимых тканей; нарушения регуляции секреции инсулина. К факторам, определяющим развитие и клиническое течение болезни, относят ожирение, неправильный режим питания, малоподвижный образ жизни, стресс.
Мутации генов, контролирующих секрецию инсулина, энергетический обмен в β-клетках и обмен глюкозы в клетках-мишенях инсулина, приводят к возникновению нескольких форм ИНСД с аутосомно-доминантным наследованием.
Основным провоцирующим фактором инсулинонезависимого диабета служит ожирение.
Этот тип диабета часто сочетается с гиперинсулинемией, что способствует ожирению. Таким образом, ожирение, с одной стороны, важнейший фактор риска, а с другой - одно из ранних проявлений сахарного диабета.
Изменения метаболизма при сазарном диабете
При сахарном диабете, как правило, соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния.
Симптомы сахарного диабета
Для всех форм диабета характерно повышение концентрации глюкозы в крови -гипергликемия.После приёма пищи концентрация глюкозы может достигать 300-500 мг/дл и сохраняется на высоком уровне в постабсорбтивном периоде, т.е. снижается толерантность к глюкозе. Снижение толерантности к глюкозе наблюдают в случаях скрытой (латентной) формы сахарного диабета. В этих случаях у людей отсутствуют жалобы и клинические симптомы, характерные для сахарного диабета, а концентрация глюкозы в крови натощак соответствует норме. Однако использование провокационных проб (например, сахарной нагрузки) выявляет снижение толерантности к глюкозе.
Повышение концентрации глюкозы в плазме крови обусловлено снижением скорости использования глюкозы тканями вследствие недостатка инсулина или снижения биологического действия инсулина в тканях-мишенях.
При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани и мышц). В мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров. Кроме того, при снижении инсулинглюкагонового индекса активируется глюконеогенез из аминокислот, глицерола и лактата. Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия). В норме проксимальные канальцы почек реабсорбируют всю фильтрующуюся в клубочках глюкозу, если её уровень не превышает 8,9 ммоль/л (160 мг/дл).
К характерным признакам сахарного диабета относят также повышение концентрации в крови кетоновых тел - кетонемия.При низком соотношении инсулин/глюкагон жиры не депонируются, а ускоряется их катаболизм, так как гормончувствительная липаза в жировой ткани находится в фосфорилированной активной форме. Концентрация неэтерифицирован-ных жирных кислот в крови повышается. Печень захватывает жирные кислоты, окисляет их до ацетил-КоА, который, в свою очередь, превращается в β-гидроксимасляную и ацетоуксусную кислоты. В тканях ацетоацетат частично декарбоксилируется до ацетона, запах которого исходит от больных сахарным диабетом и ощущается даже на расстоянии. Увеличение концентрации кетоновых тел в крови (выше 20 мг/дл, иногда до 100 мг/дл) приводит к кетонурии. Накопление кетоновых тел снижает буферную ёмкость крови и вызывает ацидоз.
Ещё один характерный признак сахарного диабета - повышенный уровень в крови ли-попротеинов (в основном, ЛПОНП) - гипер-липопротеинемия. Пищевые жиры не депонируются в жировой ткани вследствие ослабления процессов запасания, а поступают в печень, где частично превращаются в триацилглицеролы, которые транспортируются из печени в составе ЛПОНП.
При сахарном диабете дефицит инсулина приводит к снижению скорости синтеза белков в организме и усилению распада белков. Это вызывает повышение концентрации аминокислот в крови. Аминокислоты поступают в печень и дезаминируются. Безазотистые остатки гликогенных аминокислот включаются в глюконеогенез, что ещё более усиливает гипергликемию. Образующийся при этом аммиак вступает в орнитиновый цикл, что приводит к увеличению концентрации мочевины в крови и, соответственно, в моче - азотемия и азотурия.
Высокие концентрации глюкозы, кетоновых тел, мочевины требуют усиленной экскреции их из организма. Поскольку концентрационная способность почек ограничена, резко увеличивается выделение большого количества воды, в результате чего может наступить обезвоживание организма. Выделение мочи у больных возрастает в несколько раз и в некоторых случаях достигает 8-9 л в сутки, но чаще не превышает 3-4 л - полиурия.Потеря воды вызывает постоянную жажду - полидипсия.
Одним из основных механизмов повреждения тканей при сахарном диабете являетсягликозилирование белков, приводящее к изменению их конформации и функций. Некоторые белки в норме содержат углеводные компоненты, причём образование таких гликопротеинов протекает ферментативно (например, образование гликопротеиновых гормонов аденогипофиза). Однако в организме человека может происходить и неферментативное взаимодействие глюкозы со свободными аминогруппами белков - неферментативное гликозилирование белков. В тканях здоровых людей эта реакция протекает медленно. При гипергликемии процесс гликозилирования ускоряется. Степень гликозилирования белков зависит от скорости их обновления. В медленно обменивающихся белках накапливается больше изменений. К одним из первых признаков сахарного диабета относят увеличение в 2-3 раза количества гликозилированного гемоглобина (норма НbА1С 5,8-7,2%). Другим примером медленно обменивающихся белков служат кристаллины - белки хрусталика. При гликозилировании кристаллины образуют многомолекулярные агрегаты, увеличивающие преломляющую способность хрусталика. Прозрачность хрусталика уменьшается, возникает его помутнение, или катаракта.
Особенности у детей
Из всех эндокринных заболеваний сахарный диабет у детей является наиболее частым. Это заболевание обусловлено пан креатической и внепанкреатической недостаточностью инсулина и характеризуется расстройством всех видов обмена веществ, прежде всего углеводного и жирового.Болеют дети всех возрастов, но максимум заболеваний при ходится на детей дошкольного, препубертатного и пубертатного возрастов.Этиология сахарного диабета до сих пор полностью не выяс нена. Возникновение сахарного диабета у детей наблюдается чаще всего после инфекционных заболеваний (эпидемический паротит, ветряная оспа, корь, грипп, скарлатина, ангина и др.). Психическая травма, как острая, так и длительно действующая, физическая травма, особенно ушибы головы и области живота, неправильное питание с избытком углеводов и жиров—все эти факторы в большинстве случаев способствуют выявлению скры то существующей недостаточности поджелудочной железы.В настоящее время имеется много данных о том, что наслед ственные факторы играют весьма существенную роль в этиоло гии сахарного диабета. Считают, что в островковом аппарате поджелудочной железы имеется первичный, наследственно обус ловленный дефект синтеза, накопления и выделения инсулина. Наблюдения показывают, что нередко у больных сахарным диа бетом матерей рождаются вполне здоровые дети и часто более крупные, чем в норме. Многие дети хорошо прибавляют в массе тела на 1—2-м году жизни, но затем у них развивается сахар ный диабет.Клиника. Начало заболевания может быть медленным, незаметным, а иногда очень бурным, внезапным, с быстрым раз витием большинства симптомов; как правило, этих детей до ставляют в клинику машиной скорой помощи с различными диагнозами. Первыми признаками заболевания являются повы шенная жажда, сухость во рту, частое обильное мочеиспуска ние, ночное и даже дневное недержание мочи. Позднее появ ляются похудание при хорошем, иногда даже повышенном аппе тите, общая слабость, головные боли, быстрая утомляемость. Зуд кожных покровов и другие кожные проявления (пиодермия, фурункулез, экземы) у таких детей бывают сравнительно редко.Изменения в различных органах и системах при сахарном диабете у детей многообразны.Со стороны органов пищеварения могут наблюдаться сле дующие изменения: язык сухой, ярко-красного цвета, часто со сглаженными сосочками, гингивит, прогрессирующий кариес зу бов. Печень у большинства длительно болеющих детей увели чена, плотна, иногда болезненна. У некоторых детей отмечают ся диспепсические расстройства. Тоны сердца глуховаты, иногда на верхушке определяется систолический шум, пульс мягкий, лабильный, артериальное давление понижено. На электрокар диограмме выявляются признаки изменения миокарда.Со стороны нервной системы, помимо головных болей и быстрой утомляемости, могут наблюдаться раздражительность, эмотивность, вялость, ухудшение памяти. Нарушения со стороны периферической нервной системы проявляются болями, главным образом в нижних конечностях, ослаблением или угасанием су хожильных рефлексов. Со стороны органов зрения у детей от мечается нарушение аккомодации, изменение рефракции (бли зорукость или дальнозоркость), гипотония глазных яблок, развиваются диабетическая катаракта и диабетический ре тинит.
90 вопрос
Водно-солевой обмен. Содержание, распределение, биологическая роль и баланс воды. Распределение основных электролитов во внутриклеточном и внеклеточном пространствах. Гипергидратация и дегидратация тканей. Полиурия при сахарном и несахарном диабете.
Водно-солевой обмен — совокупность процессов поступления воды и солей в организм, распределения их во внутренней среде и выведения. Системы регуляции водно-солевого обмена обеспечивают постоянство суммарной концентрации растворенных частиц, ионного состава и кислотно-щелочного равновесия, а также объема и качественного состава жидкостей организма. Организм человека состоит в среднем на 65% из воды (от 60 до 70% от веса тела), которая находится в трех жидкостных фазах — внутриклеточной, внеклеточной и трансцеллюлярной. Наибольшее количество воды (40—45%) находится внутри клеток. Внеклеточная жидкость включает (в процентах от веса тела) плазму крови (5%), межклеточную жидкость (16%) и лимфу (2%). Трансцеллюлярная жидкость (1 — 3%) изолирована от сосудов слоем эпителия и по своему составу близка к внеклеточной. Это — спинномозговая и внутриглазная жидкости, а также жидкости брюшной полости, плевры, перикарда, суставных сумок и желудочно-кишечного тракта. Водный и электролитный балансы у человека рассчитываются по суточному потреблению и выделению воды и электролитов из организма. Вода поступает в организм в виде питья — примерно 1,2 л и с пищей — примерно 1 л. Около 0,3 л воды образуется в процессе обмена веществ (из 100 г жиров, 100 г углеводов и 100 г белков образуется 107, 55 и 41 мл воды соответственно). Суточная потребность взрослого человека в электролитах составляет примерно: натрий — 215, калий — 75, кальций — 60, магний — 35, хлор — 215, фосфат — 105 мг-экв (миллиграмм-эквивалент) в день. Эти вещества всасываются в желудочно-кишечном тракте и поступают в кровь. Временно они могут депонироваться в печени. Избыток воды и электролитов выводится почками, легкими, кишечником и кожей. В среднем за сутки выделение воды с мочой составляет 1,0— 1,4 л, с калом — 0,2 л, кожей и с потом — 0,5 л, легкими — 0,4 л. Вода, поступившая в организм, распределяется между различными жидкостными фазами в зависимости от концентрации в них осмотически активных веществ. Направление движения воды зависит от осмотического градиента и определяется состоянием цитоплазматической мембраны. На распределение воды между клеткой и межклеточной жидкостью оказывает влияние не общее осмотическое давление внеклеточной жидкости, а ее эффективное осмотическое давление, которое определяется концентрацией в жидкости веществ, плохо проходящих через клеточную мембрану. Осмотическое давление крови поддерживается на постоянном уровне — 7,6 атмосфер. Поскольку осмотическое давление определяется концентрацией осмотически активных веществ (осмолярная концентрация), которую измеряют криометрическим методом, то осмолярную концентрацию выражают в мосм/л или Δ °; для сыворотки крови человека это около 300 мосм/л (или 0,553°). Осмолярная концентрация межклеточной, внутриклеточной и трансцеллюлярной жидкостей обычно такая же, как и плазмы крови; выделения ряда желез (например, пот, слюна) гипотоничны. Моча млекопитающих и птиц, секрет солевых желез птиц и рептилий гипертоничны относительно плазмы крови. У человека и животных одной из важнейших констант является рН крови, поддерживаемый на уровне около 7,36. В крови имеется ряд буферных систем — бикарбонатная, фосфатная, белки плазмы, а также гемоглобин, — поддерживающих рН крови на постоянном уровне. Но в основном рН плазмы крови зависит от парциального давления углекислого газа и концентрации НСО–3. Отдельные органы и ткани животных и человека существенно различаются по содержанию воды и электролитов (таблицы 1, 2). Важнейшее значение для деятельности клеток всех органов и систем имеет поддержание ионной асимметрии между внутриклеточной и внеклеточной жидкостью. В крови и других внеклеточных жидкостях высока концентрация ионов натрия, хлора, бикарбоната; в клетках главными электролитами являются калий, магний, органические фосфаты (табл. 2). Различия электролитного состава плазмы крови и межклеточной жидкости обусловлены низкой проницаемостью для белков капиллярной стенки. В соответствии с правилом Доннана внутри сосуда, где находится белок, концентрация катионов выше, чем в межклеточной жидкости, где относительно выше концентрация анионов, способных к диффузии. Для ионов натрия и калия фактор Доннана составляет 0,95, для одновалентных анионов 1,05. Гипергидратация (гипергидрия, водное отравление) — избыточное содержание воды в организме или отдельных его частях. Является формой нарушения водно-солевого обмена.Клинически у больных появляются отёки на лице, ногах, развивается асцит, отёк легких и мозга.Вода в организме человека содержится как в клетке, так и во внеклеточном секторе (внутрисосудистая, интерстициальная и трансцеллюлярная его часть), на долю которого приходится 30 % ее общего количества.При почечной недостаточности гипергидратация связана прежде всего с нарушением состава и объема внеклеточного сектора жидкости. В свою очередь, это влияет и на внутриклеточный сектор, изменяя тканевой метаболизм в сторону катаболических процессов с распадом белков, жиров и углеводов.Дегидратация организмаНедостаточное поступление и образование воды или чрезмерно большое ее выделение приводят к уменьшению водных пространств, главным образом, интерстициального сектора, что носит название дегидратация. Это сопровождается сгущением крови, ухудшением ее реологических свойств и нарушением гемодинамики.Недостаток в организме воды в объеме 20% массы тела ведет к летальному ис ходу.
