Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
91 вопросРенин-ангиотензин-альдостероновая система в регуляции водно-солевого обмена. Главным механизмом регуляции синтеза и секреции альдостерона служит система ренинангиотензин. Ренин - протеолитический фермент, продуцируемый юкстагломерулярными клетками, расположенными вдоль конечной части афферентных (приносящих) артериол, входящих в почечные клубочки (рис. 11-34). Юкстагломерулярные клетки особенно чувствительны к снижению перфузионного давления в почках. Уменьшение АД (кровотечение, потеря жидкости, снижение концентрации NaCl) сопровождается падением перфузионного давления в приносящих артериолах клубочка и соответствующей стимуляцией высвобождения ренина. Субстратом для ренина служит ангиотензиноген. Ангиотензиноген - α2-глобулин, содержащий более чем 400 аминокислотных остатков. Образование ангиотензиногена происходит в печени и стимулируется глюкокортикоидами и эстрогенами. Ренин гидролизует пептидную связь в молекуле ангиотензиногена и отщепляет N-концевой декапептид (ангиотензин I), не имеющий биологической активности. Под действием карбоксидипептидилпептидазы, или антиотензин-превращающего фермента (АПФ), выявленного в эндотелиальных клетках, лёгких и плазме крови, с С-конца ангиотензина I удаляются 2 аминокислоты и образуется октапептид - ангиотензин II. Ангиотензин II, связываясь со специфическими рецепторами, локализованными на поверхности клеток клубочковой зоны коры надпочечников 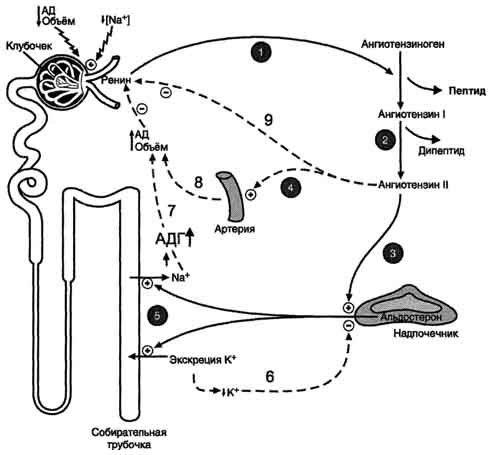 Рис. 11-34. Система ренинангиотензинальдостерон. Ренин, протеолитический фермент, .и ГМК, вызывает изменение внутриклеточной концентрации диацилглицерола и инозитолтрифосфата. Инозитолтрифосфат стимулирует высвобождение из ЭР ионов кальция, совместно с которым активирует протеинкиназу С, опосредуя тем самым специфический биологический ответ клетки на действие ангиотензина П. При участии аминопептидаз ангиотензин II превращается в ангиотензин III - гептапептид, проявляющий активность ангиотензина II. Однако концентрация гептапептида в плазме крови в 4 раза меньше концентрации октапептида, и поэтому большинство эффектов являются результатом действия ангиотензина П. Дальнейшее расщепление ангиотензина II и ангиотензина III протекает при участии специфических протеаз (ангиотензиназ). Ангиотензин II оказывает стимулирующее действие на продукцию и секрецию альдостерона клетками клубочковой зоны коры надпочечников, который, в свою очередь, вызывает задержку ионов натрия и воды, в результате чего объём жидкости в организме восстанавливается. Кроме этого, ангиотензин II, присутствуя в крови в высоких концентрациях, оказывает мощное сосудосуживающее действие и тем самым повышает АД. 92 вопросПредсердный натрийуретический фактор, его роль в регуляции осмотического и артериального давления. Предсердный натриуретический фактор (ПНФ) Это пептид, содержащий 28 аминокислот с единственным диеульфидным мостиком. ПНФ синтезируется, главным образом, в кардиомио-цитах предсердий, и хранится в виде препро-гормона, состоящего из 126 аминокислотных остатков. Основным фактором, регулирующим секрецию предсердного натрийуретического фактора, является увеличение АД. Другие стимулы секреции - увеличение осмолярности плазмы, повышение частоты сердцебиений, повышенный уровень катехоламинов и глюкокортикоидов в крови. Основные клетки-мишени ПНФ - почки, периферические артерии. В почках ПНФ стимулирует расширение приносящих артериол, усиление почечного кровотока, увеличение скорости фильтрации и экскреции ионов натрия. В периферических артериях ПНФ снижает тонус гладких мышц и соответственно расширяет артериолы (рис. 11-36). Таким образом, суммарным действием ПНФ является увеличение экскреции Na+ и понижение АД. 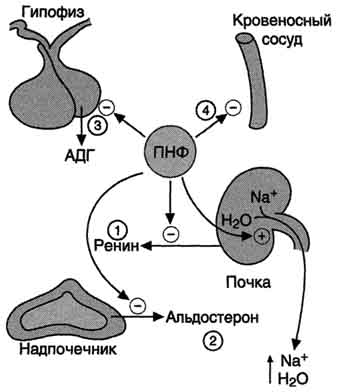 Рис. 11-36. Биологическое действие ПНФ. 1 - ингибирует выделение ренина; 2 - ингибирует секрецию альдостерона; 3 - ингибирует секрецию АДГ; 4 - вызывает релаксацию сосудов. Механизмпередачи сигнала ПНФ не включает актвивацию G-белка. Рецептор ПНФ имеет доменное строение: домен связывания с лигандом, локализованный во внеклеточном пространстве, и один домен, пронизывающий мембрану и обладающий активностью гуанилатциклазы. В отсутствие ПНФ его рецептор находится в фосфорилированном состоянии и неактивен. Связывание ПНФ с рецептором вызывает кон-формационные изменения и возрастание гуанилатциклазной активности рецептора. В результате ГТФ превращается в циклический ГМФ (цГМФ), который активирует протеинкиназу G (см. раздел 5). ПНФ обычно рассматривают как физиологический антагонист ангиотензина II, поскольку под его влиянием возникают не сужение просвета сосудов и задержка натрия, а, наоборот, расширение сосудов и увеличение почечной экскреции соли. 93 вопрос Вазопрессин и альдостерон: строение и функции. Несахарный диабет. Гипер- и гипоальдостеронизм. Антидиуретический гормон (АДГ), или вазопрессин - пептид с молекулярной массой около 1100 Д, содержащий 9 аминокислот, соединённых одним дисульфидным мостиком. 1. Синтез и секреция антидиуретического гормона АДГ синтезируется в нейронах гипоталамуса в виде предшественника препрогормона, который поступает в аппарат Гольджи и превращается в прогормон. В составе нейросекреторных гранул прогормон переносится в нервные окончания задней доли гипофиза (нейрогипофиз). Во время транспорта гранул происходит процессинг прогормона, в результате чего он расщепляется на зрелый гормон и транспортный белок - нейрофизин. Гранулы, содержащие зрелый антидиуретический гормон и нейрофизин, хранятся в терминальных расширениях аксонов в задней доле гипофиза, из которых секретируются в кровоток при соответствующей стимуляции. Стимулом, вызывающим секрецию АДГ, служит повышение концентрации ионов натрия и увеличение осмотического давления внеклеточной жидкости. При недостаточном потреблении воды, сильном потоотделении или после приёма большого количества соли осморецепторы гипоталамуса, чувствительные к колебаниям осмолярности, регистрируют повышение осмотического давления крови. Возникают нервные импульсы, которые передаются в заднюю долю гипофиза и вызывают высвобождение АДГ. Секреция АДГ происходит также в ответ на сигналы от барорецепторов предсердий. Изменение осмолярности всего на 1% приводит к заметным изменениям секреции АДГ. 2. Механизм действия Для АДГ существуют 2 типа рецепторов: V1 и V2. Рецепторы V2, опосредующие главный физиологический эффект гормона, обнаружены на базолатеральной мембране клеток собирательных трубочек и дистальных канальцев - наиболее важных клеток-мишеней для АДГ, которые относительно непроницаемы для молекул воды. В отсутствие АДГ моча не концентрируется и может выделяться в количествах, превышающих 20 л в сутки (норма 1,0-1,5 л в сутки). Связывание АДГ с V2 (рис. 11-32) стимулирует аденилатциклазную систему и активацию протеинкиназы А. В свою очередь, протеинкиназа А фосфорилирует белки, стимулирующие экспрессию гена мембранного белка - аквапорина-2. Аквапорин-2 перемещается к апикальной мембране собирательных канальцев и встраивается в неё, образуя водные каналы. Это обеспечивает избирательную проницаемость мембраны клеток для воды, которые свободно диффундируют в клетки почечных канальцев и затем поступают в интерстициальное пространство. Поскольку в результате происходит реабсорбция воды из почечных канальцев и экскреция малого объёма высококонцентрированной мочи (антидиурез), гормон называют антидиуретическим гормоном. Рецепторы типа V1 локализованы в мембранах ГМК сосудов. Взаимодействие АДГ с рецептором V1 приводит к активации фосфолипазы С, которая гидролизует фосфатидилинозитол-4,5-бисфосфат с образованием инозитолтрифосфата и диацилглицерола. Инозитолтрифосфат вызывает высвобождение Са2+ из ЭР. Результатом действия гормона через рецепторы V1 является сокращение гладкомышечного слоя сосудов. Сосудосуживающий эффект АДГ проявляется при высоких концентрациях гормона. Поскольку сродство АДГ к рецептору V2 выше, чем к рецептору V1, при физиологической концентрации гормона в основном проявляется его антидиуретическое действие. 3. Несахарный диабет Дефицит АДГ, вызванный дисфункцией задней доли гипофиза, а также нарушениями в системе передачи гормонального сигнала, приводит к развитию несахарного диабета. При этом происходит нерегулируемая экскреция воды, а наиболее опасным последствием является дегидратация организма. Под названием "несахарный диабет" объединяют заболевания с разной этиологией. Так, основными причинами центрального несахарного диабета могут быть генетические дефекты синтеза препро-АДГ в гипоталамусе, дефекты процессинга и транспорта проАДГ (наследственная форма), а также повреждения гипоталамуса или нейрогипофиза (например, в результате черепно-мозговой травмы, опухоли, ишемии). Нефрогенный несахарный диабет возникает вследствие мутации гена рецептора АДГ типа V2 (наследственная форма), следствием которого является неспособность почек реагировать на гормон. Основное проявление несахарного диабета - гипотоническая полиурия, т.е. выделение большого количества мочи низкой плотности. Снижение секреции АДГ приводит также к усиленному потреблению воды. Диагностические критерии несахарного диабета: выраженная полиурия (до 20 л в сутки, плотность мочи <1,010, в норме - 1,020). Альдостерон - наиболее активный минера-локортикостероид, синтезирующийся в коре надпочечников из холестерола. Синтез и секрецияальдостерона клетками клубочковой зоны непосредственно стимулируются низкой концентрацией Na+ и высокой концентрацией К+ в плазме крови. На секрецию альдостерона влияют также простагландины, АКТГ. Однако наиболее важное влияние на секрецию альдостерона оказывает ренинангиотензиновая система. Альдостерон не имеет специфических транспортных белков, но за счёт слабых взаимодействий может образовывать комплексы с альбумином. Гормон очень быстро захватывается печенью, где превращается в тетрагидроальдостерон-3-глюкуронид и экскретируется с мочой. 1. Механизм действия альдостерона В клетках-мишенях гормон взаимодействует с рецепторами, которые могут быть локализованы как в ядре, так и в цитозоле клетки. Образовавшийся комплекс гормон-рецептор взаимодействует с определённым участком ДНК и изменяет скорость транскрипции специфических генов. Результат действия альдостерона - индукция синтеза: а) белков-транспортёров Na+ из просвета канальца в эпителиальную клетку почечного канальца; б) Nа+,К+,-АТФ-азы, обеспечивающей удаление ионов натрия из клетки почечного канальца в межклеточное пространство и переносящей ионы калия из межклеточного пространства в клетку почечного канальца; в) белков-транспортёров ионов калия из клеток почечного канальца в первичную мочу; г) митохондриальных ферментов ЦТК, в частности цитратсинтазы, стимулирующих образование молекул АТФ, необходимых для активного транспорта ионов (рис. 11-33). Суммарным биологическим эффектом индуцируемых альдостероном белков является увеличение реабсорбции ионов натрия в канальцах нефронов, что вызывает задержку NaCl в организме, и возрастание экскреции калия. Гиперальдостеронтм Гиперальдостеронизм - заболевание, вызванное гиперсекрецией альдостерона надпочечниками. Причиной первичного гиперальдостеронизма (синдром Кона) примерно у 80% больных является аденома надпочечников, в остальных случаях - диффузная гипертрофия клеток клубочковой зоны, вырабатывающих альдостерон. При первичном гиперальдостеронизме избыток альдостерона усиливает реабсорбцию натрия в почечных канальцах. Увеличение концентрации Na+ в плазме служит стимулом к секреции АДГ и задержке воды почками. Кроме того, усиливается выведение ионов калия, магния и протонов. В результате развиваются гипернатриемия, вызывающая, в частности, гипертонию, гипер-волемию и отёки, а также гипокалиемия, ведущая к мышечной слабости, возникают дефицит магния и лёгкий метаболический алкалоз. Вторичный гиперальдостеронизмвстречается гораздо чаще, чем первичный, и может быть связан с рядом состояний (например, сердечная недостаточность, хронические заболевания почек, а также сопровождающиеся нарушением кровоснабжения опухоли, секретирующие ренин). При вторичном гиперальдостеронизме у больных наблюдают повышенный уровень ренина и ангиотензина II, что стимулирует кору надпочечников продуцировать и секретировать избыточное количество альдостерона. Клинические симптомы менее выражены, чем при первичном альдостеронизе. Одновременное определение концентрации альдостерона и активности ренина в плазме позволяет окончательно дифференцировать первичный (активность ренина в плазме снижена) и вторичный (активность ренина в плазме повышена) гиперальдостеронизм. 94 вопрос Физические свойства и состав нормальной мочи: азотсодержащие, безазотистые органические и неорганические вещества.Патологические компоненты мочи. Клинико-диагностическое определение компонентов мочи. Физические свойства мочи Моча является водным раствором электролитов и органических веществ. Основной компонент мочи - вода (от 92 до 99%), в которой растворено порядка тысячи компонентов, многие из них до настоящего времени полностью не охарактеризованы. Около 50-70 г сухих веществ ежедневно удаляется из организма с мочой, большую их часть составляют мочевина и хлористый натрий. Состав мочи значительно варьирует даже у здоровых людей. Этот факт осложняет анализ мочи и заставляет быть осторожным при интерпретации полученных результатов. Суточный объем мочи и концентрация в ней тех или иных компонентов зависят от интенсивности гломерулярной фильтрации, степени канальцевой реабсорбции и экскреции. На 97 % моча человека состоит из воды. Содержит азотистые продукты распада белковых веществ: мочевину, мочевую и гиппуровую кислоты, креатинин, ксантин, уробилин, индикан, а также соли — преимущественно хлориды, сульфаты и фосфаты Органические компоненты
Неорганические компоненты
Патологические компоненты мочи Широко используемое понятие «патологические компоненты мочи» в известной мере условно, так как большинство соединений, рассматриваемых как патологические компоненты мочи, хотя и в небольшом количестве, но всегда присутствуют в нормальной моче. Иными словами, речь идет о веществах, которые в нормальной моче не встречаются в аналитически определяемых количествах. Это прежде всего белки, глюкоза, ацетоновые (кетоновые) тела, желчные и кровяные пигменты. Белок. В нормальной моче человека содержится минимальное количество белка, присутствие которого не может быть доказано обыкновенными качественными пробами на наличие белка. При ряде заболеваний, особенно при болезнях почек, содержание белка в моче может резко возрасти (протеинурия). Источником белка мочи являются белки сыворотки крови, а также в какой-то степени белки почечной ткани.Протеинурии делятся на две большие группы: почечные и внепочечные. При почечных протеинуриях белки (в основном белки плазмы крови) попадают в мочу вследствие органического повреждения нефрона, увеличения размеров пор почечного фильтра, а также в результате замедления тока крови в клубочках. Внепочечные протеинурии обусловлены поражением мочевых путей или предстательной железы.Часто употребляемое в клинической практике название «альбуминурия» (при обнаружении в моче белка) неправильно, так как с мочой выделяются не только альбумины, но и глобулины. Например, при нефрозах общее содержание белка в моче может достигать 26 г/л, при этом концентрация альбуминов 12 г/л, аглобулинов – 14 г/л. В моче человека можно обнаружить активность ряда ферментов: липазы, рибонуклеазы, ЛДГ, аминотрансфераз, урокиназы, фосфатаз, α-амила-зы, лейцинаминопептидазы и др. Основные трудности при определении активности ферментов мочи, кроме α-амилазы и некоторых других, заключаются в необходимости сгущения (концентрирования) мочи и предотвращении ингибирования ферментов в процессе этого сгущения. Кровь. В моче кровь может быть обнаружена либо в форме красных кровяных клеток (гематурия), либо в виде растворенного кровяного пигмента (гемоглобинурия). Гематурии бывают почечные и внепочеч-ные. Почечная гематурия – основной симптом острого нефрита. Внепочеч-ная гематурия наблюдается при воспалительных процессах или травмах мочевых путей. Гемоглобинурии обычно связаны с гемолизом и гемоглоби-немией. Принято считать, что гемоглобин появляется в моче после того, как содержание его в плазме превысит 1 г на 1 л. Гематурию диагностируют, как правило, с помощью цитологического исследования (исследование осадка мочи под микроскопом), а гемоглобинурию – химическим путем. Глюкоза. Нормальная моча человека содержит минимальные количества глюкозы, которые не обнаруживаются обычными качественными пробами. При патологических состояниях содержание глюкозы в моче увеличивается (глюкозурия). Например, при сахарном диабете количество глюкозы, выделяемое с мочой, может достигать нескольких десятков граммов в сутки.Иногда в моче обнаруживают и другие углеводы, в частности фруктозу, галактозу, пентозу. Фруктозурия наблюдается при врожденной недостаточности ферментов, превращающих фруктозу в глюкозу; встречаются также и врожденная пентозурия, и врожденная галактозурия. Кетоновые (ацетоновые) тела. В нормальной моче эти соединения встречаются лишь в самых ничтожных количествах (не более 0,01 г в сутки). Они не обнаруживаются обычными качественными пробами (нитропруссидные пробы Легаля, Ланге и др.). При выделении больших количеств кетоновых тел качественные пробы становятся положительными. Это явление патологическое и называется кетонурией. Например, при сахарном диабете ежедневно может выделяться до 150 г кетоновых тел.С мочой никогда не выделяется ацетон без ацетоуксусной кислоты, и наоборот. Обычные нитропруссидные пробы позволяют определить не только присутствие ацетона, но также и ацетоуксусной кислоты; β-оксимас-ляная кислота появляется в моче лишь при сильном увеличении количества кетоновых тел (сахарный диабет и др.).Кетоновые тела выделяются с мочой не только при сахарном диабете, но и при голодании, исключении углеводов из пищи. Кетонурия наблюдается при заболеваниях, связанных с усиленным расходом углеводов: например, при тиреотоксикозе, кровоизлияниях в подпаутинные пространства, черепно-мозговых травмах. В раннем детском возрасте (продолжительные заболевания пищеварительного тракта (дизентерия, токсикозы) могут вызвать кетонемию и кетонурию в результате голода и истощения. Кетонурия нередко наблюдается при инфекционных заболеваниях: скарлатине, гриппе, туберкулезе, менингите. В этих случаях кетонурия не имеет диагностического значения и является вторичной. Билирубин. В норме моча содержит минимальное количество билирубина, которое не может быть обнаружено обычными качественными пробами. Повышенное выделение билирубина, при котором обычные качественные пробы на наличие билирубина в моче становятся положительными, называется билирубинурией. Она встречается при закупорке желчного протока и заболевании паренхимы печени.Выделение билирубина в мочу особенно сильно выражено при обтура-ционных желтухах. При застое желчи переполненные желчью канальцы травмируются и пропускают билирубин в кровяные капилляры. Если поражена паренхима печени, билирубин проникает в кровь через разрушенные печеночные клетки. Билирубинурия проявляется при уровне прямого билирубина в крови выше 3,4 мкмоль/л. Непрямой билирубин не может пройти через почечный фильтр. Это становится возможным при значительных поражениях почек. Уробилин. В моче уробилин, точнее стеркобилин, присутствует всегда в незначительном количестве. Концентрация его резко возрастает при гемолитической и печеночной желтухах. Это связано с потерей печенью способности задерживать и разрушать мезобилиноген (уробилиноген), всосавшийся из кишечника. Напротив, отсутствие в моче уробилиногена при наличии желчных пигментов (билирубина) указывает на прекращение поступления желчи в кишечник вследствие закупорки желчного протока (см. главу 16). Порфирины. В норме моча содержит лишь очень малые количества порфиринов I типа (до 300 мкг в суточном количестве). Однако выделение порфиринов может резко возрасти (в 10–12 раз) при заболеваниях печени и пернициозной анемии. При врожденной порфирии имеет место сверхпродукция порфиринов I типа (уропорфирина I и копропорфирина I). В этих случаях в суточном количестве мочи обнаруживается до 10 мг смеси этих порфиринов. При острой порфирии отмечается экскреция с мочой повышенных количеств уропорфирина III, копропорфирина III, а также порфобилиногена. Определение компонентов мочи с помощью диагностических полосок Проведение анализа. 1. Из патрона вынимают полоску, не касаясь зон индикации 2. Полоску опускают в исследуемую мочу на 1-2 с так, чтобы все зоны были смочены. Капли мочи с полоски удаляют, проведя полоской по краю пробирки. Полоску оставляют в горизонтальном положении. 3. Приблизительно через 60 с сравнивают окраску зон индикации с соответствующей цветной шкалой для компонентов мочи на наружной поверхности патрона и находят соответствующее по окраске пятно. Записывают содержание компонентов мочи. Определение рН мочи:тест основан на изменении цвета смешанного кислотно-основного индикатора с переходом от оранжевой окраски через жёлтую, зелёную до синей в диапазоне рН. Значение рН можно определить с точностью до 0,5 единицы рН. Клинико-диагностическое значение: рН мочи зависит от характера диеты и колеблется в пределах 5,0-7,0 в норме. При сахарном диабете, голодании, лихорадочных состояниях рН сдвигается в кислую сторону, а при воспалении мочевыводящих путей, сильной рвоте – в щелочную. Определение белка в моче тест основан на изменении цвета кислотно-основного индикатора под влиянием белков. Проба наиболее чувствительна к альбумину, значительно менее чувствительна к глобулинам, мукопротеинам, гемоглобину. Определение глюкозы в моче определение глюкозы основано на ферментативной (глюкозооксидаза/пероксидаза) реакции. Тест типичен для глюкозы, другие сахара не взаимодействуют. Определение уробилиногена и билирубина в моче.тест основан на реакции азосочетания со стабилизированным реактивом (триазен). Определение кетоновых тел в моче. :тест основан на нитропруссидной реакции. Проба значительно чвствительнее к ацетоуксусной кислоте, чем к ацетону. С-гидроксимасляной кислотой проба не реагирует. Определение крови в моче тест основан на способности гемоглобина катализировать окисление индикатора о-толуидина органическим гидропероксидом, содержащимся в зоне индикации. 95 вопрос Белки крови. Отдельные белковые фракции, разделение методом электрофореза, характеристика. Небелковые компоненты крови. Возрастная динамика белковых фракций. Эмбриоспецифические белки, их диагностическое значение. Остаточный азот, динамика уровня остаточного азота в постнатальный период. БЕЛКИ ПЛАЗМЫ КРОВИ В плазме крови содержится 7% всех белков организма при концентрации 60 - 80 г/л. Белки плазмы крови выполняют множество функций. Одна из них заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле. Их концентрация колеблется в пределах 5,5 – 8,5 г /100 мл. Выделяют следующие фракции: преальбумины, альбумины, a1 -, a2- , b-, g- глобулины и фибриноген. Соотношение количества белков этих фракций имеет важное диагностическое значение. 1) Преальбумины выполняют транспортную функцию. Переносят тироксин и ретинол. Содержание этого белка снижается при циррозе и хроническом гепатите печени, когда нарушается ее белоксинтезирующая активность. 2) Альбумины – наиболее гомогенная фракция белков крови. Основная функция – связывание воды, что обеспечивает коллоидно-осмотическое (онкотическое) давление в крови. Альбумины транспортируют ионы магния, кальция, билирубин, свободные ЖК, стероидные гормоны, такие лекарственные соединения как антибиотики, барбитураты, сердечные гликозиды. Снижение содержание альбуминов наблюдается при повышении проницаемости сосудов клубочка нефрона (нефротический синдром) и заболеваниях печени. 3) a1-глобулины. К этой фракции относятся два белка: Антитрипсин – ингибитор таких протеиназ как трипсина, химотрипсина, плазмина. Его содержание повышается при воспалительных заболеваниях и механических повреждениях тканей. Гликопротеин содержит в составе около 40 % углеводов. Транспортирует стероиды. Повышается его содержание при воспалительных процессах, снижается при циррозе печени. 4) a2-глобулины содержат следующие белки: Макроглобулин – цинксодержащий гликопротеин с большой молекулярной массой. Ингибирует протеолитические ферменты, как и антитрипсин. Содержание его увеличивается при циррозе, нефротическом синдроме, сахарном диабете и не изменяется при воспалении. Гаптоглобин связывает и транспортирует свободный гемоглобин А. Содержание снижается при поражениях паренхимы печени, гемолитической анемии. Увеличивается при воспалении и сахарном диабете. Церулоплазмин – медьсодержащий белок. Окисляет двухвалентное железо в трехвалентное. 3) b-глобулины представлены двумя белками: Трансферрин участвует в транспорте трехвалентного железа. Гемопексин переносит свободный гем, порфирин. Связывает гемсодержащие белки и переносит их в печень для разрушения. 4) g-глобулины. В этой фракции представлены антитела. Эти белки обладают двоякой специфичностью: по отношению к данному виду животного и к белку-антигену, вызвавшему образование антител. Они состоят из двух цепей тяжелой и легкой, соединенных между собой дисульфидными связями. Небелковые компоненты плазмыПоскольку основная функция крови транспортная, то в ней обнаруживаются многие компоненты белкового, углеводного, липидного и минерального обменов. В качестве компонентов белкового обмена в крови содержатся аминокислоты, мочевина, креатин и креатинин, мочевая кислота. К компонентам углеводного обмена относятся: глюкоза, фруктоза, галактоза, молочная кислота, пировиноградная кислота, альфа-оксимаслянная кислота, гликопротеины и сиаловые кислоты. Компоненты липидного обмена: фосфолипиды, нейтральные липиды, неэтерифицированные ЖК, холестерин и его эфиры, липопротеиды низкой плотности и ЛВП. Основными неорганическими компонентами плазмы крови являются: анионы бикарбонатов, хлоридов, фосфатов, сульфатов, катионы кальция, магния, калия, натрия, железа, меди. Отдельные белковые фракции Вообще в крови содержится до 100 различных белковых компонентов (белковых фракций крови). С помощью электрофореза на бумаге выделяют 5 белковых фракций, в агаровом геле — 7—8, в крахмальном геле — 16—18, методом иммуноэлектрофореза — около 30 фракций Обычно методом электрофореза выделяют 5-6 стандартных белковых фракций: 1 - альбумины (альбумины не делят на фракции) и 4-5 фракций глобулинов (альфа1-, альфа2-, бета- и гамма-глобулины, иногда отдельно выделяют фракции бета-1 и бета-2 глобулинов). Глобулиновые фракции более разнородны. Существует ряд методов, позволяющих оценить физиологическое состояние человека по характерным показателям сыворотки крови. Одним из них является метод хемилюминесцентного анализа, основанный на регистрации естественного свечения биологических жидкостей, который находит все большее применение для диагностики различных патологий, сопровождающихся усилением свободнорадикального окисления (СРО).Согласно свободнорадикальной теории старения, в организме с возрастом происходит нарушение баланса СРО и антиоксидантной активности, что может приводить к патологиям и ускорению процессов старения. Исследовали возрастные изменения белкового состава и хемилюминесценции (ХЛ) сыворотки крови здоровых доноров в возрасте 18-64 года. Результаты исследований показали, что с возрастом у людей происходит перераспределение содержания отдельных белковых фракций в сыворотке крови, тогда как показатели ХЛ возрастают у доноров старших возрастных групп по сравнению с более молодыми (20-30 лет). Кроме того, обнаружена высокая вариабельность показателей ХЛ в сыворотке крови людей различного возраста, которая у старших доноров (после 30 лет) значительно выше по сравнению с соответствующими величинами молодых. В наибольшей степени варьируют показатели ХЛ в сыворотке крови людей в возрасте 31-40 лет, разброс которых в 2-4 раза превышает соответствующие величины других возрастных групп. Для этой же группы характерен самый высокий коэффициент вариации (44.1) по сравнению с другими возрастными группами, где этот параметр составил 27.3 у людей 20-30 лет, 23.5 у 41-50-летних и 30.7 у доноров свыше 50-ти лет. У людей старших возрастных групп была выявлена тенденция уменьшения уровня сывороточного альбумина по сравнению с более молодыми, что может быть обусловлено общим снижением обмена веществ с возрастом и преобладанием катаболических реакций над анаболическими процессами. Полученные данные подтверждают результаты анализа показателей ХЛ. В этом случае можно отметить тенденцию усиления ХЛ в сыворотке крови доноров старших возрастных групп, что свидетельствует об увеличении уровня свободных радикалов в сыворотке крови, характерное для процессов старения. Показатели вариации как концентрации белка в сыворотке крови, так и величины ХЛ варьируют значительно сильнее у людей старшего возраста. Это может быть обусловлено индивидуальными особенностями физиологического состояния организма, образом жизни и питания, а также наличием различных патологий и действием неблагоприятных факторов окружающей среды, что необходимо учитывать при диагностике разных заболеваний. Таким образом, метод ХЛ является достаточно чувствительным для определения физиологического состояния человека, его возрастных изменений и действия различных физических, химических, биологических факторов. В связи с этим он может быть успешно использован в диагностике для выявления ранних патологий, сопровождающихся усилением свободнорадикальных процессов, и для мониторинга статуса больных при проведении различных лечебных мероприятий. Остаточный азот Под остаточным азотом понимают тот небелковый азот, который определяется в надосадочной жидкости, получаемой после осаждения белков сыворотки (плазмы) крови трихлоруксусной, фосфорномолибденовой или фосфорновольфрамовой (вольфрамовой) кислотами. При использовании других осадителей белка происходит неполная преципитация полипептидов, что может исказить результат исследования. В сущности, понятие «небелковый азот» немного объемнее, чем понятие «остаточный азот», поэтому их нельзя отождествлять. Фракция остаточного азота включает: азот мочевины (46-60% всего остаточного азота), азот аминокислот (25%), креатина (5%), креатинина (2,5 – 7,5%), мочевой кислоты (4%) и других продуктов белкового обмена (за исключением азота гетероциклических структур). Разность между всем остаточным азотом и азотом мочевины представляет собой так называемый резидуальный азот. Основная фракция резидуального азота – свободные аминокислоты. Эмбриоспецифические белки, т.е. белки, характерные только для плода и в норме не синтезирующиеся в организме матери, сохраняют большое диагностическое значение. К таким белкам в первую очередь следует отнести альфафетопротеин (АФП), ацетилхолинэстеразу, белки микроворсинок кишечника плода и стероидные гормоны. 96 вопрос Дыхательная функция крови: механизм переноса кислорода и углекислого газа. Гемоглобин, структурная характеристика. Формы и производные гемоглобина. Гемоглобин плода, его физиологическое значение. Механизм образования оксигемоглобина. Роль кооперативных взаимодействий. 2,3-дифосфоглицерат в регуляции сродства гемоглобина к кислороду. Эффект К. Бора и его роль в кислород-транспортной функции гемоглобина. Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и углекислого газа от тканей к легким. Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функция гемоглобина как переносчика кислорода основана на способности обратимо связывать кислород. Поэтому в легочных капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где парциальное давлениекислорода резко снижено, осуществляется отдача кислорода тканям. В состоянии покоя ткани и органы человека потребляют около 200 мл кислорода в минуту. При тяжелой физической работе количество потребляемого тканями кислорода возрастает в 10 раз и более (до 2–3 л/мин). Доставка от легких к тканям такого количества кислорода в виде газа, физически растворенного в плазме, невозможна вследствие малойрастворимости кислорода в воде и плазме крови. Итак, функцию переносчика кислорода в организме выполняет гемоглобин. Строение гемоглобина Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком - контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка. Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по двецепи двухразных типов. Гем соединяется с белковой субъединицей, во-первых, через остаток гистидинакоординационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащий протомер. Нормальные формы гемоглобина Существует несколько нормальных вариантов гемоглобина:
Механизм образования оксигемоглобина. При взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина кислород присоединяется к одной из половинок молекулы гемоглобина (допустим, к α-цепи этой половинки). Как только такое присоединение произойдет, α-полипептидная цепь претерпевает конформа-ционные изменения, которые передаются на тесно связанную с ней β-цепь; последняя также подвергается конформационным сдвигам. β-Цепь присоединяет кислород, имея уже большее сродство к нему. Таким путем связывание одной молекулы кислорода благоприятствует связыванию второй молекулы (так называемое кооперативное взаимодействие). После насыщения кислородом одной половины молекулы гемоглобина возникает новое, внутреннее, напряженное состояние молекулы гемоглобина, которое вынуждает и вторую половину гемоглобина изменить конфор-мацию. Теперь еще две молекулы кислорода, по-видимому, по очереди связываются со второй половинкой молекулыгемоглобина, образуя оксигемоглобин. Роль 2,3-дифосфоглицерата 2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта. 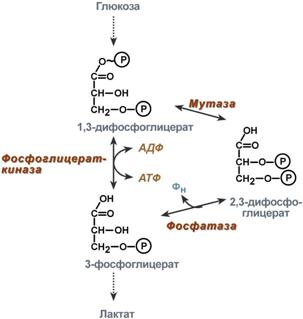 2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина. Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду. Это имеет особенное значение при подъеме на высоту, при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза. Изменение рН среды Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается. При повышенииконцентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. Влегких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина. Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид: Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород "вытесняет" ион водорода из связи с остатком гистидина гемоглобиновой молекулы. 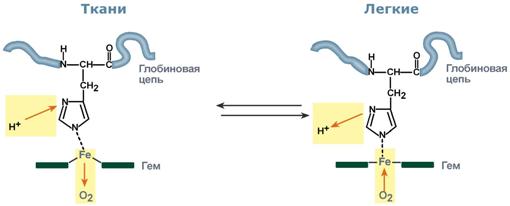 Механизм эффекта Бора 97 вопрос Патологические производные гемоглобина: карбоксигемоглобин, метгемоглобин, циангемоглобин. Принципы коррекции патологических состояний. Ферменты, участвующие в восстановлении иона железа (3+) в гемоглобине. Метгемоглобин. Метгемоглобин образуется при окислении гемоглобина и представляет собой комплекс гемина с нативным глобином. Известно, что метгемоглобин в небольших количествах имеется в крови даже в нормальных условиях. Его появление связано с тем, что при присоединении кислорода к гемоглобину небольшая часть кислорода не присоединяется к железу, а окисляет его. Таким образом, в процессе переноса кислорода все время происходит окисление гемоглобина. Образующийся метгемоглобин восстанавливается в гемоглобин с помощью восстановительных ферментативных систем эритроцита. Основным субстратом в этом процессе является глюкоза. В этом и заключается собственное дыхание эритроцитов, причем гемоглобин в данном случае выполняет функцию, которую в тканях осуществляют ферменты цитохромной системы. В результате постоянного образования и восстановления метгемоглобина устанавливается равновесие и в крови в каждый данный момент всегда имеются небольшие (0,5—1%) количества метгемоглобина. Метгемоглобин обладает способностью связывать токсические вещества типа сульфидов и цианидов. В процессе метаболизма постоянно вырабатываются небольшие количества таких токсических веществ, и «физиологический» метгемоглобин защищает такие важные участки организма, как, например, дыхательный центр, от проникновения туда токсических веществ, блокирующих цитохромоксидазу. В связи с этим свойством метгемоглобина при отравлении цианистыми соединениями в кровь в качестве терапевтического средства вводят метгемоглобинообразователи, например большие дозы метиленовой синьки. Он легко связывает CN- с образованием цианметгемоглобина и спасает организм от смертельного дейс Окись углерода обладает в 200 раз большим сродством к гемоглобину , чем кислород . Замена даже одной молекулы кислорода на окись углерода значительно усиливает связь остальных трех молекул кислорода с гемоглобином. Сдвиг кривой диссоциации карбоксигемоглобина влево нарушает доставку кислорода к тканям значительно сильнее, чем снижение насыщения крови кислородом. В противоположность метгемоглобину , карбоксигемоглобин имеет вишнево-красный цвет, и его присутствие нельзя определить по цвету крови твия цианидов. Карбоксигемоглобин. Хорошо известно, что даже при небольших концентрациях окись углерода (СО) вытесняет кислород из связи с гемоглобином, образуя карбоксигемоглобин, неспособный служить переносчиком кислорода. Повышение его содержания до 50% может быть смертельным HbS – гемоглобин серповидно-клеточной анемии. HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени. |
