Биотехнология. План реферата Введение Сохранение in vitro генофонда. Коллекции и банки Получение безвирусного посадочного материала Каллусогенез как основа создания клеточных
 Скачать 147.5 Kb. Скачать 147.5 Kb.
|
|
План реферата
2. Сохранение in vitro генофонда. Коллекции и банки 3. Получение безвирусного посадочного материала 4. Каллусогенез как основа создания клеточных культур 5. Длительно выращиваемые культуры 6. Культивирование отдельных клеток 7. Биотехнологии на основе изолированных протопластов 8. Обзор литературы Введение Клеточная биотехнология базируется на использовании культуры клеток, тканей и протопластов. Для того чтобы манипулировать клетками, нужно выделить их из растения и создать такие условия, при которых они могли бы жить и размножаться вне растительного организма. Метод культивирования изолированных клеток и тканей на искусственных питательных средах в стерильных условиях (in vitro) получил название культуры изолированных тканей и приобрел особое значение в связи с возможностью использования его в биотехнологии. Биотехнология известна с давних времен, но как самостоятельная прикладная наука сформировалась в середине 70-х годов нашего столетия, когда человечество осознало необходимость первоочередного решения на принципиально новых основах главнейших проблем современности — продовольственной, энергетической, ресурсной, загрязнения окружающей среды и др. Биотехнологические процессы базируются на использовании биосинтетического потенциала микроорганизмов, растительных и животных клеток, тканей и органов, культивируемых на искусственных питательных средах. В настоящее время во многих странах мира развитию биотехнологии придается первостепенное значение в силу ряда существенных преимуществ перед другими видами технологий: биотехнологические процессы обладают низкой энергоемкостью, почти безотходны, экологически чистые. Вместе с тем, эти технологии предусматривают использование стандартного оборудования и препаратов, а также проведение исследований круглый год, независимо от климатических условий, занимая при этом незначительные площади. Эти преимущества имеют непосредственное отношение к культуре клеток, тканей и органов растений. Роль культуры изолированных клеток и тканей в биотехнологии следует рассматривать в трех направлениях. Первое связано со способностью изолированных растительных клеток продуцировать ценные для медицины, парфюмерии, косметики и других отраслей промышленности вещества вторичного синтеза: алкалоиды, стероиды, гликозиды, гормоны, эфирные масла и др. Как правило, вторичные вещества получают из каллусной ткани, выращенной на твердой (агаризованной) или жидкой (суспензионная культура) питательной среде. На основе клеточных технологий получают такие медицинские препараты, как диосгенин из клеток диоскореи, аймолин из клеток раувольфии змеиной, тонизирующие вещества из клеток женьшеня, используемые в медицине и парфюмерии. Продуктивность культивируемых клеток в результате клеточной селекции может значительно превышать продуктивность целых растений. Преимуществом такого способа получения веществ вторичного синтеза является также возможность использовать для этой цели растения, не произрастающие в наших природных условиях, и получать продукцию круглый год. Второе направление — это использование культуры изолированных тканей для размножения и оздоровления посадочного материала от вирусов и других патогенов. Этот метод, названный клональным микроразмножением растений, позволяет получать от одной меристемы сотни тысяч растений в год. Третье направление — использование изолированных клеток в селекции растений, дающее возможность получать быстрорастущие растения, устойчивые к различным неблагоприятным факторам среды: засухе, засолению, низким и высоким температурам, фитопатогенам, тяжелым металлам и др. Вместе с тем, это направление предусматривает создание новых растений путем слияния изолированных протопластов и получения неполовых (соматических) гибридов. Перенос в изолированные протопласты чужеродных генов с помощью методов генной инженерии позволяет получать в дальнейшем растения с новыми наследуемыми свойствами. Культивирование изолированных пыльников и семяпочек на искусственных питательных средах дает возможность получать гаплоиды, культивирование зародышей — прием, позволяющий получать растения из невсхожих (с плохо развитым эндоспермом) гибридных семян. А оплодотворение в пробирке позволяет преодолеть нескрещиваемость некоторых растений. Успех в применении культуры клеток и тканей в первую очередь зависит от оптимизации физиологических процессов, обеспечивающих нормальное деление клеток, их дифференцировку и регенерацию из них взрослых растений. Наиболее сложной является регенерация растений из отдельных клеток. В первую очередь это касается злаковых растений. Поэтому важнейшее значение имеет выяснение механизма морфогенеза in vitro, регенерации и лежащих в их основе процессов. Метод культуры тканей, клеток и изолированных протопластов возник более 50 лет назад. Первые успехи были достигнуты в 1907-1913 гг. Харрисоном и Каррелом по культивированию животных тканей, благодаря выращиванию их на питательных средах природного происхождения, таких как плазма крови и зародышевая жидкость. Попытки по аналогии вырастить изолированные ткани растения на растительных экстрактах были неудачны. Одной из причин всех предшествующих неудач являлось использование в экспериментах мало подходящих для проявления ростовой активности тканей и клеток высших растений. В 1922 г. американский исследователь Роббинс и независимо от него немецкий ученый Котте показали возможность культивирования на синтетической питательной среде меристемы кончиков корня томатов и кукурузы В настоящее время известно более 150 видов растений, ткани которых удалось выращивать in vitro. Разработаны составы ряда питательных сред, что позволило получать длительные пересадочные культуры из разных органов и тканей растений. Среда Мурасиге и Скуга (MS) - наиболее универсальная и многоцелевая среда, пригодная для растительных клеток многих видов. Дает хорошие результаты при каллусообразовании большинства растений, хорошо поддерживает неорганизованный каллусный рост и вызывает индукцию морфогенеза у большинства двудольных видов. Среда Гамборга и Эвелега (среда Б5) дает хорошие результаты при культивировании клеток и тканей бобовых растений. Среда Уайта применяется для укоренения побегов и нормального роста стеблевой части после регенерации. Среда Нич, Китайские среды рекомендуются для индукции андрогенеза в культуре пыльников и для индукции морфогенеза у злаков. Среда Као и Михайлюка используется для культивирования единичных (или с малой плотностью высева) изолированных протопластов и клеток. Изучено значение макро- и микроэлементов для поддержания ростовой активности каллусной ткани. Выявлена потребность тканевых культур в витаминах и стимуляторах роста. Опытами Скуга и Миллера (1955) по изучению способности к делению и образованию каллуса клетками сердцевинной паренхимы стебля табака был открыт новый класс стимуляторов роста растений - цитокинины. Полученный в результате щелочного гидролиза ДНК животного происхождения кинетин (6-фурфуриламинопурин) оказался способным к комбинации с β-индолил-3-уксусной кислотой (ИУК) стимулировать деление клеток кусочка ткани сердцевинной паренхимы, лишенной проводящих пучков и камбия. Клетки ткани сердцевинной паренхимы, помещенной на питательную среду с ИУК, но без добавления этого нового стимулятора, не делились. В 1960 г. Кокингом был открыт метод получения изолированных протопластов из тканей корня и плодов томатов путем обработки их смесью пектоли-тических и целлюлитических ферментов, выделенных из культуральной жидкости грибов. В 1971 г. были найдены условия культивирования изолированных протопластов, при которых они образуют новую клеточную стенку, делятся и дают начало клеточным линиям, способным в ряде случаев к морфогенезу. Изолированные протопласты, еще, не образовавшие клеточную стенку, были использованы для разработки методов гибридизации соматических клеток путем слияния протопластов с помощью полиэтиленгликоля (ПЭГ) и введения в них вирусных РНК, клеточных органелл, клеток бактерий. Разработка методов электрослияния изолированных протопластов Зиммерманом в 1984 г. и разнообразных методов селекции гибридных клеток значительно облегчила гибридизацию соматических клеток растений. Сохранение in vitro генофонда. Коллекции и банки Технология сохранения в культуре in vitro генофонда, используемого в селекции, или в виде растущих коллекций (периодически субкультивируемых пробирочных растений, оздоровленных методом культуры меристем) или в виде клеточных и меристемных коллекций, хранящихся после глубокого замораживания в криобанках, в жидком азоте (температура - 196°С). Цель коллекций и банков - обеспечить селекционера в любое время генотипом, несущим искомые признаки, нужные для его работы. Растущие коллекции видов и сортов, применяют для сохранения генофонда не только растений, размножающихся вегетативно, но и размножаемых семенами. Последнее важно для поддержания маркированных изогенных линий, линий с ЦМС, гетерозисных гибридов, уникальных генотипов, свойства которых будут потеряны при половом размножении. Периодическое субкультивирование трудоемко и удорожает технологию. Период без пересадок (субклонирования) можно удлинить до 6-24 месяцев, поместив коллекции в условия низких положительных температур (1-10°С) при интенсивности освещения 4000-5000 лк. Выбор температуры определяется холодостойкостью вида растения. Так, для депонирования коллекций картофеля использовалась температура 10 °С, яблони – 1 °С. Рост растений можно также задержать добавлением к питательной среде осмотиков - маннита и сорбита, повышением концентрации сахарозы или внесением в питательную среду веществ, тормозящих рост. В качестве последних были использованы гидразид малеиновой кислоты, 2,2-метил-гидразид янтарной кислоты, абсцизовая кислота. В последнее время для замедления роста коллекций начали применять такие методы, как снижение атмосферного давления (до 0,04 мм рт. ст.) и гипоксия. Условия гипоксии создают, применяя смесь 90% азота и 10% кислорода. Иногда комбинируют эти два фактора, снижая концентрацию кислорода и одновременно уменьшая атмосферное давление. В результате рост растений хризантем по числу междоузлий снижался в 3 раза в сравнении с контролем за период выращивания 6 недель. Дополнительное достоинство сохранения генотипов в виде коллекций in vitro - возможность разместить на 1м2 площади в камере для культивирования более тысячи пробирок с растениями. Криосохранение генофонда растительного материала в жидком азоте - более совершенный метод, в сравнении с описанным выше. Он гарантирует стабильное сохранение генетических характеристик объектов практически в течение любого срока. Его можно применять для сохранения генофонда более широкого диапазона объектов - от изолированных протопластов до зародышей и семян Хорошо организованная работа криобанка менее трудоемка, чем поддержание и депонирование растущих коллекций. Метод позволяет сохранить без изменений мутантные, гибридные, трансформированные, способные к морфогенезу клетки разных видов растений, меристемы и кончики побегов, зиготические и соматические зародыши, пыльцу, семена, в том числе не выносящие обезвоживания. В настоящее время разработаны условия криосохранения более чем для 30 видов - с целью культивирования клеток, 10 видов - для каллусных культур, 8 видов - для изолированных протопластов, 13 видов - для сохранения меристем и кончиков стебля. Метод замораживания и хранения в жидком азоте меристем разработан для следующих растений: Arachis hypogea, Brassica napus, Cicer arietinum, Dianthus cariophyllus, Diqitalis lanata, Fragaria ananassa, Lycopersi-con esculentum, Mains domestica, Manihot esculenta, Pisum sativum, Solanum tuberosum, S.goniocalyx, S.chacoense. В криобанке Института физиологии растений РАН наиболее старая из хранящихся клеток культура моркови находится в жидком азоте уже более 10 лет. Наиболее проста техника Криосохранения пыльцы. Подсушенную пыльцу помещают в запечатанные пластмассовые ампулы, используемые при хранении, и прямо переносят в жидкий азот. Пыльца пяти испытанных сортов картофеля, размороженная после 1,2, и 3 лет хранения в жидком азоте, имела высокую жизнеспособность, фертильность и была эффективно использована в скрещиваниях. Криобанк пыльцы делает возможным скрещивание сортов, различающихся по времени цветения, характеризующихся кратковременностью фазы сохранения пыльцой фертильности или вариабельностью ее свойств под влиянием неблагоприятных условий. Значительно более сложна технология Криосохранения культивируемых клеток, изолированных меристем, кончиков побегов, зародышей. Трудности связаны с необходимостью защитить замораживаемые клетки и ткани от соматического стресса и механического разрушения культур в результате образования и роста кристаллов льда, а также обеспечить жизнеспособность их при оттаивании и рекультивации. Общие приемы технологии Криосохранения. Это применение криопротекторов и предобработка клеток перед замораживанием, соблюдение определенного режима замораживания в интервале от 0 до - 40 °С, специальные предосторожности при оттаивании и рекультивировании объектов. Криопротекторы - это вещества, которые на этапе замораживания должны уменьшить повреждения клеток от осмотического и механического стресса. Их отбирают по принципу наименьшей токсичности и оптимального эффекта. Это либо проникающие в клетки вещества - диметилсульфоксид (ДМСО) и глицерин, либо непроникающие высокомолекулярные - поливинил пиролидон, декстран, полиэтиленгликоль. Концентрацию и время действия оптимизируют эмпирически в зависимости от объекта. ДМСО - криопротектор, наиболее часто используемый в чистом виде или с добавлением других веществ, например, сахарозы, глицерина, применяют в концентрации 5-10%, глицерин в концентрации 10-20%. Помогает защитить клетки от стрессов замораживания также предобработка их осмотически активными веществами - маннитом, пролином и некоторым другими аминокислотами, добавленными к питательной среде. Большое значение для успеха Криосохранения имеет режим замораживания на этапе от 0 до - 40 0С, который может быть медленными, со скоростью 0,5-1°С в минуту ли сверхбыстрым (непосредственное погружение в жидкий азот объекта размером до 0,5 мм). Замораживание в медленном режиме дает более успешные результаты. Программные замораживатели разработаны и производятся в Институте криобиологии АН Украины. Оттаивание и восстановление часто является критическим этапом процесса. Криобанки предоставляют возможность селекционерам широко использовать пул генов сортов, в том числе старой селекции и диких видов. Можно сохранять без генетических изменений уникальные гибридные, мутантные и трансформированные линии. Криобанки могут сохранить пул генов исчезающих видов растений. Получение безвирусного посадочного материала Небольшой размер экспланта, применяемый для клонального микроразмножения, поверхностная стерилизация его, асептический перенос на питательную среду и субкультивирование в условиях, исключающих инфицирование, приводят к оздоровлению полученных растений от нематод, грибных и бактериальных патогенов. Этого недостаточно доя оздоровления созданного клональным микроразмножением посадочного материала от вирусов, вироидов, микоплазм. Но именно вирусные болезни - причина потери от 10 до 50% урожая сельскохозяйственных культур, размножающихся вегетативно. Выяснено, что соя и многие другие важные бобовые растения передают вирусы потомству и при семенном размножении, т.е. сорта постепенно отягощаются грузом вирусных инфекций. Недавно была открыта возможность борьбы с вирусами томатов и огурцов в защищенном грунте с помощью вакцинации растений непатогенными вирусными штаммами, мутантами исходных патогенных. Отечественные вакцинные штаммы S7 и V-69 защищают урожай многих сортов томатов, поражаемых ВТМ. Прибавка урожая для таких сортов составляет примерно 23%. Вакцинируемые поражаемые сорта томатов на 10-15% превышают по урожаю устойчивые к ВТМ гибриды, полученные селекционным путем. Особенно трудно перенести гены устойчивости к нескольким наиболее болезнетворным вирусам. С помощью генной инженерии созданы растения табака и томатов, устойчивые к ВТМ и вирусу мозаики люцерны. Но о практическом использовании таких трансгенных растений говорить рано. Необходимо изучение стабильности признака в онтогенезе и при передаче потомству. Пока же создание безвирусного посадочного материала картофеля, винограда, плодовых, ягодных и других растений остается актуальной задачей клеточной биотехнологии. Наиболее эффективен способ культивирования меристем стебля или органов стеблевого происхождения. Иногда этот метод культуры меристем дополняют термотерапией. Сейчас успешно выращивают растения из апикальной меристемы, состоящей из конуса нарастания и одного или двух листовых зачатков. Зона, свободная от вирусных частиц, - различна для разных вирусов. Это зависит от вида и сорта растения. Так, при вычленении под бинокулярным микроскопом апикальной меристемы картофеля величиной 0,2 мм (конус нарастания апекса с од ним листовым зачатком) среди полученных растений только 10% были свободны от Х-вируса, но 70% - от Y-вируса картофеля. Можно использовать предельно малый размер экспланта (0,075-0,1 мм) или сочетать термотерапию и культуру меристем. Предварительная термотерапия исходных растений позволяет получать оздоровление от вирусов при использовании меристемных эксплантов размером 0,3-0,8 мм. Однако применение термотерапии в ряде случаев приводит к отставанию в росте и деформации органов меристемных растений. Этот прием может также увеличить латентные вирусные инфекции. Для оздоровления меристемных растений была использована химиотерапия. Получены хорошие результаты при внесении в питательную среду, до которой культивируют меристемы, аналога гуанозина - 1 β-Д-рибофуранозил--1,2,4-триазол-карбоксимида. Этот препарат, получивший коммерческое название «вирозол» (синтетический рибавирин), добавленный к питательней среде в концентрации 40-200 мМ, увеличил процент безвирусных меристемных растений до 80-100 % при 0-41% в контроле. Использование иммуноферментной техники, особенно в ее микроварианте, применение моноклональных антител, метод молекулярной гибридизации меченых фрагментов РНК и ДНК вироидов и вирусов с вирусами тестируемого объекта, позволяющий просто и 6ыстро детектировать присутствие патогенов в I капельке экстракта из растения, - все- эти, методы удовлетворят требованию к специфичности и чувствительности.. При этом может возрасти стоимость тестирования и цена оздоровленного растения. Оздоровленные применением меристемной культуры растения размножают далее обычным методом клонального микроразмножения. Исключением является техника микропрививок, которую применяют для оздоровления цитрусовых растений, персика, иногда яблони. Для цитрусовых необходимость этой тех пики связана со слабым эффектом при использовании меристем маленького 1 размера. Более успешных результатов достигают при прививке меристемы лимонов и апельсинов размером 0,14-0,18 мм на пробирочные подвои, полученные 1 из семян. Можно получить 30-50% успешных прививок, 95% привитых растений сохраняется при высадке в почву. Развивающиеся побеги цитрусовых лишены ювенильных признаков, цветение и плодоношение их ускоряется. Из семи вирусов, распространенных у цитрусовых, для пяти оздоровление наблюдали на 1 уровне 100% привитых растений, для двух - на уровнях 80-98%. Каллусогенез как основа создания клеточных культур Важные для сельского хозяйства технологии in vitro разработаны с использованием объектов разной сложности организации, начиная с изолированных протопластов, и кончая изолированными завязями или зародышами. Однако культивируемые клетки играют при этом центральную роль, выступая либо не посредственным объектом генетических манипуляций, либо обязательным этапом создаваемых на основе других объектов технологий. Основным типом культивируемой растительной клетки является каллусная. Реже культивируют клетки опухолей растений разного происхождения. Культуры опухолевых клеток как при поверхностном, так и при глубинном выращивании, мало отличаются внешне от культур каллусных клеток, даже на уровне морфологии клеток. Значительным физиологическим различием между ними служит гормононезависимость опухолевых клеток, позволяющая им делиться и расти на питательных средах без добавок стимуляторов роста. Опухолевые клетки лишены также способности давать начало нормальным организованным структурам - корням или побегам в процессе органогенеза и эмбриоидам в процессе соматического эмбриогенеза. В некоторых случаях они образуют тератомы (уродливые органоподобные структуры), которые дальше не могут развиваться нормально. Каллусные клетки в пересадочной культуре могут спонтанно приобрести способность к росту на среде без стимуляторов роста. Природа такой независимости к одному или обоим стимуляторам (ауксину и цитокинину), обычно применяемым при получении и выращивании клеточных культур растений, может быть генетической (результат мутации) или эпигенетической (результат экспрессии генов, определяющих независимость клетки от экзогенных стимуляторов). При генетической независимости каллусные клетки ведут себя так же, как опухолевые, при эпигенетической они теряют признак зависимости в ряду превращений клетка—> растение—> клетка, что и является доказательством негенетической природы такой приобретенной независимости от присутствия в среде стимуляторов роста. Каллусная клетка, в результате деления которой возникает каллусная ткань или каллус, представляет собой один из типов клеточной дифференцировки, присущей высшему растению. Для растения каллус является тканью, возникающей в исключительных обстоятельствах (обычно при травмах) и функционирующей непродолжительное время. Эта ткань защищает место поранения, накапливает питательные вещества для регенерации анатомических структур или утраченного органа. Для получения культивируемых каллусных клеток фрагменты тканей разных органов высших растений (экспланты) помещают на искусственную питательную среду в пробирки, колбы, чашки Петри. Процесс получения первичного каллуса и поддержания пересадочной культуры требуют абсолютной асептики. Для этого с помощью различных стерилизующих растворов, содержащих чаще всего активный хлор или ртуть (гипохлориты, сулема, диацид), к которым для лучшего смачивания добавлены детергенты, стерилизуют экспланты. После инкубации в стерилизующем растворе материал промывают в трех порциях стерилизованной воды, по 10 минут в каждой. Прописи стерилизации разных объектов даны в таблице 1. Стерилизуют в автоклаве или фильтрованием через ультрафильтры питательную среду. В автоклаве при давлении 0,15 мм рт. ст. в течение 60 мин или сухим паром в шкафах при температуре 160°С стерилизуют посуду, инструменты, материалы, необходимые для работы. Манипуляции с культурами проводят в боксах микробиологического типа, облучаемых перед работой ультрафиолетом или в ламинар-боксах, где асептика достигается постоянной подачей стерильного воздуха в рабочий объем. Таблица 1 Стерилизация исходного растительного материала
Особенности дедифференцировки клеток экспланта и каллусогенеза зависят от эпигенетических характеристик составляющих его тканей. Клетки тканей запасающей паренхимы, корня и стебля, мезофилла листа и других специализированных тканей, эксплантированных в питательную среду, содержащие минеральные соли, источники углерода, витамины и стимуляторы роста, должны дедифференцироваться, т.е. потерять структуры, характерные для их специфических функций в растении, и вернуться к состоянию делящейся клетки. Часто эксплант используемый для получения каллуса, является фрагментом органа и включает ткани, клетки которых различно дифференцированы. Например, взятый целиком фрагмент стебля имеет в своем составе клетки эпидермальные, первичной коровой паренхимы, камбия и сосудистой системы, сердцевинной паренхимы. В разных условиях культивирования и в зависимости от различий в физиологическом состоянии исходного растения можно наблюдать преимущественную пролиферацию клеток либо камбия и его молодых дериватов, либо коры, либо сердцевинной паренхимы. Различное тканевое происхождение первичных каллусных клеток является одной из причин гетерогенности культуры каллусной ткани, т.к. некоторые функциональные особенности исходных дифференцированных клеток передаются в ряду клеточных поколений как стойкие, эпигенетически наследуемые признаки. В клетках экспланта в самом начале культивирования могут наблюдаться изменения в метаболизме, связанные с травматическими синтезами, с дедифференцировкой и подготовкой к процессу деления. Между этими процессами может существовать причинно-следственная связь, механизм которой точно не известен. Можно предположить, что травма приводит к высвобождению из клеток биологически активных веществ - индукторов или элиситоров клеточных делений, отличающихся по своей природе от стимуляторов роста растений (ауксинов, цитокининов, гиббереллинов). В роли элиситоров могут выступать продукты разрушения полисахаридов клеточной стенки. Их действием можно объяснить и быструю дедифференцировку специализированной клетки, приводящую к метаболизации веществ запаса, перестройке пластидного аппарата, увеличению структур, связанных с синтезом белков. В готовящейся к делению клетке стимулируется синтез всех форм РНК, начинается репликация ядерной ДНК, исчезают тканеспецифичные белки антигены и появляются белки, специфичные для делящихся клеток и для каллусной ткани. Эти наблюдения свидетельствуют об изменениях в активности генов и белкового аппарата клеток при дедифференцировке. Образование каллуса не во всех случаях связано с поверхностью экспланта. Каллус может образоваться в результате пролиферации внутренних тканей без связи с поверхностью среза. Развивающийся каллус разрывает слой ткани и обычно выходит на поверхность. Ярким примером образования каллуса, не связанного с травмой, служит каллусогенез, наблюдающийся в культуре изолированного пыльника. Каллусогенез при эксплантировании фрагмента ткани в условиях in vitro свойственен не только покрытосеменным, но и голосеменным растениям, папоротникам, мхам, печеночникам. Первичный каллус, образовавшийся на эксплантах, через 4-6 недель (в зависимости от темпов роста) переносится на свежую питательную среду (субкультивируется). Масса трансплантанта (переносимого кусочка) при культивировании на агаризованной питательной среде обычно колеблется от 60 до 100 мг ткани на 20-40 мл питательной среды. Техника культивирования тканей растений позволяет в настоящее время получить длительную пересадочную каллусную культуру из любых живых тканевых клеток интактного растения. Различно дифференцированные клетки (в том числе и меристематические) переходят in vitro к сложному процессу де дифференциации, теряют присущую им структурную организацию и специфические функции и индуцируются к делению, образуя первичный каллус. В процессе субкультивирования формируется штамм, характеризующийся индивидуальными генетическими и физиологическими особенностями. Длительно выращиваемые культуры Культура каллусных тканей выращивается поверхностным способом либо на полутвердой агаризованной среде (концентрация агар-агара 0,6-1,0 %) или среде с применением других желирующих полимеров, либо на мостиках из фильтровальной бумаги или на дисках из пенополиуретана, полупогруженных в жидкую питательную среду. Основные компоненты питательных сред для культуры тканей и клеток растений - минеральные соли (макро- и микроэлементы), источник углеродного питания (обычно сахароза или глюкоза), витамины, регуляторы роста. Иногда в состав питательных сред включают комплексные органические добавки. Это могут быть эндоспермы: кокосовых орехов в концентрации 7-20%, конского каштана - 5-15, а также березовый сок - 10-20, экстракты из органов вегетирующего растения - 0,1-1, томатный сок - 5-10. Солодовый экстракт - 5-10, дрожжевой экстракт - 0,1-0,2, гидролизат казеина - 0,02-0.1%, смесь аминокислот, дрожжевой экстракт, экстракты из разных органов растений. Начиная работать с новым объектом, авторы модифицируют состав стандартных сред, особенно часто изменяя концентрацию и набор органических компонентов. Оптимизацию состава среды целесообразно проводить с применением методов математического планирования эксперимента. Каллусная ткань, выращиваемая поверхностным Способом, представляет собой аморфную массу тонкостенных паренхимных клеток, не имеющую строго определенной анатомической структуры. Цвет массы каллусной ткани может быть белым, желтоватым, зеленым, красноватым, бурым, пигментированным полностью или зонально присутствием хлорофилла и антоцианов. В зависимости от происхождения и условий выращивания каллусные ткани бывают: 1) рыхлыми, сильно обводненными, легко распадающимися на отдельные клетки; 2) средней плотности, с хорошо выраженными меристематическими очагами; 3) плотными, с зонами редуцированного камбия и сосудов (в основном, трахеидоподобных элементов). Обычно, в длительной пересадочной культуре на средах, включающих ауксины, особенно синтетический аналог ауксина - 2,4-дихлорфеноксиуксусную кислоту (2,4-Д), каллусные ткани теряют пигментацию и становятся более рыхлыми. В цикле выращивания каллусные клетки после ряда делений проходят обычный для клетки растения онтогенез, они приступают к росту растяжением, затем дифференцируются как зрелые каллусные клетки и, наконец, деградируют. Н 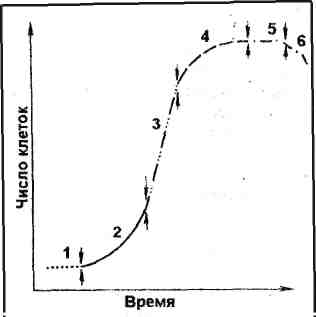 а рисунке 1 представлен ростовой цикл популяции культивируемых клеток при поверхностном и глубинном периодическом выращивании. Субкультивирование рекомендуется проводить, используя трансплант или инокулюм из фаз замедления роста или ранней стационарной предыдущего цикла выращивания. а рисунке 1 представлен ростовой цикл популяции культивируемых клеток при поверхностном и глубинном периодическом выращивании. Субкультивирование рекомендуется проводить, используя трансплант или инокулюм из фаз замедления роста или ранней стационарной предыдущего цикла выращивания.Критериями роста в цикле выращивания служит увеличение числа клеток, их сырой и сухой массы. Ростовая кривая (модельная) имеет S-образную форму. На ней различают (рис. 1) латентную (лаг) фазу, в которой видимый рост инокулюма не наблюдается ни по одному из критериев (1); экспоненциальную фазу, характеризующуюся ростом с ускорением (2); линейную, в которой скорость роста постоянна (3); фазу замедленного роста (4), стационарную фазу (5) и фазу деградации клеток (6). Форма реальных ростовых кривых может значительно отличаться продолжительностью фаз от модельной. Это зависит как от генетической характеристики популяции (вида растения), так и от количества инокулюма и условий выращивания. Деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Синтез вторичных продуктов возрастает в фазе замедленного роста клеточной популяции и достигает максимума в стационарной фазе. Исключение составляет фаза биосинтеза некоторых алкалоидов, которая совпадает по времени с фазой максимальной митотической активности или экспоненциальным ростом Чаще механизм и условия, блокирующие клеточную пролиферацию и активный рост, являются одновременно механизмами активации ферментов вторичного метаболизма. Неспецифические стрессовые условия, воздействующие на клетки в конце экспоненциальной фазы, могут стимулировать переход к синтезу вторичных продуктов и увеличить их выход. Каллусные ткани, выращиваемые поверхностным способом, часто применяют для сохранения в растущем состоянии коллекций разных штаммов, линий мутантов, из них получают суспензии клеток, растущих в жидкой питательной среде. Как правило, для регенерации растений предпочитают также каллусные ткани. Культуры клеток растений, выращиваемые в жидкой питательной среде, обычно называют суспензионными культурами. Отдельные клетки, небольшие группы или достаточно крупные агрегаты (более 50 клеток) выращивают во взвешенном состоянии в жидкой среде. Применяют различные аппараты и способы поддержания их в таком состоянии. Начальный момент получения суспензионной клеточной культуры является событием рандомическим. Это означает, что только клетки, которые по ряду причин способны к перестройке метаболизма, и делятся с высоким коэффициентом в данных кон-Рис. 7. Модельная кривая роста в конкретных условиях суспензионного цикле периодического выращивания культивирования, образуют «хорошие линии». Оптимальные характеристики таких линий: высокая степень дезагрегации (5-10 клеток в группе), морфологическая выравненность клеток (небольшие размеры, сферическая или слегка овальная форма, плотная цитоплазма), отсутствие трахеидоподобных элементов. Обычным способом получения клеточной суспензии является перенос каллусной ткани в жидкую питательную среду в колбу, которая затем помещается на качалку, или в специальные сосудики, перемешивание суспензии в которых производится с помощью роллеров разного типа. Инициация суспензионной культуры требует 2-3 г свежей массы каллусной ткани на 60-100 мл жидкой питательной среды. Скорость перемешивания для получения первичной суспензии на круговой качалке - 100-120 об/мин. Суспензионную культуру можно получить и прямо из фрагмента органа растения диски запасающей паренхимы мясистых корней моркови, петрушки, клубней картофеля и др., однако такой путь более трудный и длительный. Клетки экспланта должны образовать первичный каллус, и только после этого поверхностные каллусные клетки, попавшие в жидкую среду и размножившиеся в ней, дадут начало линии, способной расти в суспензии. Рыхлые обводненные культуры каллусных тканей более пригодны для перевода в суспензию, чем структурированные, плотные каллусы. Выращивание каллусов на среде с 2,4-Д, исключение из среды ионов Са++ ,обработка пектиназой транспланта, предназначенного для выращивания в суспензионной культуре, увеличивает шансы на успех. Первичную суспензию перед субкультивированием фильтруют через 1-2 слоя марли, нейлоновые или металлические сита, чтобы избавиться от крупных, плотных кусков каллусной ткани (или остатков экспланта) и очень крупных агрегатов. Генетическая изменчивость клеток как следствие их культивирования вне организма, исчезновение одних и появление других стойких эпигенетических изменений, передающихся в. ряду клеточных поколений, адаптивный отбор, идущий в популяциях, приводят к возникновению из первичной каллусной ткани генетически и фенотипически различающихся линий клеток. Получение суспензии, обогащенной отдельными клетками и их небольшими группами, облегчает выделение линий, маркированных но определенным признакам, а также отбор мутантов и вариантов на селективных средах. Культивирование отдельных клеток Источниками отдельных (одиночных) клеток являются клеточные суспензии, растущие в жидкой питательной среде, мацерация тканей растений (например, мезофилла листа), изолированные протопласты после восстановления ими клеточной стенки. Культивирование отдельных клеток позволяет получать клоны и исследовать генетическую и физиологическую стабильность или изменчивость при выращивании клонового материала. Для создания технологий важно изучать условия, определяющие возникновение стимулов к делению у отдельных клеток, изолированных от влияния других клеток популяции и тканей. Изолированные из тканей растения или протопласты культивируемых клеток после образования клеточной стенки являются идеальными отдельными клетками. Отдельные клетки могут быть изолированы из суспензий с использованием микроманипулятора, проточного цитофлюориметра с сортером или путем последовательных разбавлений. Для использования последнего метода суспензия готовится разными способами: 1). 1-2 мл суспензии отбирают из супернатанта после оседания основной массы клеток. 2 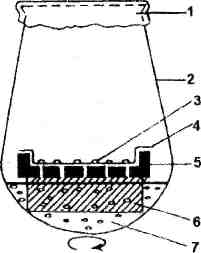 ). Суспензию фильтруют через фильтры с уменьшающимся размером пор (нейлоновые сетки или металлические фильтры). Для последовательных разбавлений используют платы для . микротитрований. Это позволяет микроскопически контролировать клеточный состав при последовательных разбавлениях. Индукция делений отдельных клеток из суспензии, изолированных протопластов, отдельных или высеянных при очень низкой плотности клеток, полученных методом последовательных разбавлений, возможна при использовании очень богатой питательной среды, например среды ). Суспензию фильтруют через фильтры с уменьшающимся размером пор (нейлоновые сетки или металлические фильтры). Для последовательных разбавлений используют платы для . микротитрований. Это позволяет микроскопически контролировать клеточный состав при последовательных разбавлениях. Индукция делений отдельных клеток из суспензии, изолированных протопластов, отдельных или высеянных при очень низкой плотности клеток, полученных методом последовательных разбавлений, возможна при использовании очень богатой питательной среды, например средыРис. 2. Использование «няньки» - культуры суспензионных клеток при выращивании изолированных протопластов и одиночных клеток кукурузы: 1 - фольга; 2 - колба Эрленмейера; 3 - колонии клеток; 4 - фильтровальная бумага; 5 - алюминиевая сетка; 6 - пенополиуретан; 7 - суспензия клеток Као и Михайлюка. При этом объем среды, в которую помещаются клетки, должен быть минимальным (микрокапли в чашке Купрака объемом 20 мкл). Даже и при соблюдении всех этих условий процент разделившихся клеток остается низким. Более эффективны методы использования ткани-«няньки» или «кормящего слоя». Для создания «кормящего слоя» используют суспензию клеток того же вида растения, что и одиночная клетка, или близкого вида (рис. 2). Клеточная суспензия берется в ранней экспоненциальной фазе ростового цикла. Каллусная культура, служащая тканью-«нянькой», также должна быть в состоянии активного роста. При достижении колонией, возникающей из отдельной клетки, величины 0,5-1 мм клон может быть перенесен для дальнейшего выращивания на агаризованную питательную среду непосредственно или на фильтр, помещенный на поверхность агара. Использование «кормящего слоя», ткани-«няньки» и минимального объема среды, в которую помещается отдельная клетка, связано с феноменом, носящим название «действие фактора кондиционирования». Несмотря на многочисленные попытки определить химическую природу веществ (или вещества), индуцирующих деление отдельной клетки, и раскрыть механизм действия фактора кондиционирования, ясности здесь пока нет. Уверенно можно сказать, что это фактор химической, а не физической природы, термостабилен, включает низкомолекулярные вещества и не заменяется фитогормонами. Биотехнологии на основе изолированных протопластов Гибридизация соматических клеток растений путем слияния изолированных протопластов - еще один из способов создания генетического разнообразия для селекции. Преимущество этого метода - возможность переноса искомых генов на далекие таксономические расстояния. Это особенно важно тогда, когда половое скрещивание невозможно, а методы in vitro, помогающие преодолеть прогамную или постгамную несовместимость, не помогают. Получение соматических гибридов стало возможным после разработки приемов слияния изолированных протопластов и культивирования их на питательных средах, дополненных осмотическими стабилизаторами. В процессе культивирования изолированные протопласты и продукты их слияния образуют новую клеточную стенку, осуществляют ряд последовательных делений и превращаются в колонии каллусных клеток. Перенос на среду для регенерации индуцирует образование зачатков стеблей или эмбриоидов и заканчивается регенерацией растений. Этап получения изолированных протопластов, благодаря существованию большого набора ферментных препаратов пектолитического и целлюлолитического действия, а также препаратов, активно разрушающих гемицеллюлозу, не представляет особой сложности. При изолировании протопластов применяют следующие растворы ферментных препаратов: 1). Из мезофилла листа табака: целлюлаза - 2,5%, пектиназа - 0,25%, маннит - 0,4 М. 2). Из мезофилла листьев и суспензионных культур картофеля: ксиланаза -2%, маннит - 0,3-0,4%. 3). Из каллусных тканей пшеницы: целлюлаза 1- 2%, пектинааза - 0,3%, СаС12 - 0,25 М (осмотик). 4). Из гипокотилей рапса: целлюлаза - 0,5%, мацерозим - 0.05%, маннит -0,4 М. Для подготовки листьев пробирочных растений к инкубации в растворе ферментов удаляют нижний эпидермис или разрезают их па полоски шириной 0,5-1 мм (желательно в растворе плазмолитика). Затем листья помещают на поверхность раствора ферментов и плазмолитика и инкубируют в растворе ферментов (время, температуру и рН буфера или среды подбирают эмпирически). При использовании меристемных тканей при выделении протопластов, в небольшом числе происходит спонтанное слияние протопластов. Для индуцированного слияния изолированных протопластов с целью гибридизации соматических клеток используют следующие методы: 1). Добавление в среду инкубации изолированных протопластов веществ, стимулирующих слияние. Например, добавляют нитраты (NaNO3), полиэтиленгликоль (ПЭГ), среду с высоким рН и высокой концентрацией ионов кальция. 2). Методика Као (1976). - Пастеровской пипеткой суспензии протопластов (0,1 мл) переносят на покровное стекло, помещенное в чашку Петри (60 х 15 мм). - Через 5 мин (после того, как протопласты осядут на дно капли), осторожно добавляют маленькими каплями 0,45 мл раствора полиэтиленгликоля в концентрации 40%. - Инкубируют при комнатной температуре в течение 15-30 мин. - Осторожно добавляют в течение 10 мин 0,5 мл питательной среды, в ко-] торой будут культивироваться протопласты. - Промывают протопласты 5 раз добавлением свежей питательной среды с интервалом 5 минут между добавлениями. Перед добавлением свежей порции на покровном стекле оставляют тонкий слой старой среды, чтобы не подсушить] протопласты. 3). Слияние с помощью электрического тока. Метод электрослияния изолированных протопластов основан на применении неоднородного электрического поля, создаваемого переменным током с напряжением 100 В и частотой 50 Гц в камере, куда помещают изолированные протопласты и вводят платиновые электроды. В этих условиях наблюдается диэлектрофорез, и протопласты выстраиваются в цепочку между электродами. Для слияния используют сильный импульс постоянного тока 1,2 кВ/см в течение 50 МКС. Техника получения изолированных протопластов разработана для многих растений. Культивирование и получение на их основе проще удается для представителей семейства пасленовых, капустных, зонтичных, рутовых и некоторых других, труднее для злаков и бобовых. И здесь уже есть успехи: из протопластов риса, изолированных из каллусной ткани, возникшей из микроспоры, удалось получить колонии. В четырех из них наблюдали развитие корней и стеблевых зачатков, из которых один образовал проросток. Получены зародыши и проростки в клеточной суспензии, возникшей из протопластов африканского проса. Исследователям фирмы Мицубиши в Японии удалось получить растение - соматический гибрид путем слияния протопластов риса и проса. Гибридизация соматических клеток методом слияния протопластов, безсомнения, обогатила клеточную биологию. Появилась возможность изучать по ведение гибридных ядерных геномов при разной степени таксономической удаленности партнеров. Межродовая соматическая гибридизация между картофе лем (Solanum tuberosum) и томатом (Lycopersicon esculentum) позволила получить гибридные растения двух типов, которые авторы назвали «топато» и «помато» в зависимости от родовой характеристики хлоропластов гибрида. В первом случае хлоропласта были томатные, во втором - картофельные. Эти растения не обладали хозяйственно полезными свойствами, но позволили наблюдать проявление признаков партнеров и сочетание их на морфологическом и биохимическом (синтез алкалоидов) уровнях. Анализ перспектив отдаленной соматической гибридизации, результатом которой является получение растений с гибридным ядерным геномом для практической селекции далеко не так оптимистичен. Удалось получить только межвидовые, а не отдаленные гибриды. При межвидовой соматической гибридизации могут возникнуть как стерильные, так и фертильные растения. В последнем случае есть возможность получить потомство от самоопыления или обратного скрещивания с культурными сортами. Последнее важно, так как часто у гибридов (например, между сортами картофеля и дикими видами) преобладают признаки диких видов. Принципиальное отличие соматических гибридов, полученных методом слияния протопластов, от гибридов, полученных половым путем, состоит в том, что в большинстве случаев при половом скрещивании цитоплазматические гены передаются только материнским путем, при соматической гибридизации - от обоих родителей. Сегрегация ядер соматических гибридов, слияние изолированного протопласта с цитопластом, лишенным ядра, слияние протопласта-реципиента с энуклеированным протопластом или протопластом, ядро которого инактивировано облучением и не способно к делению, приводит к получению так называемых цибридов. Цибридизация - способ введения важных цитоплазматических генов, несущих такие признаки, как ЦМС, устойчивость к некоторым гербицидам и патогенам, в изолированный протопласт растения с интересующим селекционера генотипом. В литературе есть сведения о переносе этим способом гена устойчивости к гербециду триазину, кодирующего синтез белка мембраны хлоропластов с молекулярной массой 32 000 Д, от устойчивого растения паслена черного картофелю. Может представлять интерес использование цибридизации для переноса гена устойчивости к тентотоксину (Alternaria solanii) от табака картофелю, а также других цитоплазматических генов, определяющих устойчивость. При переносах цитоплазматических генов, кроме метода слияния изолированных протопласта-реципиента с цитопластом или протопластом с инактивированным ядром, можно использовать и другие методы введения их: микроинъекцию и перенос с помощью липосом. Методы и условия манипуляций с клеткой, которые можно назвать собственно клеточной инженерией растений, еще только разрабатываются биотехнологами, последствия их в большинстве случаев не изучены. Медленный рост (время удвоения числа клеток 1-3 дня), длительный период выращивания (2-3 недели) в строго асептических условиях, чувствительность к механическим повреждениям, во многих случаях низкое содержание искомого продукта являются недостатками метода культивирования каллусных культур, ограничивающими его применение в промышленности. Обзор литературы | ||||||||||||||||||||||||||||||||||||||||
