Плазмиды и их роль в жизнедеятельности бактериальной клетки
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПРИКЛАДНОЙ БИОТЕХНОЛОГИИ КАФЕДРА МИКРОБИОЛОГИИ И ИММУНОЛОГИИ Курсовая работа по микробиологии. Тема: «Плазмиды и их роль в жизнедеятельности бактериальной клетки». 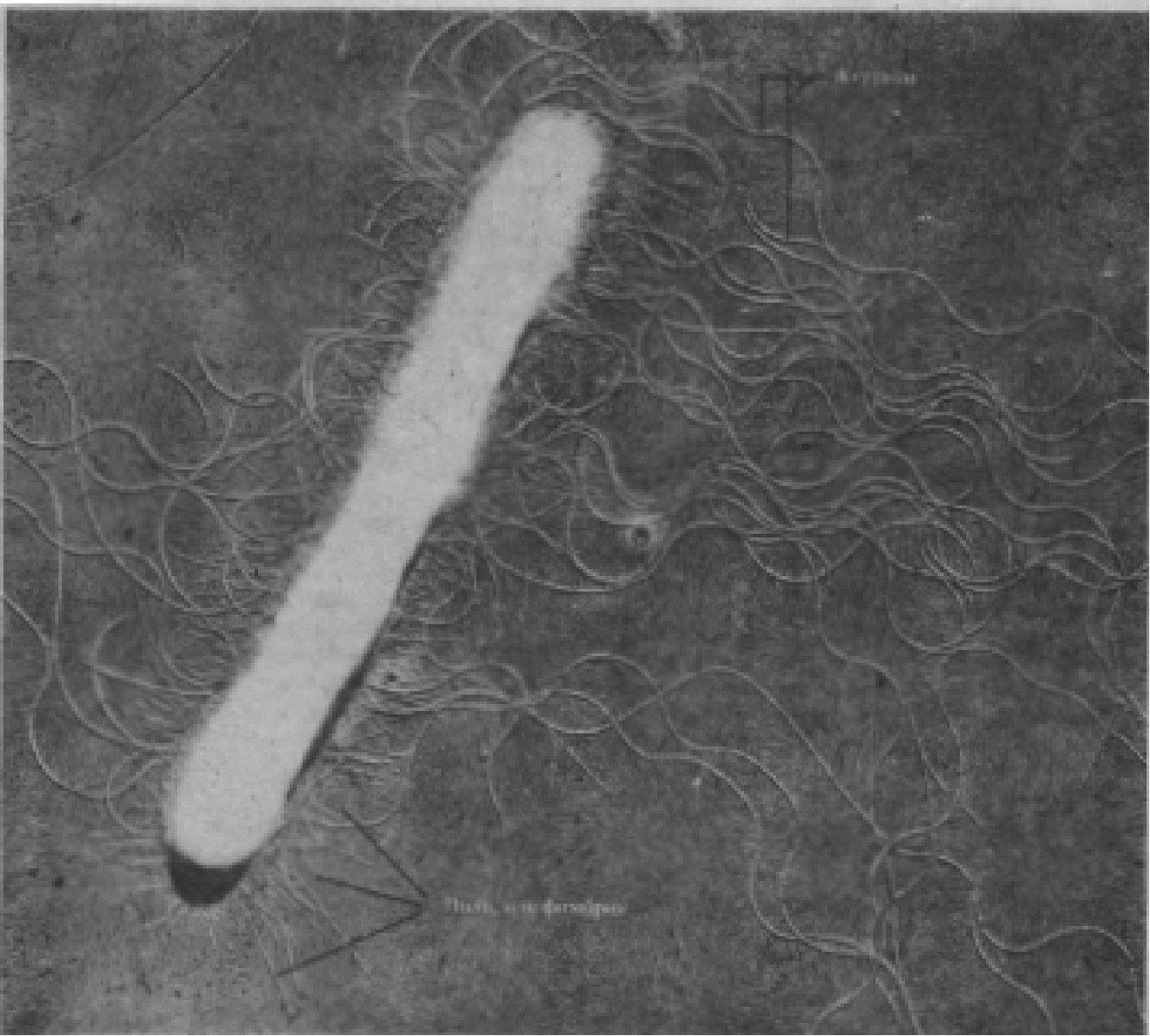 Написал: студент I курса 9 группы ветеринарно-санитарного факультета Кочергин-Никитский Константин Проверил: Скородумов Дмитрий Иванович Москва 2000-2001 г. План. I Введение. II Основная часть.
III Заключение. IV Список использовавшейся литературы. Плазмиды – внехромосомные генетические элементы, способные к автономному поддержанию в цитоплазме бактерий или существованию в интегрированном в хромосому состоянии, откуда они могут свободно выходить в цитоплазму (иногда с фрагментами хромосомы). Некоторые хромосомы могут распространяться в бактериальной популяции между ее членами. Плазмиды определяют ряд важных свойств бактерий:
В последнее время природа факторов внехромосомной наследственности микроорганизмов приобрела особый интерес в связи с появлением данных о возможности использования плазмид в качестве векторов эукариотных генов. Такая возможность открывает неограниченные перспективы для генетического моделирования не только при решении проблем молекулярной биологии, но и в практическом аспекте, в частности в медицинской микробиологии и иммунологии (создание новых бактерийных профилактических и лечебных препаратов) и микробиологической промышленности. Большой опыт экспериментального мутагенеза на модели бактерий и вирусов способствовал раскрытию генетических и молекулярных механизмов регуляции функций внехромосомных элементов. Их способность включаться в хромосому и формировать комплексы «замещенных» плазмид широко используется в экспериментальной биологии и генетике. Замещенные плазмиды несут фрагменты хромосомы бактерии-хозяина и в автономном состоянии функционируют под контролем регуляторных механизмов бактериальной клетки. Расширение методических и технических возможностей экспериментальных исследований в области молекулярной биологии позволяет целенаправленно использовать генетические модели в решении важных практических задач. Определились реальные пути более гибкого вмешательства в процессы физиологически нормального генетического обмена у бактерий, осуществляемого с участием внехромосомных элементов, способствующих конъюгации, формированию рекомбинантов, передаче генетического материала путем трансдукции умеренными фагами, мобилизации нетрансмиссивных элементов плазмидами, имеющими в своей структуре «гены трансмиссивности», и сочетания с этими генами фрагментов хромосомы с последующим переносом вновь формирующихся структур и их ассоциаций в клетки реципиентов. Актуальное значение приобретает исследование механизмов взаимодействия внехромосомных элементов с хромосомой и между собой в естественных или сконструированных искусственно полиплазмидных системах. Подчинение этих систем общим регуляторным механизмам на уровне клетки и популяции микроорганизмов выдвигает новые проблемы: изучение специфических особенностей полиплазмидных популяций при наличии дополнительных генетических факторов, не обязательных для воспроизведения жизнеспособного потомства, и возможностей практического использования искусственно обогащенного генома популяций бактерий. В последнее десятилетие интенсивно накапливаются данные о генетической природе и биологических особенностях плазмид, с которыми непосредственно связана патологическая активность бактерий. Это – элементы Hly, Ent, Vir, сведения о которых в мало обобщены. Практическое значение в инфекционной патологии приобретают «вторичные» процессы при ожоговых заболеваниях и постхирургических осложнениях, возникающих в связи с неограниченно возрастающей множественностнной лекарственной устойчивостью возбудителей этих процессов, контролируемой трансмиссивными и нетрансмиссивными факторами инфекционной резистентности. Менее полно изучены, но не менее важны плазмиды, контролирующие патогенные свойства стафилококков, стрептококков, псевдомонад. В настоящее время на основе использования трансмиссивных эписом интенсивно разрабатывается новое направление исследований - «генетическая инженерия» и как специальный раздел этого направления - «генная инженерия». Последняя представляет собой область прикладной молекулярной генетики и биологии, развитие которой только начинается. Однако первоисточником «сырья» для осуществления конкретных задач конструирования новых биологически активных молекул являются внехромосомные элементы, способные функционировать в виде самостоятельных оперонов и репликонов. Они сохраняют эту функцию в гетерологичных системах микроорганизмов и, что особенно привлекает «биоинженеров», - в системах эукариотов. История исследования плазмид. Начало исследования плазмид относят к 20 гг. XX века. В 1921 г. Bourdet и Ciuca открыли лизогенные бактерии, способные спонтанно лизироваться. В 1925 г. Gratia обнаружил фактор, подавлявший рост некоторых видов энтеробактерий – «принцип V». Wollman в 1928 г. высказал предположение о трансмиссивности факторов лизогенности. В 1932 г. Gratia идентифицировал обнаруженный им фактор, обладавший антагонистической активностью как белковоподобное вещество. Это исследование дало начало изучению колициногенности – способности бактерий E.Coli продуцировать колицины – вещества, подавляющие рост близкородственных бактерий. В 1946 г. Д. Ледерберг и Э. Татум использовали смешанное культивирование ауксотрофных мутантов E. Coli K12 и открыли конъюгацию бактерий. В дальнейшем было доказано, что при конъюгации часть клеток являются донорами, а часть реципиентами, что зависит от присутствия внехромосомного фактора фертильности: F-фактора, откуда следовал вывод об односторонности механизма и наличия F+ и F- фенотипов. Дальнейшие исследования показали возможность превращения клеток F- в F+ в смесях клеток обоих типов, что указывало на трансмиссивность F-фактора. Было также доказано существование внехромосомных элементов – «плазмид». Как оказалось позднее, плазмида (фактор) F является чистым фактором генетического переноса, так как обладает лишь генами переноса и генами репликации. Внехромосомная природа фактора F была доказана на основании результатов обработки бактерий F+ акридиновыми красителями, что приводит к «удалению» фактора F из клеток популяции и превращает их из доноров в реципиентов (Hirota, Jidjima, 1956; Lederberg, 1958; Wollman, Jacob, 1956). Работы 50-х годов показали, что плазмида F может находиться как автономном состоянии (в цитоплазме), так и в интегрированном в хромосому. В 1952 г. Lwoff систематизировал материалы по лизогении и впервые предложил термин «плазмиды» для обозначения «внехромосомных симбиотических организмов». В настоящее время этот термин рекомендуется в качестве основного для определения внехромосомных факторов наследственности у бактерий. В начале 60-х гг. была установлена возможность выхода плазмиды из хромосомы в цитоплазму. При этом иногда захватываются гены хромосомы. Fredericq (1963) показал связь колициногенных факторов с факторами «половой полярности» бактерий и привел экспериментальные доказательства возможности рекомбинаций между внехромосомными элементами и фрагментами хромосомы бактерии хозяина. Открытие во второй половине 50-х годов японскими исследователями генетических элементов, контролирующих множественную трансмиссивную устойчивость бактерий к наиболее широко применявшимся антибиотикам и синтетическим химиотерапевтическим препаратам сульфаниламидного ряда, ознаменовало новый этап в изучении внехромосомных факторов наследственности бактерий (Watanabe, 1963; Mitsuchashi, 1960, и др.). Она передавалась в результате клеточных контактов, независимо от переноса бактериальной хромосомы. Для обозначения детерминантов лекарственной резистентности Mitsuhashi S. предложил символ R. Многочисленные исследования в 60 -70-е гг. показали, что R-плазмиды присутствуют в бактериях многих видов, широко распространены географически, отличаются друг от друга и по генетическому составу и по фенотипическим проявлениям. В середине 60-х годов английские исследователи (Datta, 1965; Anderson, 1965; Datta, Meynell, 1965) представили данные о природе фактора трансмиссивности—RTF, и его аналога—фактора А, способных существовать в свободном состоянии и формировать комплексы с детерминантами резистентности к отдельным антибиотикам, не обладающим собственными генами трансмиссивности. Эти исследователи установили функциональную гомологию «секс-фактора» и фактора передачи резистентности к антибиотикам, а также показали филогенетические связи плазмид резистентности с другими трансмиссивными плазмидами. Важное значение для понимания механизмов передачи внехромосомных элементов имели исследования поверхностных структур у бактерий, опосредующих конъюгационную передачу генетического материала (Brinton, 1965; Meynell, Lawn, 1967). Эти работы явились основой для дифференцированного подхода к оценке роли «ворсинок» разного типа в определении групп совместимости (или несовместимости) факторов резистентности и других внехромосомных элементов. В 1967 г. Smith и соавторы открыли внехромосомные элементы, непосредственно контролирующие формирование патогенных свойств у энтеробактерий, выделенных от животных и человека. Был выявлен трансмиссивный Детерминант гемолитической активности – фактор Н1у в штаммах E. coli животного происхождения (Smith, Halls, 1967). В той же лаборатории обнаружен самостоятельный внехромосомный элемент, контролирующий синтез энтеротоксина — плазмида Ent (Smith, Linggood, 1971). Д. Г. Кудлай и соавт. (1969) выявили трансмиссивный элемент Н1у, контролирующий синтез гемолизинов типа р и токсических веществ, вызывающих дермонекрозы и гибель лабораторных животных, у штаммов E. coli, выделенных от человека при токсической диспепсии. В 70-е гг. появляются сведения о детерминированной резистентности к тяжелым металлам, о контроле плазмидами метаболизма липополисахаридов и других компонентов клеточной стенки бактерий, синтеза токсинов, бактериоцинов, синтеза различных ферментов. В 80-е гг. были открыты полиплазмидные системы переноса плазмид. В России исследования плазмид были начаты в конце 50-х гг. в лабораториях Д. Г. Кудлай и А. П. Пехова. Идентификация плазмид. Идентификация на генетическом уровне. Этот метод идентификации основан на учете фенотипов исследуемых бактерий (свежих изолятов) по сравнению с фенотипами известных штаммов, а так же на последующем установлении трансферабельности интересующего свойства к другим бактериям. Что бы проверить, детерминируется ли отличающий признак плазмидой, прибегают к конъюгационным скрещиваниям резистентных клеток (доноры) с чувствительными клетками (акцепторы). Положительный результат в форме наблюдения конъюгации и селекции резистентных трансконъюгантов означает, что лекарственная устойчивость в исследуемом случае трансмиссивная. При получении отрицательных результатов, сначала делают предположение, что признак контролируется неконъюгативной плазмидой. В этом случае пытаются провести мобилизацию на перенос исследуемую плазмиду известной конъюгативной плазмидой. Если и этот тест не дал положительных результатов, то предполагают, что возможно, по каким-то причинам, плазмида оказалась недоступной для мобилизации. Вопрос о плазмидной резистентности в данном случае решают в зависимости от результатов экспериментов по трансдукции. Установление плазмидной резистентности должно сопровождаться исключением резистентности, контролируемой транспозируемыми генетическими элементами (транспозонами). В тех случаях, когда исследуемый признак легко обнаруживается при изучении отдельных колоний, дополнительную информацию может дать изучение стабильности плазмид. При этом исследуют как спонтанную элиминацию плазмид (следствие ошибок репликации или распределения между дочерними клетками плазмидных копий, что с трудом поддается математическому учету), так и индуцированную. К индуцированной элиминации прибегают тогда, когда спонтанная элиминация происходит с чрезвычайно низкой частотой. Обычно используют акридин оранжевый или этидий бромид. Универсального элиминационного химического агента к настоящему времени не найдено, поэтому обычно прибегают к комбинированной обработке различными химическими веществами. Если резистентность детерминируется хромосомно, то мутация, сопровождающаяся утерей признака, может ошибочно указать на плазмидный контроль признака. В этом случае прибегают к индукции обратных мутаций, что позволит исключить ложное предположение. Для идентификации F-подобных факторов генетического переноса прибегают к использованию реакции нарастания титра F-дононорспецифических фагов (РНТФ) в культурах исследуемы бактерий, которые не имеют видимых свойств, указывающих на содержание в них плазмид. Положительная РНТФ указывает на присутствие в клетках фактора переноса. Значительно сложнее осуществлять идентификацию и определение типовой принадлежности плазмид в бактериальной клетке, которые могут содержать комплексы плазмид, состоящие из нескольких плазмид разных типов, включая F-факторы. В таких случаях прибегают к «разгонке» плазмид с помощью скрещиваний или физических методов с последующей генетической характеристикой каждой плазмиды. Идентификация на молекулярном уровне. Идентификация плазмид в этом случае производится путем выделения, очистки и характеристики плазмидной ДНК, количество которой в плазмидосодержащих клетках составляет около 5% тотальной ДНК клетки. Основная сложность в выделении ДНК плазмид – отделение от хромосомной ДНК. Это достигается с помощью ультрацентрифугирования в градиенте плотности хлористого цезия. В исследованиях используют метод электрофореза, с помощью ферментов-рестриктаз получают физические карты плазмид. Молекулярная масса ДНК плазмиды определяется с помощью определения контурной длины молекулы используя электронную микроскопию. Распространение плазмид. Плазмиды в диких бактериальных популяциях распространены очень широко и их можно выявить у бактерий по всей планете. Плазмиды выявляются во многих видах грамотрицательных анаэробов и аэробов, неспоровых анаэробов, кокков, коккобацилл, грамположительных неспоровых палочковых форм и кокков, споровых палочек и кокков, актиномицетов и родственных форм, микоплазм, спирилл, миксококков, фототрофов, цианобактерий, одноклеточных водорослей, дрожжей, трипаносом и т.д. Классификация плазмид. В 50-е гг. плазмиды R стали классифицировать на fi+ и fi- (по способности ингибировать перенос плазмиды F). Далее стали, в зависимости от различия в пилях, выделять F и I-подобные плазмиды. Современные подходы к классификации плазмид основаны на комплексном учете их генетических свойств. Еще в ранних работах по изучению плазмид было замечено, что существуют факторы, препятствующие конъюгационному переносу плазмид от доноров к реципиентам, содержащим одинаковые и сходные плазмиды. Один из таких факторов – поверхностное исключение: в скрещиваниях плазмида не переходит из клеток доноров в клетки реципиенты, содержащие сходную плазмиду. В результате поверхностного исключения перенос снижается в 10-400 раз по сравнению с нормой. Следующий фактор был открыт в 60-е гг. – летальный зигозиз. Смешивание клеток доноров с клетками реципиентами, добавленными в смесь в значительно меньшем количестве, чем клетки доноры, сопровождается снижением числа жизнеспособных зигот, наследующих донорский генетический материал. Наконец результативность переноса зависит от несовместимости плазмид. В наиболее простом виде несовместимость заключается в том, что при переносе одна из плазмид элиминируется. Если в клетке обе плазмиды сохраняются, то это указывает на их совместимость. Обычно несовместимы те плазмиды, контроль репликации которых одинаков. |
