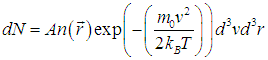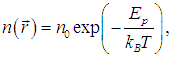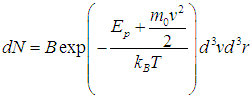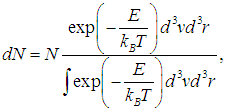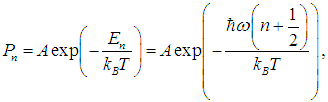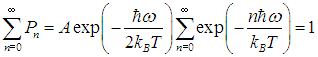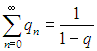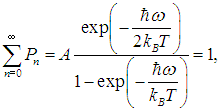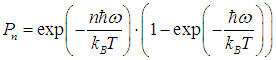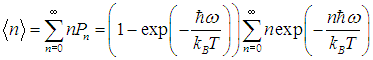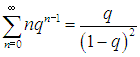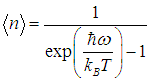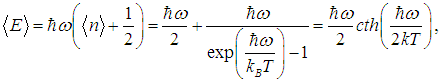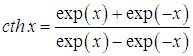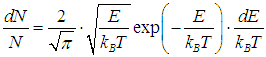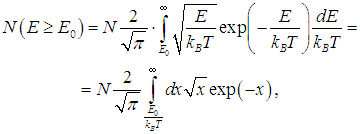13 Распределение Молекул по скоростям. Положение о равномерном распределении молекул в пространстве и равномерном распределении их скоростей по всем направлениям называют
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
3.5. Распределение Максвелла — БольцманаМы установили функцию, описывающую распределение молекул по скоростям (распределение Максвелла), и зависимость, характеризующую распределение молекул по значениям потенциальной энергии (распределение Больцмана). Обе зависимости можно объединить в одно обобщенное распределение. Рассмотрим бесконечно малый объем dV газа, расположенный в точке с радиусом-вектором
Но концентрация молекул n(r) зависит от расположения этого объема во внешних силовых полях:
где n0 — концентрация молекул в точке, где Еp = 0. Тогда
Поскольку выражение
представляет собой полную энергию частицы во внешнем потенциальном силовом поле, мы приходим к обобщенному распределению Максвелла — Больцмана по энергиям молекул:
где N — полное число частиц в системе, a dN — число частиц с координатами между r и r + dr и (одновременно) со скоростями между v и v + dv. Средняя энергия квантового осциллятора. Распределение Максвелла — Больцмана было получено в классической физике, но оно оказалось справедливым и в квантовой механике, где были подвергнуты пересмотру многие казавшиеся незыблемыми положения. В качестве примера рассмотрим задачу о грузе массой т, закрепленном на конце пружинки с жесткостью k. Уравнение движения хорошо известно, и его решением являются гармонические колебания тела с круговой частотой 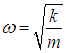 Классическая энергия системы, моделирующей колебания атомов в молекуле дается формулой (3.62) и может принимать любые значения в зависимости от амплитуды колебаний. Как нам известно из квантовой механики, энергия колебаний квантуется, то есть принимает дискретный ряд значений, определяемых формулой: 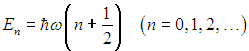 В соответствии с общими принципами статистической физики вероятность Рn найти осциллятор в состоянии, характеризуемом неким значением n колебательного квантового числа, определяется формулой
где А — нормировочная постоянная. Для ее определения надо воспользоваться условием нормировки вероятности
Для этого в известную формулу для геометрической прогрессии
подставим значение 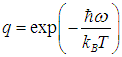 Получаем тогда вместо (2)
откуда следует выражение для постоянной А. Используя его в выражении (1), приходим к вероятности
Видно, что чем больше значение квантового числа n, тем меньше вероятность обнаружить осциллятор в таком состоянии. Чем выше температура, тем большие значения n становятся практически значимыми для системы. При к нулю стремятся все вероятности Рn с n > 1, и лишь Иными словами, при нулевой температуре нет тепловых возбуждений, и осциллятор совершает «нулевые колебания» — находится в основном состоянии с наименьшей энергией Распределение осцилляторов по энергиям в зависимости от температуры системы показано на рис. 3.9 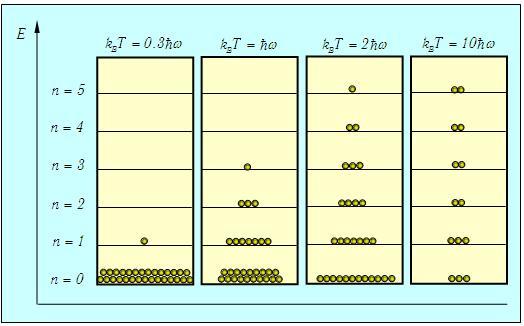 Рис. 3.9. Примерное распределение N = 30 квантовых осцилляторов по энергетическим уровням в зависимости от температуры. Показаны только основной и пять первых возбужденных уровней энергии. При Т = 0 все осцилляторы находятся в основном состоянии. По мере роста температуры становятся доступными все более высокие энергии, и распределение осцилляторов по уровням становится все более равномерным Для наглядности мы взяли систему из небольшого (N = 30) числа осцилляторов (строго говоря, статистические законы применимы к системам с гораздо большим числом частиц). Возникает вопрос: каково среднее значение
Чтобы сделать это, продифференцируем по q обе части равенства (3.67) для геометрической прогрессии: 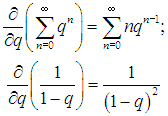 откуда получаем
Используя (7) при 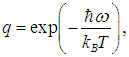 получаем из (6) выражение для искомого среднего
Теперь легко получить среднюю энергию осциллятора
где функция cth — гиперболический котангенс определена соотношением
На рис. 3.10 сплошной линией изображена средняя энергия квантового осциллятора, измеренная в единицах ħω, 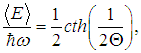 в зависимости от «безразмерной температуры» 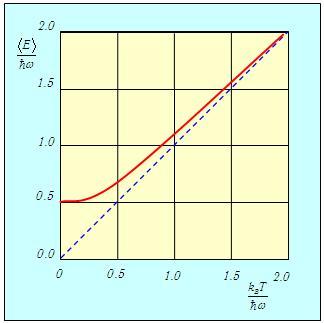 Рис. 3.10. Средняя энергия квантового осциллятора в зависимости от температуры Пунктирная линия соответствует результату классической физики. Действительно, энергия приходящаяся на одну степень свободы, является средним значением как кинетической, так и потенциальной энергий классического осциллятора, так что среднее значение полной энергии как раз равно Видно, что квантовые поправки важны при низких температурах: при q < 0,3 средняя энергия осциллятора близка к энергии основного состояния ħω/2. В таком случае говорят, что колебательные степени свободы «заморожены», то есть тепловой энергии недостаточно для возбуждения колебаний. Но уже при q = 2 обе энергии практически совпадают, то есть квантовые поправки малы. Значение q = 1 можно принять за условную границу между квантовой и классическими областями. Ее смысл прозрачен: при тепловая энергия равна минимальной энергии возбуждения осциллятора, то есть разности между энергией первого возбужденного состояния и энергией основного состояния осциллятора. Какие же температуры можно считать низкими для осциллятора, моделирующего реальную систему, например молекулу водорода Н2? Характерные частоты молекулярных колебаний располагаются обычно в инфракрасной области и имеют порядок n = 1014 Гц. Этому соответствуют энергия и температура 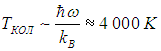 Средняя энергия квантового ротатора. Таким образом, привычные для нас комнатные температуры оказываются достаточно низкими с точки зрения возбуждения колебаний молекул. Посмотрим, что происходит с молекулами при температурах Т < ТК0Л. Так как колебания отсутствуют, двухатомную молекулу можно представить в виде «гантели» — двух атомов, жестко соединенных между собой. Такая система называется ротатором и, как мы видели ранее, имеет пять степеней свободы - три поступательных (движение центра масс) и две вращательных. Энергия вращательного движения классического ротатора имеет вид (3.61). Учитывая связь между угловой частотой вращения ω, моментом инерции I и моментом импульса L, записываем классическую энергию вращения молекулы как В квантовой механике квадрат момента импульса квантуется, Здесь J — ротационное квантовое число, поэтому квантуется и энергия вращательного движения молекулы 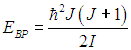 Используя это соотношение и распределение Максвелла — Больцмана, можно получить выражение для средней энергии квантового ротатора. Однако в этом случае формулы достаточно сложны, и мы ограничимся качественными результатами. При высоких температурах средняя энергия стремится к классическому значению kBТ, соответствующему двум степеням свободы (вращение вокруг двух ортогональных осей). При низких температурах ротатор будет находиться в основном состоянии, соответствующем значению J = 0 (отсутствие вращения). «Переход» между двумя этими предельными случаями осуществляется, очевидно, при такой температуре ТВР когда тепловое движение способно возбудить вращательные степени свободы. Минимальная (отличная от нуля) энергия вращения равна как это следует из формулы для ЕВР при J = 1. Поэтому 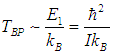 Для момента инерции молекулы можно принять оценку где mр = 1,67·10–27 кг (масса протона), а аВ = 5·10–11 м — радиус Бора. Получаем тогда 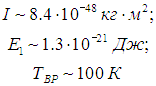 Полученные оценки подтверждаются измерениями молярной теплоемкости при постоянном объеме сnV, которые мы уже обсуждали в предыдущей главе. При температурах ниже 100 К в тепловом движении участвуют только поступательные степени свободы молекулы. Средняя энергия молекулы равна 3kBТ/2, а энергия одного моля — 3NAkBT/2=3RT/2, откуда следует выражение для теплоемкости сnV = 3R/2. В диапазоне температур от 100 К до 200 К молярная теплоемкость увеличивается до значения сnV = 5R/2, что свидетельствует о «размораживании» двух дополнительных (вращательных) степеней свободы (то есть о добавлении kBT энергии на молекулу). В районе температур от 4 000 К до 5 000 К молярная теплоемкость снова увеличивается, на этот раз до значения сnV = 7R/2. Это «разморозилась» колебательная степень свободы, что принесло дополнительную энергию kBT на молекулу. Скорость химических реакций. У химиков есть эмпирическое правило, что при повышении температуры на 10 °С скорость реакции удваивается. Это — всего лишь грубое обобщение, из него есть множество исключений, но все же в целом оно более или менее верно. Объяснение можно и здесь дать на основе распределения Максвелла — Больцмана. Для протекания многих химических реакций необходимо, чтобы энергия участвующих в них частиц превышала некое пороговое значение, которое мы обозначим Е0. Чем больше таких частиц, тем выше скорость реакции. Из формул (3.28), (3.29) следует распределение частиц по энергиям. В них надо лишь выразить скорость частицы v через ее кинетическую энергию Е 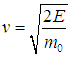 и учесть, что 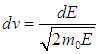 В результате получаем распределение частиц по энергиям
Отсюда находим число частиц с энергией Е > Е0:
где мы сделали замену переменных интегрирования Для численных оценок мы примем пороговую энергию равной энергии возбуждения колебаний молекулы: Е0 = 6·10–20 Дж. Тогда для комнатной температуры Т1 = 300 К получаем величину E0/kBT1 = 14,5, а для температуры Т2 = 310 К это отношение равно Е0/kBТ2 = 14,0. Числа частиц, участвующих в реакции, определяются соотношениями 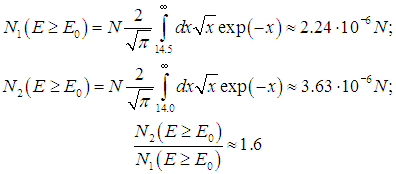 Действительно, повышение температуры всего на 10 градусов привело к увеличению на 60 % числа частиц, энергия которых превышает пороговое значение. |