Получение радиоизотопов использование радионуклидов и радиофармпрепаратов в медицине
 Скачать 228.5 Kb. Скачать 228.5 Kb.
|
|
4.2. Томский циклотрон для производства РФП. Циклотрон У-120, запущенный в 1959 г в НИИ ЯФ ТПУ, успешно применяется для производства медицинских радиоизотопов для клиник Томска и Сибирского региона c 1985 г. Препарат на основе изотопа 199Tl. РФП на основе таллия широко применяются в медицинской диагностике для перфузионной сцинтиграфии миокарда и головного мозга. Использование этого нуклида основано на его свойстве накапливаться в сердечной мышце. До последнего времени для этой цели применяли радионуклид 201Tl, который может быть получен при облучении стабильных изотопов в реакциях: 203Tl (p, 3n) 201Pb 9,4ч 201Tl, (4.2) 205Tl(p, 5n) 201Pb 9,4ч 201Tl на ускорителях, обеспечивающих энергию протонов 30 МэВ и более. Методики его получения достаточно сложны и включают до 10 радиохимических операций. При этом образуется большое количество радиотоксичных отходов, суммарная активность которых переработки облученных мишеней длится до 2 суток. На западном рынке стоимость препаратов таллия-201 составляет около 50 долларов США за 1 мКи, В России – несколько больше, что связанно с отсутствием в нашей стране специализированных ускорителей, работающих на производство медицинских радионуклидов. Например, завод «Медрадиопрепарат» (г. Москва) выпускает около 2,5 Ки таллия в год против 7000 Ки в развитых промышленных странах. В Томске с 1985 г. исследовалась возможность использования для радионуклидной диагностики вместо 201Tl его короткоживущего аналога 199Tl (T1/2 =7,4 часа). Этот изотоп может быть получен на сравнительно небольших циклотронах по реакции 197Au(a,2n)199Tl, (4.3) путём облучения золота альфа-частицами с энергией 22-27 МэВ. Характеристики гамма- и рентгеновских линий излучения радионуклида 199Tl приведены в таблице 4.3. Таблица 4.3 Гамма и ХРИ – излучение радионуклида таллия-199
Основная трудность получения радионуклида 199Tl связана с образованием по конкурирующим реакциям других изотопов таллия: 200Tl по реакции (a,n) и 198Tl по реакции (a,3n). Исследования показали, что наилучшее выделение целевого нуклида над фоновыми изотопами происходит при энергии альфа-частиц (27 – 28) МэВ. Прохождение α-частицы через мишень сопровождается её торможением, в результате максимальные значения концентраций тех или иных изотопов таллия достигаются на различных глубинах мишени в соответствии с зависимостями сечений этих процессов от энергии Еα. Исследования зависимости концентрации образовавшихся в мишени (стопка золотых 5 мкм фольг) изотопов таллия от толщины мишени показали, что наиболее чистый продукт таллия -199 нарабатывается в слое до 10 мкм. Однако в этом случае его выход от общего количества не превышает 10%, что нетехнологично. Оптимальной была выбрана толщина в 30 мкм, с содержанием примесей таллия – 201 около 1,5% (см. рис. 4.1). Полученные данные и сделанные на их основе оценки показали, что на циклотроне У-120 за одно облучение могут быть наработаны партии таллия-199 с активностью 50 мКи и более. Для практического получения таких количеств нуклида потребовалось разработать специальные конструкции мишеней и устройств для их дистанционной загрузки-выгрузки из канала ионопровода с одновременным вращением и охлаждением потоком воды. Облучение тонких фольговых мишеней толщиной от 30 до 500 мкм представляет собой достаточно сложную задачу, поскольку отдаваемая пучком альфа-частиц тепловая мощность составляет (600 – 800) Вт. 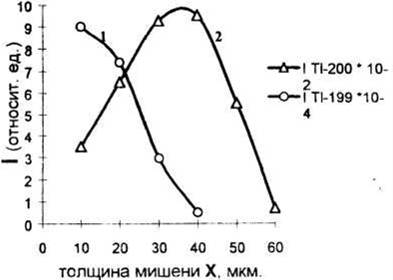 Рис 4.1. Выход I (относит. ед.) радионуклидов 199Tl (1) и 200Tl (2) по глубине мишени, Eα = 27,2 МэВ. В стационарных условиях при общей площади мишени 12,6 см2 подводимая мощность пучка приходится на участок площадью около 1 см2. В результате происходит локальный разогрев мишени. Отвод тепла от этого участка осуществляется потоком дистиллированной воды, протекающей по поверхности мишени с её обратной стороны. Значительное ослабление тепловой нагрузки в области падения пучка достигается также за счёт вращения мишени в процессе облучения. Скорость вращения регулируется в пределах от 1 до 10 об/мин. Для того, чтобы центр пучка не попадал в одно и тоже место, сфокусированный пучок смещался от оси канала и мишени на (0,5 – 1,0) см. После окончания облучения необходимо выделить таллий-199 из состава золотых фольг. Для этого применяется метод возгонки (сублимации) в токе воздуха или кислорода с последующей конденсацией, т.е., таллий окисляется, переходит в газообразное состояние и уносится с током газа. Для выделения таллия из мишеней была разработана и изготовлена сублимационная установка. Схематически она показана на рис. 4.2. Основными узлами установки являются сублимационная камера (1), выполненная из кварцевого стекла с нагревающим электроэлементом (2) и термопарой, конденсор (3) с уплотняющим кольцом (4), шприц (5) с физиологическим раствором (0,9% раствор NaCl), подсоединённый через двухходовой вентиль (6) к ёмкости для смыва конденсата (7) и флакону-сборнику (8) с иглами (9) и (10). Облучённую мишень (11) помещают на дно)предварительно прогретой до заданной температуры камеры (позиция I). Над ней устанавливают охлаждаемый водой конденсор. По окончании сублимации конденсор с осаждаемым на нём таллием переносят в в ёмкость для смыва (7) (позиция II). Сюда из шприца (5) через вентиль (6), установленный в положение «Р» подают физиологический раствор и осуществляют смыв конденсата таллия Обратным ходом поршня полученный раствор переводят в шприц и затем через вентиль (положение «О») переводят во флакон-сборник 8. При этом вытесняемый воздух выходит через иглу (10). Полученный раствор таллия-хлорида 199Tl стерилизуется в паровом автоклаве. Оптимальная температура процесса сублимации (650 – 700)°С, время извлечения (15 – 20) минут. Получаемый в результате раствор представляет собой готовый препарат «Таллия хлорид, 199Tl», годный после стерилизации к диагностическим исследованиям. Одним из определяющих факторов его качества является содержание в полученном продукте примеси таллия-200, которое не должно превышать 1,5% на время приготовления. Поэтому основная задача при сублимационном выделении сводилась к определению точного момента времени окончания процесса, т.к. при передержке мишени в камере содержание примеси в сублимате может превысить указанный предел, а при раннем прекращении сублимации велики потери продукта. 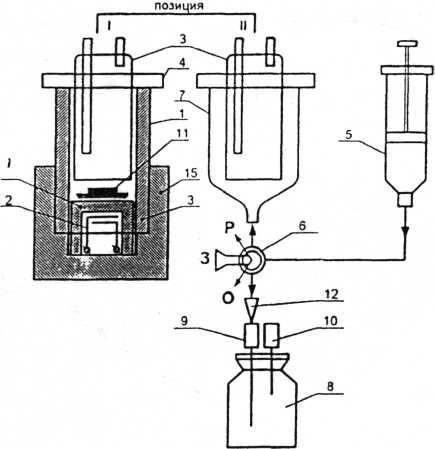 Рис 4.2. Схема установки для сублимационного выделения таллия-199. Получаемый в результате раствор представляет собой готовый препарат «Таллия хлорид, 199Tl», годный после стерилизации к диагностическим исследованиям. Одним из определяющих факторов его качества является содержание в полученном продукте примеси таллия-200, которое не должно превышать 1,5% на время приготовления. Поэтому основная задача при сублимационном выделении сводилась к определению точного момента времени окончания процесса, т.к. при передержке мишени в камере содержание примеси в сублимате может превысить указанный предел, а при раннем прекращении сублимации велики потери продукта. В результате оптимизации всех процедур удалось выйти на уровень производства РФП до 70 мКи за один цикл облучения ((7-8) часов) при токе альфа-частиц (25-30) мкА. Годовой объём производства радионуклида таллия-199 на Томском циклотроне превышает 2,5 Ки, что сопоставимо с объёмом производимого в России таллия-201. В таблице 4.4 приведены расчётные значения эквивалентных доз облучения важнейших (критических) органов человека при введении 4 мКи препарата 199Tl на начало и конец срока его годности и 1,5 мКи препарата 201Tl. Как показывает таблица, применение таллия-199 в медицине позволяет в несколько раз уменьшить радиационную нагрузку на организм человека. На данный препарат была разработана и утверждена Минздравом СССР, и затем Минздравом РФ, вся необходимая нормативно-техническая документация. Основным потребителем данного РФП для диагностики заболеваний сердечно-сосудистой системы и головного мозга выступает НИИ кардиологии ТНЦ СО РАМН. Таблица 4.4 Расчетные значения доз облучения критических органов человека при введении 4 мКи препарата 199Tl на начало и конец срока его годности
Получение РФП на основе радионуклида123I.. Коммерчески доступный для ядерной медицины радионуклид йод-123, использующийся для диагностики заболеваний почек, обычно получают, используя ядерные реакции 127I(p,5n)123Xe®123I, (4.4) 124Te(p,2n) ®123I. Реакции протекают на ускоренных до энергии 30 МэВ и выше протонах. Ввиду того, что йод-123 имеет небольшой период полураспада (Т1/2 = 13,3 ч), существенное значение приобретают такие факторы, как продолжительность его выделения из мишенного материала и изготовления РФП, а также время транспортировки препарата от места производства до потребителя. Суммарное время не должно превышать 24-30 часов. Указанный срок годности радионуклида определяется ещё и тем, что со временем в препарате накапливаются примеси других радионуклидов (более долгоживущих), образующихся по конкурирующим реакциям на примесных изотопах мишенного материала (см. таблицу 4.5). Таблица 4.5 Ядерные характеристики изотопов йода
Так, если по 1 реакции на момент получения примесь йода-125 составляет всего 0,2%, то к концу срока годности её содержание возрастает до 1%. Соответственно, для второй реакции примесь йода-124 увеличивается от 0,8% до 5%. Это делает препараты йода-123 малодоступными для удалённых регионов. Вместе с тем существует реальная возможность получения йода-123 для «домашнего» использования на циклотронах низких и средних энергий типа У-120. Возможности этих ускорителей отвечают реакциям: 121Sb(a,2n) ®123I, 123Te(p,n)®123I, (4.5) 122Te(d,n) ®123I. Первая из них требует использования альфа-частиц с энергией 28 МэВ для того, чтобы примесь йода-124 по конкурирующей реакции (a,n) не превышала на момент получения 3% для толстых мишеней или (1,5-2,0)% - для тонких. Оценочный выход продукта не превышает 0,5 мКи/мкА×ч. Вторая реакция имеет более высокий выход, однако требует наличия 15-17 МэВ-ных пучков протонов. Выход может составить до 300 мКи. Требуется предварительное обогащение теллура-123 до 90%. Возможностям У-120 в наибольшей степени соответствует третья реакция, осуществляемая на дейтронах с энергией 10-14 МэВ. Причём мишенью служит обогащённый теллур-122, которого в естественном составе содержится почти в три раза больше, чем теллура-123. Исследования показали, что при использовании толстых мишеней из обогащённого до (86-93)% теллура-122 может быть достигнут выход (0,7-0,8) мКи/мкА×ч. Реальное время облучения 3-4 часа при токе пучка дейтронов не менее 10 мкА. При работе с таким током возникают жёсткие требования к тепловой стойкости мишени, к её конструкции. Тонкий слой оксида теллура-122 наносится на подложку из листовой платины. Подводимая мощность пучка составляет (250-300) Вт. Передняя стенка мишени охлаждается потоком газа с высокой теплопроводностью (гелием), нагнетаемым с высокой скоростью компрессором. Обратная сторона мишени охлаждается потоком дистиллированной воды. После облучения мишень помещают в загрузочную камеру и нагревают. Выделяемые из мишени пары йода-123 транспортируются потоком воздуха. Далее газообразный радионуклид вступает во взаимодействие с раствором о-йодгиппуровой кислоты. Происходит реакция изотопного обмена с атомами неактивного йода, входящими в состав кислоты. В результате процессов сублимации и изотопного обмена получается препарат, содержащий радиоактивный изотоп йод-123. Этот РФП прошёл тестирование на соответствие действующим требованиям к продукции данного вида. Подлинность «О-йодгиппурата, 123I» устанавливалась по спектру гамма-излучения основного радионуклида, а также по соответствию полученного раствора препарата стандартному тесту на аминогруппу. Доклинические испытания препарата на почках животных были успешно проведены в НИИ кардиологии ТНЦ СО РАМН.
Основное применение реакторные РН находят в радиотерапии поскольку большинство из них являются нейтронно-избыточными и распадаются с испусканием - - частиц. В таблице 4.6 приведён перечень основных медицинских радионуклидов, получаемых на ядерном реакторе для целей диагностики радиотерапии и диагностики. Таблица 4.6 Реакторные РН для ядерной медицины
Одним из самых распространённых и широко применяющихся в ядерной медицине для диагностики ряда заболеваний человека является радионуклид 99mTс, который является дочерним продуктом b- - распада материнского изотопа 99Mo. К середине 90-х годов объём его мирового производства приблизился к 10 кКи в неделю (ядерные реакторы Канады, Бельгии, ЮАР, России и др.). Для его получения на ядерных реакторах используются две основные схемы: реакция деления урана - 235U(n,f)99Mo, реакция радиационного захвата - 98Mo(n,) 99Mo. Сечения этих реакций, соответственно, равны 582,6 и 0,136 барн. Недостаток первого метода заключается в образовании большого количества неиспользуемых радиоактивных отходов: 50 Ки отходов на 1 Ки 99Mo. Необходимость в последующей переработке и утилизации отходов, наряду с операцией отделения от них урана для повторного использования, приводит к большим экологическим проблемам. При использовании реакции радиационного захвата (n,) отходы практически не образуются. Основная проблема здесь связана с получением высоких удельных активностей 99Mo. Так, при облучении природного молибдена, содержащего 24,13% 98Mo, в потоке тепловых нейтронов 11014 н/см2с в течении 100 часов, выход 99Mo не превышает 0,35 Ки/г. В тех же условиях на обогащённом 98Mo (степень обогащения > 95 %) расчётная активность 99Mo может быть повышена до (12-15) Ки/г за счёт увеличения резонансной составляющей в нейтронном спектре реактора При этом величина сечения может достигать 0,7 барн и более. На реакторах с потоком нейтронов 51015 н/см2с возможна наработка 99Mo с активностью порядка 200 Ки/г. Несмотря на то, что реакция (n,) не обеспечивает высокой удельной активности 99Mo, её можно достаточно эффективно использовать для последующей наработки из такого сырья высокоактивного технеция-99m: 98Mo(n,g)99Mo®66,74ч®99mTс®6,05ч®99Tc. (4.6) Себестоимость 99mTс при этом снижается в 5-6 раз по сравнению с реакцией 235U(n,f)99Mo. Приведённая реакция характеризует генераторную схему накопления во времени изотопа 99mTс. Для его выделения могут быть использованы различные методы: сорбционный, хроматографический и экстракционный. На основе первых двух методов разработаны мобильные переносные генераторы небольшой мощности, предназначенные для обеспечения препаратом 1-2 медицинских учреждений. Экстракционные генераторы представляют собой стационарные установки большой мощности способные удовлетворять в РФП потребность целого региона страны. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
